一种D-赖氨酸的制备方法与流程
一种d-赖氨酸的制备方法
技术领域
1.本发明涉及生物技术领域,具体涉及一种d-赖氨酸的制备方法。
背景技术:
2.d-赖氨酸为非蛋白质氨基酸,它具有有效的抗真菌性和抗菌性,是新药开发的重要药物中间体,在医药上具有重要的作用。d-赖氨酸是合成促黄体生成素释放激素类似物的前体,也可以用于合成促性腺激素释放激素高活性类似物,口服和静脉给药均可降低肿瘤治疗中放射性肽的肾摄取,d-赖氨酸比l-赖氨酸更适合在癌症治疗中使用。
3.现有的d-赖氨酸的制备方法主要采用化学法,但是化学法来制备d-赖氨酸流程复杂,涉及到的中间产物的分离提取过程复杂,且成本高,不适合大规模的工业化生产。
技术实现要素:
4.本发明所要解决的技术问题是现有的制备d-赖氨酸的方法复杂,成本高,不适合大规模工业化生产,目的在于提供一种d-赖氨酸的制备方法,以解决以上问题。
5.本发明通过下述技术方案实现:
6.一种d-赖氨酸的制备方法,包括以下步骤:
7.构建表达赖氨酸消旋酶的工程菌;
8.构建表达lysox的工程菌bl21(de3)/prsf-lysox;
9.菌株培养得到高活性表达赖氨酸消旋酶的菌株以及bl21(de3)/prsf-lysox菌株;
10.提供一混合溶液,所述混合溶液包括l-赖氨酸及其盐、l-赖氨酸氧化酶和过氧化氢清除剂(cat);向所述混合溶液通入氧气或空气进行反应,得含6-氨基-2-氧代己酸和d-赖氨酸的混合液。
11.分离纯化。
12.可选地,所述表达赖氨酸消旋酶的工程菌的过程为:
13.将赖氨酸消旋酶lyr的氨基酸序列(gene id:nz_cp043870.1)进行密码子优化后,全基因合成该序列,两端设计酶切位点ndei和xhoi,克隆到载体pet28a上,获得重组质粒pet28a-lyr;将构建好的重组质粒pet28a-lyr转化至大肠杆菌表达宿主bl21(de3)中,得到表达赖氨酸消旋酶的菌株bl21(de3)/pet28a-lyr。
14.可选地,所述构建表达lysox的工程菌bl21(de3)/prsf-lysox的过程为:
15.将lysox的氨基酸序列(gene id:ab937978.1)进行密码子优化后,全基因合成该序列,两端分别设计酶切位点ncoi和bamhi,克隆到表达载体prsf-duet上,得到重组质粒prsf-lysox;将重组质粒prsf-lysox导入e.colibl21的感受态细胞中,得到表达lysox的重组菌bl21(de3)/prsf-lysox。
16.可选地,将得到的bl21(de3)/pet28a-lyr菌株、bl21(de3)/prsf-lysox菌株分别在培养基中培养;
17.所述培养基为lb液体及固体培养基,培养条件为:37℃、200rpm,复苏培养1h转至
37℃恒温箱培养过夜。
18.酸的过程包括:
19.制备赖氨酸消旋酶全细胞;
20.向ph为7.0,0.2mol/l的磷酸盐缓冲液中加入所述赖氨酸消旋酶全细胞、l-赖氨酸,于37℃、200r/min振荡反应1~3h;12000rpm离心5min,去除赖氨酸消旋酶细胞;
21.向体系中补加重组菌bl21(de3)/prsf-lysox,调节ph至7.0~9.0,继续37℃震荡反应8-12h,至hplc检测l-赖氨酸被消耗完,停止反应。
22.可选地,所述制备赖氨酸消旋酶全细胞的过程为:
23.将得到的bl21(de3)/pet28a-lyr菌株接种在含有卡那霉素抗性lb的摇管里,37℃200rpm条件下培养8h,转接到含有卡那霉素抗性的摇瓶里,震荡培养至od600nm为0.3~0.6;
24.向上述摇瓶中加入终浓度为0.2mm的iptg进行诱导,在20℃、200rpm条件下诱导培养至od600nm为40~50;
25.将得到的菌液在4000g条件下离心10min,弃上清,并将收集的细胞用ph为7.0的pbs重悬,得到赖氨酸消旋酶全细胞;
26.所述发酵培养基成分为:酵母膏10~15g/l,蛋白胨10~15g/l,磷酸二氢钾1~5g/l,磷酸氢二钾10~20g/l,甘油5~20g/l,硫酸镁0.1~1g/l,氯化铵0.5~2g/l,氯化钠1~10g/l,葡萄糖1~10g/l。
27.可选地,所述赖氨酸消旋酶全细胞与l-赖氨酸在体系中的浓度比为10~30:100~133。
28.可选地,重组菌bl21(de3)/prsf-lysox在体系中的浓度为30~60g/l。
29.可选地,所述混合液为包含d-赖氨酸和6-氨基-2-氧代己酸的溶液;
30.所述分离纯化的过程为:
31.调整所述混合液的ph至3.5~4.5;
32.将混合液与阳离子交换树脂进行离子交换,洗脱,得d-赖氨酸洗脱液;
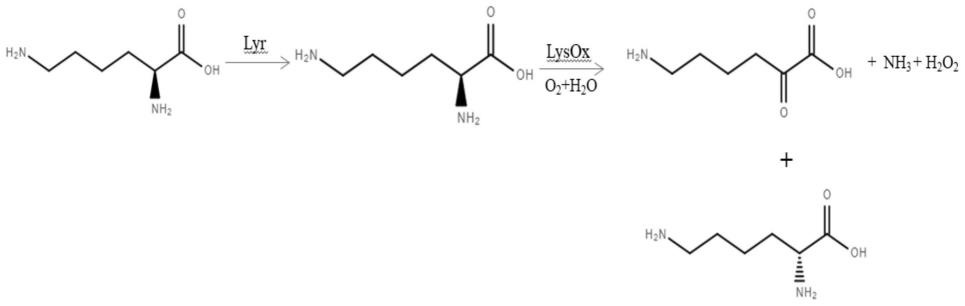
33.浓缩所述d-赖氨酸洗脱液,降温析晶,分离。
34.可选地,所述阳离子交换树脂中的固定相对d-赖氨酸吸附,洗脱时使用的洗脱剂为氨水,洗脱浓度为2~6%。
35.本发明具有如下的优点和有益效果:
36.本发明采用酶利用多酶偶联催化,通过构建表达赖氨酸消旋酶的工程菌bl21(de3)/pet28a-lyr、表达对d-赖氨酸具有专一性的lysox的工程菌bl21(de3)/prsf-lysox进行赖氨酸消旋、拆分,然后进行全细胞催化,在催化反应结束后反应体系中只剩下d-赖氨酸,l-赖氨酸被全部转化为6-氨基-2-氧代己酸,使得制备的d-赖氨酸的光学纯度达到98%以上,纯度达到90以上,收率高,克服了现有赖氨酸制备过程中的中间产物提纯工艺繁琐、收率低的缺陷,操作简单、成本低,且有效提高了d-赖氨酸的纯化提取收率。
附图说明
37.为了更清楚地说明本发明示例性实施方式的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被
看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。在附图中:
38.图1为本发明实施例制备d-赖氨酸的路线图;
39.图2为本发明实施例构建的重组表达载体pet-28a-lyr的图谱。
40.图3为本发明实施例构建的重组表达载体prsfduet-lysox的图谱。
41.图4为本发明实施例进行lyr蛋白表达时的sds-page检测结果图,图中m为蛋白marker,1代表总蛋白,2代表可溶性蛋白。
42.图5为本发明实施例进行lysox蛋白表达时的sds-page检测结果图,图中m为蛋白marker,1,3代表总蛋白,2,4代表可溶性蛋白。
43.图6为实施例3中全细胞催化过程中hplc谱图,图中a代表d-赖氨酸标准品图谱,b分别代表反应结束后体系中d-赖氨酸的hplc图谱。
具体实施方式
44.为使本发明的目的、技术方案和优点更加清楚明白,下面结合实施例,对本发明作进一步的详细说明,本发明的示意性实施方式及其说明仅用于解释本发明,并不作为对本发明的限定。
45.在以下描述中,为了提供对本发明的透彻理解阐述了大量特定细节。然而,对于本领域普通技术人员显而易见的是:不必采用这些特定细节来实行本发明。在其他实施例中,为了避免混淆本发明,未具体描述公知的材料或方法。
46.实施例1:基因工程菌的构建
47.1、赖氨酸消旋酶基因工程菌的构建
48.(1)将赖氨酸消旋酶lyr的氨基酸序列(gene id:nz_cp043870.1)进行密码子优化后,全基因合成该序列,两端设计酶切位点ndei和xhoi,克隆到载体pet28a上,获得重组质粒pet28a-lyr。图谱见附图2。
49.(2)将构建好的重组质粒pet28a-lyr转化至大肠杆菌表达宿主bl21(de3)中,得到表达赖氨酸消旋酶的菌株bl21(de3)/pet28a-lyr。
50.2、l-赖氨酸-α-氧化酶(lysox)工程菌的构建
51.(1)将lysox(1.4.3.14)的氨基酸序列(geneid:ab937978.1)进行密码子优化后,全基因合成该序列,两端分别设计酶切位点ncoi和bamhi,克隆到表达载体prsf-duet上,得到重组质粒prsf-lysox,图谱见附图3。
52.(2)将重组质粒pet28a-lysox导入e.colibl21的感受态细胞中,得到表达lysox的重组菌bl21(de3)/pet28a-lysox。
53.实施例2:菌种培养
54.1、挑选奇异变形杆菌来源、具有赖氨酸消旋酶活性的bl21(de3)/pet28a-lyr单株,在培养基中培养,得到高活性的bl21(de3)/pet28a-lyr菌种。
55.具体的培养条件为:37℃、200rpm培养至od600约为0.5。加入iptg至终浓度0.5mm,30℃,200rpm诱导培养12h。培养基为lb液体及固体培养基。
56.2、挑选黄绿木霉菌来源、具有表达l-赖氨酸-α-氧化酶的菌株bl21(de3)/pet28a-lysox单株,在培养基中培养,得到高活性的bl21(de3)/pet28a-lysox菌种。
57.具体的培养条件为:37℃、200rpm培养至od600约为0.5。加入iptg至终浓度0.5mm,30℃,200rpm诱导培养12h。培养基为lb液体及固体培养基。
58.实施例3:全细胞催化及分离纯化
59.(1)将实施例2得到的保存在冻存管中的高活性的bl21(de3)/pet28a-lyr菌种接种在含有卡那霉素抗性lb的摇管里,37℃、200rpm条件下培养8h,转接到含有卡那霉素抗性lb的1l摇瓶里,37℃、200rpm震荡培养至od600nm为0.3~0.6;转至发酵培养基中进行培养。其中发酵培养基成分为:酵母膏10~15g/l,蛋白胨10~15g/l,磷酸二氢钾1~5g/l,磷酸氢二钾10~20g/l,甘油5~20g/l,硫酸镁0.1~1g/l,氯化铵0.5~2g/l,氯化钠1~10g/l,葡萄糖1~10g/l。
60.(2)待od
600
为18~22,加入终浓度为0.2mm的iptg进行诱导,在20℃、200rpm条件下诱导培养16h,此时od600nm为40;
61.(3)诱导培养结束后,将步骤(2)中得到的菌液在4000g条件下离心10min,弃上清,将收集的细胞用ph为7.0的pbs重悬两遍,得到赖氨酸消旋酶全细胞;
62.(4)以l-赖氨酸为原料,转化生产d-赖氨酸,具体步骤如下:向ph为7.0,0.2mol/l的磷酸盐缓冲液中加入赖氨酸消旋酶全细胞和l-赖氨酸,使得体系中赖氨酸消旋酶全细胞及l-赖氨酸的浓度分别为20g/l、133g/l及过氧化氢清除剂cat的浓度为3g/l;37℃、200r/min振荡反应2h;然后12000rpm,离心5min,去除赖氨酸消旋酶细胞;向体系中补加重组菌bl21(de3)/prsf-lysox,体系内重组菌bl21(de3)/prsf-lysox的浓度为40g/l,并调节体系的ph至8.0,继续37℃震荡反应8-12h,至hplc检测l-赖氨酸被消耗完,停止反应。
63.经液相检测,l-赖氨酸经过8h的全细胞催化反应被消耗完全,结果见图6,由图6可知在4min左右l-赖氨酸开始出峰。其中,本实施例中进行hplc检测时采用的仪器为岛津液相色谱仪,色谱柱为c18色谱柱,流动相为90%含0.05%三氟乙酸的水和10%含0.05%三氟乙酸的乙腈,流速为1ml/min,温度为30℃,检测波长210nm,取样量为100ul,进样衍生剂为1ml的硼酸盐缓冲液和1ml的fmoc-cl缓冲液,缓冲5min后进样,进样量2ul。
64.(5)分离纯化
65.a)将实施例4中得到的含有d-赖氨酸和6-氨基-2-氧代己酸的混合液的ph调整至3.5~4.5,然后将调整后的混合液与001
×
7型阳离子交换树脂接触,进行离子交换,使d-赖氨酸吸附到阳离子交换树脂上,该阳离子交换树脂对d-赖氨酸吸附;
66.b)使未被吸附到阳离子交换树脂上的含6-氨基-2-氧代己酸的溶液被淋洗液置换下来,得到流穿液;
67.c)步骤b)中得到的含6-氨基-2-氧代己酸的流穿液经浓缩,然后降温析晶,得到的6-氨基-2-氧代己酸纯度约为98%。
68.d)用氨水作为洗脱剂,将步骤a)中的已吸附到阳离子交换树脂上的d-赖氨酸洗脱,得到d-赖氨酸洗脱液(即一次母液);
69.e)将步骤d)中的一次母液浓缩,降温析晶,然后离心分离,得到d-赖氨酸和二次离心母液,对得到的d-赖氨酸进行洗涤,收集洗涤液,将二次离心母液与该洗涤液合并,得到二次母液;
70.f)将步骤e)中的二次母液通入001
×
7型阳离子交换树脂进行吸附,之后再通入洗脱剂氨水进行洗脱,收集洗脱液,该洗脱液中d-赖氨酸含量≥15%、纯度≥90%;
71.g)将f)中的洗脱液进行浓缩、降温析晶、离心分离、干燥,即得d-赖氨酸。
72.最终得到的d-赖氨酸的光学纯度为99%,收率为49.5%。6-氨基-2-氧代己酸的产量为66g/l,摩尔收率为49.6%。
73.其中,淋洗液为纯水,在洗脱过程中洗脱液浓度为2%~6%的氨水。
74.实施例4:全细胞催化及分离纯化
75.(1)将实施例2得到的保存在冻存管中的高活性的bl21(de3)/pet28a-lyr菌种接种在含有卡那霉素抗性lb的摇管里,37℃、200rpm条件下培养8h,转接到含有卡那霉素抗性lb的1l摇瓶里,37℃、200rpm震荡培养至od600nm为0.3~0.6;
76.(2)向上述摇瓶中加入终浓度为0.2mm的iptg进行诱导,在20℃、200rpm条件下诱导培养16h,此时od600nm为40;
77.(3)诱导培养结束后,将步骤(2)中得到的菌液在4000g条件下离心10min,弃上清,将收集的细胞用ph为7.0的pbs重悬两遍,得到赖氨酸消旋酶全细胞;
78.(4)以l-赖氨酸为原料,转化生产d-赖氨酸,具体步骤如下:向ph为7.0,0.2mol/l的磷酸盐缓冲液中加入赖氨酸消旋酶全细胞和l-赖氨酸,使得体系中赖氨酸消旋酶全细胞及l-赖氨酸的浓度分别为20g/l、133g/l,同时体系中过氧化氢清除剂cat浓度为3g/l;37℃、200r/min振荡反应2h;然后12000rpm,离心5min,去除赖氨酸消旋酶细胞;向体系中补加重组菌bl21(de3)/prsf-lysox,体系内重组菌bl21(de3)/prsf-lysox的浓度为40g/l,并调节体系的ph至7.0,继续37℃震荡反应8-12h,hplc检测l-赖氨酸还有少许残留,残留量1.3g/l。
79.(5)分离纯化:采用与实施例4相同的方法进行。
80.最终得到的d-赖氨酸的光学纯度为99%,收率为49%。6-氨基-2-氧代己酸的产量为65.3g/l,摩尔收率为49.1%。
81.实施例5:全细胞催化及分离纯化
82.(1)将实施例2得到的保存在冻存管中的高活性的bl21(de3)/pet28a-lyr菌种接种在含有卡那霉素抗性lb的摇管里,37℃、200rpm条件下培养8h,转接到含有卡那霉素抗性lb的1l摇瓶里,37℃、200rpm震荡培养至od600nm为0.3~0.6;
83.(2)向上述摇瓶中加入终浓度为0.2mm的iptg进行诱导,在20℃、200rpm条件下诱导培养16h,此时od600nm为40;
84.(3)诱导培养结束后,将步骤(2)中得到的菌液在4000g条件下离心10min,弃上清,将收集的细胞用ph为7.0的pbs重悬两遍,得到赖氨酸消旋酶全细胞;
85.(4)以l-赖氨酸为原料,转化生产d-赖氨酸,具体步骤如下:向ph为7.0,0.2mol/l的磷酸盐缓冲液中加入赖氨酸消旋酶全细胞和l-赖氨酸,使得体系中赖氨酸消旋酶全细胞及l-赖氨酸的浓度分别为20g/l、133g/l,同时体系中过氧化氢清除剂cat浓度为3g/l;37℃、200r/min振荡反应2h;然后12000rpm,离心5min,去除赖氨酸消旋酶细胞;向体系中补加重组菌bl21(de3)/prsf-lysox,体系内重组菌bl21(de3)/prsf-lysox的浓度为40g/l,并调节体系的ph至9.0,继续37℃震荡反应8-12h,hplc检测l-赖氨酸还有少许残留,残留量2.7g/l。
86.(5)分离纯化:采用与实施例4相同的方法进行。最终得到的d-赖氨酸的光学纯度为99%,收率为48%。6-氨基-2-氧代己酸的产量为63.8g/l,摩尔收率为48.1%。
87.以上各实施例中的分离纯化过程中,调整含有d-赖氨酸和6-氨基-2-氧代己酸的混合液的ph至3.5~4.5,可以使赖氨酸在液体中的存在形式为lys
+
,而6-氨基-2-氧代己酸的表面净电荷为0,不带电,因此d-赖氨酸就可以被吸附在阳离子交换树脂上,6-氨基-2-氧代己酸不被吸附而流穿下来。
88.本发明实施例采用酶利用多酶偶联催化,通过构建表达赖氨酸消旋酶的工程菌bl21(de3)/pet28a-lyr、表达对d-赖氨酸具有专一性的lysox的工程菌bl21(de3)/prsf-lysox进行赖氨酸消旋、拆分,然后进行全细胞催化,在催化反应结束后反应体系中只剩下d-赖氨酸,l-赖氨酸被全部转化为6-氨基-2-氧代己酸,具体可参见附图1中所示。通过该制备方法,得到的d-赖氨酸的光学纯度达到98%以上,纯度达到90以上,收率高,克服了现有赖氨酸制备过程中的中间产物提纯工艺繁琐、收率低的缺陷,操作简单、成本低,且有效提高了d-赖氨酸的纯化提取收率。
89.同时本发明实施例构建的基因工程菌的酶活高,生产成本低,转化率高,适用于大规模工业化生产。
90.以上各实施例中所使用的各种试剂均可以通过市购或现有的技术获得,过程中涉及到的仪器、设备等均采用已知设备,过程中未提及到的方法等均是采用已知技术,在此不进行赘述。
91.以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1