一种牛骨蛋白肽螯合锌制备工艺的制作方法
1.本发明涉及生物技术领域,尤其涉及一种牛骨蛋白肽螯合锌制备工艺。
背景技术:
2.早在二十世纪六十年代中期,就有研究者发现氨基酸和多肽具有促进金属离子吸收和转运的作用,且氨基酸和肽的金属复合体如铁、锌和锰的生物学利用率比无机盐高,且无毒副作用。在我国,近年来对肽锌螯合物的研究比较活跃,目前大多集中在植物蛋白和水产动物蛋白与锌的螯合物上,而对于畜禽骨蛋白肽螯合锌的研究甚少。主要有花生肽锌螯合物、玉米肽锌螯合物、大豆多肽锌螯合物、绿豆多肽锌螯合物和牡蛎肽锌螯合物、河豚鱼皮胶原肽锌螯合物、罗非鱼鳞胶原肽锌螯合物、克氏原螯虾壳肽锌螯合物、细点圆趾蟹肉酶解肽锌螯合物、鲢鱼蛋白小肽锌螯合物等。
3.人体对饮食中锌的吸收率较低,主要原因是锌与植酸在小肠中可形成不溶的复合物,由于人类肠道缺少相应的植酸酶,这种不易溶解的锌植酸复合物不能被人类消化吸收,大大降低了锌的生物利用率。
4.蛋白质被摄入后,在体内大量蛋白酶的作用下酶解为多肽类物质,由于分子量相对较小,可以被人体更好地吸收和利用。研究发现多肽在体内的吸收方式与氨基酸存在差异,是两种完全不同的吸收机制,且多肽的吸收效率高于氨基酸。因此充分利用多肽在体内这一特殊的吸收机制,将多肽与金属锌离子进行螯合反应形成多肽锌螯合盐,因其具有特殊的环状螯合结构,性质较其他锌盐稳定,同时多肽还具有促进锌吸收的作用,增加机体对锌的储留量。此外,多肽类物质,特别是低聚肽或寡肽,是优良的天然抗氧化剂,将多肽与锌离子螯合后可以增强其抗氧化活性,能够抑制大分子氧化损伤和清除自由基。
5.综上所述,蛋白肽螯合锌不仅能够促进锌离子的吸收,补充人体所需要的微量元素,还具备较高的抗氧化生物活性,有着巨大的市场潜力及良好的发展前景,国内尚未见牛骨胶原蛋白肽与微量元素锌螯合的研究报道。
技术实现要素:
6.本发明的目的是要提供一种牛骨蛋白肽螯合锌制备工艺。
7.为达到上述目的,本发明是按照以下技术方案实施的:
8.本发明包括以下步骤:
9.s1:取新鲜牛骨经破骨机进行破碎备用;
10.s2:把破碎后的牛骨放入清洗机,加水清洗,排水清渣;加入naoh水溶液清洗,沥干洗至中性;再加入h2so4水溶液清洗,沥干洗至中性;
11.s3:将清洗干净的牛骨重新注入清水加压煮沸,而后降压恒温蒸煮;
12.s4:待常压,降至适宜温度,调节ph值,先加入碱性蛋白酶酶解,继续降低温度,再加入胰蛋白酶酶解,煮沸,高温灭酶,迅速冷却至室温;
13.s5:将步骤s4所得料液通过筒式及板框过滤器,过滤出的清液即为牛骨胶原蛋白
肽水溶液;
14.s6:将步骤s5制得牛骨胶原蛋白肽水溶液用naoh和hcl调节ph值,加入六水硫酸锌溶液,升温进行螯合反应制得反应液;
15.s7:将步骤s6反应液用乙醇醇沉,将醇沉液置于低温高速离心机中离心,取沉淀物,再加入乙醇重复醇沉与离心操作2~3次;
16.s8:将步骤s7得到的沉淀物先预冷冻,再放入冻干机中冻干,即得牛骨蛋白肽螯合锌。
17.优选的,所述步骤s1中,将新鲜牛骨破碎至5~10cm备用。
18.优选的,所述步骤s2中,加水清洗时间10min,naoh水溶液清洗时间30min,h2so4水溶液清洗时间30min。
19.优选的,所述步骤s2中,naoh水溶液为0.2%,h2so4水溶液为0.3%。
20.优选的,所述步骤s3中,加压煮沸压力为0.25mpa,继续加热15~20min后,降低压力至0.16mpa,在恒温恒压下煮沸6.5h。
21.优选的,所述步骤s4中,温度降至55℃,调节ph值至8.0,碱性蛋白酶为3.0%,酶解时间3h;继续降低温度至45℃,胰蛋白酶为2.0%,酶解时间2h;高温灭酶时间15min。
22.优选的,所述步骤s6中,naoh为0.1mol/l,hcl为0.1mol/l,调节ph值至7.2,牛骨蛋白肽与锌质量浓度比为2.2:1,升高温度至64.0℃,螯合反应时间2.5h。
23.优选的,所述步骤s7中,乙醇为95%,离心转速4000r/min;离心时间15~20min。
24.优选的,所述步骤s8中,预冷冻温度为-24℃、冷冻时间5h或温度-80℃、时间1h,冻干机的冻干温度为-45℃、冻干时间24h、压力23pa。
25.本发明的有益效果是:
26.本发明是一种牛骨蛋白肽螯合锌制备工艺,与现有技术相比,本发明采用的水体系螯合合成法,具有设备要求低、工艺操作简单、螯合反应条件容易控制、能量消耗低、无污染、产率相对较高等特点,具有推广应用的价值。
附图说明
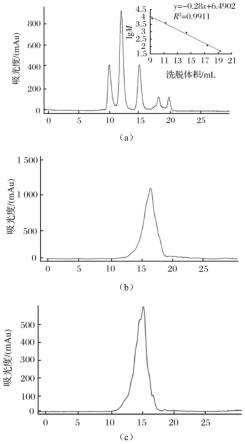
27.图1是标准蛋白(a),cp(b)和cp-zn(c)的分子质量分布图;
28.图1中a:标准蛋白;b:cp;c:cp-zn;
29.图2是cp(a)和cp-zn(b)的maldi-tof质谱图;
30.图2中:a:cp;b:cp-zn。
具体实施方式
31.下面以具体实施例对本发明作进一步描述,在此发明的示意性实施例以及说明用来解释本发明,但并不作为对本发明的限定。
32.本发明包括以下步骤:
33.s1:取新鲜牛骨经破骨机进行破碎至5~10cm备用;
34.s2:把破碎后的牛骨放入清洗机加水清洗10min,排水清渣;加入0.2%naoh水溶液清洗30min,沥干洗至中性;再加入0.3%h2so4水溶液清洗30min,沥干洗至中性;
35.s3:将清洗干净的牛骨重新注入清水加压至0.25mpa煮沸,继续加热15~20min,然
后降压至0.16mpa,在恒温恒压下蒸煮6.5h;
36.s4:待常压,温度降至55℃,调节ph值至8.0,先加入3.0%碱性蛋白酶酶解3h,继续降低温度至45℃,再加入2.0%胰蛋白酶酶解2h,煮沸,高温灭酶15min,迅速冷却至室温;
37.s5:将步骤s4所得料液通过筒式及板框过滤器过滤,过滤出的清液即为牛骨胶原蛋白肽水溶液;
38.s6:将步骤s5制得牛骨胶原蛋白肽水溶液用0.1mol/l的naoh和0.1mol/l的hcl调节ph值至7.2,加入牛骨蛋白肽与锌质量浓度比为2.2:1的六水硫酸锌溶液,升温至64.0℃,螯合反应2.5h;
39.s7:将步骤s6反应液用95%乙醇醇沉,醇沉液置于低温高速离心机中在4000r/min条件下离心15~20min,取沉淀物,再加入95%乙醇重复醇沉与离心操作2~3次;
40.s8:将步骤s7得到的沉淀物先置于-24℃预冷冻5h或-80℃预冷冻1h,再放入冻干机中在温度-45℃、压力23pa冻干24h,即得牛骨蛋白肽螯合锌。
41.将本发明实施例制备的牛骨蛋白肽螯合锌分别进行如下试验:胶原肽分子量的测定:
42.采用akta全自动蛋白层析系统对牛骨胶原蛋白肽的分子量分布进行测定。以50mmol/l磷酸盐、0.10mol/l氯化钠、ph7.0的缓冲液为流动相,流速0.5ml/min,进样量50μl。采用标准蛋白分子量的对数值对洗脱体积做标准曲线,得到回归方程:
43.igm=-0.28v+6.4902(r2=0.9911)
44.式中:v-洗脱体积;m-分子量。
45.通过洗脱体积计算胶原肽的分子量分布。
46.牛骨蛋白肽螯合锌的成分及得率测定:
47.牛骨蛋白肽螯合锌得率按式(1)进行计算测定:
48.牛骨蛋白肽螯合锌得率(%)=w1/w0×
100%
49.式(1)
50.式中,w0:反应物的总重量(g);w1:螯合锌的总重量(g)。
51.紫外-可见吸收光谱:
52.分别配制10mg/ml的牛骨胶原蛋白寡肽以及等浓度的牛骨胶原蛋白肽螯合锌水溶液,用紫外-可见分光光度计在100~900nm波长范围内进行紫外可见吸收光谱扫描。
53.dpph自由基清除率的测定:
54.将检测样品与0.1mol/l dpph-无水乙醇溶液按1:1的体积比例混合均匀,室温避光反应40min,于517nm处测吸光值,记为a1;将dpph-无水乙醇溶液替换为无水乙醇溶液,以同样方式操作得到的吸光值,记为a
10
;将样品替换成超纯水,以同样方式操作得到的吸光值,记为a0;每组试验重复3次,取平均值并求标准差。dpph清除率的计算公式如式(2)。
[0055][0056]
羟基自由基清除率的测定:
[0057]
在0.4ml样品中依次加入0.4ml 9mmol/l fes04、0.4ml 9mmol/l水杨酸-乙醇溶液和0.4ml 8.8mmol/lh2o2,于37℃下水浴40min,于510nm波长下测吸光度,记为a1;以等量
超纯水代替h2o2,测其吸光度a
10
;以等量超纯水代替样品,测其吸光度a
01
。羟基自由基清除率的计算公式如式(3)。
[0058][0059]
fe
3+
还原能力的测定:
[0060]
取0.5ml样品溶液,加入0.5ml 1g/100ml铁氰化钾溶液,于55℃下水浴加热30min,加入0.5ml的10g/100ml三氯乙酸溶液,混匀后8000r/min离心10min后取上清液1ml,加入1ml超纯水,混匀后加入150μl 0.1g/100ml的氯化铁溶液,在室温反应10min后,于700nm波长处测定吸光度。
[0061]
体内抗氧化活性的测定:
[0062]
将50只spf级的雄性sd大鼠,随机分为五组,分别为缺锌组、硫酸锌组、葡萄糖酸锌组、牛骨蛋白肽螯合锌低剂量组和高剂量组,每组10只。大鼠饲喂缺锌饲料,并饮用去离子水,用缺锌饲料喂养7d后,不同分组在缺锌饲料的基础上每日按照一定剂量灌胃给药,自由饮水,连续喂养28d。由于实验室在进行体内抗氧化活性动物实验之前,已对牛骨蛋白肽螯合锌进行了毒理学安全性评价实验,经口急性毒性实验结果显示,牛骨蛋白肽螯合锌的ld
50
为6.7528g/kg,95%的可信限为6.2252~7.7920g/kg。硫酸锌和葡萄糖酸锌的灌胃剂量也均按ld
50
计算确定。实验期结束后,10%水合氯醛麻醉,腹主动脉取血,分离血清,并于-20℃冰箱保存备用。血清中谷胱甘肽(gsh)、丙二醛(mda)、总抗氧化能力(t-aoc)、总超氧化物歧化酶(t-sod)指标的测定均按照试剂盒说明进行。
[0063]
成分分析:
[0064]
牛骨胶原蛋白肽与锌螯合后,经纯化冻干所制备的牛骨胶原蛋白肽螯合锌,得率为74.68%
±
2.15%。牛骨蛋白肽螯合锌的蛋白质含量为(83.16
±
0.68)g/100g,水分含量为(4.36
±
1.12)g/100g,锌含量为(13.76
±
1.12)g/100g。由于膜过滤有效地去除了制备过程中调节ph所引入的钠盐,未参加反应的蛋白和锌盐等杂质,因此蛋白质的含量和锌含量都相对较高。
[0065]
紫外可见吸收光谱分析:
[0066]
牛骨胶原蛋白寡肽螯合前后的吸收波长和强弱有较明显的变化。牛骨胶原蛋白寡肽在230nm处出现一个较强的吸收峰,在螯合后,吸收峰蓝移至228nm。此外,牛骨胶原蛋白寡肽在278nm处附近有较弱的吸收,螯合后,此吸收峰有明显的红移,移至287nm处,且强度有所增强。
[0067]
体外抗氧化活性实验:
[0068]
dpph通常用来检测生物活性物质对自由基的清除能力的强弱。牛骨胶原蛋白寡肽及其螯合锌对dpph自由基的清除作用:螯合锌对dpph自由基的清除率相较于牛骨胶原蛋白寡肽有所提高,螯合锌浓度在4.5mg/ml时对dpph自由基的清除率已经达到65%,说明其对dpph自由基具有很好的清除作用。经计算得出牛骨胶原蛋白寡肽对dpph自由基清除率的ic
50
值为4.38mg/ml,螯合锌的ic
50
值为2.89mg/ml。
[0069]
羟自由基是活泼性最强,氧化性最大的自由基,能与体内多种生物大分子发生反应,造成细胞的突变或者坏死。牛骨胶原蛋白寡肽及其螯合锌对羟自由基均具有一定的清
除能力,而且清除能力与样品浓度有良好的剂量-效应关系。在低浓度时,螯合锌与胶原寡肽的清除作用相差不明显,但在浓度高于2mg/ml后螯合锌的清除率明显强于胶原寡肽。经计算牛骨蛋白肽螯合锌对羟自由基清除率的ic
50
值为7.22mg/ml,而牛骨胶原蛋白寡肽的ic
50
值为9.34mg/ml。
[0070]
对fe
3+
的还原能力也是衡量其抗氧化活力的重要指标,抗氧化剂给出电子与自由基结合,从而清除自由基。吸光度越大,表明还原力越强。牛骨胶原蛋白寡肽及螯合锌对三价铁均有一定的还原能力,随着浓度的增大,其吸光度值也不断增大,而且螯合锌的三价铁还原能力高于牛骨胶原蛋白寡肽。
[0071]
体内抗氧化活性实验:
[0072]
机体自由基的产生与清除的酶系统之间维持着动态平衡。当机体发生病变,自由基的生成常常增加,从而引发体内抗氧化酶sod、gsh含量的改变。当自由基的生成超过机体抗氧化酶的清除能力时,就会引发脂质过氧化反应,形成脂质过氧化终产物mda。mda的量直接反映机体内脂质过氧化的程度,在一定程度上间接反映出细胞损伤的程度。体内抗氧化活性实验以硫酸锌和葡萄糖酸锌作为阳性对照组,比较了牛骨蛋白肽螯合锌对缺锌大鼠的抗氧化作用。缺锌饲料喂养7d后,大鼠出现厌食现象,皮毛失去光泽并变黄脱落,给药后,各组大鼠摄食量有明显的增加,体重增长均比缺锌组快,见表1。从给药第14d开始,高剂量组、葡萄糖酸锌组大鼠的体重与缺锌组比较有显著性差异。给药28d后,高剂量组大鼠的体重总增加值为(279.86
±
8.40)g,葡萄糖酸锌组的体重总增加值为(277.43
±
5.26)g,而缺锌组的体重总增加值为(262.07
±
9.19)g,表明牛骨蛋白肽螯合锌能有效改善大鼠的生长发育。表2为不同给药组对缺锌大鼠血清t-sod、mda、gsh、t-aoc含量的影响。从表中可以看到,缺锌组大鼠血清的mda含量最高。给药后,各组大鼠的抗氧化能力有了明显的提升,血清中t-sod、gsh、t-aoc含量均有不同程度的升高,mda含量都有所下降。其中高剂量组、葡萄糖酸锌组的大鼠血清t-sod、mda、gsh、t-a0c含量与缺锌组比较有显著性差异,而且高剂量组的抗氧化活性要优于同剂量的葡萄糖酸锌组;硫酸锌组、低剂量组的大鼠血清t-aoc含量与缺锌组比较有极显著性差异。从表中的数据可以得出,牛骨蛋白肽螯合锌对机体具有良好的抗氧化活性功能,在同等剂量的条件下,其效果明显优于硫酸锌和葡萄糖酸锌。
[0073]
表1
[0074]
组别实验前(g)给药14d(g)给药28d(g)总增重(g)缺锌组92.31
±
3.19252.38
±
12.84351.38
±
12.38262.07
±
9.19硫酸锌组92.41
±
6.16255.50
±
18.74363.13
±
10.75275.72
±
11.59葡萄糖酸锌组92.70
±
3.12262.07
±
6.89366.13
±
12.38277.43
±
5.26低剂量组92.96
±
2.60259.25
±
6.52354.63
±
12.10270.67
±
11.50高剂量组92.64
±
3.10263.13
±
8.31368.50
±
11.50279.86
±
8.40
[0075]
表2
[0076]
[0077][0078]
采用凝胶色谱对cp和cp-zn的分子质量分布进行测定,如图1所示。图1-a是5种标准蛋白的分子质量分布图,按照出峰顺序,从左到右分别为细胞色素c(m=12384)、抑肽酶(m=6512)、杆菌肽a(m=1422)、甘氨酸-甘氨酸-甘氨酸(m=189)、甘氨酸(m=75)。采用标准蛋白分子质量的对数值对洗脱体积做标准曲线,得到回归方程:igm=-0.28v+6.4902(r2=0.9911)。通过洗脱体积可计算样品的分子质量分布。由图1-b和图1-c可知,cp的分子质量组成处在标准相对分子质量的低段,主要集中在1000da以内,为小分子的胶原肽,峰值位置为16.1ml,其分子质量在600da附近。从出峰位置判断,cp-zn的分子质量范围明显要大于cp的分子质量,分子质量分布在200~3000da,峰值位置为14.3ml,通过回归方程可估算其所在的分子质量约为1500da。图2是cp和cp-zn的maldi-tof质谱图,通过质谱图可以对cp和cp-zn的分子质量作进一步的判断。谱图中的纵坐标为离子丰度,横坐标为离子的质荷比。经maldi-tof质谱仪测定cp的准分子离子峰[m+h]
+
均小于1200,即cp的相对分子质量主要在1200da内,这与凝胶色谱的测定结果较为吻合。图2-a所示,cp的主峰为质荷比643.243的离子,对应为[m+h]
+
,而与锌离子形成螯合物后,在cp-zn的质谱图中,形成了一个电荷的质荷比为707.404的特征峰,对应为[m-h+zn]
+
。对比得出,多肽[m+h]
+
结合一个锌变为质荷比为707.404的峰[m
–
h+zn]
+
,这也表明了多肽螯合锌的生成。
[0079]
将本发明制备的牛骨胶原蛋白肽螯合锌用100mol/l的三羟甲基氨基甲烷盐酸盐缓冲液稀释至合适的浓度混合物,吸取25μl牛骨胶原蛋白肽螯合锌与三羟甲基氨基甲烷盐酸盐缓冲液加入到酶标板中。在38℃下孵育10min后,加入50μl dpp-iv酶液,混匀后在38℃下精确孵育60min,立即加入100μl 1mol/l的醋酸-醋酸钠缓冲液终止反应,计算样品的dpp-iv抑制率为92.1%。
[0080]
本发明之所以选用肽锌螯合技术,是因为所谓肽锌螯合物就是肽与可溶性锌盐中的锌离子反应,通过配位共价化学键的作用,形成化学性质较为稳定的多元环状螯合物。在适当的条件下,肽的n-端氨基、c-端羧基、氨基酸侧链以及肽链中的羰基和亚氨基等基团均可以作为配体,为金属锌离子提供配位电子,形成配位电子对而产生较为稳定的环状螯合物,在这些螯合物中,锌离子大多位于环的中心,不易被解离出来,因此,多肽锌螯合物与氨基酸锌、葡萄糖酸锌等相比而言化学性质更加稳定。
[0081]
本发明的技术方案不限于上述具体实施例的限制,凡是根据本发明的技术方案做出的技术变形,均落入本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1