枯草芽孢杆菌BS273及其应用的制作方法
枯草芽孢杆菌bs273及其应用
技术领域
1.本发明属于微生物技术领域,具体涉及枯草芽孢杆菌bs273及其应用。
背景技术:
2.伏马毒素主要是由层出镰刀菌和拟轮枝镰刀菌产生的一种水溶性次级代谢产物,也是近年来全球污染最严重的霉菌毒素之一。粮食、饲料和食品等由于种植、储藏和运输不当,极易发生霉变产生伏马毒素。伏马毒素不仅使经济遭受巨大损失,而且还能造成人畜健康威胁。流行病学数据显示,在非洲、美洲和东亚等地区,玉米中伏马毒素的含量影响着当地人民食管癌的发病率。现已分离鉴定了28 种伏马毒素结构类似物,其中以fb1毒性最大。国际癌症研究署(iarc)已将fb1 列为2b类致癌物质。针对伏马毒素污染带来的严重危害,欧盟和美国先后制定了伏马毒素在食品、饲料上的限量标准。
3.由于伏马毒素化学性质稳定,且具有很大的危害性,亟需找到合适的方法去除该毒素。目前,伏马毒素的去除方法主要有物理法、化学法和生物法。但传统的理化方法存在一些问题,如可能形成潜在的有毒物质、改变农产品的营养价值及风味、或所需设备价格昂贵等原因,限制了其在实际生产中的应用。生物法是利用有益的生物及其代谢产物抑制产毒菌株的生长或者抑制其毒素的合成,通过生物粘附、降解等作用去除伏马毒素。相比理化方法,生物脱毒的处理条件温和、不破坏农产品原有品质,具有安全高效、环境友好等优点。2014年11月,奥地利的biomin公司研发的伏马毒素降解酶制剂成为首个得到欧盟认证的能够将伏马毒素通过生物转化降解为无毒代谢产物的酶。
4.在自然界,伏马毒素产毒菌在农作物种植区广泛存在,而且很多农作物本身的湿度为产毒菌的繁殖和产毒的形成提供了有力条件。农作物在田间受到伏马毒素产毒菌的感染,收割后贮藏过程中若温度和湿度适宜,产毒菌株会大量繁殖产生更多的毒素,在粮食和饲料的加工过程中不可避免造成伏马毒素污染。水稻是我国主要的粮食作物之一,由层出镰刀菌侵染引起的水稻穗腐病是水稻穗期的主要病害之一,会造成严重的产量损失和稻米伏马毒素污染。层出镰刀菌寄主范围广,为害水稻、玉米、小麦、大麦、芦笋等多种农作物。随着全球气候变暖,以及水稻—小麦、玉米—水稻轮作和免耕技术的推广,水稻穗腐病在不同生态区发生频率不断增加,发生范围逐渐扩大,呈现日益加重趋势。
5.目前,在农作物的伏马毒素防控中存在一个亟需解决的问题,由于层出镰刀菌和拟轮枝镰刀菌等伏马毒素产毒菌生存能力强,尤其产生的子囊孢子可以抵抗多种恶劣的生态环境,使用常规的伏马毒素脱毒技术并不能从源头上彻底避免伏马毒素的污染问题。因此,降低产毒真菌对农作物感染率,有利于在伏马毒素发生早期从根本上解除伏马毒素的产生、积累,进而有效控制和降低农作物上伏马毒素的污染,对于保障农作物的食用安全、谷物的深加工利用以及整个食品安全链具有重要意义。本发明公布了一株枯草芽孢杆菌,以及在抑制层出镰刀菌生长和降解伏马毒素中的应用。
技术实现要素:
6.针对现有技术存在的问题,本发明的目的在于设计提供一种枯草芽孢杆菌 bs273及其应用的技术方案。
7.为了实现上述技术效果,本发明提供以下技术方案:
8.本发明一方面提供了一种枯草芽孢杆菌(bacillus subtilis)bs273。该菌株已于2021年11月16日保藏于中国微生物菌株保藏管理委员会普通微生物中心 (简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为cgmcc no.23922,建议的分类命名为枯草芽孢杆菌bacillussubtilis。
9.本发明从全国不同省份采集具有代表性的土壤,如沙土、红壤土、黑土、粘土等,样品来源于农田、牧草地、森林土等不同区域。将土壤样品制备成菌悬浮液,以伏马毒素为唯一碳源进行初筛培养,获得6株伏马毒素降解菌株。再以伏马毒素的降解率为复筛指标,获得一株高效降解伏马毒素的菌株bs273。通过形态学特征、生理生化指标和分子生物学鉴定,将其定义为枯草芽孢杆菌(bacillussubtilis)。
10.本发明第二方面提供了一种含有枯草芽孢杆菌bs273菌体和/或发酵液的生防菌剂。
11.进一步,该生防菌剂中枯草芽孢杆菌bs273的浓度至少达到109cfu/ml。
12.本发明第三方面提供了一种含有枯草芽孢杆菌bs273的生防菌剂的制备方法,其以枯草芽孢杆菌bs273经菌株活化、种子培养、发酵培养和菌剂制备得到,具体包括如下步骤:
13.1)枯草芽孢杆菌bs273划线接种于lb固体培养基上,30℃恒温培养24h,获得活化菌株;
14.2)活化后的枯草芽孢杆菌单菌落接种于种子培养基中,30℃、180r/min,振荡培养24h,得到种子液;
15.3)按3~5%的接种量将种子液接种于发酵培养基中,30~37℃,150~ 180r/min,36~48h,溶氧量为60~65%,通气量5~10%,发酵结束后菌体浓度至少达到109cfu/ml,即为发酵液;
16.4)在发酵液中添加液体制剂,充分混匀,得到枯草芽孢杆菌生防菌剂。
17.进一步,所述步骤2)中种子培养基由如下组分组成:蛋白胨10g,牛肉浸膏3g,氯化钠5g,用蒸馏水定容至1l,ph值为7.0。
18.进一步,所述步骤3)中发酵培养基由如下组分组成:蛋白胨10g,葡萄糖 8g,氯化钠8.5g,kh2po
4 1g,k2hpo
4 0.1g,mgso4·
7h2o 0.25g,用蒸馏水定容至1 l,ph值为6.5~7.5。
19.进一步,所述步骤4)中液体制剂为壳聚糖、硫酸铵和淀粉的混合物,液体制剂相对于100重量份的枯草芽孢杆菌的发酵液,所述液体制剂中,按重量份计,壳聚糖、硫酸铵、淀粉组分比例为5:10:5。
20.本发明第四方面提供了一种含有枯草芽孢杆菌bs273菌体和/或发酵液的生防菌剂在降解农作物中伏马毒素污染的应用。
21.进一步,所述的农作物包括但不限于水稻,或玉米,或小麦,或大麦,或高粱。
22.本发明第五方面提供了一种含有枯草芽孢杆菌bs273菌体和/或发酵液的生防菌
剂在防治水稻穗腐病方面的应用。
23.本发明的枯草芽孢杆菌发酵液与层出镰刀菌菌株fp9(孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.)进行共培养,发现其对层出镰刀菌的生长和伏马毒素的形成具有显著抑制作用。针对枯草芽孢杆菌发酵液的杀菌生物活性和抑制伏马毒素的生物功能,进一步发现其对水稻穗腐病有较好的防治效果,且能显著降低水稻中伏马毒素污染水平。值得指出的是,本发明实现对水稻穗腐病防治效果的机制,一方面在于,枯草芽孢杆菌bs273本身对于层出镰刀菌具有很好的拮抗作用,使得水稻穗腐病的发生率大为降低。另一方面在于,枯草芽孢杆菌bs273对层出镰刀菌合成的伏马毒素有降解作用,从而降低水稻中伏马毒素的积累。
24.本发明提供的以枯草芽孢杆菌为活性成分的生防菌剂在防治水稻穗腐病中的应用效果,表明本发明的枯草芽孢杆菌bs273或生防菌剂能够用于抑制伏马毒素产毒菌的生长和产毒,降低农作物病害的发生和流行,提高农作物产量,减少农产品中伏马毒素的污染水平。
25.与现有技术相比,本发明的有益效果:
26.(1)本发明的枯草芽孢杆菌bs273,为解决水稻穗腐病防治困难提供了一条有效途径。利用该菌株有效遏制层出镰刀菌对农作物的感染,减少农作物上伏马毒素的积累。本发明的枯草芽孢杆菌能够从源头上控制伏马毒素的污染,有利于在伏马毒素产生的关键时期起到生物防控的效果,更好地满足了农业生产中水稻穗腐病防治的要求。
27.(2)本发明的枯草芽孢杆菌bs273生长快速,降解伏马毒素的效率高、特异性强,能够高效抑制伏马毒素产毒菌株的生长、繁殖和产毒。本发明在解决伏马毒素污染的过程中,生产使用成本低,操作方法简便,脱毒的同时保持农产品的营养价值和物理性质,对农作物和环境不存在二次污染,能够提高农产品的质量,确保人畜的食品安全,具有广阔的应用前景。
附图说明
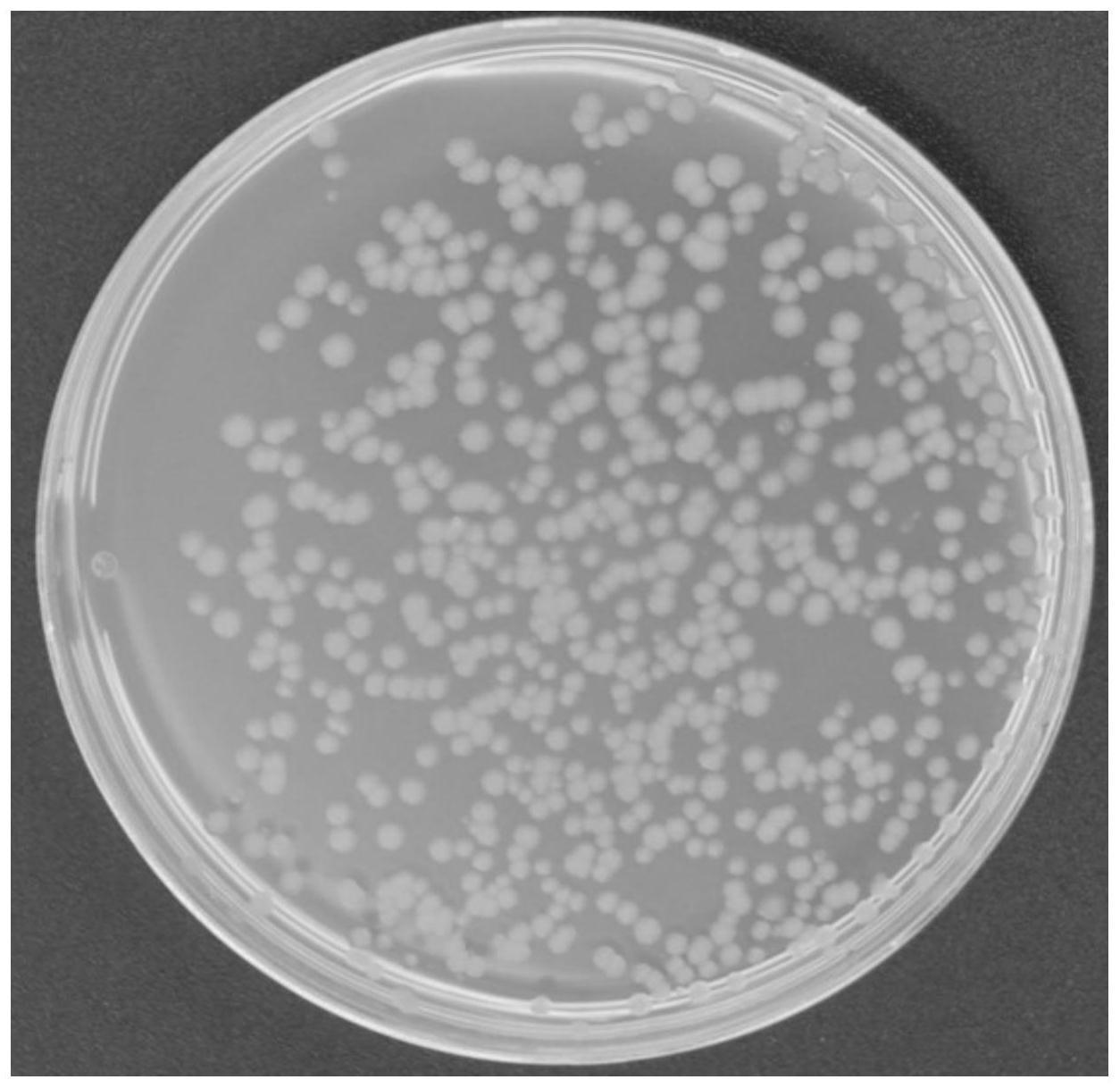
28.图1为枯草芽孢杆菌菌株bs273在lb培养基上的菌落形态。
29.图2为枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9的拮抗作用。a:层出镰刀菌菌株fp9单独培养;b:枯草芽孢杆菌发酵液与层出镰刀菌菌株fp9对峙培养。
30.图3为枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9分生孢子萌发的抑制作用。 a:层出镰刀菌菌株fp9的孢子数量;b:枯草芽孢杆菌发酵液添加后层出镰刀菌菌株fp9的孢子数量。
31.图4为枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9伏马毒素fb1的降解作用。a:层出镰刀菌菌株fp9中fb1含量测定的hplc图谱;b:枯草芽孢杆菌发酵液添加后层出镰刀菌菌株fp9中fb1含量测定的hplc图谱。
32.图5为以枯草芽孢杆菌为活性成分的生防菌剂对水稻穗腐病的防治作用。a:生防菌剂处理后水稻穗腐病的发病程度;b:喷施清水后水稻穗腐病的发病程度。
具体实施方式
33.为了使本技术领域的人员更好地理解本发明实施例中的技术方案,并使本发明实施例的上述目的、特征和优点能够更加明显易懂,下面结合实施例对本发明作进一步的具体描述,但不能理解为是对本发明保护范围的限定。
34.本发明实施例中提供的枯草芽孢杆菌菌株bs273,分类命名为bacillussubtilis。该菌株已于2021年11月16日保藏于中国微生物菌株保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏编号为cgmcc no.23922。
35.本发明实施例中所述的产生伏马毒素的层出镰刀菌菌株fp9,记载于“孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.”一文。
36.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
37.下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
38.下述实施例涉及的培养基和试剂组分包括:
39.初筛液体培养基(g/l):mgso4·
7h2o 0.2g,(nh4)2·
so42.0 g,cacl2·
2h2o 0.01 g,na2hpo4·
12h2o1.5 g,feso4·
7h2o 0.001g,kh2po
4 1.5g,用蒸馏水定容至1l, ph值为6.8。121℃,20min,高压灭菌。临用时加入100μg/ml放线菌酮。
40.初筛固体培养基(g/l):mgso4·
7h2o 0.2g,(nh4)2·
so42.0 g,cacl2·
2h2o 0.01 g,na2hpo4·
12h2o1.5 g,feso4·
7h2o 0.001g,kh2po
4 1.5g,琼脂20g,用蒸馏水定容至1l,ph值为6.8。121℃,20min,高压灭菌。临用时加入100μg/ml放线菌酮。
41.lb固体培养基(g/l):酵母提取物5g,胰蛋白胨10g,氯化钠10g,琼脂20g,用蒸馏水定容至1l,ph值为7.0。121℃,20min,高压灭菌。
42.种子培养基(g/l):蛋白胨10g,牛肉浸膏3g,氯化钠5g,用蒸馏水定容至 1l,ph值为7.0。121℃,20min,高压灭菌。
43.发酵培养基(g/l):蛋白胨10g,葡萄糖8g,氯化钠8.5g,kh2po41g,k2hpo
4 0.1g,mgso4·
7h2o 0.25g,用蒸馏水定容至1l,ph值为6.5~7.5。121℃,20min,高压灭菌。
44.马铃薯葡萄糖(pdb)培养基(g/l):葡萄糖20g,马铃薯200g,用蒸馏水定容至1l。121℃,20min,高压灭菌。
45.马铃薯葡萄糖琼脂(pda)培养基(g/l):葡萄糖20g,马铃薯200g,琼脂 20g,用蒸馏水定容至1l。121℃,20min,高压灭菌。
46.dl产毒培养基:6mm谷氨酰胺,22mm kh2po4,2.5mm mgso4,85mmnacl, 110mm葡萄糖,ph值为6.0。121℃,20min,高压灭菌。
47.稻谷产毒培养基:50g稻谷置于250ml三角瓶中,加入10ml蒸馏水浸泡过夜。 121℃,20min,高压灭菌。
48.实施例1:枯草芽孢杆菌菌株bs273的获得
49.一、伏马毒素降解菌的分离
50.通过多点采样法采集土壤,并将土壤研细装入无菌水的离心管中充分振荡,使土壤中的微生物悬浮于水中,静置1h。取土壤悬浮液,按0.5
‰
的接种量接种于含伏马毒素fb1初筛液体培养基中,使fb1终浓度500ppb。在初筛液体培养基中加入100μg/ml放线菌酮,以
抑制真菌的生长。在30℃、180r/min,培养16h 后;再按0.5
‰
的接种量转接到含fb1初筛液体培养基上,继续培养16h,连续转接三次。最后,取培养液稀释至10-5
,涂布于lb固体培养基中。在30℃培养,直至长出菌落。用接种环挑取平板上形态、大小、颜色、透明度不同的菌株,在含fb1终浓度为500ppb的初筛固体培养基中连续培养三代,挑选出能稳定生长的六种细菌,菌株编号分别为ee36、st58、pt124、bs273、th373、ta421。
51.二、伏马毒素降解菌的复筛
52.当降解菌株与伏马毒素fb1直接接触时,主要有两种效应,一种是菌体发酵产生的酶对毒素的降解作用,另一种是菌体细胞对毒素的吸附作用。吸附作用实际是一种物理绑定,菌体细胞通过其细胞壁中某些成分(如肽聚糖、细胞壁多糖和蛋白质)把毒素绑定在细胞上,且这种吸附作用是可逆的。因而,进一步判别上述筛选的六种细菌对伏马毒素的去除效应为降解作用或吸附结合。
53.将初筛得到的六种细菌接种至种子培养基中,30℃、180r/min培养48h后,分别收集菌体细胞和发酵上清液。将沉淀的菌体细胞用ph7.0的磷酸盐缓冲液,连续冲洗两次,再用磷酸盐缓冲液溶解菌体,即为菌体细胞悬浮液。将发酵上清液用0.22μm大小孔径的滤膜过滤。在菌体细胞悬浮液和发酵上清液中分别加入 fb1,使fb1终浓度为500ppb。在30℃、180r/min反应72h后,测定溶液中fb1 的含量,计算六种细菌的菌体细胞悬浮液和发酵上清液对fb1的降解率,计算方法为:
54.fb1降解率(%)=(初始fb1含量—降解后fb1含量)/初始fb1含量
×
100%。
55.fb1检测方法为高效液相色谱-串联质谱(hplc-ms)法。具体如下:
56.将样品用甲醇-水-乙酸(74∶25∶1)提取后,收集净化液,移入sax固相萃取小柱,收集洗脱液,50℃氮气吹至近干,加入含0.1%乙酸的30%乙腈,过 0.22μm有机滤膜,用hplc-ms法测定fb1浓度。液相色谱分离条件:zorbax extend
ꢀ‑
c18反相色谱柱;流动相:a为0.1%乙酸水溶液,b为乙腈;二元梯度洗脱程序:0~1min,70%a;1~6min,70%~20%a;6~9min,20%a;9~9.01min, 20%~70%a;9.01~15min,70%a;流速为0.2ml/min。柱温:30℃。电喷雾离子源,正离子采集模式,选择反应监测;喷雾电压3200v;辅助气(n2)压力为34.48kpa,鞘气(n2)压力为206.89kpa;毛细管温度为350℃;离子源温度 350℃。
57.结果如表1所示,六种细菌的发酵上清液比菌体细胞对fb1的去除效果要强,这表明这六种细菌对fb1的降解效应,均是细菌分泌至胞外的活性代谢物质主导的生物降解作用,而不是细菌细胞壁的吸附作用。其中,bs273菌株对fb1的降解率最高,达到92.5%。因此,确定bs273为目标菌株,进一步分析该菌株的发酵上清液对fb1的降解作用。
58.将菌株bs273发酵后的上清液经过高温、蛋白酶k处理后,对fb1的降解能力明显降低,分别为20.7%和35.4%。因此,可初步判断菌株bs273降解fb1起作用的活性物质存在于胞外提取液中,且具有蛋白质的属性。
59.表1六种细菌对伏马毒素fb1的降解效果
60.菌株编号菌体细胞fb1降解率(%)发酵上清液fb1降解率(%)ee365.3
±
0.3c32.8
±
4.6bcst588.5
±
0.5b22.5
±
1.1cpt1240
±
0d27.4
±
0.9cbs27313.7
±
0.8a92.5
±
8.5a
th3739.6
±
1.2b48.9
±
3.9bta4218.4
±
0.7b15.1
±
1.6d
61.注:同列相同字母代表无差异性显著(p《0.05)。
62.实施例2:枯草芽孢杆菌菌株bs273的鉴定与保藏
63.一、枯草芽孢杆菌菌株bs273的鉴定
64.将菌株bs273接种于lb固体培养基上,于30℃恒温箱中培养24h。待菌落长出,进行微生物的种属鉴定,鉴定内容包括:形态分析、生理生化指标分析和分子生物学鉴定。
65.(1)形态鉴定
66.菌落bs273在lb培养基上为淡黄色、圆形,菌落边缘整齐,中间凸起,生长时间过长会呈褶皱状。菌体平均大小为(0.5~1.5)μm
×
(1.5~2.5)μm,革兰氏染色为阳性,有芽孢,杆状,其在lb培养基上的形态特征如图1。
67.(2)生理生化指标鉴定
68.菌株bs273能利用葡萄糖、蔗糖发酵培养基产酸,但不产气,能水解淀粉,明胶液化试验阳性,v.p反应阳性,接触酶反应阳性,甲基红反应阳性,硝酸盐还原试验阳性,其它生理生化特征见表2。参照《伯杰氏细菌鉴定手册》对革兰氏阳性好氧菌的阐述并结合bs273菌株形态的观察,初步确定菌株bs273属于枯草芽孢杆菌。
69.(3)分子生物学鉴定
70.通过细菌16s rrna基因序列分析对菌株bs273进行分子生物学鉴定。
71.16s rrna基因扩增所用的引物序列为:
72.27f:5
′‑
agagtttgatcctggctcag-3
′
(如seq id no.1);
73.1492r:5
′‑
ggttaccttgttacgactt-3
′
(如seq id no.2);
74.pcr扩增反应程序为:94℃预变性5min;94℃变性30s,55℃退火30s, 72℃延伸50s,共30个循环;72℃延伸10min。pcr产物送至上海生工生物工程有限公司测序。
75.经测序可知,菌株bs273的16s rrna序列如seq id no.3所示。将该基因序列与ncbi中genbank数据库进行blast比对,菌株bs273的16s rrna序列与枯草芽孢杆菌(bacillus subtilis)的16s rrna序列(genbank:mt974190)相似性达到100%。
76.综合菌体形态培养特征、生理生化特性以及16s rrna序列分析,将菌株bs273 鉴定为枯草芽孢杆菌,其分类命名为bacillus subtilis。该枯草芽孢杆菌属于真细菌界,后壁菌门,杆菌纲,芽孢杆菌目,芽孢杆菌属。
77.表2菌株bs273的生理生化指标测定
78.测定项目试验结果测定项目试验结果葡萄糖产酸+v-p实验+葡萄糖产气-淀粉水解测定+蔗糖产酸+油脂水解测定-蔗糖产气-明胶液化测定+厌氧生长-石蕊牛奶测定凝固50℃生长-分解酪素测定+ph5.7生长+产硫化氢测定-7%nacl生长+吲哚产生+
接触酶测定+柠檬酸盐利用+氧化酶测定+硝酸盐还原+甲基红测定-尿素+阿拉伯糖利用-卵磷脂酶活性测定+甘露糖利用+丙二酸盐利用+d-果糖利用+纤维素分解+d-木糖利用+半乳糖利用+
79.其中,+表示菌株有反应或可以利用,-表示菌株没有反应或不可以利用。
80.二、枯草芽孢杆菌菌株bs273的保藏
81.本发明的枯草芽孢杆菌菌株bs273已于2021年11月16日保藏于中国微生物菌株保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏登记号为cgmcc no.23922。
82.实施例3:枯草芽孢杆菌生防菌剂的制备
83.一、菌种活化
84.将枯草芽孢杆菌菌株bs273甘油保藏管中的菌液在lb固体培养基上划线培养,于30℃培养24h,得到枯草芽孢杆菌单菌落。
85.所述的lb培养基为:酵母提取物5g,胰蛋白胨10g,氯化钠10g,琼脂20g,用蒸馏水定容至1l,ph值为7.0。121℃,20min,高压灭菌。
86.二、种子液的制备
87.挑取活化后的枯草芽孢杆菌菌株bs273的单菌落接种于种子培养基中,30℃、 180r/min,振荡培养24h,得到种子液。
88.所述种子培养基由如下组分组成:蛋白胨10g,牛肉浸膏3g,氯化钠5g,用蒸馏水定容至1l,ph值为7.0。121℃,20min,高压灭菌。
89.三、发酵液的制备
90.将种子液按体积比3~5%的接种量接种于发酵培养基中,30~37℃,150~ 180r/min,36~48h,溶氧量为60~65%,通气量5~10%,发酵结束后菌体浓度至少达到109cfu/ml,即为发酵液。
91.所述发酵培养基由如下组分组成:蛋白胨10g,葡萄糖8g,氯化钠8.5g,kh2po
4 1g,k2hpo
4 0.1g,mgso4·
7h2o 0.25g,用蒸馏水定容至1l,ph值为6.5~7.5。 121℃,20min,高压灭菌。
92.四、生防菌剂的制备
93.在枯草芽孢杆菌的发酵液中添加液体制剂,充分混匀,得到以枯草芽孢杆菌为活性成分的生防菌剂。
94.所述液体制剂为壳聚糖、硫酸铵、淀粉的混合物。相对于100重量份的枯草芽孢杆菌发酵液,所述液体制剂中,其按重量份计,壳聚糖、硫酸铵、淀粉组分比例为5:10:5。
95.实施例4:枯草芽孢杆菌发酵液对伏马毒素fb1的降解作用
96.一、枯草芽孢杆菌发酵液不同反应时间对fb1的降解效果
97.在初筛液体培养基中加入fb1,使得fb1终浓度为1000ppb。将实施例3中制备的枯草芽孢杆菌发酵液按照1%的接种量接种于含有fb1毒素的初筛液体培养基中。30℃,180r/
min,摇床培养。在接种后12h、24h、48h、72h、96h取样,测定培养基中fb1含量,计算枯草芽孢杆菌发酵液对fb1的降解率,计算方法为:
98.fb1降解率(%)=(初始fb1含量—降解后fb1含量)/初始fb1含量
×
100%。
99.结果表明,枯草芽孢杆菌发酵液和fb1共同孵育12h、24h、48h、72h、96h,对fb1降解率分别为20.3%、57.6%、75.2%、94.3%、99.4%。说明枯草芽孢杆菌对fb1的降解率随着反应时间的延长而增加。
100.二、枯草芽孢杆菌发酵液对不同浓度fb1的降解效果
101.在初筛液体培养基中加入fb1,使得fb1终浓度分别为1000ppb、10000ppb、 100000ppb、500000ppb。将实施例3中制备的将枯草芽孢杆菌发酵液按照1%的接种量接种于含有不同浓度fb1毒素的初筛液体培养基中。30℃,180r/min,摇床培养,在接种后72h取样进行培养基中fb1含量测定,计算枯草芽孢杆菌发酵液对fb1的降解率。
102.结果表明,枯草芽孢杆菌发酵液对1000ppb、10000ppb、100000ppb、500000 ppb的fb1的降解率分别为96.8%、82.8%、72.3%、23.6%。说明枯草芽孢杆菌发酵液和伏马毒素共同孵育的过程中,随着fb1浓度的提高,枯草芽孢杆菌发酵液对fb1的降解率逐渐下降。
103.实施例5:枯草芽孢杆菌发酵液对层出镰刀菌的生长和产毒的影响
104.一、枯草芽孢杆菌发酵液对层出镰刀菌菌丝生长的拮抗作用
105.采用平板对峙法测定枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9的抑菌能力。
106.所述的产生伏马毒素的层出镰刀菌菌株fp9,记载于“孙磊,王玲,刘连盟,侯雨萱,黎起秦,黄世文.水稻穗腐病菌强致病力且高产伏马菌素菌株筛选.中国水稻科学,2018,32(6):610~616.”一文。
107.将层出镰刀菌菌株fp9接种于pda培养基平板的中央,处理组在病原菌四周滴加10μl的实施例3中制备的枯草芽孢杆菌发酵培养液,对照组在病原菌四周滴加10μl无菌水。28℃培养7d后,测量菌落生长直径,计算枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9的菌丝生长抑制率,计算公式如下:
108.菌丝生长抑制率(%)=(对照组fp9菌落直径—处理组fp9菌落直径)/对照组fp9菌落直径
×
100%。
109.如图2所示,加入枯草芽孢杆菌发酵液后,层出镰刀菌菌株fp9不能呈现圆形生长或覆盖本发明的枯草芽孢杆菌生长。相对于对照组,处理组中枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9的菌丝生长抑制率为69.2%。结果表明,枯草芽孢杆菌发酵液对层出镰刀菌有明显的拮抗作用。
110.二、枯草芽孢杆菌菌株bs273发酵液对层出镰刀菌分生孢子萌发的抑制作用
111.将层出镰刀菌菌株fp9接种于pda固体培养基上。28℃培养7~8d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为106个/ml的菌悬液。取1ml层出镰刀菌的菌悬液接种于100ml的pdb培养液中。处理组加入1ml实施例3制备的枯草芽孢杆菌的发酵液于pdb培养液中,对照组中加入1ml无菌水。28℃、180r/min,培养3d后,在显微镜下观察层出镰刀菌菌株fp9的分生孢子数量,计算分生孢子萌发抑制率,计算公式如下:
112.孢子萌发抑制率(%)=(对照组fp9分生孢子数量—处理组fp9分生孢子数量)/对照组fp9分生孢子数量
×
100%。
113.如图3所示,与对照组相比,枯草芽孢杆菌发酵液对层出镰刀菌菌株fp9的分生孢
子萌发的抑制率达到86.8%。结果表明,枯草芽孢杆菌发酵液能够显著抑制层出镰刀菌的分生孢子萌发。
114.三、枯草芽孢杆菌菌株bs273发酵液对层出镰刀菌产生的伏马毒素的降解作用
115.将层出镰刀菌菌株fp9接种于pda培养基平板的中央,28℃培养7d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为106个/ml的菌悬液。按5%接种量将层出镰刀菌的菌悬液接种于100ml的dl产毒培养基中。处理组中加入1ml 实施例3中制备的枯草芽孢杆菌发酵液于dl产毒培养基中,对照组中加入1ml 无菌水。30℃、180r/min,摇瓶培养10d后,测定dl产毒培养基中的fb1含量,计算枯草芽孢杆菌发酵液对层出镰刀菌产生的fb1的降解率,计算方法为:
116.fb1降解率(%)=(对照组fb1含量—处理组fb1含量)/对照组fb1含量
×
100%。
117.如图4所示,处理组中加入枯草芽孢杆菌发酵液后,层出镰刀菌产生的fb1 毒素含量为2452ppb。相比于对照组,层出镰刀菌产生的fb1含量降低了72.1%,结果表明,枯草芽孢杆菌的发酵液能够显著降解层出镰刀菌的fb1毒素。
118.实施例6:枯草芽孢杆菌生防菌剂对稻谷中伏马毒素的降解能力
119.将层出镰刀菌菌株fp9接种于pda培养基平板的中央,28℃培养7d后,用无菌水洗脱分生孢子,稀释得到分生孢子浓度为106个/ml的菌悬液。取1ml层出镰刀菌的菌悬液接种于稻谷产毒培养基中,28℃黑暗培养15d,每隔3~4d,摇匀一次,以便于培养物的发散,获得含有伏马毒素的稻谷。
120.处理组按5%重量比将实施例3中制备的枯草芽孢杆菌生防菌剂接种于伏马毒素污染的稻谷中,以添加无菌水为对照组。在30℃下培养72h后,测定稻谷中伏马毒素fb1含量。
121.结果表明,对照组中稻谷的伏马毒素fb1含量为24605.4μg/kg,而加入枯草芽孢杆菌生防菌剂后稻谷的fb1含量降低至4954.5μg/kg。与对照组相比,处理组中稻谷的fb1含量显著下降了79.86%。可以看出,以枯草芽孢杆菌为活性成分的生防菌剂对fb1污染的稻谷脱毒效果非常显著。
122.实施例7:室内评价枯草芽孢杆菌发酵液对水稻穗腐病的防治效果
123.将层出镰刀菌菌株fp9接种于pda培养基平板的中央,28℃培养7d后,获得分生孢子浓度为106个/ml的菌悬液。在水稻孕穗期(剑叶和倒二叶叶枕距2~ 3cm)进行人工接种。处理组先将实施例3制备的枯草芽孢杆菌发酵液注射于稻穗苞中部,进行预防接种,待菌液干燥后,再将层出镰刀菌的菌悬液注射于穗苞中,进行感染接种。对照组先接种无菌水,待水分干燥后,再将层出镰刀菌的菌悬液注射于穗苞中,进行感染接种。将接种后的水稻植株置于人工气候箱中,保持温度28℃、相对湿度80%,光照12h/黑暗12h,交替培养14d。观察水稻穗腐病的发病情况,根据表3的症状描述,记载接种稻穗的病情级别,计算病情指数,评价枯草芽孢杆菌发酵液对水稻穗腐病的防治效果。
124.病情指数=∑(各级发病穗数
×
各级病情级数代表值)/(接种总穗数
×
严重度最高级代表值)
×
100。
125.防治效果(%)=(对照组病情指数—处理组病情指数)/对照组病情指数
×
100%。
126.接种后14d调查病情如图5所示,经枯草芽孢杆菌发酵液预防接种处理后,水稻穗腐病的病情发生较轻。对照组中接种层出镰刀菌,水稻穗腐病的病情指数为93.4;处理组先
接种枯草芽孢杆菌再接种层出镰刀菌,水稻穗腐病的病情指数为24.8,枯草芽孢杆菌发酵液对水稻穗腐病的防治效果达到了73.4%。由此可见,枯草芽孢杆菌发酵液对层出镰刀菌有良好的拮抗作用,能够有效抑制层出镰刀菌对水稻的感染,减轻水稻穗腐病的发生程度。
127.表3水稻穗腐病病情级别划分
[0128][0129][0130]
实施例8:田间施用枯草芽孢杆菌生防菌剂对水稻穗腐病的防治效果
[0131]
水稻穗腐病的试验安排在浙江省杭州市富阳区水稻穗腐病的适发区,该试验田上一年水稻穗腐病发生严重。田间种植水稻穗腐病的感病品种为秀水134,适当调整播种时间,使植株发病期与适宜水稻穗腐病发生流行的气候条件相遇。
[0132]
处理组在水稻的孕穗期和抽穗扬花期,按照3kg/亩生防菌剂的用量,分别将实施例3制备的枯草芽孢杆菌生防菌剂均匀地喷洒到水稻植株上。以喷施等体积的清水为对照组。每个处理包括3次重复,随机区组排列,每个小区面积为66.7 m2,各小区土壤肥力均匀一致,常规田间管理措施。在水稻蜡熟期,调查水稻穗腐病的发病情况。根据表3的症状描述,记载稻穗的病情级别,计算病情指数,评价生防菌剂对水稻穗腐病的防治效果,检测稻谷中伏马毒素fb1的含量。各参数计算公式如下:
[0133]
穗发病率(%)=(发病穗数/调查总穗数)
×
100%。
[0134]
病情指数=∑(各级发病穗数
×
各级病情级数代表值)/(调查总穗数
×
严重度最高级代表值)
×
100。
[0135]
防治效果(%)=(对照组病情指数—处理组病情指数)/对照组病情指数
×
100%。
[0136]
由表4可以看出,对照组中水稻穗腐病的穗发病率为87.6%,病情指数为47.8,稻谷中fb1含量为4856.4μg/kg;处理组中水稻穗腐病的穗发病率为24.5%,病情指数为5.3,稻谷中fb1含量为80.3μg/kg。施用以枯草芽孢杆菌为活性成分的生防菌剂后,水稻穗腐病的穗发病率明显下降了72.0%,稻谷中fb1的积累量显著减低了98.3%,生防菌剂对水稻穗腐病的防治效果达到了88.9%。分析原因主要在于:一方面,枯草芽孢杆菌生防菌剂抑制了层出镰刀菌对水稻的感染,减轻了水稻穗腐病的发病严重度;另一方面,该生防菌剂对层出镰刀菌产生的伏马毒素有降解作用,从而降低水稻中伏马毒素的污染水平。由此可见,以枯草芽孢杆菌为活性成分的生防菌剂能够抑制伏马毒素产毒菌的生长和产毒,可以用于水稻穗腐病的田间防治。
[0137]
表4施用枯草芽孢杆菌后水稻穗腐病发病程度和伏马毒素污染水平
[0138]
组别穗发病率(%)病情指数fb1含量(μg/kg)对照组87.6
±
7.2a47.8
±
3.4a4856.4
±
256.5a处理组24.5
±
3.2b5.3
±
0.6b80.3
±
8.2b
[0139]
注:同列不相同字母代表差异性显著(p《0.05)。
[0140]
应当注意的是,以上列举的仅是本发明的若干个具体实施例,并不构成对本发明的任何限制。本领域的技术人员应该理解,本发明不限于以上实施例,还可以对本发明作进一步的变更和修改。但是,在不脱离本发明宗旨和范围的前提下,由本发明公开的内容所作的任何变更、变形或改进,均应认为是本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1