一种HRP标记鼠抗林麝IgG单克隆抗体及其制备方法
一种hrp标记鼠抗林麝igg单克隆抗体及其制备方法
技术领域
1.本发明属于生物工程技术领域,具体公开了一种hrp标记鼠抗林麝igg单克隆抗体及其制备方法。
背景技术:
2.林麝(moschus berezoviskii,fmd),别名香獐、林獐、麝鹿等,属偶蹄目、麝科、麝属,是我国重要的资源动物。成年雄性林麝分泌的麝香为名贵的中药材和高级香料,具有很高的经济价值。但近年来,由于栖息地的破坏和过度捕杀,野生林麝的数量急剧下滑。因此我国政府开始鼓励野麝圈养,先后在四川和陕西等省份建立人工养麝场,把林麝作为主要的养殖品种。人工养麝虽已经历了半个多世纪的发展,但由于疾病的频发,至今仍未能形成规模化养殖。利用可靠技术及早确诊患病动物是有效防控动物疾病的基础,但现有的血清学诊断方法对林麝各类疾病并没有很强的特异性,同时也尚无商品化的林麝用检测试剂盒,其原因是缺少可与林麝血清特异性结合的酶标抗体。
技术实现要素:
3.本发明的第一目的在于提供一种hrp标记鼠抗林麝igg单克隆抗体,其能够有效解决现有的酶标抗体与林麝血清特异性结合效果差且效价较低的技术问题。
4.本发明的第二目的在于提供一种hrp标记鼠抗林麝igg单克隆抗体的制备方法,该方法能够有效制得与林麝血清特异性结合效果好且效价较高的酶标抗体,从而为商品化的林麝用检测试剂盒的制备打下基础,实现人工养麝事业的推动。
5.本发明提供了一种hrp标记鼠抗林麝igg单克隆抗体的制备方法,包括如下步骤:提取林麝体内的免疫球蛋白g,得到林麝igg,将林麝igg与弗氏佐剂混合后对多只balb/c小鼠进行动物免疫再测定多只balb/c小鼠的抗体效价,选取抗体效价最高的balb/c小鼠并取其脾脏破碎,得到b细胞;复苏小鼠骨髓瘤细胞,制备饲养层细胞,将复苏后的小鼠骨髓瘤细胞、b细胞和饲养层细胞混合培养并进行细胞融合,得到融合细胞,再筛选融合细胞内的阳性杂交瘤细胞,对阳性杂交瘤细胞进行亚克隆,得到亚克隆细胞;将亚克隆细胞分别接种于多只balb/c小鼠体内,待多只balb/c小鼠的腹腔胀大后抽取腹水,对腹水进行纯化,得到纯化抗体;将纯化抗体用linkine
tm
辣根过氧化物酶偶联试剂盒标记后加入hrp labeling溶液、activated hrp溶液和去离子水避光反应后得到粗品,向粗品中加入quencher溶液后即得到hrp标记鼠抗林麝igg单克隆抗体。
6.本发明还提供了一种hrp标记鼠抗林麝igg单克隆抗体,该抗体由上述方法制备得到。
7.与现有技术相比,本发明至少具有如下的优点与积极效果:
8.一、本发明提供了一种hrp标记鼠抗林麝igg单克隆抗体的制备方法,该方法通过多次筛选和亚克隆以获得能够稳定分泌特定抗体的杂交瘤细胞,再通过该细胞最终制得hrp标记鼠抗林麝igg单克隆抗体,该方法能够稳定且高效的制得该hrp标记鼠抗林麝igg单
克隆抗体,并且不需要使用较为复杂的实验仪器,方便hrp标记鼠抗林麝igg单克隆抗体的大规模生产,便于林麝用检测试剂盒的商品化。
9.二、本发明还提供了一种hrp标记鼠抗林麝igg单克隆抗体,其仅与林麝igg的重链发生结合,实现了与林麝血清良好的特异性结合,并且其还具有较高的效价,拥有良好的免疫效果。
附图说明
10.为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
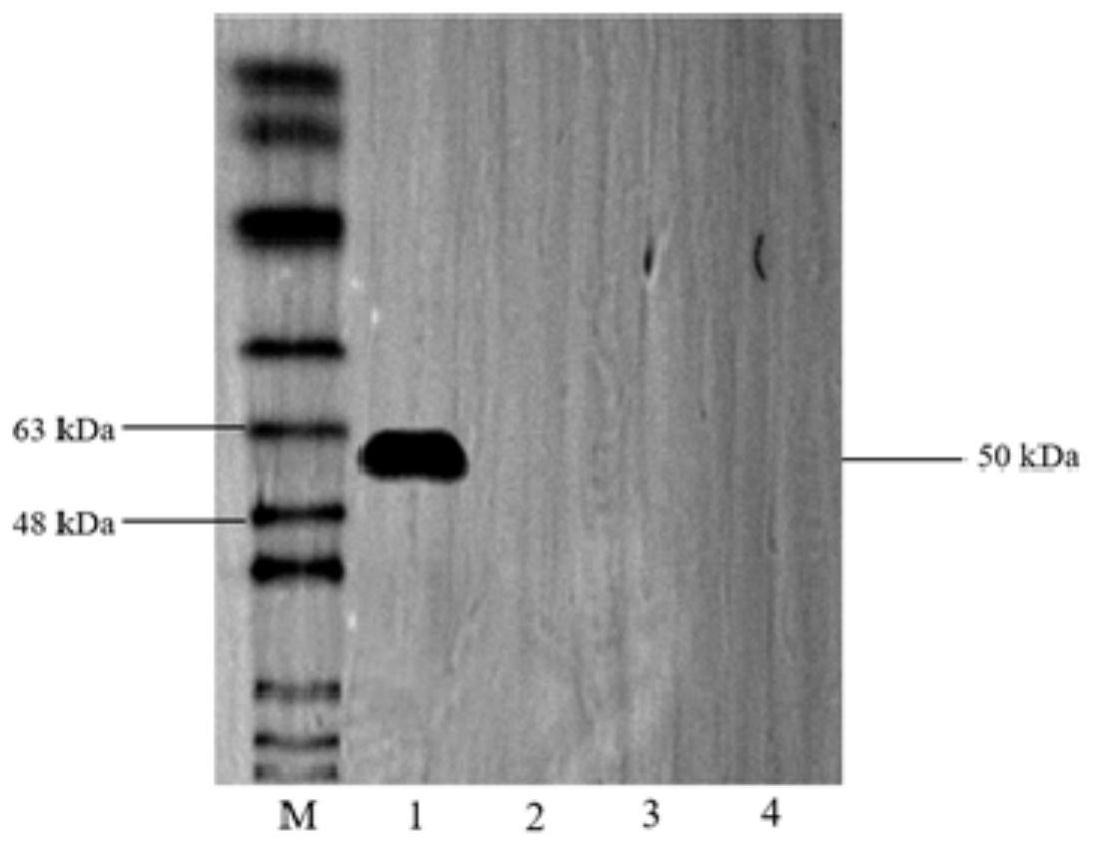
11.图1为本发明试验例1中hrp标记鼠抗林麝igg单克隆抗体特异性鉴定的结果图。
具体实施方式
12.为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
13.需要说明的是,在不冲突的情况下,本技术中的实施例及实施例中的特征可以相互组合。下面将参考具体实施例来详细说明本发明。
14.本发明的实施例提供了一种hrp标记鼠抗林麝igg单克隆抗体的制备方法,包括如下步骤:提取林麝体内的免疫球蛋白g,得到林麝igg,将林麝igg与弗氏佐剂混合后对多只balb/c小鼠进行动物免疫再测定多只balb/c小鼠的抗体效价,选取抗体效价最高的balb/c小鼠并取其脾脏破碎,得到b细胞;复苏小鼠骨髓瘤细胞,制备饲养层细胞。将复苏后的小鼠骨髓瘤细胞和b细胞进行细胞融合,得到融合细胞,将融合细胞和饲养层细胞混合培养,再筛选融合细胞内的阳性杂交瘤细胞,对阳性杂交瘤细胞进行亚克隆,得到亚克隆细胞;将亚克隆细胞分别接种于多只balb/c小鼠体内,待多只balb/c小鼠的腹腔胀大后抽取腹水,对腹水进行纯化,得到纯化抗体;将纯化抗体用linkine
tm
辣根过氧化物酶偶联试剂盒标记后加入hrp labeling溶液、activated hrp溶液和去离子水避光反应后得到粗品,向粗品中加入quencher溶液后即得到hrp标记鼠抗林麝igg单克隆抗体。该方法能够稳定且高效的制得该hrp标记鼠抗林麝igg单克隆抗体,并且不需要使用较为复杂的实验仪器,方便hrp标记鼠抗林麝igg单克隆抗体的大规模生产,便于林麝用检测试剂盒的商品化。
15.上述动物免疫包括初次免疫,所述初次免疫包括如下步骤:用90-110μl浓度为3-5mg/ml的所述林麝igg与等体积的弗氏完全佐剂混合后皮下注射于所述balb/c小鼠体内免疫14d,注射量为0.2-0.3ml/只。通过动物免疫步骤能够得到小鼠体内产抗林麝igg抗体的b细胞,从而为后续制备hrp标记鼠抗林麝igg单克隆抗体提供原料,该剂量和浓度范围能够保证小鼠体内产抗林麝igg抗体的b细胞能够大量增殖的同时又不会过多的影响小鼠体内b细胞的活性,并且通过混合弗氏完全佐剂以进一步刺激小鼠的局部免疫反应,从而增强b细胞产抗林麝igg抗体的功能,从而保证后续能够得到数量较多且特异性较强的抗林麝igg抗
体。
16.上述动物免疫还包括二次免疫、三次免疫和四次免疫,所述二次免疫包括如下步骤,在所述初次免疫后,用90-110μl浓度为3-5mg/ml的所述林麝igg与等体积的弗氏不完全佐剂混合后皮下注射于所述balb/c小鼠体内免疫14d,注射量为0.2-0.3ml/只;所述三次免疫和所述四次免疫的步骤与所述二次免疫相同。通过二次免疫、三次免疫和四次免疫进一步增强小鼠体内产抗林麝igg抗体的b细胞的增殖以及特异性,其中通过混合不含分枝杆菌的弗氏不完全佐剂在保证增强小鼠局部免疫反应的同时,减小小鼠在免疫过程中的副作用。
17.上述制备方法还包括加强免疫,所述加强免疫包括如下步骤:在所述测定多只所述balb/c小鼠的抗体效价后,在每只所述balb/c小鼠的腹腔注射90-110μl浓度为3-5mg/ml的所述林麝igg,所述注射量为0.2-0.3ml/只。通过加强免疫以进一步直接刺激小鼠体内b细胞产抗林麝igg抗体的功效。
18.上述小鼠骨髓瘤细胞的复苏包括如下步骤:于所述细胞融合前的7-14d用含1%wt的青链霉素和20%wt的胎牛血清的dmem细胞完全培养液培养所述小鼠骨髓瘤细胞至所述小鼠骨髓瘤细胞于所述细胞融合时刚好处于对数生长期。小鼠骨髓瘤细胞(sp 2/0)中无tk和hgprt来进行dna的紧急合成,因此更加有利于后续进行细胞融合后通过调节培养基成分进行阳性杂交瘤细胞的筛选。
19.上述饲养层细胞为未免疫的所述balb/c小鼠的腹腔内巨噬细胞,饲养层细胞的制备在所述细胞融合前12-24h。由于在细胞融合后,单个的或数量很少的细胞不易生存与繁殖,必须提前在细胞培养板上加入其它活的细胞才能使其生长繁殖,因此选用未免疫的balb/c小鼠的腹腔内巨噬细胞作为饲养层细胞来促进单个的或数量很少的细胞生存和繁殖。
20.上述细胞融合时,所述小鼠骨髓瘤细胞与所述b细胞的数量比为1:(5-10)。该数量比能够提高小鼠骨髓瘤细胞与b细胞的融合成功率,当比例低于该区间时,会由于b细胞过多而导致小鼠骨髓瘤细胞与更多的b细胞接触而导致融合易错,从而降低融合成功率,当该比例高于该区间时,会由于b细胞过少而导致小鼠骨髓瘤细胞无法与充足的b细胞接触而导致融合成功率降低。
21.上述纯化抗体的制备包括如下步骤:取健康balb/c雌性小鼠多只,每只腹腔注射0.4-0.6ml液体石蜡,7-14d后得到预处理小鼠;取所述阳性杂交瘤细胞于800-1200r/min离心5min,弃上清液,收集沉淀并用生理盐水重悬,调整细胞数量至106个/ml,得到待注射细胞,向每只所述预处理小鼠的腹腔注射0.4-0.6ml的待注射细胞;注射后待小鼠烦躁、腹腔胀大、肿瘤扩散、严重脱水、恶病质或失重大于20%后立即抽取腹水,于2800-3200r/min离心8-12min后弃脂肪层和细胞层并收集中间澄清层,将所述中间澄清层于55-60℃水浴灭活30min后用辛酸-硫酸铵法进行纯化,即得到所述纯化抗体。通过使用细胞融合所得到的杂交瘤细胞来刺激小鼠产生鼠抗林麝igg的单克隆抗体,从而提高所制得的抗体的特异性,使其只能与林麝igg重链发生结合。
22.上述纯化抗体与所述hrp labeling溶液的质量比为1:(0.25-1),所述粗品与所述quencher溶液的体积比为(1:0.15)。该比例区间能够提高hrp与鼠抗林麝igg的单克隆抗体的链接成功率。而粗品与quencher溶液的比例区间能够有效淬灭hrp标记鼠抗林麝igg单克
隆抗体的激发态分子,使其发光,从而达到方便检测的目的。
23.本发明还提供了一种由上述方法所制得的hrp标记鼠抗林麝igg单克隆抗体。该抗体仅与林麝igg的重链发生结合,实现了与林麝血清良好的特异性结合,并且其还具有较高的效价,拥有良好的免疫效果。
24.实施例
25.林麝igg的获得:
26.根据有关动物保护法,于林麝外周静脉取血,静置30min后,3000r/min离心20min,吸取血清。将林麝血清使用protein g agarose(fast flow)5ml预装柱过滤,得到纯化的igg。
27.动物免疫:
28.将100μl浓度为4mg/ml的林麝igg与等体积的弗氏完全佐剂混合后,对balb/c小鼠进行初次免疫,共免疫4只;14d后,用100μl浓度为4mg/ml的林麝igg与等体积的弗氏不完全佐剂混合乳化,进行第二次免疫,免疫剂量为0.2ml/只;28d后,再次进行免疫,免疫程序与第二次相同。28d和35d后,对小鼠尾静脉采血并分离血清,用间接elisa方法测定抗体效价,在细胞融合前3d,用不加佐剂的林麝igg对小鼠进行加强免疫,具体免疫流程见表1。同时,在相同的饲养环境下,对2只balb/c小鼠只接种佐剂,作为阴性对照。
29.表1小鼠免疫过程
[0030][0031][0032]
sp 2/0细胞的准备:
[0033]
于细胞融合前的7d复苏sp 2/0细胞,培养液为含1%青链霉素,20%胎牛血清,的dmem细胞完全培养液,在培养过程中适当进行传代和冻存,以调整细胞状态,使sp 2/0细胞在进行细胞融合时的刚好处于对数生长期。饲养层细胞的制备:
[0034]
在细胞融合后,单个的或数量很少的细胞不易生存与繁殖,必须提前在细胞培养板上加入其它活的细胞才能使其生长繁殖,加入的细胞称之为饲养层细胞,使用小鼠腹腔的巨噬细胞,在进行细胞融合前的24h制备,具体步骤如下:
[0035]
1)取未免疫的balb/c小鼠摘除眼球放血,并分离血清作阴性对照用,拉颈处死小鼠,浸泡于75%酒精溶液5min,随即放入超净工作台,腹部朝上;
[0036]
2)用镊子提起小鼠腹部皮肤,用剪刀剪一个小口,然后用手向上下两侧方向撕拉皮肤,充分暴露腹膜;
[0037]
3)用酒精棉球擦拭腹膜消毒;
[0038]
4)用注射器吸取dmem培养液8ml,注入小鼠腹腔,右手固定注射器,使针头留置在腹腔内,左手持酒精棉球轻轻按摩腹部1min,也可用该注射器在腹腔内反复抽吸、注射数次;
[0039]
5)用原注射器抽回腹腔内液体,注入离心管;
[0040]
6)1000r/min离心10min,弃上清液;
[0041]
7)先用10ml hat培养液将沉淀细胞悬浮并混匀,进行细胞计数,然后根据细胞计数结果,补加hat培养液,使细胞浓度为1
×
106个/ml;
[0042]
8)将细胞悬液加入96孔细胞培养板孔内,培养板置于37℃、5%co2的培养箱内培养。
[0043]
细胞融合:
[0044]
取抗体效价最高的小鼠,眼球采血并分离其血清做阳性对照。无菌取其脾脏,置于已灭菌的培养皿内,剥去结缔组织,用dmem基础培养液清洗,直至组织变白为止。用针头多点刺破脾脏,获得b细胞,1000r/min离心10min,弃去上清,加入10ml dmem基础培养液重悬细胞,37℃存放备用。
[0045]
将sp 2/0细胞和b细胞进行细胞计数,按照1:5的比例加入50ml离心管。用适量37℃预热的dmem基础培养液混匀细胞,1000r/min离心10min,弃去上清。手指轻弹管底,使细胞呈现出松散的糊状,将离心管管底浸于37℃水浴中进行保温,边缓慢旋转离心管边沿着内侧管壁加入1ml预热好的peg 1500溶液,操作在2min内完成。加完后于37℃水浴中静置2min。在5min内,遵从先慢后快的原则,向管中加入预热的20ml dmem基础培养液,终止融合后,1000r/min离心10min,弃去上清,然后加入40ml预热的含20%胎牛血清的hat完全培养液,混匀,按100μl/孔加到96孔细胞培养板中,将96孔板置于细胞培养箱中培养。培养3d后,使用倒置显微镜观察细胞的生长情况。融合后第4d,根据细胞生长状态而定,将hat培养液半量换液。当1/10孔底面积存在细胞时,开始进行阳性克隆细胞的筛选。第15d改用ht培养液培养;21d后使用dmem完全培养液继续培养。
[0046]
阳性杂交瘤细胞的筛选:
[0047]
细胞融合后10d,当杂交瘤细胞长至培养孔的1/10时,用林麝igg(0.625μg/ml)包被酶标板,使用间接elisa方法对杂交瘤细胞进行初步筛选,以sp 2/0细胞培养液上清做阴性对照,选择p/n≥2.1的阳性孔进行细胞亚克隆。
[0048]
杂交瘤细胞的亚克隆:
[0049]
利用有限稀释法,用ht完全培养液适当稀释杂交瘤细胞,并转移入另一个96孔板中,使每一个孔理论上只有1个细胞。第二天观察细胞生长状态,对存在细胞较多的孔内的细胞进行分离,移入其他孔内继续培养。当1/10孔底面积存在细胞时,利用间接elisa方法对克隆孔进行检测,选取只有一个细胞集落且od
450
值最高的孔,进行第二次和第三次亚克隆,最终选出生长状态较好,抗体分泌水平较高的杂交瘤细胞,并选择生长良好的细胞转入6孔细胞培养板,用dmem完全培养液(含20%胎牛血清)培养,最后转入25cm2细胞培养瓶培养。
[0050]
腹水的制备和纯化:
[0051]
单克隆抗体的大量制备一般采用动物体内诱生单克隆抗体的方法,即腹水制备技术。取成年健康balb/c雌性小鼠4只,每只腹腔注射0.5ml液体石蜡,10d后备用。将处于对数生长期的阳性杂交瘤细胞轻轻吹下来,1000r/min离心5min,弃上清液,收集细胞。用生理盐水将细胞重悬,调整细胞数量至106个/ml,每只预处理的小鼠腹腔注射0.5ml阳性克隆杂交瘤细胞;接种后每日对小鼠进行观察,包括姿势、活力、进食、饮水、呼吸及机体状况。在7d后,发现小鼠异常烦躁、小鼠腹腔明显胀大,肿瘤扩散、严重脱水、恶病质或失重大于20%,立即抽取腹水。用75%酒精消毒皮肤,用注射器刺入腹腔下部,采集腹水,1d后再次采集。收集腹水,3000r/min离心10min,弃脂肪层和细胞层,收集中间澄清层,56℃水浴灭活30min后,用辛酸-硫酸铵法对腹水进行纯化,纯化后的抗体保存至-70℃冰箱。hrp酶标抗体的制备:
[0052]
参照linkine
tm
辣根过氧化物酶偶联试剂盒说明书对纯化后的igg进行标记,以1:3的比例加入抗体和hrp labeling溶液,加入去离子水至100μl,室温避光反应2h,最后加入15μl quencher溶液即可制备完成,与50%甘油混合后置于-20℃保存。
[0053]
试验例1
[0054]
单克隆抗体特异性鉴定:
[0055]
进行wb试验,分别将林麝血清、牛血清、马血清、兔血清上样,以制备的该hrp标记鼠抗林麝igg单克隆抗体作一抗,来检测其特异性,所得结果如图1所示,其中m为蛋白分子质量标准,1为林麝血清,2为牛血清,3为马血清,4为兔血清。根据图1结果所示,仅林麝血清所在的泳道出现1条条带,为50kda的igg重链,与预期目的条带相符。而其他泳道未见条带,说明从腹水中获得的单克隆抗体只与林麝igg重链结合,特异性非常好。
[0056]
试验例2
[0057]
酶标抗体的效价测定:
[0058]
用lb培养基复苏林麝肺炎克雷伯氏菌株,于37℃恒温培养24h,做进一步扩大培养,用灭菌后的生理盐水将其洗出并定量装入瓶中,用稀释法进行菌落计数,将菌液浓度调为10
10
cfu/ml,然后用高压灭菌锅121℃灭活2h,5000r/min离心30min,用灭菌生理盐水洗涤沉淀至上清透亮,分装至1.5ml灭菌的离心管中,4℃保存备用。稀释法进行菌落计数并调整其浓度为5
×
106cfu/ml,将其包被在酶标板上。将林麝血清稀释50倍作为一抗孵育,将制备的hrp标记鼠抗林麝igg单克隆抗体作为酶标二抗以1:400起始做2倍比稀释,用间接elisa方法进行检测。反应结束后,测定各孔的od
450
值,根据p/n值计算酶标抗体的效价,结果见表2。根据表2结果所示,当酶标二抗的稀释度为1:25600时,反应结束后,阳性孔与阴性对照od450值的比值p/n仍大于2.1,表明单克隆抗体被成功标记了hrp,且该酶标抗体效价可达到1:25600。
[0059]
表2酶标二抗效价测定
[0060][0061]
综上所述:
[0062]
一、本发明提供了一种hrp标记鼠抗林麝igg单克隆抗体的制备方法,该方法通过多次筛选和亚克隆以获得能够稳定分泌特定抗体的杂交瘤细胞,再通过该细胞最终制得hrp标记鼠抗林麝igg单克隆抗体,该方法能够稳定且高效的制得该hrp标记鼠抗林麝igg单克隆抗体,并且不需要使用较为复杂的实验仪器,方便hrp标记鼠抗林麝igg单克隆抗体的大规模生产,便于林麝用检测试剂盒的商品化。
[0063]
二、本发明还提供了一种hrp标记鼠抗林麝igg单克隆抗体,其仅与林麝igg的重链发生结合,实现了与林麝血清良好的特异性结合,并且其还具有较高的效价,拥有良好的免疫效果。
[0064]
以上所描述的实施例是本发明一部分实施例,而不是全部的实施例。本发明的实施例的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1