一种双氰乙基脂环胺加氢制备双氨丙基脂环胺的方法与流程
1.本发明属于有机合成技术领域,具体涉及一种双氰乙基脂环胺加氢制备双氨丙基脂环胺的方法。
背景技术:
2.随着复合材料工业的不断发展,环氧树脂在电子产品、电气绝缘材料、汽车轻量化、路桥基建等高端领域有着愈发广泛的应用;而固化剂作为环氧树脂的重要组成部分,这势必对固化剂的品质提出了更高的要求。现有的胺类环氧树脂固化剂种类虽多,但在实际使用过程中存在凝胶时间长、固化温度高、力学性能差等多种缺点,依然无法满足高端领域的需求,所以对胺类固化剂进行改造成为环氧树脂领域的研究热点。
3.环氧胺类固化剂包括脂肪胺、脂环胺以及芳香胺等多种类型,其中脂环胺由于黏度低、适用期长、色泽优异的特点更受市场关注,进而摆在大家面前的是如何对脂环胺的改进。现有胺类固化剂改性策略包括:环氧乙烷或环氧丙烷加成改性、丙烯腈michael加成改性、酮亚胺化或醛亚胺化改性、曼尼希反应改性、n烷基化取代等。其中利用丙烯腈加成后再加氢方式得到的改性脂环胺有助于增强产品自身的韧性,提升产品的表干活性,有望被应用在高端环氧固化剂领域,目前国内外针对现有领域的研究正在逐步开展。
4.从分子结构角度看,双氨丙基脂环胺类可以分为单氨丙基脂环仲胺和双氨丙基脂环叔胺两大类,由于分子结构的不同,导致它们的应用性能存在较大的差异,面向的领域也不尽相同;目前,这两类改性胺的合成同时成为了相关领域研究的热点,但是从反应机理而言,由于腈乙基脂环胺的支链过长的缘故,它的结构稳定性往往较差,在催化加氢过程中难免会发生分解脱氨的现象,而且由于副产物的存在,导致加氢所用的催化剂寿命严重不足,二者的研发难度也不尽相同,目前很少有相关技术的统一公布。
5.cn 112934250 a公开了一种腈加氢的催化剂制备方法及应用,该发明为了解决间歇釜式工艺催化剂易失活的问题,采用共沉淀法与浸渍法相结合制备了不同于雷尼系催化剂的一款负载型催化剂。cn 103539676 a公开了一种间苯二甲胺加氢制备间苯二甲胺的方法,该发明为了解决现有技术催化剂用量大、产品选择性不理想以及高压釜间歇操作催化剂寿命短等问题,采用了一种集中孔分布镍基催化剂进行催化。cn 107812534 a公开了一种己二腈催化剂的制备方法,该发明同样是为了解决间歇釜式工艺催化剂易失活的问题,采用等体积浸渍法制备了全硅负载型镍基催化剂,但该款催化剂的活性较低,而且产物收率也很低。
6.cn 103977819 a公开了一种己二腈加氢催化剂的活化方法,该发明采用了可溶性金属盐与naoh的混合液对失活雷尼镍催化剂进行微波加热清洗,重新恢复催化剂的活性,但该方法操作流程复杂,不利于连续化生产;cn 101062485 b公开了一种镍基加氢催化剂的再生方法,该催化剂的再生包括两个阶段,一是缩聚物的氨解,二是氨解产物的加氢,采用该方法可以延长催化剂的寿命,但是活化条件复杂,能耗过大。
7.综上,目前腈乙基脂环胺加氢过程中依然存在着催化剂易失活、寿命短、活化程序
复杂、产物易分解等非常多的技术问题,影响了脂环胺在高端环氧树脂固化剂领域的持续拓展,因而开发一款双腈乙基脂环胺的加氢工艺势在必行。
技术实现要素:
8.本发明的目的在于,针对于现有的腈乙基化胺加氢工艺中存在的问题,提出了一种新双腈乙基脂环胺的加氢工艺。本发明提供的催化剂不仅能够连续套用更多的反应批次,而且能够降低产物中脱氨组分的含量,达到提升目标产品的实际收率的目的。
9.为实现上述发明目的,本发明采用如下的技术方案:
10.一种双氰乙基脂环胺加氢制备双氨丙基脂环胺的方法,所述方法以双氰乙基脂环胺为原料,在阴阳离子配体催化剂[m1m2(nh3)
x1
]
m+x2
[m2al(oh)
y1
]
n-y2
作用下,通过加氢制得目标产物;其中,催化剂中的金属元素m1为ag、co、cu、ni、cr、zn和pt中的一种或多种,优选co和/或ni;金属元素m2为li、na、k、rb和cs中的一种或多种,优选li和/或k;x1表示与金属m1及m2相互结合或配位的nh3分子的数量,x1为3-10的整数;x2表示阳离子配体的数量,x2为1-2的整数;y1表示与金属al及m2相互结合或配位的oh-离子的数量,y1为5-7的整数;y2表示阴离子配体的数量,y2为1-3的整数;m表示阳离子配体的价态,m为2-4的整数;n表示阴离子配体的价态,n为1-3的整数。
[0011]
本发明通过两种不同的阴阳离子配体缩合的方式得到相应的催化剂,再针对性地用于双氰乙基脂环胺的加氢工艺,该方法抑制了双氰乙基脂环胺加氢过程中产生的缩合高聚物对催化剂表面的覆盖,增强了原料氰基-cn与催化剂表面活性位点的结合作用,加快了氰基的活化,减少了脱氨产物的生成,提升了目标产品收率,同时也缩短了反应时长,从而提高了生产效率。
[0012]
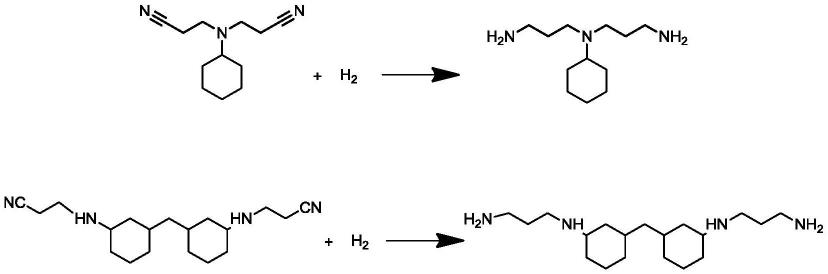
在两种实施方案中,分别以双腈乙基-环己胺和双腈乙基-二氨基二环己基甲烷进行加氢,相关反应如下:
[0013][0014]
本发明中,所述双氰乙基脂环胺为带有1或2个酯环的双氰乙基脂环胺,优选带有1或2个5元或6元酯环的双氰乙基脂环胺,更优选双氰乙基环戊胺、2-甲基双氰乙基环戊胺、双氰乙基环己胺、2-甲基双氰乙基环己胺、2,3-二甲基-双氰乙基环己胺、双氰乙基环戊二胺、双氰乙基环己二胺、1-甲基-2,3-二双氰乙基基环己胺、双氰乙基胺甲基环己烷、双氰乙基二氨基二环己基丙烷、3,3
’‑
二甲基-4,4
’‑
双氰乙基二氨基二环己基甲烷中的一种或多种,最优选双氰乙基环己胺和/或双氰乙基二氨基二环己基甲烷;优选地,所述双氰乙基脂环胺与催化剂的质量比为(1~200):1,优选(10~100):1。
[0015]
本发明中,所述加氢为半连续工艺。
[0016]
本发明中,所述加氢反应温度为50~150℃,优选70~120℃。
[0017]
本发明中,所述加氢反应压力为绝压3~9mpa,优选4~8mpa。
[0018]
本发明中,所述加氢反应延续时间为10~60min,优选20~40min。
[0019]
在一种实施方案中,所述方法的具体步骤为:先在反应釜中加入一定量的阴阳离子配体催化剂[m1m2(nh3)
x1
]
m+x2
[m2al(oh)
y1
]
n-y2
催化剂以及一定量溶剂进行铺底,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至反应温度,补压h2至反应压力,通过进料泵连续加入双腈乙基脂环胺原料,进料结束之后反应至一定吸氢量结束,将反应液过滤、取样色谱分析;接着再进一步连续套用催化剂,直至催化剂完全失活。套用过程中催化剂失活的标准可以为产品组成中双氨丙基脂环胺的收率低于95%。
[0020]
本发明中,所述催化剂的制备方法为:
[0021]
s1:将m1盐的溶液加入至m2氨基碱的溶液中,得到活性组分配体[m1m2(nh3)
x
]
m+
;
[0022]
s2:将m2盐和铝盐溶于水中,加入m2醇碱水溶液,保温,冷却,得到凝胶状多孔物质p;
[0023]
s3:洗脱和清洗p后加热至凝胶态,得到阴离子配体[m2al(oh)y]
n-;
[0024]
s4:将s1的[m1m2(nh3)
x
]
m+
加入至s3的阴离子配体[m2al(oh)y]
n-中,搅拌至完全沉淀,过滤得到催化剂[m1m2(nh3)
x1
]
m+x2
[m2al(oh)
y1
]
n-y2
。
[0025]
本发明中,所述s1中的m1盐为盐酸盐、硫酸盐、磷酸盐、亚硫酸盐和醋酸盐中的一种或多种,优选盐酸盐和/或硫酸盐。
[0026]
本发明中,s1中的m2氨基碱为linh2、nanh2、knh2、rbnh2和csnh2中的一种或多种,优选linh2和/knh2。
[0027]
本发明中,s1中的两种溶液都为醇溶液,优选醇为甲醇、乙醇和异丙醇中的一种或多种,更优选甲醇和/或乙醇;优选地,m1盐的溶液的浓度为1~40wt%,优选10~20wt%;优选地,m2氨基碱的溶液的浓度为1~50wt%,优选10~20wt%。
[0028]
本发明中,s1中m1与m2的金属元素摩尔比为1:5~20,更优选1:10~15。
[0029]
本发明中,所述s1在nh3气氛下进行;优选地,所述nh3的压力为绝压1~10mpa,优选2~3mpa。
[0030]
本发明中,s1中的反应温度为50~150℃,优选80~120℃。
[0031]
本发明中,s1中搅拌时间为1~10h,优选3~5h。
[0032]
本发明中,所述s2的m2金属盐和铝盐为盐酸盐、硫酸盐、磷酸盐、亚硫酸盐和醋酸盐中的一种或多种,优选盐酸盐和/或硫酸盐;优选地,所述m2金属盐和铝盐的浓度为1~20wt%,优选4~10wt%。
[0033]
本发明中,s2中的m2醇碱为ch3oli、ch3ona、ch3ok、ch3orb、ch3ocs、c2h5oli、c2h5ona、c2h5ok、c2h5orb和c2h5ocs中的一种或多种,优选ch3oli和/或c2h5ok;优选地,所述m2醇碱水溶液的浓度为1~30wt%,优选15~25wt%。
[0034]
本发明中,s2中m2金属盐与m2醇碱的元素摩尔比为1:(0.5~1.5),优选1:(0.8~1.2)。
[0035]
本发明中,所述s2的反应温度为50~120℃,优选80~100℃。
[0036]
本发明中,s2所述保温时长为1~10h,优选4~6h。;
[0037]
本发明中,s2所述冷却为降至室温。
[0038]
本发明中,所述s3用酚类物质进行洗脱;优选地,所述酚类物质为茶多酚、2,6-二叔丁基对甲苯酚和叔丁基对苯二酚中的一种或多种,优选2,6-二叔丁基对甲苯酚和/或叔丁基对苯二酚;优选地,所述酚类物质与凝胶状多孔物质p的质量比为(1~10):1,优选(3~6):1。
[0039]
本发明中,所述s3中的洗脱时长为1~5h,优选2~3h。
[0040]
本发明中,所述s3中的温度为50~120℃,优选80~100℃。
[0041]
本发明中,所述s4中[m1m2(nh3)
x
]
m+
的m1与[m2al(oh)y]
n-的m2的摩尔比为1:(0.1~5),优选1:(1~3)。
[0042]
本发明中,所述s4在超声条件下搅拌;优选地,所述超声时长为1~5h,优选2~3h。
[0043]
本发明的另一目的在于提供一种阴阳离子配体催化剂。
[0044]
一种阴阳离子配体催化剂,采用上述的催化剂的制备方法制备获得,所述催化剂的结构为[m1m2(nh3)
x1
]
m+x2
[m2al(oh)
y1
]
n-y2
,其中,催化剂中的金属元素m1为ag、co、cu、ni、cr、zn和pt中的一种或多种,优选co和/或ni;金属元素m2为li、na、k、rb和cs中的一种或多种,优选li和/或k;x1表示与金属m1及m2相互结合或配位的nh3分子的数量,x1为3-10的整数;x2表示阳离子配体的数量,x2为1-2的整数;y1表示与金属al及m2相互结合或配位的oh-离子的数量,y1为5-7的整数;y2表示阴离子配体的数量,y2为1-3的整数;m表示阳离子配体的价态,m为2-4的整数;n表示阴离子配体的价态,n为1-3的整数。
[0045]
如无特别说明,本发明中的压力均为绝压。
[0046]
与现有技术相比较,本发明提供的技术方案具有如下积极效果:
[0047]
本发明的技术方案加快了氰基的活化,减少了脱氨产物的生成,提升了目标产品收率,同时也缩短了反应时长,提高了生产效率。本发明的工艺可以实现双腈乙基脂环胺的转化率达到100%,双氨丙基脂环胺的选择性达到98%以上,脱氨副产物的选择性低于0.5%,单氨丙基脂环胺的选择性低于1%,其它产物的选择性低于0.5%。
具体实施方式
[0048]
下面结合实施例,对本发明作进一步的说明,但本发明不限于所列出的实施例。
[0049]
反应原料的来源:
[0050]
双腈乙基-环己胺:纯度≥99%,万华化学;
[0051]
双腈乙基-4,4
’‑
二氨基二环己基甲烷:纯度≥99%,万华化学;
[0052]
甲醇:纯度≥99.5%,阿拉丁试剂;
[0053]
乙醇:纯度≥99.5%,阿拉丁试剂;
[0054]
雷尼钴:grace公司;
[0055]
雷尼镍:grace公司;
[0056]
cocl2:纯度≥99.7%,阿拉丁试剂;
[0057]
linh2:纯度≥95%,阿拉丁试剂;
[0058]
knh2:纯度≥95%,阿拉丁试剂;
[0059]
licl:纯度≥99.9%,阿拉丁试剂;
[0060]
li2so4:纯度≥98.5%,阿拉丁试剂;
[0061]
nicl2:纯度≥98.5%,阿拉丁试剂;
[0062]
alcl3:纯度≥99.9%,默克试剂;
[0063]
al2(so4)3:纯度≥99.9%,阿拉丁试剂;
[0064]
coso4:纯度≥98%,阿拉丁试剂;
[0065]
ch3oli:纯度≥98%,阿拉丁试剂;
[0066]
c2h5ok:纯度≥95%,阿拉丁试剂;
[0067]
2,6-二叔丁基对甲苯酚:纯度≥99.5%,阿拉丁试剂;
[0068]
叔丁基对苯二酚:纯度≥98%,阿拉丁试剂。
[0069]
所用反应器为耐压反应釜。
[0070]
测试方法:
[0071]
气相色谱:采用安捷伦7890和db-5(30mm
×
0.25mmid
×
0.25μm),进样器温度为280℃,检测器温度为300℃。升温程序如下:起始柱温为50℃,保持2min;以5℃/min升温至80℃,保持0min;以15℃/min升温至300℃,保持15min。通过归一化法测定组分含量。
[0072]
本发明在加氢反应后,通过气相色谱分析,所得产物中双腈乙基-脂环胺的含量为0时,可确认反应完全,产物中主要为双氨丙基-脂环胺。
[0073]
实施例1
[0074]
催化剂制备:
[0075]
s1:在2mpa的nh3气氛下,升温至80℃,并采用半连续的方式将129.84g浓度为10wt%的cocl2的甲醇溶液缓慢添加至229.63g浓度为10wt%的linh2的甲醇溶液当中,连续搅拌3h后得到活性组分配体[coli(nh3)7]
3+
。
[0076]
s2:取53.0g licl以及6.67g alcl3同时溶于水中配成浓度为4wt%的盐溶液,升温至80℃下,再向其中逐滴加10.13g浓度为15wt%的ch3oli水溶液,在停止进料后立刻停止搅拌,保温4h后进行冷却降至室温,得到凝胶状的多孔物质。
[0077]
s3:在s2中的凝胶多孔类物质中加入277.51g的2,6-二叔丁基对甲苯酚进行搅拌洗脱2h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至100℃得到凝胶状态的大阴离子配体[lial(oh)7]
3-。
[0078]
s4:在100℃条件下,按照m1/m2元素摩尔比1/1的比例将s1中的液体状活性组分配体[coli(nh3)7]
3+
缓慢加入至s3中的凝胶状态大阴离子配体[lial(oh)7]
3-中,在超声条件下进行搅拌2h直至完全沉淀,过滤得到催化剂[coli(nh3)7]
3+
[lial(oh)7]
3-。
[0079]
加氢反应:
[0080]
反应釜中加入5g催化剂[coli(nh3)7]
3+
[lial(oh)7]
3-以及200g甲醇,分别用n2和h2置换3次,在保持h2的氛围下进行加热至70℃,补压h2至绝压8mpa,通过进料泵连续加入50g双氰乙基环己胺,进料结束之后反应25min至吸氢结束,将反应液收集并进行取样色谱分析;双氨丙基脂环胺的收率为98.9%,脱氨副产物的收率为0.3%,单氨丙基脂环胺的收率为0.4%,其它产物的收率为0.4%。
[0081]
实施例2
[0082]
催化剂制备:
[0083]
s1:3mpa的nh3气氛下,升温至120℃,并采用半连续的方式将64.8g浓度为20wt%的nicl2的乙醇溶液缓慢添加至413.48g浓度为20wt%的knh2的乙醇溶液当中,连续搅拌5h后得到活性组分配体[nik(nh3)7]
3+
。
[0084]
s2:取372.75g kcl以及66.7g alcl3同时溶于水中配成浓度为10wt%的盐溶液,升温至100℃下,再向其中逐滴加201.98g浓度为25wt%的c2h5ok水溶液,在停止进料后立刻停止搅拌,保温6h后进行冷却降至室温,得到凝胶状的多孔物质。
[0085]
s3:在s2中的凝胶多孔类物质中加入750.29g的2,6-二叔丁基对甲苯酚进行搅拌洗脱3h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至120℃得到凝胶状态的大阴离子配体[kal(oh)7]
3-。
[0086]
s4:在100℃条件下,按照m1/m2元素摩尔比1/1的比例将s1中的液体状活性组分配体[nik(nh3)7]
3+
缓慢加入至s3中的凝胶状态大阴离子配体[kal(oh)7]
3-中,在超声条件下进行搅拌3h直至完全沉淀,过滤得到催化剂[nik(nh3)7]
3+
[kal(oh)7]
3-。
[0087]
加氢反应:
[0088]
首先在反应釜中加入5g催化剂[nik(nh3)7]
3+
[kal(oh)7]
3-以及200g甲醇,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至120℃,补压h2至4mpa,通过进料泵连续加入500g双氰乙基环己胺,进料结束之后延长反应35min后至吸氢结束,将反应液过滤、取样色谱分析;双氨丙基脂环胺的收率为98.7%,脱氨副产物的收率为0.4%,单氨丙基脂环胺的收率为0.4%,其它产物的收率为0.5%。
[0089]
实施例3
[0090]
催化剂制备:
[0091]
s1:2mpa的nh3气氛下,升温至90℃,并采用半连续的方式将169.87g浓度为10wt%的agno3的甲醇溶液缓慢添加至153.09g浓度为15wt%的linh2的乙醇溶液当中,连续搅拌4h后得到活性组分配体[agli(nh3)3]
2+
。
[0092]
s2:取114.92g lino3以及21.30g al(no3)3同时溶于水中配成浓度为6wt%的盐溶液,升温至90℃下,再向其中逐滴加15.19g浓度为20wt%的ch3oli水溶液,在停止进料后立刻停止搅拌,保温5h后进行冷却降至室温,得到凝胶状的多孔物质。
[0093]
s3:在s2中的凝胶多孔类物质中加入284.73g的叔丁基对苯二酚进行搅拌洗脱2h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至110℃得到凝胶状态的大阴离子配体[lial(oh)5]-。
[0094]
s4:在100℃条件下,按照m1/m2元素摩尔比12的比例将s1中的液体状活性组分配体[agli(nh3)3]
2+
缓慢加入至s3中的凝胶状态大阴离子配体[lial(oh)5]-当中,在超声条件下进行搅拌2h直至完全沉淀,过滤得到催化剂[agli(nh3)3]
2+
[lial(oh)5]-2
。
[0095]
加氢反应:
[0096]
首先在反应釜中加入5g催化剂[agli(nh3)3]
2+
[lial(oh)5]-2
以及200g甲醇,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至80℃,补压h2至5mpa,通过进料泵连续加入200g双氰乙基-二氨基二环己基甲烷,进料结束之后延长反应10min后至吸氢结束,将反应液过滤、取样色谱分析;双氨丙基脂环胺的收率为99.5%,脱氨副产物的收率为0.2%,单氨丙基脂环胺的收率为0.2%,其它产物的收率为0.1%。
[0097]
实施例4
[0098]
催化剂制备:
[0099]
s1:3mpa的nh3气氛下,升温至90℃,并采用半连续的方式将61.50g浓度为20wt%的crcl2的乙醇溶液缓慢添加至413.48g浓度为20wt%的knh2的乙醇溶液当中,连续搅拌5h
后得到活性组分配体[crk(nh3)
10
]
4+
。
[0100]
s2:取372.75g kcl以及66.67g alcl3同时溶于水中配成浓度为10wt%的盐溶液,升温至100℃下,再向其中逐滴加201.98g浓度为25wt%的c2h5ok水溶液,在停止进料后立刻停止搅拌,保温6h后进行冷却降至室温,得到凝胶状的多孔物质。
[0101]
s3:在s2中的凝胶多孔类物质中加入748.31g的叔丁基对苯二酚进行搅拌洗脱3h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至110℃得到凝胶状态的大阴离子配体[kal(oh)6]
2-。
[0102]
s4:在110℃条件下,按照m1/m2元素摩尔比1/2的比例将s1中的液体状活性组分配体[crk(nh3)
10
]
4+
缓慢加入至s3中的凝胶状态大阴离子配体[kal(oh)6]
2-当中,在超声条件下进行搅拌3h直至完全沉淀,过滤得到催化剂[crk(nh3)
10
]
4+
[kal(oh)6]
2-2
。
[0103]
加氢反应:
[0104]
首先在反应釜中加入5g催化剂[crk(nh3)
10
]
4+
[kal(oh)6]
2-2
以及200g甲醇,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至110℃,补压h2至6mpa,通过进料泵连续加入300g双氰乙基-二氨基二环己基甲烷,进料结束之后延长反应20min后至吸氢结束,将反应液过滤、取样色谱分析;双氨丙基脂环胺的收率为99.2%,脱氨副产物的收率为0.2%,单氨丙基脂环胺的收率为0.3%,其它产物的收率为0.3%。
[0105]
实施例5
[0106]
催化剂制备:
[0107]
s1:在2mpa的nh3气氛下,升温至100℃,并采用半连续的方式将106.4g浓度为15wt%的cuso4的甲醇溶液缓慢添加至153.09g浓度为15wt%的linh2的甲醇溶液当中,连续搅拌4h后得到活性组分配体[culi(nh3)5]
3+
。
[0108]
s2:取274.85g li2so4以及68.43g al2(so4)3同时溶于水中配成浓度为8wt%的盐溶液,升温至90℃下,再向其中逐滴加30.38g浓度为20wt%的ch3oli水溶液,在停止进料后立刻停止搅拌,保温5h后进行冷却降至室温,得到凝胶状的多孔物质。
[0109]
s3:在s2中的凝胶多孔类物质中加入277.51g的叔丁基对苯二酚进行搅拌洗脱2h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至110℃得到凝胶状态的大阴离子配体[lial(oh)7]
3-。
[0110]
s4:在110℃条件下,按照m1元素摩尔比1/1的比例将s1中的液体状活性组分配体[culi(nh3)5]
3+
缓慢加入至s3中的凝胶状态大阴离子配体[lial(oh)7]
3-中,在超声条件下进行搅拌2h直至完全沉淀,过滤得到催化剂[culi(nh3)5]
3+
[lial(oh)7]
3-。
[0111]
加氢反应:
[0112]
反应釜中加入5g催化剂[culi(nh3)5]
3+
[lial(oh)7]
3-以及200g甲醇,分别用n2和h2置换3次,在保持h2的氛围下进行加热至100℃,补压h2至绝压5mpa,通过进料泵连续加入250g双氰乙基环己胺,进料结束之后反应25min至吸氢结束,将反应液收集并进行取样色谱分析;双氨丙基脂环胺的收率为99.1%,脱氨副产物的收率为0.4%,单氨丙基脂环胺的收率为0.3%,其它产物的收率为0.2%。
[0113]
实施例6
[0114]
催化剂制备:
[0115]
s1:在3mpa的nh3气氛下,升温至110℃,并采用半连续的方式将90.87g浓度为
15wt%的zncl2的乙醇溶液缓慢添加至661.56g浓度为10wt%的knh2的乙醇溶液当中,连续搅拌3h后得到活性组分配体[znk(nh3)5]
3+
。
[0116]
s2:取254.34g licl以及40g alcl3同时溶于水中配成浓度为5wt%的盐溶液,升温至80℃下,再向其中逐滴加100.99g浓度为20wt%的c2h5ok水溶液,在停止进料后立刻停止搅拌,保温4h后进行冷却降至室温,得到凝胶状的多孔物质。
[0117]
s3:在s2中的凝胶多孔类物质中加入916.22g的2,6-二叔丁基对甲苯酚进行搅拌洗脱2h,将之进行抽滤后得到相应固态物质,再分别使用乙醇和水冲洗3次,将得到的固态物质再进一步加热至100℃得到凝胶状态的大阴离子配体[kal(oh)7]
3-。
[0118]
s4:在100℃条件下,按照m1元素摩尔比1/1的比例将s1中的液体状活性组分配体[znk(nh3)5]
3+
缓慢加入至s3中的凝胶状态大阴离子配体[kal(oh)7]
3-中,在超声条件下进行搅拌2h直至完全沉淀,过滤得到催化剂[znk(nh3)5]
3+
[kal(oh)7]
3-。
[0119]
加氢反应:
[0120]
反应釜中加入5g催化剂[znk(nh3)5]
3+
[kal(oh)7]
3-以及200g甲醇,分别用n2和h2置换3次,在保持h2的氛围下进行加热至90℃,补压h2至绝压7mpa,通过进料泵连续加入20g双氰乙基环己胺,进料结束之后反应35min至吸氢结束,将反应液收集并进行取样色谱分析;双氨丙基脂环胺的收率为98.6%,脱氨副产物的收率为0.5%,单氨丙基脂环胺的收率为0.4%,其它产物的收率为0.5%。
[0121]
对比例1
[0122]
与实施例1的区别在于所用的催化剂为雷尼镍催化剂。
[0123]
首先在反应釜中加入3g催化剂雷尼镍催化剂以及200g甲醇,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至70℃,补压h2至8mpa,通过进料泵连续加入50g双氰乙基环己胺,进料结束之后延长反应35min后至吸氢结束,将反应液过滤、取样色谱分析;双氨丙基脂环胺的收率为97.9%,脱氨副产物的收率为0.7%,单氨丙基脂环胺的收率为0.6%,其它产物的收率为0.8%。
[0124]
对比例2
[0125]
与实施例3的区别在于所用的催化剂为雷尼钴催化剂。
[0126]
首先在反应釜中加入5g雷尼钴催化剂以及200g甲醇,接着分别用n2和h2置换3次,在保持h2的氛围下进行加热至80℃,补压h2至5mpa,通过进料泵连续加入200g双氰乙基-二氨基二环己基甲烷,进料结束之后延长反应25min后至吸氢结束,将反应液过滤、取样色谱分析;双氨丙基脂环胺的收率为98.5%,脱氨副产物的收率为0.7%,单氨丙基脂环胺的收率为0.6%,其它产物的收率为0.2%。
[0127]
本发明的应用不限于以上的实施例,对于本领域技术人员来说,凡在本发明精神下所作相关任何修饰或变更,皆包括在本发明意图保护之范畴。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1