一种肉灵芝、包含肉灵芝的高浓度口服液及其制备方法与流程
1.本发明属于食药用菌类培育领域,具体公开了一种肉灵芝、包含肉灵芝的高浓度口服液及其制备方法。
背景技术:
2.肉灵芝(meat-like ganoderma lucidum,mgl)民间又称太岁,目前对肉灵芝的实验研究还未确定它的生物学分类,是神秘的“未知生物”,不属于其他三种常见生物类群(动物,植物,微生物),被称为第四生命体。它们被发现的位置一般是在地下或河边,说明这种“未知生物”生活环境应该在土壤中或水中。研究人员对“未知生物”的生物组成进行分离鉴定后发现,“未知生物”中含有大量的黏菌和少量的霉菌、细菌和酵母菌,又因为“不明生物”主要由微生物组成,故专称为“特大型罕见黏菌复合物”。目前对肉灵芝研究过少,主要信息来源于民间传说和个别新闻报道。在明代医学家李时珍的《本草纲目》中提到,"肉芝状如肉,乃生物也,白者如截肪,黄者如紫金,皆光明洞彻如坚冰也"。《神农本草经》也有记载到"肉灵芝,无毒,补中、益精气、久服轻身不老”。两者都是描述肉灵芝的药用价值。目前市场上的肉灵芝均为野生品种,目前也有多篇发明尝试人工培育肉灵芝,但是其菌种均来自于野生肉灵芝,是直接将野生肉灵芝的一部分切割或者浸出后,再进行人工培育。比如专利cn111534441a-一种肉灵芝的快速培育方法、肉灵芝口服液及其制备方法,公开了所述快速培育方法包括以下步骤:第一步、获取原生肉灵芝菌种;第二步、多级培养获取养殖肉灵芝菌种,分为一级肉灵芝菌种的培养和二级肉灵芝菌种的培养;第三步、用二级肉灵芝菌种进行人工养殖,可得养殖肉灵芝。cn103922819a-一种肉灵芝营养液制备方法及肉灵芝快速培育方法,公开了包括以下步骤:a选取水果0.08-0.50重量份,禽蛋0.03-0.20重量份,打浆,过滤;b加入蜂蜜0.01-0.25重量份,搅拌均匀,形成营养液;c将营养液置于肉灵芝原液中,按重量比营养液:肉灵芝原液=1:5-12的比例加入;d在17-30℃的环境下,放置完全成型,形成肉灵芝;e取出肉灵芝,置于矿泉水中,即可进行下步繁育。cn200810126198.2中药培养养殖肉灵芝方法及养殖肉灵芝保健品的制备方法,公开了中药培养养殖肉灵芝的方法为通过将肉灵芝和冬虫夏草、五味子、甘草、红景天、人参、山药、大枣、天山雪莲、猴头、银耳、香菇和枸杞及肉灵芝原液经发酵获得中药培养养殖肉灵芝,上述发明其品质受原始菌种的质量限制,无法规模化培养,并且培育时间长(均需要一个月以上),产量少,培养基昂贵,无法连续培养,因此有必要对肉灵芝的从头培育进行研究。
技术实现要素:
3.为了解决上述问题,本发明公开了一种肉灵芝、包含肉灵芝的高浓度口服液及其制备方法。
4.本发明的技术方案如下:
5.一种肉灵芝,其特征在于,由以下步骤培育而成:
6.1)菌种制备:将枯草芽孢杆菌(bacillus subtilis)、嗜酸乳杆菌
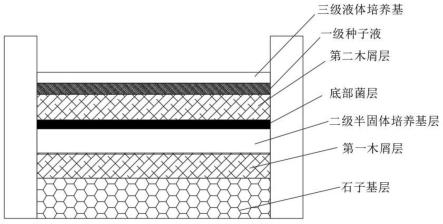
(lactobacillusacidophilus)、保加利亚乳杆菌(lactobacillusbulgaricus)、干酪乳杆菌(lactobacillus casei)、产朊假丝酵母(candida utilis)、地衣芽孢杆菌(bacillus licheniformis)、灰团网黏菌(arcyria cinerea)、灯笼黏菌(dictydiumcancelatum)、淡黄绒泡黏菌(physarummelleum)、灰葡萄孢菌(botrytis cinerea)分别单独培养,随后混合,制备成浓度为od600=1-1.8的种子原液;
7.2)一级培养:配置一级液体培养基:牛肉膏5-10g/l、蛋白胨10-20g/l、nacl 5-10g/l、半乳糖5-10g/l,ph7-7.6;将步骤1制备的菌种接种入液体培养基,接种量为体积比1:100-200,先三角瓶静置培养24-48h,温度25-30℃;随后摇瓶培养36-48h,rpm80-150,得的一级种子液;
8.3)二级培养:配置二级半固体培养基:琼脂粉4-10g/l、酵母膏10-20g/l、全脂牛奶粉20-40g/l、ε-吡咯赖氨酸10-20g/l、异亮氨酸5-10g/l、nacl5-10g/l、ph7-7.6;
9.先用石子铺设石子基层,随后在石子基层上铺设第一木屑层,最后在第一木屑层上均匀铺设所述二级半固体培养基,形成二级半固体培养基层;将步骤2获得一级种子液均匀喷洒在所述二级半固体培养基层上;培养24-48h,温度25-30℃,获得底部菌层;
10.4)发酵:向底部菌层上铺设第二木屑层,随后再次将步骤2获得一级种子液均匀喷洒在第二木屑层上;随后每隔24-36h,在第二木屑层上喷洒三级液体培养基,所述三级液体培养基为:酵母膏10-20g/l、半乳糖5-10g/l、ε-吡咯赖氨酸10-20g/l、异亮氨酸5-10g/l、nacl 5-10g/l、ph7-7.6;控制培养温度30-40℃,湿度70-90%。
11.进一步的,上述一种肉灵芝,还包括步骤5)收获:在发酵7-10天后收获所述肉灵芝,每次收获割除第二木屑层上方不超过三分之二的肉灵芝,剩余肉灵芝重复步骤4喷洒三级液体培养基的步骤进行循环培养。
12.进一步的,上述一种肉灵芝,步骤1中所述每ml种子原液中,由以下菌落数cfu的菌株构成:
[0013][0014]
进一步的,上述一种肉灵芝,所述石子基层的厚度为30-60cm,底部做防水设置;所述第一木屑层的厚度为20-40cm;所述半固体培养基层的厚度为10-20cm;所述第二木屑层的厚度为25-35cm。所述石子优选花岗岩石子,平均粒径2cm;所述木屑优选杉木屑。
[0015]
进一步的,上述一种肉灵芝,所述步骤3或者4中的一级种子液与所述二级半固体培养基层的体积比为1:100-150。
[0016]
进一步的,上述一种肉灵芝,所述步骤4中每次三级液体培养基的喷洒量与所述二级半固体培养基层的体积之比为1:10-1:20。
[0017]
进一步的,一种肉灵芝提取液,由以下步骤制得:
[0018]
将肉灵芝清洗后-80℃真空冻干,制成肉灵芝冻干粉后,质量比1:5-10溶于水中。
[0019]
进一步的,一种包含肉灵芝提取物的高浓度口服液,由以下重量份的原料制成:
[0020][0021]
上述高浓度口服液由以下步骤制成:将上述重量粉的原料均匀混合,按照重量比1:5-1:10混悬于超纯水中。
[0022]
进一步的,上述肉灵芝或包含肉灵芝的口服液在制备降低血脂或者血糖的药物或者保健品中的用途。
[0023]
进一步的,上述肉灵芝或包含肉灵芝的口服液在制备增强卡培他滨疗效或者增强免疫力的药物或者保健品中的用途。
[0024]
本发明具有如下有益效果:一种肉灵芝、包含肉灵芝的高浓度口服液及其制备方法和应用。本发明克服了传统的肉灵芝培育中需要野生肉灵芝原液,培育时间过程,培养基原料昂贵,成分不均一,质量难以控制的缺陷,首次公开了人工的使用数十种菌作为起始菌,从头培育肉灵芝的一种工业上可行的方法,本发明创造性的将灰团网黏菌(arcyria cinerea)、灯笼黏菌(dictydium cancelatum)、淡黄绒泡黏菌(physarummelleum)三种黏菌和枯草芽孢杆菌(bacillus subtilis)以及产朊假丝酵母(candida utilis)等菌种混合培育,通过常用的低成本培养基,再添加少量ε-吡咯赖氨酸和异亮氨酸,在恰当条件下就可以快速的生长成为肉灵芝,产量高,质量均一可控,可持续培育,为肉灵芝的工业化生产开辟了新的道路;同时本发明还发现,在动物实验中,本发明所制备的肉灵芝,具有较为明显的降低血糖和血脂的作用,以及促进某些化疗药物疗效和降低化疗副作用,增加免疫力的功效,在相关药物和保健品中具有良好的应用前景。
[0025]
说明书附图
[0026]
附图1为本发明所述的肉灵芝培育的多层结构示意图;
[0027]
附图2为本发明所制备获得的肉灵芝实例图;
[0028]
附图3本发明所制备获得的肉灵芝的内部丝状结构图。
具体实施方式
[0029]
一种肉灵芝,由以下步骤培育而成:
[0030]
1)菌种制备:将枯草芽孢杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、产朊假丝酵母、地衣芽孢杆菌、灰团网黏菌、灯笼黏菌、淡黄绒泡黏菌、灰葡萄孢菌分别单独培养,随后混合,制备成浓度为od600=1-1.8的种子原液;
[0031]
2)一级培养:配置一级液体培养基:牛肉膏5-10g/l、蛋白胨10-20g/l、nacl 5-10g/l、半乳糖5-10g/l,ph7-7.6;将步骤1制备的菌种接种入液体培养基,接种量为体积比1:100-200,先三角瓶静置培养24-48h,温度25-30℃;随后摇瓶培养36-48h,rpm80-150,得的一级种子液;
[0032]
3)二级培养:配置二级半固体培养基:琼脂粉4-10g/l、酵母膏10-20g/l、全脂牛奶粉20-40g/l、ε-吡咯赖氨酸10-20g/l、异亮氨酸5-10g/l、nacl5-10g/l、ph7-7.6;
[0033]
先用石子铺设石子基层,随后在石子基层上铺设第一木屑层,最后在第一木屑层上均匀铺设所述二级半固体培养基,形成二级半固体培养基层;将步骤2获得一级种子液均匀喷洒在所述二级半固体培养基层上;培养24-48h,温度25-30℃,获得底部菌层;
[0034]
4)发酵:向底部菌层上铺设第二木屑层,随后再次将步骤2获得一级种子液均匀喷洒在第二木屑层上;随后每隔24-36h,在第二木屑层上喷洒三级液体培养基,所述三级液体培养基为:酵母膏10-20g/l、半乳糖5-10g/l、ε-吡咯赖氨酸10-20g/l、异亮氨酸5-10g/l、nacl 5-10g/l、ph7-7.6;控制培养温度30-40℃,湿度70-90%。
[0035]
5)收获:在发酵7-10天后收获所述肉灵芝,每次收获割除第二木屑层上方不超过三分之二的肉灵芝,剩余肉灵芝重复步骤4喷洒三级液体培养基的步骤进行循环培养。
[0036]
所述每ml种子原液中,由以下菌落数cfu的菌株构成:
[0037][0038][0039]
所述石子基层的厚度为30-60cm,底部做防水设置;所述第一木屑层的厚度为20-40cm;所述半固体培养基层的厚度为10-20cm;所述第二木屑层的厚度为25-35cm。
[0040]
所述步骤3或者4中的一级种子液与所述二级半固体培养基层的体积比为1:100-150。
[0041]
所述每次三级液体培养基的喷洒量与所述二级半固体培养基层的体积之比为1:10-1:20。
[0042]
一种肉灵芝提取液,由以下步骤制得:
[0043]
将肉灵芝清洗后-80℃真空冻干,制成肉灵芝冻干粉后,质量比1:5-10溶于水中。
[0044]
一种包含肉灵芝提取物的高浓度口服液,由以下重量份的原料制成:
[0045][0046]
上述高浓度口服液由以下步骤制成:将上述重量粉的原料均匀混合,按照重量比1:5-1:10混悬于超纯水中。
[0047]
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
[0048]
本发明实施例中使用的试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规试剂产品。
[0049]
ε-吡咯赖氨酸(cas no.74509-14-1)购自昊睿化学(上海)有限公司。所有原始菌种商业化购自宁波明舟生物科技有限公司。
[0050]
枯草芽孢杆菌(bacillus subtilis)、货号bmz135812;
[0051]
嗜酸乳杆菌(lactobacillus acidophilus)、货号bmz133552;
[0052]
保加利亚乳杆菌(lactobacillus bulgaricus)、货号bmz124642;
[0053]
干酪乳杆菌(lactobacillus casei)、货号bmz134812;
[0054]
产朊假丝酵母(candida utilis)、货号bmz123128;
[0055]
地衣芽孢杆菌(bacillus licheniformis)、货号bmz135439;
[0056]
灰团网黏菌(arcyria cinerea)、bmz126340;
[0057]
灯笼黏菌(dictydium cancelatum)、bmz126346;
[0058]
淡黄绒泡黏菌(physarum melleum)、bmz126349;
[0059]
灰葡萄孢菌(botrytis cinerea)、货号bmz080202。
[0060]
实施例1
[0061]
制备例
[0062]
一种肉灵芝,由以下步骤培育而成:
[0063]
1)菌种制备:将枯草芽孢杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、产朊假丝酵母、地衣芽孢杆菌、灰团网黏菌、灯笼黏菌、淡黄绒泡黏菌、灰葡萄孢菌分别单独培养,随后混合,制备成浓度为od600=1的种子原液;
[0064]
2)一级培养:配置一级液体培养基:牛肉膏5g/l、蛋白胨10g/l、nacl 5g/l、半乳糖5g/l,ph7;将步骤1制备的菌种接种入液体培养基,接种量为体积比1:200,先三角瓶静置培养24,温度25℃;随后摇瓶培养36h,rpm80,得的一级种子液;
[0065]
3)二级培养:配置二级半固体培养基:琼脂粉4g/l、酵母膏10g/l、全脂牛奶粉20g/
l、ε-吡咯赖氨酸10g/l、异亮氨酸5g/l、nacl 5g/l、ph7;
[0066]
先用石子铺设石子基层,随后在石子基层上铺设第一木屑层,最后在第一木屑层上均匀铺设所述二级半固体培养基,形成二级半固体培养基层;将步骤2获得一级种子液均匀喷洒在所述二级半固体培养基层上;培养24h,温度25℃,获得底部菌层;
[0067]
4)发酵:向底部菌层上铺设第二木屑层,随后再次将步骤2获得一级种子液均匀喷洒在第二木屑层上;随后每隔24h,在第二木屑层上喷洒三级液体培养基,所述三级液体培养基为:酵母膏10g/l、半乳糖5g/l、ε-吡咯赖氨酸10g/l、异亮氨酸5g/l、nacl 5g/l、ph7;控制培养温度30℃,湿度70%。
[0068]
5)收获:在发酵7天后收获所述肉灵芝,每次收获割除第二木屑层上方不超过三分之二的肉灵芝,剩余肉灵芝重复步骤4喷洒三级液体培养基的步骤进行循环培养。
[0069]
所述每ml种子原液中,由以下菌落数cfu的菌株构成:
[0070][0071]
所述石子基层的厚度为30cm,底部做防水设置;所述第一木屑层的厚度为20cm;所述半固体培养基层的厚度为10cm;所述第二木屑层的厚度为25cm。
[0072]
所述步骤3或者4中的一级种子液与所述二级半固体培养基层的体积比为1:100。
[0073]
所述每次三级液体培养基的喷洒量与所述二级半固体培养基层的体积之比为1:10。
[0074]
计算收率,每7天可收获肉灵芝86g/l(二级半固体培养基)。
[0075]
一种肉灵芝提取液,由以下步骤制得:
[0076]
将肉灵芝清洗后-80℃真空冻干,制成肉灵芝冻干粉后,质量比1:10溶于水中。
[0077]
一种包含肉灵芝提取物的高浓度口服液,由以下重量份的原料制成:
[0078][0079]
上述高浓度口服液由以下步骤制成:将上述重量粉的原料均匀混合,按照重量比1:10混悬于超纯水中。
[0080]
实施例2
[0081]
制备例
[0082]
一种肉灵芝,由以下步骤培育而成:
[0083]
1)菌种制备:将枯草芽孢杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、产朊假丝酵母、地衣芽孢杆菌、灰团网黏菌、灯笼黏菌、淡黄绒泡黏菌、灰葡萄孢菌分别单独培养,随后混合,制备成浓度为od600=1.5的种子原液;
[0084]
2)一级培养:配置一级液体培养基:牛肉膏7.5g/l、蛋白胨15g/l、nacl7.5g/l、半乳糖7.5g/l,ph7.3;将步骤1制备的菌种接种入液体培养基,接种量为体积比1:150,先三角瓶静置培养36h,温度28℃;随后摇瓶培养42h,rpm100,得的一级种子液;
[0085]
3)二级培养:配置二级半固体培养基:琼脂粉7g/l、酵母膏15g/l、全脂牛奶粉30g/l、ε-吡咯赖氨酸15g/l、异亮氨酸7.5g/l、nacl7.5g/l、ph7.3;
[0086]
先用石子铺设石子基层,随后在石子基层上铺设第一木屑层,最后在第一木屑层上均匀铺设所述二级半固体培养基,形成二级半固体培养基层;将步骤2获得一级种子液均匀喷洒在所述二级半固体培养基层上;培养36h,温度28℃,获得底部菌层;
[0087]
4)发酵:向底部菌层上铺设第二木屑层,随后再次将步骤2获得一级种子液均匀喷洒在第二木屑层上;随后每隔30h,在第二木屑层上喷洒三级液体培养基,所述三级液体培养基为:酵母膏15g/l、半乳糖7.5g/l、ε-吡咯赖氨酸15g/l、异亮氨酸7.5g/l、nacl 7.5g/l、ph7.3;控制培养温度35℃,湿度80%。
[0088]
5)收获:在发酵7天后收获所述肉灵芝,每次收获割除第二木屑层上方不超过三分之二的肉灵芝,剩余肉灵芝重复步骤4喷洒三级液体培养基的步骤进行循环培养。
[0089]
所述每ml种子原液中,由以下菌落数cfu的菌株构成:
[0090][0091]
所述石子基层的厚度为45cm,底部做防水设置;所述第一木屑层的厚度为30cm;所述半固体培养基层的厚度为15cm;所述第二木屑层的厚度为30cm。
[0092]
所述步骤3或者4中的一级种子液与所述二级半固体培养基层的体积比为1:125。
[0093]
所述每次三级液体培养基的喷洒量与所述二级半固体培养基层的体积之比为1:15。
[0094]
计算收率,每7天可收获肉灵芝112g/l(二级半固体培养基)。
[0095]
上述的培育的多层结构示意图如附图1所示,制备获得的肉灵芝外观如附图2所示,其内部丝状结构如附图3所示。
[0096]
一种肉灵芝提取液,由以下步骤制得:
[0097]
将肉灵芝清洗后-80℃真空冻干,制成肉灵芝冻干粉后,质量比1:8溶于水中。
[0098]
一种包含肉灵芝提取物的高浓度口服液,由以下重量份的原料制成:
[0099][0100]
上述高浓度口服液由以下步骤制成:将上述重量粉的原料均匀混合,按照重量比1:8混悬于超纯水中。
[0101]
实施例3
[0102]
制备例
[0103]
一种肉灵芝,由以下步骤培育而成:
[0104]
1)菌种制备:将枯草芽孢杆菌、嗜酸乳杆菌、保加利亚乳杆菌、干酪乳杆菌、产朊假丝酵母、地衣芽孢杆菌、灰团网黏菌、灯笼黏菌、淡黄绒泡黏菌、灰葡萄孢菌分别单独培养,
随后混合,制备成浓度为od600=1.8的种子原液;
[0105]
2)一级培养:配置一级液体培养基:牛肉膏10g/l、蛋白胨20g/l、nacl 10g/l、半乳糖10g/l,ph7.6;将步骤1制备的菌种接种入液体培养基,接种量为体积比1:100,先三角瓶静置培养48h,温度30℃;随后摇瓶培养48h,rpm150,得的一级种子液;
[0106]
3)二级培养:配置二级半固体培养基:琼脂粉10g/l、酵母膏20g/l、全脂牛奶粉40g/l、ε-吡咯赖氨酸20g/l、异亮氨酸10g/l、nacl10g/l、ph7.6;
[0107]
先用石子铺设石子基层,随后在石子基层上铺设第一木屑层,最后在第一木屑层上均匀铺设所述二级半固体培养基,形成二级半固体培养基层;将步骤2获得一级种子液均匀喷洒在所述二级半固体培养基层上;培养48h,温度30℃,获得底部菌层;
[0108]
4)发酵:向底部菌层上铺设第二木屑层,随后再次将步骤2获得一级种子液均匀喷洒在第二木屑层上;随后每隔36h,在第二木屑层上喷洒三级液体培养基,所述三级液体培养基为:酵母膏20g/l、半乳糖10g/l、ε-吡咯赖氨酸20g/l、异亮氨酸10g/l、nacl 10g/l、ph7.6;控制培养温度40℃,湿度90%。
[0109]
5)收获:在发酵7天后收获所述肉灵芝,每次收获割除第二木屑层上方不超过三分之二的肉灵芝,剩余肉灵芝重复步骤4喷洒三级液体培养基的步骤进行循环培养。
[0110]
所述每ml种子原液中,由以下菌落数cfu的菌株构成:
[0111][0112]
所述石子基层的厚度为60cm,底部做防水设置;所述第一木屑层的厚度为40cm;所述半固体培养基层的厚度为20cm;所述第二木屑层的厚度为35cm。
[0113]
所述步骤3或者4中的一级种子液与所述二级半固体培养基层的体积比为1:150。
[0114]
所述每次三级液体培养基的喷洒量与所述二级半固体培养基层的体积之比为1:20。
[0115]
计算收率,每7天可收获肉灵芝123g/l(二级半固体培养基)。
[0116]
一种肉灵芝提取液,由以下步骤制得:
[0117]
将肉灵芝清洗后-80℃真空冻干,制成肉灵芝冻干粉后,质量比1:10溶于水中。
[0118]
一种包含肉灵芝提取物的高浓度口服液,由以下重量份的原料制成:
[0119][0120]
上述高浓度口服液由以下步骤制成:将上述重量粉的原料均匀混合,按照重量比1:10混悬于超纯水中。
[0121]
实施例4
[0122]
根据实施例1-3的收率情况可发现,根据实施例2的制备参数,可以在收率和培养基的投入成本之间取得平衡,下面,以实施例2的制备参数为基准,进一步研究不同菌种(对比例1-4)和不同的培养基之间(对比例5-8)对肉灵芝培育的影响,其分析比较见表1和表2
[0123]
表1调整菌种对肉灵芝培育的影响
[0124] 实施例2对比例1对比例2对比例3对比例4枯草芽孢杆菌√√√√
×
嗜酸乳杆菌√√√√√保加利亚乳杆菌√√√√√干酪乳杆菌√√√√√产朊假丝酵母√√√√√地衣芽孢杆菌√√√√√灰团网黏菌√√√
×
√灯笼黏菌√√
××
√淡黄绒泡黏菌√
×××
√灰葡萄孢菌√√√√√肉灵芝收率g/l1125112021
[0125]
根据表1的数据可以看出,灰团网黏菌、灯笼黏菌、淡黄绒泡黏菌同时存在时,产量最大,达到112g/l,当缺少淡黄绒泡黏菌时,产量减半,当再缺乏灯笼黏菌时,产量降低为原来的十分之一,可以看出三种黏菌在肉灵芝的培育中产生了很强的协同增效作用,同时,当枯草芽孢杆菌缺失时,产量降低为原来的五分之一,可以看出,枯草芽孢杆菌与上述三种黏菌也产生了协同增效作用。
[0126]
表2调整培养基成分对肉灵芝培育的影响
[0127][0128]
根据表2的数据可以看出,当一级液体培养基中的半乳糖替换为蔗糖时,产率会下降15%,当二级半固体培养基中的酵母膏替换为牛肉膏时,产率也会下降15%左右,当二级半固体培养基中的全脂牛奶粉替换为蔗糖时,产率下降的更大,可见全脂奶粉比蔗糖对于肉灵芝的培育具有更好的效果;当使用赖氨酸替换ε-吡咯赖氨酸时,肉灵芝的产量急剧下降,可以看出ε-吡咯赖氨酸对于本发明中的肉灵芝的生长具有关键的作用,有可能ε-吡咯赖氨酸对于本发明中的某些黏菌合成某些蛋白质具有关键的促进作用,值得进一步的研究其机理。
[0129]
实施例5
[0130]
本实施例研究实施例2制备的包含肉灵芝提取物的高浓度口服液(以下简称口服液)对荷瘤模型小鼠抗肿瘤及免疫调节作用
[0131]
1.实验材料
[0132]
1.1实验动物:雌性balb/c小鼠,120只,7周龄,购自鼠来宝(武汉)生物科技有限公司,s-180小鼠腹水瘤细胞购自上海素冉生物科技有限公司。
[0133]
1.2主要试剂:il-2、tnf-y的elisa检测试剂盒(上海酶联生物),卡培他滨(齐鲁制药有限公司)。
[0134]
1.3主要仪器:multiskan fc全自动酶标仪(赛默飞世尔(上海)仪器有限公司。
[0135]
2.实验方法
[0136]
荷瘤小鼠制备与处理:常规复苏s180细胞,取对数生长期的细胞pbs洗涤三次,调整细胞浓度为1x107/ml,取1ml细胞悬液注射到小鼠腹腔中,7天后待小鼠腹水明显时,抽取腹水,调整细胞浓度为1
×
107/ml:注射到小鼠左侧腋下皮下,0.1ml/只。24小时后随机分为6组。1组为模型组,2组为卡培他滨对照组;3组为口服液低剂量组:4组为口服液低剂量+卡培他滨组:5组为口服液高剂量组:6组为口服液高剂量+卡培他滨组。在接种肿瘤细胞2周时2组、4组和6组口服卡培他滨25mg/kg,连续五天,3组-6组同时分别用低剂量(0.2ml/10g)和高剂量(0.4m1/10g)灌胃,1组和2组用等量生理盐水灌胃,每日一次。共5周。末次灌胃后24小时称重,眼球放血,分离血清,用elisa法检测血清中il-2和ifn-y;剥离肿瘤组织,电子天
平称取瘤重。
[0137]
3.实验结果
[0138]
3.1口服液对荷瘤小鼠瘤重的影响
[0139]
表3口服液对荷瘤小鼠瘤重的影响
[0140]
组别n(只,去除死亡)瘤重(平均值g)模型组172.63
±
0.12卡培他滨对照组191.64
±
0.09口服液低剂量组182.67
±
0.13口服液低剂量+卡培他滨组201.51
±
0.06口服液高剂量组192.71
±
0.15口服液高剂量+卡培他滨组201.43
±
0.08
[0141]
结果显示卡培他滨组及卡培他滨联合低剂量和高剂量组口服液的瘤重明显低于模型组(见表3),而口服液高剂量和低剂量组与模型组有统计学意义。该结果表明,单独使用口服液,其低剂量和高剂量组对肿瘤组织无抑制作用,但联合使用卡培他滨对肿瘤组织有抑制作用,并且其抑制作用大于卡培他滨单独使用时对肿瘤组织的抑制作用,且与口服液的剂量正相关,说明口服液能够促进卡培他滨抑制重量,且成剂量依赖性。
[0142]
3.2口服液对荷瘤小鼠il-2、ifn-γ的影响。
[0143]
表4荷瘤小鼠血清中的il-2的变化
[0144]
组别n(只,去除死亡)il-2(pg/ml)模型组1728.21
±
2.11卡培他滨对照组1929.52
±
2.43口服液低剂量组1828.32
±
3.15口服液低剂量+卡培他滨组2034.56
±
3.56口服液高剂量组1928.43
±
2.21口服液高剂量+卡培他滨组2037.83
±
4.24
[0145]
结果显示口服液高剂量组及卡培他滨联合低剂量和高剂量组的il-2分泌明显高于模型组及卡培他滨组(见表4),而低剂量组与模型组及卡培他滨组对比也有显著提高。该结果表明,单独使用低剂量、高剂量口服液或卡培他滨联合使用口服液可提高机体il-2的水平,并与口服液剂量成正相关。
[0146]
表5荷瘤小鼠血清中的ifn-γ的变化
[0147]
组别n(只,去除死亡)ifn-γ(pg/ml)模型组1741.24
±
3.25卡培他滨对照组1943.15
±
3.56口服液低剂量组1842.67
±
3.79口服液低剂量+卡培他滨组2045.28
±
4.11口服液高剂量组1942.81
±
3.67口服液高剂量+卡培他滨组2047.29
±
4.26
[0148]
结果显示卡培他滨联合口服液的ifn-γ分泌明显高于各组(见表5),并与口服液
的剂量正相关,而其余各组对比均无统计学意义,该结果表明,使用卡培他滨联合使用口服液可提高机体ifn-γ的水平。
[0149]
实施例6
[0150]
本实施例研究实施例2制备的包含肉灵芝提取物的高浓度口服液(以下简称口服液)对肥胖模型小鼠血糖血脂调节作用。
[0151]
1.实验材料
[0152]
1.1实验动物:c57bl/6j小鼠,60只,4周龄,购自鼠来宝(武汉)生物科技有限公司。
[0153]
1.2主要试剂:高脂饲料购自协同生物,货号xthf60(60%脂肪供能高脂饲料),血清甘油三酯,血糖检测试剂盒(美国贝克曼库尔特)。
[0154]
1.3主要仪器:multiskan fc全自动酶标仪(赛默飞世尔(上海)仪器有限公司,全自动生化分析仪(ua5800美国贝克曼库尔特)。
[0155]
2.实验方法
[0156]
2.1实验动物的分组与处理
[0157]
c57bl/6j小鼠,120只,4周龄,基础饲料,自由饮水喂养适应3天后,随机分为5组,每组24只。1组:基础饲料对照组;2组为高脂饲料组;3组为高脂饲料+低剂量口服液组;4组为高脂饲料+中剂量口服液组;5组为高脂饲料+高剂量口服液组。1组采用基础饲料喂养,自由摄食饮水;2-5组采用高脂饲料喂养,自由摄食饮水。每周称取体重两次。实验第四周造模成功后,3-5组分别给与低剂量口服液(0.2ml/10g),中剂量口服液(0.4ml/10g)和高剂量口服液(0.8/10g)口服液灌胃,每日一次。1-2组用等量生理盐水灌胃。连续灌胃12周后,小鼠眼球放血,3000转/min,分离血清,进行血糖、血脂检测。
[0158]
3.实验结果
[0159]
3.1包含肉灵芝提取物的高浓度口服液(以下简称口服液)对高脂饲料小鼠血糖的影响,结果见表6
[0160]
表6口服液对高脂饲料小鼠血糖的影响
[0161][0162]
表6的结果表明各高脂饲料组小鼠的血糖明显高于基础饲料对照组,各剂量口服液组小鼠的血糖与高脂饲料对照组随着口服液剂量的增加而降低,说明包含肉灵芝提取物的高浓度口服液能够降低高脂饲料组小鼠的血糖,并且具有剂量依赖性。其原因尚不清楚,可能是本口服液可以整体上提高小鼠的新陈代谢。
[0163]
3.2包含肉灵芝提取物的高浓度口服液(以下简称口服液)对高脂饲料小鼠血脂的
影响,结果见表7
[0164]
表7口服液对高脂饲料小鼠血脂的影响
[0165][0166]
表7的结果表明,各高脂饲料组小鼠的血脂明显高于基础饲料对照组,各剂量口服液组小鼠的血脂与高脂饲料对照组随着口服液剂量的增加而降低,说明包含肉灵芝提取物的高浓度口服液能够降低高脂饲料组小鼠的血脂,并且具有剂量依赖性。其原因尚不清楚,可能是本口服液可以促进高脂饲料小鼠对于脂肪的水解,或者整体上提高小鼠的新陈代谢。
[0167]
综合实施例1-7可以得出以下结论,本发明所述的肉灵芝培育工艺培育时间短,产品质量均一,产量高,适合工业化、规模化生产;在动物实验中,我们还发现,本发明所述的肉灵芝具有降低血糖血脂,并且提高化疗药物卡培他滨治疗效果和提高癌症动物免疫力的作用,提示本发明制备的肉灵芝在制备相关药物和保健品中具有良好的前景。
[0168]
以上所述实施例仅表达了本发明的有限几种优选实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1