一种复合丝素蛋白仿生类肝小叶支架及其制备方法与应用
1.本发明涉及一种复合丝素蛋白仿生类肝小叶支架及其制备方法与应用,该支架具有仿生放射状构型及优化的物理性能,利用该复合支架构建的仿生类肝小叶组织模型具备提升的表型及功能。
背景技术:
2.随着组织微环境对细胞命运调控研究的不断深入,组织工程化肝脏构建过程中,生物支架特性与在体微环境各因素的匹配越来越被强调。越来越多被揭示和重视的微环境因素也对肝组织模型的仿生构建提出了更高的要求和挑战。值得关注的是,人体组织中细胞的有序排列在维持组织形态与功能方面发挥重要作用,生物支架仿生的构型能够影响体外培养细胞的分布、增殖与分化。尽管确切调控机制尚未完全阐明,但越来越多的学者关注到“高度定向细胞排列”在组织器官构建方面的重要性。天然肝脏具有有序的组织结构和复杂的生物功能,而组织结构是构成其形态和功能的基础。尽管“肝小叶基质构型”的仿生三维(three dimensional,3d)肝组织模型已取得了一定进展,但由于生物材料、加工技术等因素限制,现有研究模型仍存在不足,一个可高度模拟肝小叶放射状结构的生物支架亟待建立。
技术实现要素:
3.为了解决现有技术所存在的不足,本发明提供了一种理想的仿生复合丝素蛋白类肝小叶支架,在维持肝细胞生长活性的同时,可形成仿生的类肝小叶放射状肝细胞排列构型,显著提高肝细胞表型以及功能活性。
4.本发明提供了一种复合仿生丝素蛋白仿生类肝小叶支架,所述支架是由生物型高分子量聚合物与丝素蛋白结合,形成具有放射状孔隙的肝小叶支架。
5.进一步地,上述技术方案中,所述生物型高分子量聚合物包括i型鼠尾胶原或海藻酸钠。
6.进一步地,上述技术方案中,所述肝小叶支架为外径5-6mm、内径0.8-1mm、厚1-2mm的圆柱形结构。
7.本发明还提供了一种仿生三维肝组织模型,所述的肝小叶支架上,肝细胞延放射状孔隙结构分布迁移,相互连接形成仿生三维肝组织模型。
8.本发明还提供了所述肝小叶支架的制备方法,包括如下步骤:
9.(1)将浓度为2-2.5mg/ml i型鼠尾胶原或1.4%-1.6%(w/v)海藻酸钠溶液,以2:1-5:1的体积比与6.5-5.5%(w/v)的丝素蛋白溶液混合,震荡混匀后得到浓度为4%-5%(w/v)丝素蛋白-胶原(silk fibroin-collagen,sfc)-或丝素蛋白-海藻酸钠(silk fibroin-alginate,sfa)混合溶液,并以相应浓度丝素蛋白溶液为对照组;
10.(2)将上述混合溶液于液氮中冷冻,再进行冷冻干燥;
11.(3)冷冻干燥后,高压诱导,制得具有放射状多孔结构的肝小叶支架。
12.进一步地,上述技术方案中,步骤(2)中,混合溶液于液氮中冷冻20-30min,再进行冷冻干燥48-72h。
13.进一步地,上述技术方案中,步骤(3)中,高压诱导使支架形成β-片层,降低支架溶解性。
14.进一步地,上述技术方案中,步骤(3)中,高压为0.12-0.13mpa。
15.本发明还提供了所述仿生三维肝组织模型的制备方法,包括如下步骤:
16.1)采用浓度为0.15-0.2mg/ml的基质胶溶液对无菌丝素蛋白溶液进行预包被后,将肝细胞-胶原混合悬液接种至肝小叶支架内;
17.2)将接种完成的肝小叶支架于细胞培养箱中培养,即得。
18.本发明还提供了所述仿生三维肝细胞模型或所述的制备方法制备的仿生三维肝细胞模型的应用,应用于药物肝脏代谢评价筛选或作为细胞模块应用于生物性人工肝。
19.发明有益效果
20.本发明通过将丝素蛋白溶液与生物型高分子量聚合物混合后,采用定向冷冻技术制备了丝素蛋白-胶原或丝素蛋白-海藻酸钠复合类肝小叶支架。除仿生的放射状多孔结构外,复合支架在不影响丝素蛋白分子构象改变和降解性的情况下,具有更优的吸水性及孔隙率,以及更接近正常肝脏硬度的压缩模量。通过接种肝细胞,同时添加胶原作为培养机制,可成功构建仿生类肝小叶组织模型,肝细胞在支架内的贴附及迁移明显增加、形成仿生的类肝细胞板样结构,同时肝细胞表型及功能活性显著提升。该发明将为生物人工肝提供理想功能模块,为药物代谢评价筛选提供新模型。
附图说明
21.图1是本发明实施例制备的复合类肝小叶支架的制备流程图。
22.图2是本发明实施例制备的复合类肝小叶支架的扫描电镜图。
23.图3是本发明实施例复合类肝小叶支架的吸水性及孔隙率检测。a.吸水性检测;b.孔隙率检测。(*p《0.05)。
24.图4是本发明实施例复合类肝小叶支架的分子构象检测。a.sf组支架检测结果;b.sfc组支架检测结果;c.sfa组支架检测结果(带*表示高压前)。
25.图5是本发明实施例复合类肝小叶支架的体外降解速率检测。a.sf组支架在xiv蛋白酶溶液降解速率检测;b.sf组支架在pbs溶液中降解速率检测;c.sfc及sfa组复合支架在xiv蛋白酶溶液降解速率检测;d.sfc及sfa组复合支架在pbs溶液中降解速率检测。
26.图6是本发明实施例复合类肝小叶支架的力学性能检测。a-b.各组复合支架的应力-应变曲线;c-d.各组复合支架的压缩模量(*p《0.05)。
27.图7是本发明实施例复合类肝小叶支架内c3a细胞活性及形态表征。a.live/dead染色检测各组细胞活性;b.扫描电镜检测各组细胞形态;c.h&e染色检测各组细胞形态(白色标尺=100μm,红色标尺=100μm,黑色标尺=50μm)。
28.图8是本发明实施例复合类肝小叶支架内c3a细胞的功能检测。a.ihc染色显示各组细胞cyp3a4表达情况;b.ihc半定量分析结果;c.rt-qpcr检测各组细胞alb及cyp3a4的表达(黑色标尺=50μm,*p《0.05)。
具体实施方式
29.下述非限定性实施例可以使本领域的普通技术人员更全面地理解本发明,但不以任何方式限制本发明。
30.实施例1
31.本发明提供了一种结合i型鼠尾胶原或海藻酸钠的仿生丝素蛋白放射状多孔类肝小叶支架的制备方法,所述支架是使用i型鼠尾胶原-丝素蛋白或海藻酸钠-丝素蛋白混合溶液冷冻干燥所形成的具有放射状孔隙和优化物理性能的丝素蛋白支架。通过接种肝细胞构建人仿生类肝小叶组织模型。
32.构建方法依次按照如下步骤进行:
33.(1)取浓度为2-2.5mg/ml的i型鼠尾胶原或1.4-1.6%(w/v)海藻酸钠溶液,以2:1的体积比与6.5%(w/v)的丝素蛋白溶液混合,震荡混匀后得到丝素蛋白-胶原或丝素蛋白-海藻酸钠混合溶液。
34.(2)将上述混合溶液转移至15ml离心管,垂直、快速浸入液氮中放置20min,冷冻干燥48h。
35.(3)冷冻干燥后,高压(0.12mpa,121℃,20min)方法诱导支架β-片层的形成降低溶解性,制得外径5-6mm、内径0.8-1mm、厚1-2mm的具有放射状多孔结构的仿生类肝小叶支架。
36.(4)采用浓度为0.15mg/ml的bd基质胶(corning,usa)溶液对无菌丝素蛋白溶液进行预包被(4℃过夜)
37.(5)消化离心人肝细胞(c3a),使用1mg/ml的i型胶原溶液重悬细胞,密度为20000个细胞/μl,取20-25μl的人肝细胞(c3a)-胶原混合悬液接种至支架内,保证肝细胞数量为400,000-500,000cells/支架;
38.上述人肝细胞是将人肝细胞株c3a(atcc,usa)常规培养于mem培养基(invitrogen)添加10%fbs(sciencell),1%抗生素(invitrogen),细胞生长至85~90%融合度时采用0.25%胰蛋白酶-edta溶液进行消化传代,传代比例为1:3所生成的人肝细胞。
39.(6)将接种完成的复合支架按照1个支架/孔的密度放置到多孔细胞培养板中,添加培养基后,置于37℃、5%co2恒温细胞培养箱中共培养10~20天。
40.实施例2
41.一种结合i型鼠尾胶原或海藻酸钠的仿生丝素蛋白放射状多孔类肝小叶支架的制备方法依次按照如下步骤进行:
42.(1)取浓度为2-2.5mg/ml的i型鼠尾胶原或1.4-1.6%(w/v)海藻酸钠溶液,以5:1的体积比与5.5%(w/v)的丝素蛋白溶液混合,震荡混匀后得到丝素蛋白-胶原或丝素蛋白-海藻酸钠混合溶液。
43.(2)将混合溶液转移至15ml离心管,垂直、快速浸入液氮中放置30min,冷冻干燥72h。
44.(3)冷冻干燥后,高压方法诱导支架β-片层的形成降低溶解性,制得外径5-6mm、内径0.8-1mm、厚1-2mm的具有放射状多孔结构的仿生类肝小叶支架。
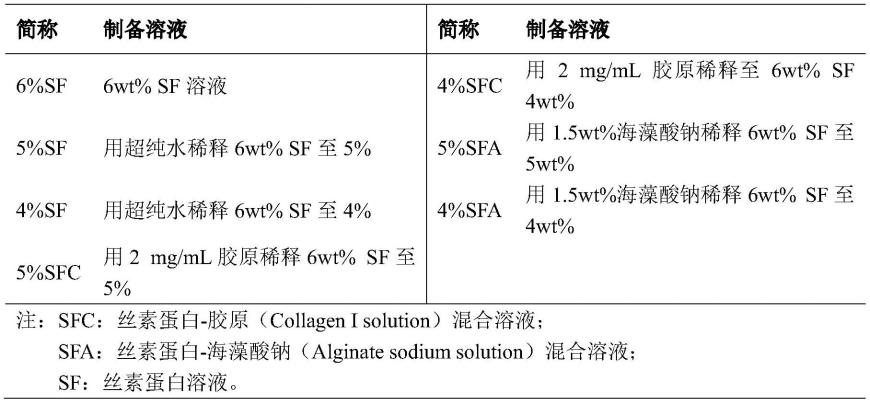
45.(4)采用浓度为0.15mg/ml的bd基质胶溶液对无菌丝素蛋白溶液进行预包被(4℃过夜)。
46.(5)消化离心人肝细胞(c3a),使用1mg/ml的i型胶原溶液重悬细胞,密度为20000
个细胞/μl,取20-25μl的人肝细胞(c3a)-胶原混合悬液接种至支架内,保证肝细胞数量为400,000-500,000cells/支架;
47.上述人肝细胞是将人肝细胞株c3a(atcc,usa)常规培养于mem培养基(invitrogen)添加10%fbs(sciencell),1%抗生素(invitrogen),细胞生长至85~90%融合度时采用0.25%胰蛋白酶-edta溶液进行消化传代,传代比例为1:3所生成的人肝细胞。
48.(6)将接种完成的复合支架按照1个支架/孔的密度放置到多孔细胞培养板中,添加培养基后,置于37℃、5%co2恒温细胞培养箱中共培养10~20天。
49.本发明所述丝素蛋白复合类肝小叶支架的分组及溶液配制见表1。
50.表1.复合材料的配制及分组
[0051][0052]
实施例3
[0053]
一、建立仿生复合丝素蛋白放射状多孔类肝小叶支架检测平台
[0054]
扫描电镜检测:空白支架于37℃烘箱内烘干,液氮冷冻淬断。处理完成的各组样品进行喷金,扫描电镜下观察拍照(电压3kv)。
[0055]
吸水性检测:室温下将一定体积的类肝小叶支架浸泡于超纯水中24h。去除表面多余水分,称重湿态支架为ws(g);于60℃烘箱过夜烘干,称重干态支架为wd(g)。根据以下公式计算吸水比率:((ws
–
wd)/wd)
×
100%。每组设3个支架,测量3次取平均值进行计算。
[0056]
孔隙率检测:重量为w(g)、体积为v(cm3)的类肝小叶支架,密封避光条件下,于正己烷溶液内浸泡10min。去除表面多余液体,称重支架为w1(g)。根据正己烷溶液密度(0.66g/cm3),计算支架孔隙率为:((w1-w)/0.66v)
×
100%。每组设3个支架,测量3次取平均值进行计算。
[0057]
傅里叶变换红外光谱仪检测:各组支架烘干后去除表层,取1~2mm厚的切片进行压片,用ftir的表面全反射模式进行测试,设定波数范围为400-4000cm-1
,检测各组支架的二级结构。
[0058]
力学性能检测:压缩模式下,采用万能材料测试机测定圆柱形支架(高度8mm、直径8mm)的力学性能。轴向压缩速率为2mm/min,量程500n,当支架应变达到初始高度的50%时,判断数据失效。每组设3个支架,测量3次取平均值进行计算。
[0059]
体外降解性能检测:称重圆柱形干燥支架(高度2mm、直径8mm)为w0(g)。将支架置于48孔板(1个支架/孔),并添加1ml xiv型蛋白酶溶液(6u/ml),于37℃进行孵育,每两天更
换孔板内溶液。第2、4、6和8天时,每组各取3个样品,去离子水清洗,烘干并称重为wd(g)。剩余支架质量分数的计算公式为:(wd/w0)
×
100%。实验中,以不含xiv型蛋白酶的pbs溶液为对照组,每组样品/时间点设3个支架,测量3次取平均值进行计算。
[0060]
二、建立仿生类肝小叶组织检测平台
[0061]
肝细胞活性检测:根据试剂说明书,使用live/dead染色试剂盒检测样品活性,具体步骤如下:样品用pbs清洗两次后,置于1.5ml eppendorf管中,添加适量染色试剂(1ml基础培养基中添加0.5μl calcein-am试剂和2μl ethd-1试剂),于37℃、5%二氧化碳浓度的恒温培养箱内染色2h,注意避光;pbs彻底清洗去除多余染色剂,使用激光共聚焦显微镜进行拍照观察。
[0062]
苏木素和伊红(hematoxylin&eosin,h&e)染色:收集培养样品,使用4%的多聚甲醛浸泡过夜固定;pbs清洗样品去除多聚甲醛,经梯度无水乙醇(50%、70%、80%、90%、100%)脱水、二甲苯透明后,常规石蜡包埋并切片(厚度为5μm);石蜡切片于60℃烘箱内烘烤1小时,经二甲苯、梯度无水乙醇(100%、90%、70%、50%)脱蜡后,浸泡于超纯水中水化;脱蜡后的切片于苏木中浸泡染色2min,使用1%盐酸酒精分色、1%氨水返蓝,分色及返蓝步骤遵循少量多次原则;于伊红中染色2min。完成染色的切片经梯度酒精(50%、70%、80%、90%、100%)脱水、二甲苯透明、中性树脂封片后,使用光学正置显微镜进行拍照观察。
[0063]
免疫组织化学(immunohistochemical staining,ihc)染色:石蜡切片脱蜡后,于1
×
抗原修复液中高压5min进行抗原修复。切片自然冷却后,使用免疫组化试剂盒进行染色,具体步骤如下:内源性过氧化物酶阻断剂室温孵育30min,pbs清洗(5min/次
×
3次),非特异性抗原封闭液(山羊血清)室温封闭30分钟;弃除多余非特异性抗原封闭液,加一抗4℃过夜孵育。次日用pbs清洗(5min/次
×
3次),先后滴加山羊抗鼠/兔二抗和辣根过氧化物酶工作液室温孵育30分钟,期间用pbs彻底清洗(5min/次
×
3次)去除多余二抗;根据试剂说明书配制dab显色液,pbs清洗(5min/次
×
3次)切片后,使用配制好的dab显色液覆盖组织,显色约1-2分钟。苏木复染2-3分钟,梯度酒精脱水、二甲苯透明、中性树脂封片后,使用光学显微镜进行拍照观察。染色过程中使用的一抗具体信息:mouse anti-human alb(1:50,santa cruz biotechnology,usa)和rabbit anti-human cyp3a4(1:100,proteintech,china)。
[0064]
实时荧光定量pcr(real-time-quantitative pcr,rt-qpcr)检测:收集培养样品,采用trizol裂解细胞,并提取总rna;采用primescript tm rt master mix kit反转录cdna,使用和premix ex taq
tm
ii试剂盒进行定量rt-pcr扩增。以β-actin为内参、使用2-δδct法计算相对表达量,具体引物信息见下表。
[0065]
表1.引物名称及具体序列信息
[0066][0067]
三、结果
[0068]
使用sem检测各组类肝小叶复合支架的表面形貌。由图2可见,6%-4%浓度的丝素蛋白溶液均可形成放射状多孔结构。与单纯丝素蛋白制备的支架(超纯水稀释组)相较,与不同生物大分子材料混合后制备的sf复合支架(丝素蛋白-胶原复合支架或丝素蛋白-海藻
酸钠复合支架)虽仍具有多孔放射状构型,但其表面形貌改变:2mg/ml i型鼠尾胶原溶液的添加,支架片层间出现粘连,表面形成不均匀的突起;1.5%海藻酸钠溶液的添加显著提升支架孔隙间的连通性。
[0069]
支架的吸水性和孔隙率是影响细胞接种率和营养物质与代谢产物交换的关键特征,因此本实施例对各组类肝小叶支架的吸水性和孔隙率进行检测。由图3a可见,随着sf溶液浓度下降,支架吸水比率逐渐上升。i型鼠尾胶原和海藻酸钠的添加显著提升支架的吸水性,与5%丝素蛋白支架相比(635.0
±
68.3%),5%sfc的吸水比率上升至778.1
±
56.5%(p《0.05)、5%sfa增高至744.4
±
12.5%(p《0.05)。孔隙率的变化趋势与吸水比率相似,提示孔隙率及孔隙结构的改变显著影响支架吸水性能,可能与孔隙改变导致支架容水量及溶胀性的变化有关(图3b)。
[0070]
采用ftir检测各组支架的分子构象进行表征,明确i型鼠尾胶原、海藻酸钠的添加对支架ii级分子构象的影响。如图4a所见,丝素蛋白溶液浓度改变不影响以β-折叠为主的ii级分子构象的形成,经高压处理后的各浓度支架,光谱特征峰处于1615cm-1-1630cm-1(酰胺i特征峰)和1515cm-1-1535cm-1(酰胺ii特征峰)之间,属于β-折叠构象。i型鼠尾胶原和海藻酸钠的添加不影响支架β-折叠构象的形成,经过高压处理后,各组复合支架光谱发生右偏,表明形成以β-折叠为主的分子构象(图4b-4c)。
[0071]
生物支架的降解速率是影响组织工程模型体内、外培养时间的关键因素。由图5a和5c(图中,sfc:丝素蛋白-胶原(collagen i solution)混合溶液;sfa:丝素蛋白-海藻酸钠(alginate sodium solution)混合溶液;sf:丝素蛋白溶液)可见,相较于pbs缓冲液(ph 7.4)(图5b和5d),浸泡于xiv蛋白酶溶液后,各组支架重量下降较快,随着丝素蛋白溶液浓度下降,支架降解速率增加。4%浓度的复合支架降解速率快于相应5%组支架。
[0072]
支架的力学性能显著影响细胞的生物学行为,本实施例中对各组复合类肝小叶支架的力学性能进行了检测。由图6a-6b可见,在相同应力下,支架的应变随丝素蛋白溶液浓度下降而增加,表明其硬度逐渐降低;6%、5%和4%浓度的丝素蛋白支架压缩模量分别为95.63
±
11.16kpa、68.20
±
5.451kpa和24.17
±
5.805kpa(p《0.05)。添加i型鼠尾胶原和海藻酸钠后的复合支架的力学性能改变显著,压缩模量明显下降;5%i型鼠尾胶原-丝素蛋白复合支架和5%海藻酸钠-丝素蛋白复合支架压缩模量分别约为5%丝素蛋白支架的26%和7.5%(p《0.05),而4%i型鼠尾胶原-丝素蛋白复合支架和4%海藻酸钠-丝素蛋白复合支架压缩模量为15.27
±
4.94kpa和4.75
±
1.38kpa(图6c-6d)。
[0073]
连续培养14天后,各组支架内c3a细胞活性良好,仅可见少量死细胞(图7a)。扫描电镜显示c3a细胞延支架放射状孔隙分布生长,细胞呈圆形并伴有细胞外基质的存在(图7b)。h&e染色显示多数细胞分布于支架周边,而5%i型鼠尾胶原-丝素蛋白复合支架内,c3a细胞延放射状孔隙大量分布迁移,相互连接形成仿生的类肝板样结构,提示其可促进细胞贴附和迁移(图7c)。
[0074]
由图8a-8b可见,各组支架内c3a细胞均表达alb和cyp3a4,其中alb的表达在各组间未见明显差异,而5%i型鼠尾胶原-丝素蛋白复合支架和5%海藻酸钠-丝素蛋白复合支架内细胞cyp3a4的表达明显高于丝素蛋白组。alb和cyp3a4基因表达与蛋白表达一致,与丝素蛋白组相较5%i型鼠尾胶原-丝素蛋白复合支架和5%海藻酸钠-丝素蛋白复合支架组c3a细胞cyp3a4的表达显著上调(图8c,p《0.05)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1