一种肺-脑SARS-CoV-2感染模型与应用
一种肺-脑sars-cov-2感染模型与应用
技术领域
1.本发明属于器官芯片模型技术领域,具体涉及一种肺-脑sars-cov-2感染模型与应用。
背景技术:
2.新冠肺炎(covid-19)是一种系统性疾病,累及多个脏器。虽然covid-19症状主要集中在呼吸系统,临床病例统计30-40%的covid-19患者会有明显的神经症状,如头痛、精神错乱、嗅味觉减退、脑血管损伤、癫痫、脑炎等。时至今日,关于新冠肺炎中神经系统症状的原因,医学界尚无定论。仍不清楚,这些症状是由sars-cov-2直接入侵脑引起,还是由于病毒感染肺部引发的全身性系统炎症引发。
3.在人脑中,有一个高度选择性的屏障系统——血脑屏障(bbb),负责调控血液和神经系统之间的营养物质、代谢产物的运输。此外,血脑屏障可以作为保护性屏障,防止毒素和病原体(包括病毒)进入脑实质。在一些传染性脑疾病中,嗜神经病毒可感染并破坏血脑屏障,并通过血液途径进一步侵入人脑,如hsv-1和寨卡病毒等。然而,关于sars-cov-2是否可以通过类似的途径穿过血脑屏障侵入大脑仍然未知。
4.到目前为止,对于sars-cov-2感染引发脑损伤的研究主要来自于新冠肺炎死者脑样本病例分析、动物模型和脑类器官。但这三种样本都有不同程度的缺陷。对于死者脑样本而言,来源非常有限,并且不同人之间的个体差异非常大。动物模型因为生理结构和遗传背景与人存在差异的原因,其在sars-cov-2感染后的部分症状和病理改变与人存在差别。在近年来,干细胞诱导来源的脑类器官越来越多应用于神经科学研究领域,包括sars-cov-2感染研究。但现阶段,脑类器官模型没有血管网络,缺失屏障系统和免疫细胞,无法用于探究病毒入脑路径和病毒感染过程中的机体免疫反应。此外,考虑到新冠肺炎是一种累及多器官的系统性疾病,到目前为止,还没有多器官的人源化模型用于sars-cov-2感染研究。
5.器官芯片——作为一门迅速发展起来的科学技术,由多学科技术交叉汇聚而成,已经在生物医学领域展现了其独特的优势。该技术主要基于微流控芯片,集合微加工、细胞生物学、材料和生物组织工程等学科技术,在体外构建仿生的3d人体器官模型,包含多种活细胞、功能组织界面、生物流体等。该模型具有接近人体水平的生理功能,同时还能精确地控制多个系统参数。研究人员可以更加直观地研究机体行为,预测或再现疾病中的病理反应、药理反应。在生命科学研究、疾病模拟和新药研发及精准医疗等领域拥有广阔的应用前景。
6.现有技术中对于sars-cov-2感染对多器官的病理反应的器官芯片模型还属于技术空白,待研究人员的开发研究。
技术实现要素:
7.本发明提供一种基于器官芯片技术,在多器官水平探究sars-cov-2感染对于脑影响的新方法。本发明创新性地构建了串联的肺-脑器官芯片模型体系,基于该器官芯片模型
系统可以模拟sars-cov-2感染肺并进而影响脑的病理损伤过程,以反映sars-cov-2感染过程中复杂的多器官的病理反应,探究疾病过程中多器官之间的互作机制,填补了该研究领域的空白。
8.本发明提供了一种肺-脑sars-cov-2感染模型,由两个串联的夹膜芯片组成;所述夹膜芯片包括上层基底、下层基底和多孔膜,所述上层基底包括上层通道,所述下层基底包括下层通道,所述多孔膜位于上层通道和下层通道之间;
9.所述两个串联的夹膜芯片分别为肺芯片和bbb芯片;
10.所述肺芯片为在处于所述夹膜芯片的下层通道侧的多孔膜上接种肺微血管内皮细胞,在处于所述夹膜芯片的上层通道侧的多孔膜上接种肺泡上皮细胞;肺芯片的上层通道的培养基为含有sars-cov-2的肺泡上皮细胞培养基,肺芯片的下层通道的培养基为含有人外周血单个核细胞的内皮细胞培养基;
11.所述bbb芯片为在处于所述夹膜芯片的下层通道侧的多孔膜上接种星形胶质细胞,在所述夹膜芯片的下层通道的底面接种小胶质细胞培养区,在处于所述夹膜芯片的上层通道侧的多孔膜上接种脑微血管内皮细胞;bbb芯片的上层通道的培养基为肺芯片的下层通道获得的感染sars-cov-2病毒的肺芯片内皮培养基按照比与新鲜的内皮培养基混合。
12.进一步地,上述技术方案中,所述多孔膜包括pet多孔膜、pdms多孔膜。
13.进一步地,上述技术方案中,所述多孔膜的孔径为2-4μm。
14.进一步地,上述技术方案中,所述上层基底和下层基底的材料包括pdms。
15.进一步地,上述技术方案中,所述含有sars-cov-2的肺泡上皮细胞培养基中,sars-cov-2感染复数moi=0.1-10。
16.优选地,sars-cov-2感染复数moi=1。
17.进一步地,上述技术方案中,所述下层通道的两端分别设有上层细胞入口和上层细胞出口,所述下层通道的两端分别设有下层细胞入口和下层细胞出口;所述肺芯片的下层细胞出口与bbb芯片的上层细胞入口连同;所述肺芯片在所述bbb芯片的上游。
18.进一步地,上述技术方案中,所述上层通道和下层通道的尺寸为:1.5mm宽、0.2mm高。
19.进一步地,上述技术方案中,所述bbb芯片的下层通道的培养基为等体积混合的星形胶质细胞培养基和小胶质培养基
20.本发明还提供了所述的肺-脑sars-cov-2感染模型作为在多器官水平探究sars-cov-2感染对于肺和脑的影响模型中应用。
21.本发明还提供了所述的肺-脑sars-cov-2感染模型在sars-cov-2感染后,对多种细胞状态和功能障碍进行实时监测,以及监测外周免疫细胞的反应中的应用。
22.本发明还提供了一种基于器官芯片的sars-cov-2感染导致脑损伤的评价新方法,具体过程如下:
23.(1)肺芯片构建
24.将肺微血管内皮细胞制备成2,000细胞/μl的细胞悬液,取25μl细胞悬液注入芯片下层通道,并将芯片倒置放于37℃培养箱中,贴壁培养2小时。
25.将肺泡上皮细胞制备成4,000细胞/μl的细胞悬液,取25μl细胞悬液注入芯片上层通道,并将芯片放于37℃培养箱中过夜培养。
26.将注射泵联通到芯片的上、下层通道入口处,流速100μl/h,37℃培养箱中灌流培养3天。
27.(2)bbb芯片构建
28.将星形胶质细胞制备成2,000细胞/μl的细胞悬液,取25μl细胞悬液注入芯片下层通道,并将芯片倒置放于37℃培养箱中,贴壁培养2小时。
29.将小胶质细胞制备成2,000细胞/μl的细胞悬液。将芯片通道中残留的星形胶质细胞培养基吸干,取25μl小胶质细胞悬液注入芯片下层通道。将脑微血管内皮细胞制成4,000细胞/μl的细胞悬液,取25μl细胞悬液注入芯片上层通道。将芯片放于37℃培养箱中过夜培养。
30.将注射泵联通到芯片的上、下层通道入口处,流速100μl/h,37℃培养箱中灌流培养3天。
31.(3)芯片功能检测
32.通过血管内皮细胞钙粘蛋白ve-cadherin和紧密连接蛋白zo-1免疫荧光染色检测肺芯片屏障的完整性。通过ii型肺泡上皮细胞特异性标记物(spc、htii-280)检测肺泡上皮细胞特异性。
33.通过血管内皮细胞钙粘蛋白ve-cadherin和紧密连接蛋白zo-1免疫荧光染色检测bbb芯片屏障的完整性。采用fitc标记的右旋糖苷(fitc-dextran)监测bbb芯片通透性。利用跨膜电阻仪监测bbb芯片跨膜电阻值。
34.(4)肺芯片感染sars-cov-2
35.肺芯片灌流培养3天后,在接种了肺泡上皮细胞的上层通道加入含有sars-cov-2的肺泡上皮细胞培养基(sars-cov-2感染复数moi=1),下层通道培养基为星形胶质细胞培养基(sciencell公司,no.1801)与小胶质培养基的混合培养基(procell公司,no.mp150410)(体积比1:1)。1小时后,新鲜培养基清洗上层通道两次后,注入100μl新鲜不含病毒肺泡上皮培养基。
36.吸干下层通道培养基,加入100μl含有100,000个人外周血单个核细胞的内皮细胞培养基,模拟体内循环血液中的免疫细胞。
37.将芯片放平移入37℃培养箱中培养。每2天收集内皮细胞培养基,放于-80℃保存,后续实验用作条件培养基。换新鲜培养基,并向下层道注入100,000个人外周血单个核细胞。连续培养6天。
38.(5)感染肺芯片内皮培养基处理bbb芯片
39.将收集的感染病毒的肺芯片内皮培养基按照1:2的体积比与新鲜的内皮培养基混合,注入到bbb芯片的上层微血管通道。37℃培养4天,每隔2天换液一次。
40.(6)感染肺芯片内皮培养基灌注bbb芯片后,bbb损伤检测
41.在bbb芯片灌注感染肺芯片内皮培养基后,可以通过fitc标记的右旋糖苷的渗透性,评估bbb完整性变化。通过内皮细胞外连接(例如zo-1、occludin、claudin-5、ve-cadherin)免疫荧光染色评估脑微血管内皮完整性变化。通过星形胶质细胞特异性标记物(gfap、s100β)和小胶质细胞特异性标记物(iba1、cd11b)检测两种胶质细胞的活化状态。通过细胞因子阵列试剂盒检测上下通道培养基中细胞因子水平。
42.本发明建立一种探究sars-cov-2感染对脑损伤影响的模型方法。该模型体系由上
游的肺芯片和下游的bbb芯片共同构成。在肺芯片肺泡上皮通道加入sars-cov-2,在肺微血管内皮通道加入外周血单个核细胞,模拟体内循环血液中的外周血免疫细胞,构成sars-cov-2肺炎的肺损伤病理微环境。通过收集肺微血管内皮通道培养基,与新鲜的内皮培养基混合,注入bbb芯片的脑微血管内皮通道,构建sars-cov-2感染引发的脑损伤模型。
43.本发明提供的sars-cov-2感染脑损伤模型,不仅模拟病毒感染过程中肺-脑两器官之间的关联方式,对肺、脑屏障的功能损伤进行实时检测,还能对外周免疫细胞、胶质细胞在sars-cov-2感染引发的脑损伤中的作用进行研究。
44.本发明提供的sars-cov-2感染脑损伤模型,可采用生物学上常用的细胞检测手段对bbb屏障损伤、多种细胞状态和炎症因子水平进行检测,包括fitc-dextran渗透性检测、细胞活力检测、细胞免疫荧光染色、qrt-pcr、细胞因子阵列检测等。
45.本发明利用器官芯片技术,具有良好生物相容性、透光性的pdms和pet多孔膜为细胞的成像观察提供极大便利。该装置适用于检测病毒感染后检测屏障组织水平的变化(肺泡屏障、血脑屏障)及各种细胞的行为及变化,例如mrna变化、蛋白表达变化、细胞因子分泌、细胞死亡等。
附图说明
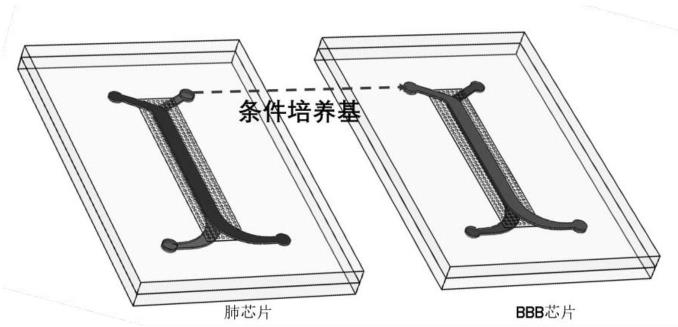
46.图1为本发明肺芯片-bbb芯片串连构成的肺-脑sars-cov-2感染模型示意图。
47.图2为本发明微流控芯片结构及功能分区示意图。
48.其中,a为肺芯片:1、pet多孔膜,2、肺泡上皮细胞培养区,3、肺微血管内皮细胞培养区。
49.b为bbb芯片:4、pet多孔膜,5、脑微血管内皮细胞培养区,6、星形胶质细胞培养区,7、小胶质细胞培养区。
50.图3为病毒作用下肺泡芯片病毒感染情况(肺芯片侧视图);
51.图4为病毒作用下bbb芯片各种细胞变化。
具体实施方式
52.下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。
53.实施例1
54.利用夹膜芯片分别构建肺芯片和bbb芯片。
55.如图1-2所示,所述夹膜芯片由上层基底和下层基底粘合封接而成,上层基底和下层基底之间设有pet多孔膜。所述上层基底上设有上层通道,下层基底上设有下层通道。所述上层通道上设有上层细胞入口和上层细胞出口,所述下层通道上设有下层细胞入口和下层细胞出口。当夹膜芯片组装后,上层通道和下层通道呈现“x”形。所述上层通道和下层通道的尺寸均为1.5mm宽、0.2mm高。所述pet多孔膜孔径为2μm。所述上层基底和下层基底的材料为pdms。
56.所述肺芯片为在处于所述夹膜芯片的下层通道侧的pet多孔膜上接种肺微血管内皮细胞,在处于所述夹膜芯片的上层通道侧的pet多孔膜上接种肺泡上皮细胞。通过上层细胞入口向上层通道加入含有sars-cov-2的肺泡上皮细胞培养基(sars-cov-2感染复数moi=1),通过下层细胞入口向下层通道加入含有人外周血单个核细胞的内皮细胞培养基,模
拟体内循环血液中的免疫细胞。
57.所述bbb芯片为在处于所述夹膜芯片的下层通道侧的pet多孔膜上接种星形胶质细胞,在所述夹膜芯片的下层通道的底面接种小胶质细胞培养区,在处于所述夹膜芯片的上层通道侧的pet多孔膜上接种脑微血管内皮细胞。
58.肺芯片在上游,bbb芯片在下游。
59.将肺芯片下层通道获得的感染sars-cov-2病毒的肺芯片内皮培养基按照1:2的体积比与新鲜的内皮培养基(sciencell公司,no.1001)混合,作为条件培养基,注入到bbb芯片的上层通道;下层通道培养基为星形胶质细胞培养基(sciencell公司,no.1801)与小胶质培养基的混合培养基(procell公司,no.mp150410)(体积比1:1),构建肺-脑sars-cov-2感染模型。
60.实施例2
61.一种基于器官芯片技术,在多器官水平探究sars-cov-2感染对于脑影响的新方法。具体过程如下:
62.(1)夹膜芯片灭菌及包被
63.将夹膜芯片放于6cm培养皿中,将培养皿开盖放置于超净台中紫外照射过夜。
64.在夹膜芯片的上层通道和下层通道各注满50μg/ml纤连蛋白(fibronectin)溶液,并放置于37℃培养箱中24小时。接种细胞前,吸干纤连蛋白溶液,并用pbs清洗三次。
65.(2)构建肺芯片:
66.将肺微血管内皮细胞制备成2,000细胞/μl的细胞悬液,取25μl细胞悬液注入夹膜芯片下层通道,并将夹膜芯片倒置放于37℃培养箱中,贴壁培养2小时,使肺微血管内皮细胞贴壁于位于下层通道侧的pet多孔膜上。将肺泡上皮细胞制备成4,000细胞/μl的细胞悬液,取25μl细胞悬液注入夹膜芯片上层通道,并将夹膜芯片放于37℃培养箱中过夜培养,使肺泡上皮细胞贴壁于位于上层通道侧的pet多孔膜上。肺芯片上层通道培养基为肺泡上皮细胞培养基(90%rpmi 1640基础培养基+10%胎牛血清+1%青霉素/链霉素);下层通道培养基为肺微血管内皮细胞培养基(procell公司,no.cm-0565)。将注射泵联通到夹膜芯片的上层细胞入口和下层细胞入口,上层细胞出口和下层细胞出口连接收集装置。培养基流速100μl/h,37℃培养箱中灌流培养3天。
67.(3)构建bbb芯片:
68.将星形胶质细胞制备成2,000细胞/μl的细胞悬液,取25μl细胞悬液注入芯片夹膜芯片下层通道,并将夹膜芯片倒置放于37℃培养箱中,贴壁培养2小时,使星形胶质细胞贴壁于位于下层通道侧的pet多孔膜上。将小胶质细胞制备成2,000细胞/μl的细胞悬液。将夹膜芯片下层通道中残留的星形胶质细胞培养基吸干,取25μl小胶质细胞悬液注入夹膜芯片下层通道,使小胶质细胞贴壁于下层通道的底面。将脑微血管内皮细胞制成4,000细胞/μl的细胞悬液,取25μl细胞悬液注入夹膜芯片上层通道。将夹膜芯片放于37℃培养箱中过夜培养,使脑微血管内皮细胞贴壁于位于上层通道侧的pet多孔膜上。将注射泵联通到夹膜芯片的上层细胞入口和下层细胞入口,上层细胞出口和下层细胞出口连接收集装置。培养基流速100μl/h,37℃培养箱中灌流培养3天。
69.(4)芯片功能检测
70.通过血管内皮细胞钙粘蛋白ve-cadherin和紧密连接蛋白zo-1免疫荧光染色检测
肺芯片屏障的完整性。通过ii型肺泡上皮细胞特异性标记物(spc、htii-280)检测肺泡上皮细胞特异性。
71.通过血管内皮细胞钙粘蛋白ve-cadherin和紧密连接蛋白zo-1免疫荧光染色检测bbb芯片屏障的完整性。采用fitc标记的右旋糖苷(fitc-dextran)监测bbb芯片通透性。利用跨膜电阻仪监测bbb芯片跨膜电阻值。
72.(5)构建肺-脑sars-cov-2感染模型:
73.肺芯片灌流培养3天后,在接种了肺泡上皮细胞的上层通道加入含有sars-cov-2的肺泡上皮细胞培养基(sars-cov-2感染复数moi=1)。1小时后,新鲜培养基清洗上层通道两次后,注入100μl新鲜不含病毒肺泡上皮培养基。吸干下层通道培养基,加入100μl含有100,000个人外周血单个核细胞的内皮细胞培养基,模拟体内循环血液中的免疫细胞。将芯片放平移入37℃培养箱中培养。每2天收集内皮细胞培养基,放于-80℃保存,后续实验用作条件培养基。
74.换新鲜培养基,并向下层通道注入100,000个人外周血单个核细胞。连续培养6天。在此期间,通过免疫荧光检测发现,sars-cov-2主要感染肺泡上皮细胞,并在其中大量复制,其结果如图3所示。
75.将收集的感染病毒的肺芯片内皮培养基(条件培养基)按照1:2的体积比与新鲜的内皮培养基混合,注入到bbb芯片的接种了内皮细胞的上层通道,下层通道培养基为星形胶质细胞培养基(sciencell公司,no.1801)与小胶质培养基的混合培养基(procell公司,no.mp150410)(体积比1:1)。37℃培养4天,每隔2天换液一次。在第四天,通过免疫荧光分别检测bbb芯片上三种细胞,发现脑微血管内皮细胞外连接(zo-1指示紧密连接、ve-cadherin指示黏着连接)在病毒感染组显著减弱;星形胶质细胞明显激活(gfap、s100β显著上调);小胶质细胞明显激活(iba1、cd11b显著上调),说明新冠肺炎患者的神经症状是由于病毒感染肺部引发的全身系统炎症引起的。结果如图4所示。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1