用于检测血清4型禽腺病毒的重组蛋白在制备ELISA检测试剂盒中的应用的制作方法
用于检测血清4型禽腺病毒的重组蛋白在制备elisa检测试剂盒中的应用
技术领域
1.本发明涉及用于检测血清4型禽腺病毒的重组蛋白在制备elisa检测试剂盒中的应用,属于生物医药领域。
背景技术:
2.心包积液-肝炎综合征(hydropericardium hepatitis syndrome,hhs)是由禽腺病毒属的ⅰ群腺病毒中特定血清型感染引起的。禽腺病毒属根据其抗原性的不同可分为3个群:ⅰ、ⅱ和ⅲ群,血清4型禽腺病毒(fowl adenovirus serotype 4,fadv-4)隶属于腺病毒科禽腺病毒属ⅰ亚群,该亚群已鉴定了5个禽腺病毒种,其名称用字母a~e表示,根据其血清型测试分为12个血清型。fadv-4属于禽腺病毒c种血清4型。fadv-4病毒粒子无囊膜,直径70~90nm,呈20面体对称,由衣壳(capsid)、纤突(fiber)、核酸芯髓(core)及相关蛋白构成。fadv-4是hhs的病原体,已经成为引起我国鸡群禽腺病毒感染的主要血清型。fadv-4感染发病鸡临床表现为精神沉郁、羽毛松乱、食欲下降、缩在角落和排出绿色稀粪等,感染的家禽病程快,死亡率高,感染后3~5天就死亡,剖检可见心包腔内含有淡黄色积液,肝脏肿胀变黄等典型病变,因此称为心包积液-肝炎综合征(hhs)。组织病理变化检查发现病死鸡肝细胞内有核内包涵体,胸腺、脾脏、肾、法氏囊等组织变性坏死。此外,该病传播途径广泛,既可通过食物、粪便和养殖器械水平传播,也可以通过鸡胚垂直传播,增加防控fadv-4的难度。接种疫苗是预防fadv-4的重要手段,目前国内已有fadv-4灭活疫苗使用。病毒感染宿主后在体内大量复制,会刺激动物机体产生大量的结构蛋白和非结构蛋白抗体,而一般认为灭活疫苗中除去绝大部分非结构蛋白,因此灭活苗免疫的动物体内不产生或很少产生非结构蛋白的抗体,感染动物与灭活苗免疫动物体内非结构蛋白抗体水平存在差异,可通过检测非结构蛋白抗体来识别自然感染的动物。禽腺病毒的22k蛋白编码于禽腺病毒的晚期基因4区(l4),仅在病毒复制时释放,在病毒感染后期会大量表达,刺激动物机体产生相应的抗体,是fadv-4主要的非结构蛋白之一。
3.目前针对fadv-4的检测方法有限制性内切酶分析(rea)、dna探针原位杂交、聚合酶链式反应(pcr)、实时荧光定量pcr和高分辨率熔解曲线(high-resolution melting,hrm)、琼脂扩散试验和酶联免疫吸附试验(elisa)检测方法。但目前的检测方法仍不能满足临床检测的需求,其敏感性和特异性还有待进一步提高。elisa检测方法操作简单,特异性好且成本低廉,在临床上应用广泛,适用于大批量检测临床样品。然而常规的elisa检测方法主要是检测fadv-4的结构蛋白的抗体,结构蛋白的抗体既可以通过免疫获得,也可以由自然感染而引起,因此不能区分灭活疫苗免疫的动物和自然感染动物,无法及时发现和清除自然感染动物。
4.鉴于此,建立一种有效的检测方法区分fadv-4自然感染动物和灭活苗免疫动物能够为hhs疫病的防控提供可靠、有效的手段。
技术实现要素:
5.本发明所要解决的技术问题是如何更特异、灵敏、可靠和/或准确地检测血清4型禽腺病毒(fowl adenovirus serotype 4,fadv-4),和/或如何鉴别血清4型禽腺病毒自然感染动物和灭活疫苗免疫动物。所要解决的技术问题不限于所描述的技术主题,本领域技术人员通过以下描述可以清楚地理解本文未提及的其它技术主题。
6.为解决上述技术问题,本发明首先提供了重组蛋白的应用,所述应用可为下述任一种:
7.d1)重组蛋白在检测血清4型禽腺病毒或制备用于检测血清4型禽腺病毒的产品中的应用;
8.d2)重组蛋白在诊断或辅助诊断血清4型禽腺病毒感染所引起的疾病或制备用于诊断或辅助诊断血清4型禽腺病毒感染所引起的疾病的产品中的应用;
9.d3)重组蛋白在筛查或辅助筛查血清4型禽腺病毒感染所引起的疾病或制备用于筛查或辅助筛查血清4型禽腺病毒感染所引起的疾病的产品中的应用;
10.d4)重组蛋白在鉴别血清4型禽腺病毒自然感染动物和灭活疫苗免疫动物或制备用于鉴别血清4型禽腺病毒自然感染动物和灭活疫苗免疫动物的产品中的应用;
11.d5)重组蛋白在制备用于检测血清4型禽腺病毒的检测抗原中的应用;
12.d6)重组蛋白在制备血清4型禽腺病毒抗体中的应用;
13.d7)重组蛋白在血清4型禽腺病毒感染所引起疾病的防控中的应用;
14.所述重组蛋白名称为22k,可为下述任一种:
15.a1)氨基酸序列是seq id no.1的蛋白质;
16.a2)将seq id no.1所示的氨基酸序列经过氨基酸残基的取代和/或缺失和/或添加得到的与a1)所示的蛋白质具有80%以上的同一性且具有相同功能的蛋白质;
17.a3)在a1)或a2)的n端和/或c端连接标签或信号肽得到的具有相同功能的融合蛋白质。
18.为了使a1)中的蛋白质便于纯化或检测,可在由序列表中seq id no.1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接标签蛋白。
19.所述标签蛋白包括但不限于:gst(谷胱甘肽巯基转移酶)标签蛋白、his6标签蛋白(his-tag)、mbp(麦芽糖结合蛋白)标签蛋白、flag标签蛋白、sumo标签蛋白、ha标签蛋白、myc标签蛋白、egfp(增强型绿色荧光蛋白)、ecfp(增强型青色荧光蛋白)、eyfp(增强型黄绿色荧光蛋白)、mcherry(单体红色荧光蛋白)或avitag标签蛋白。
20.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化或点突变的方法,对本发明的编码重组蛋白22k的核苷酸序列进行突变。那些经过人工修饰的,具有与本发明分离得到的重组蛋白22k的核苷酸序列75%或75%以上同一性的核苷酸,只要编码重组蛋白22k且具有重组蛋白22k的功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
21.上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
22.本文中,同一性是指氨基酸序列或核苷酸序列的同一性。可使用国际互联网上的同源性检索站点测定氨基酸序列的同一性,如ncbi主页网站的blast网页。例如,可在高级blast2.1中,通过使用blastp作为程序,将expect值设置为10,将所有filter设置为off,使
用blosum62作为matrix,将gap existence cost,per residue gap cost和lambda ratio分别设置为11,1和0.85(缺省值)并进行检索以对氨基酸序列的同一性进行计算,然后即可获得同一性的值(%)。
23.本文中,所述80%以上的同一性可为至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%的同一性。
24.本发明还提供了与所述重组蛋白22k相关的生物材料的应用,所述应用可为下述任一种:
25.h1)在检测血清4型禽腺病毒或制备用于检测血清4型禽腺病毒的产品中的应用;
26.h2)在诊断或辅助诊断血清4型禽腺病毒感染所引起的疾病或制备用于诊断或辅助诊断血清4型禽腺病毒感染所引起的疾病的产品中的应用;
27.h3)在筛查或辅助筛查血清4型禽腺病毒感染所引起的疾病或制备用于筛查或辅助筛查血清4型禽腺病毒感染所引起的疾病的产品中的应用;
28.h4)在鉴别血清4型禽腺病毒自然感染动物和灭活疫苗免疫动物或制备用于鉴别血清4型禽腺病毒自然感染动物和灭活疫苗免疫动物的产品中的应用;
29.h5)在制备用于检测血清4型禽腺病毒的检测抗原中的应用;
30.h6)在制备血清4型禽腺病毒抗体中的应用;
31.h7)在血清4型禽腺病毒感染所引起疾病的防控中的应用;
32.所述生物材料可为下述c1)至c5)中的任一种:
33.c1)编码所述重组蛋白22k的核酸分子;
34.c2)含有c1)所述核酸分子的表达盒;
35.c3)含有c1)所述核酸分子的重组载体、或含有c2)所述表达盒的重组载体;
36.c4)含有c1)所述核酸分子的重组微生物、或含有c2)所述表达盒的重组微生物、或含有c3)所述重组载体的重组微生物;
37.c5)含有c1)所述核酸分子的重组细胞、或含有c2)所述表达盒的重组细胞、或含有c3)所述重组载体的重组细胞。
38.上述应用中,c1)所述核酸分子可为下述任一种:
39.b1)编码序列是seq id no.2所示的dna分子;
40.b2)核苷酸序列是seq id no.2所示的dna分子。
41.上述应用中,所述产品可为试剂或试剂盒。
42.进一步地,所述血清4型禽腺病毒(fowl adenovirus serotype 4,fadv-4)感染所引起的疾病可为心包积液-肝炎综合征(hydropericardium hepatitis syndrome,hhs)。
43.seq id no.2所示的dna分子编码氨基酸序列是seq id no.1的重组蛋白22k。
44.本文所述核酸分子可以是dna,如cdna、基因组dna或重组dna。
45.本文所述载体是本领域技术人员公知的,包括但不限于:质粒、噬菌体(如λ噬菌体或m13丝状噬菌体等)、黏粒(即柯斯质粒)、人工染色体(如酵母人工染色体(yac)、细菌人工染色体(bac)、p1人工染色体(pac)或ti质粒人工染色体(tac)等)、病毒载体(如逆转录病毒(包括慢病毒)、腺病毒、腺相关病毒或疱疹病毒(如单纯疱疹病毒)等),所述载体具体可为20-t vecter和/或pet-32a(+)载体。
46.本文所述微生物可为酵母、细菌、藻或真菌。其中,细菌可来自埃希氏菌属(escherichia),欧文氏菌(erwinia),根癌农杆菌属(agrobacterium)、黄杆菌属(flavobacterium),产碱菌属(alcaligenes),假单胞菌属(pseudomonas),芽胞杆菌属(bacillus)等。
47.本文所述细胞是指可用于导入载体的细胞,其包括但不限于:真核细胞(如酵母细胞、曲霉菌)、动物细胞(如哺乳动物细胞、昆虫细胞)或原核细胞(如大肠杆菌或枯草杆菌)。所述细胞具体可为trans5αchemically competent cell和/或bl(21)de3感受态细胞。
48.所述重组载体具体可为重组载体pet-32a-22k。所述重组载体pet-32a-22k是将pet-32a(+)载体的ecor i和xho i识别位点间的片段(小片段)替换为核苷酸序列是序列表中seq id no.2的dna片段,保持pet-32a(+)载体的其他核苷酸序列不变,得到的重组表达载体。重组载体pet-32a-22k表达氨基酸序列如seq id no.1所示的重组蛋白22k。
49.所述重组细胞具体可为重组细胞bl(21)de3/pet-32a-22k。所述重组细胞bl(21)de3/pet-32a-22k是将所述重组载体pet-32a-22k导入bl(21)de3感受态细胞得到的表达重组蛋白22k的重组细胞。所述重组细胞bl(21)de3/pet-32a-22k含有seq id no.2所示的重组蛋白22k的基因。
50.本发明还提供了一种用于检测血清4型禽腺病毒的试剂盒,所述试剂盒包括所述重组蛋白22k。
51.进一步地,所述试剂盒可为酶联免疫试剂盒。
52.本发明还提供了制备所述试剂盒的方法,所述方法包括将所述重组蛋白22k制成16μg/ml的溶液包被固相载体得到包被抗原的固相载体的步骤。
53.上述方法中,所述包被固相载体的条件可为37℃放置2h后4℃放置14h。
54.所述包被是指抗原通过物理吸附作用被结合在固相载体上。
55.进一步地,所述固相载体可为酶标板、膜载体、微球、生物芯片或磁珠。
56.所述固相载体的材料可为聚苯乙烯、纤维素、交联右旋糖苷、聚丙烯酰胺、聚乙烯、聚丙烯、聚氯乙烯、交联葡聚糖、玻璃、硅橡胶或琼脂糖凝胶但不限于此。
57.所述膜载体可为硝酸纤维素膜、玻璃纤维素膜或尼龙膜但不限于此。
58.上述试剂盒名称可为血清4型禽腺病毒间接elisa检测试剂盒或fadv-4elisa检测试剂盒。
59.进一步地,所述试剂盒还包括包被液、标准阳性血清、标准阴性血清和酶标二抗。
60.所述酶标二抗是指用酶标记的能够特异性识别结合待测抗体的第二抗体。所述用于标记的酶可为辣根过氧化酶(horseradish peroxidase,hrp)、碱性磷酸酶(alkaline phosphatase,akp)、β-半乳糖苷酶(β-galactosidase)、葡萄糖氧化酶(glucose oxidase,god)、酸性磷酸酶但不限于此。
61.进一步地,所述试剂盒还包括样品稀释液、酶标抗体稀释液、底物显色液、终止液和洗涤液。
62.进一步地,所述试剂盒中的酶标二抗可为hrp标记山羊抗鸡igg抗体。
63.进一步地,所述试剂盒还包括记载有本文中所述用于检测血清4型禽腺病毒抗体的方法的可读性载体。所述可读性载体可为关于实践本发明方法的试剂盒说明书(例如印刷形式的说明书)或在其上已记录了信息的计算机可读的介质(例如软盘、cd等)。
64.包被本发明抗原(重组蛋白22k)的酶标板的制备方法为:用elisa包被液稀释抗原(纯化后的重组蛋白22k)后包被酶标板(每孔100μl),抗原包被浓度为16μg/ml,包被条件为:37℃静置2h后4℃包被14h;用pbst洗板后每孔加入封闭液(5%脱脂奶)200μl,37℃条件下封闭60min。
65.本发明所述标准阳性血清为fadv-4感染鸡阳性血清,标准阴性血清为spf鸡阴性血清,样品稀释液为1%bsa溶液,酶标抗体稀释液为1%bsa溶液,底物显色液为tmb显色液,终止液为2mol/l h2so4,洗涤液为pbst(商品名1
×
pbst缓冲液,公司北京索莱宝科技有限公司,货号p1031)。
66.本发明还提供了所述试剂盒在血清4型禽腺病毒抗体检测中的应用。
67.本发明还提供了一种用于检测血清4型禽腺病毒抗体的方法,所述方法是以所述重组蛋白22k作为抗原,采用elisa间接法检测待测样品中的血清4型禽腺病毒抗体。
68.上述方法中,所述方法可包括如下步骤:
69.e1)向本文中任一所述的试剂盒中加入待测样品;
70.e2)加入待测样品后孵育30min;
71.e3)加入酶标二抗孵育30min,所述酶标二抗为hrp标记山羊抗鸡igg抗体;
72.e4)加入酶的反应底物显色。
73.上述方法中,所述待测样品可为血清。
74.进一步地,在本发明的一个实施方案中,本发明所述方法包括如下步骤:
75.1、抗原包被酶标板:用elisa包被液(北京索莱宝科技有限公司产品,货号c1050)稀释抗原(纯化后的重组蛋白22k)后包被酶标板(每孔100μl),抗原包被浓度为16μg/ml,包被条件为:37℃静置2h后4℃包被14h;
76.2、洗板:弃去酶标板内的包被抗原,在吸水纸上拍干,孔内加满洗涤液(pbst),静置2~3min,再在吸水纸上拍干,如此洗涤3次;
77.3、封闭:每孔加入封闭液(5%脱脂奶)200μl,37℃条件下封闭60min;
78.4、洗板:同步骤2;
79.5、加待测样本:将待测样本血清(一抗血清)用稀释液(1%bsa)按照1:100的比例稀释,加入到酶标板中,每孔100μl,并设阳性血清对照、阴性血清对照和空白对照,37℃下孵育30min;
80.6、洗板:同步骤2;
81.7、加酶标二抗:用稀释液(1%bsa)将酶标二抗(hrp标记山羊抗鸡igg抗体)按照1:5000的比例稀释,加入到酶标板中,每孔100μl,37℃下孵育30min;
82.8、洗板:同步骤2;
83.9、加底物显色:每孔加入tmb显色液(北京索莱宝科技有限公司产品,货号pr1201)100μl,37℃下孵育11min;
84.10、终止反应:每孔加终止液(2mol/l h2so4)50μl终止反应,最后通过酶标仪检测。
85.结果判定:阴性、阳性临界值(cut-off)为:0.382,即当d
450nm
值大于等于0.382时,判断为阳性(说明待测样品含有fadv-4抗体);d
450nm
值小于0.382时,判断为阴性(说明待测样品不含有fadv-4抗体)。
86.本文所述重组蛋白22k,和/或,所述生物材料也在本发明的保护范围内。
87.与本发明所述蛋白质22k同源不同家族蛋白及不同源的同功能蛋白在本文所述d1)~d7)中的应用均在本发明的保护范围内。
88.本文中,术语“重组蛋白22k”、“22k重组蛋白”“22k蛋白”、“蛋白22k”及“22k”具有相同的含义,可以互换使用。
89.上述应用和方法的目的可以是疾病诊断目的、疾病预后目的和/或疾病治疗目的,它们的目的也可以是非疾病诊断目的、非疾病预后目的和非疾病治疗目的;它们的直接目的可以是获取疾病诊断结果、疾病预后结果和/或疾病治疗结果的中间结果的信息,它们的直接目的可以是非疾病诊断目的、非疾病预后目的和/或非疾病治疗目的。
90.上述应用的待测样品可为来自非有生命的人体或动物体的样品,如环境样品(如空气)、食品(如冷冻食品或新鲜食品)。
91.本文中,术语酶联免疫吸附试验(enzyme linked immunosorbent assay,elisa)是指将抗原或抗体吸附于固相载体上,检测过程中将待测抗体(或抗原)及酶标记物按先后顺序依次加入反应体系中,使其与固相载体上的抗原(或抗体)反应形成抗原抗体复合物,然后洗去未结合的游离酶标记物及游离抗原(或抗体),测定已结合的酶标记物的酶活性,从而确定样品中待测抗体(或抗原)的含量。elisa包括直接法、间接法、双抗夹心法、竞争法及抗酶抗体法等类型。虽然本发明提供的实施例采用的是elisa间接法检测血清4型禽腺病毒抗体,但本发明不限于该特定方法。本领域技术人员可采用其他方法,只要是利用本发明抗原(重组蛋白22k)与抗体的免疫反应和酶的高效催化作用结合起来的方法均未脱离本发明的范围,本发明应包括这些替代方法。
92.为建立鉴别血清4型禽腺病毒(fadv-4)感染的elisa方法,本发明以fadv-4非结构蛋白22k重组蛋白作为elisa包被抗原,优化反应条件,建立检测fadv-4抗体的间接elisa方法:22k-elisa。该方法与fadv-4感染的阳性血清特异性结合,与其他禽病阳性血清无交叉反应,特异性好;阳性血清稀释640倍仍可以用22k-elisa方法检测到,灵敏度高;22k-elisa方法批内和批间最大变异系数均小于10%,重复性好。用22k-elisa方法分别检测fadv-4人工感染spf鸡血清样品50份,结果均为阳性;而检测50份fadv-4灭活苗免疫spf鸡血清样品时,结果均为阴性;分别对养殖场fadv-4灭活苗免疫和非免疫的鸡血清样品进行检测验证,也表明该方法可区分灭活苗免疫和自然感染产生抗体的鸡,鉴别fadv-4的感染,为fadv-4的净化提供技术支持。
附图说明
93.图1为重组蛋白22k基因的pcr扩增凝胶成像系统观察结果。其中m表示dl2000marker,1-4表示重组蛋白22k基因扩增产物。
94.图2为重组质粒(pet-32a-22k)的双酶切鉴定结果。其中m表示dna marker,1表示pet-32a-22k双酶切产物。
95.图3为重组蛋白22k诱导表达的sds-page电泳结果。其中,m表示marker;1表示空菌体;2-7表示诱导时间分别为0、2、4、6、8、10h时的表达产物。
96.图4为重组蛋白22k诱导表达的sds-page电泳结果。其中,m表示marker;1表示空菌体;2-7表示iptg终浓度分别为0,0.2,0.4,0.6,0.8,1.0mmol/l时的表达产物。
97.图5为重组蛋白22k的可溶性鉴定。其中m表示蛋白marker,1表示空菌体,2表示全
菌体,3表示诱导菌液上清,4表示诱导菌液沉淀。
98.图6为重组蛋白22k的纯化结果。其中m表示蛋白marker,1表示纯化前蛋白,2-3表示冲洗液,4-5表示纯化后蛋白。
99.图7为重组蛋白22k的western-blot鉴定。其中m表示蛋白质分子质量标准,1表示重组蛋白22k,2表示阴性对照。
100.图8为实施例4中fadv-4elisa检测方法特异性试验结果。
101.图9为实施例4中fadv-4elisa检测方法敏感性试验结果。
102.图10为实施例4中fadv-4elisa检测方法样品鉴别检测结果。
具体实施方式
103.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
104.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
105.下述实施例中的fadv-4分离株gx2019-010记载于如下文献中:栾勇娇,谢芝勋,王盛,罗思思,张蕾,谢丽基,谢志勤,邓显文,张民秀,张艳芳,曾婷婷,范晴.血清4型禽腺病毒广西分离株gx2019-010全基因组测序与分析[j/ol].中国畜牧兽医:1-12[2022-06-13].http://kns.cnki.net/kcms/detail/11.4843.s.20200806.1044.002.html。公众可从申请人处获得该生物材料,该生物材料只为重复本发明的实验所用,不可作为其它用途使用。
[0106]
下述实施例中的fadv-4感染鸡阳性血清(简称fadv-4阳性血清)、fadv-4灭活苗免疫鸡血清样品和spf鸡阴性血清由本技术发明人所在实验室采集保存;鸡新城疫病毒(ndv)、禽呼肠孤病毒(arv)、h5亚型禽流感病毒(aiv-h5)、h9亚型禽流感病毒(aiv-h9)、传染性法氏囊病毒(ibdv)和传染性支气管炎病毒(ibv)阳性血清由本技术发明人所在实验室保存;公众可从申请人处获得上述生物材料,该生物材料只为重复本发明的实验所用,不可作为其它用途使用。
[0107]
下述实施例中的临床样品为广西富凤鸡场采集的fadv-4灭活苗免疫鸡血清样品96份,未免疫鸡血清样品217份。公众可从申请人处获得上述生物材料,该生物材料只为重复本发明的实验所用,不可作为其它用途使用。
[0108]
下述实施例中的pcr supermix购自北京全式金生物技术股份有限公司。
[0109]
下述实施例中的载体20-t vecter购自宝生物工程(大连)有限公司,pet-32a(+)载体购自北京索莱宝科技有限公司。
[0110]
下述实施例中的trans5αchemically competent cell和bl(21)de3感受态细胞购自北京全式金生物技术股份有限公司。
[0111]
实施例1、用于检测血清4型禽腺病毒的重组蛋白抗原的制备
[0112]
本实施例中用于检测血清4型禽腺病毒(fadv-4)的重组蛋白抗原为血清4型禽腺
病毒(fadv-4)非结构蛋白22k,通过大肠杆菌原核表达系统表达获得。重组蛋白22k的氨基酸序列为seq id no.1,重组蛋白22k的编码序列(cds)为seq idno.2。
[0113]
1、重组蛋白22k基因的克隆
[0114]
1-1、引物设计
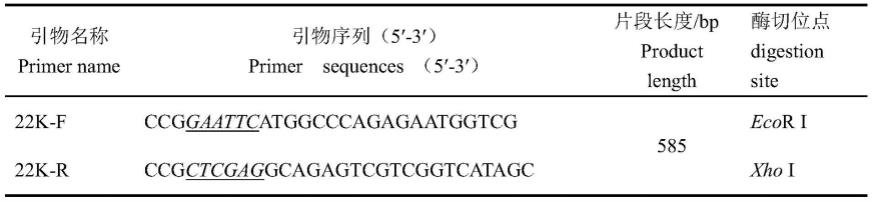
[0115]
参考genbank上已经公布的fadv-4非结构蛋白22k的基因序列,用primer 5.0设计特异性引物,插入合适的酶切位点,引物由华大生物有限公司合成。引物具体信息见表1。
[0116]
表1、用于扩增重组蛋白22k基因的特异性引物序列
[0117][0118]
1-2、重组蛋白22k基因的扩增
[0119]
1-2-1、病毒dna提取
[0120]
根据dna/rna共提试剂盒(北京全式金生物技术股份有限公司产品)说明书操作,提取fadv-4广西分离株(gx2019-010)dna(fadv-4 dna),置于-35℃冰箱备用。
[0121]
1-2-2、重组蛋白22k基因的pcr扩增
[0122]
以步骤1-2-1中提取的fadv-4dna为模板,扩增重组蛋白22k基因,pcr反应体系与反应程序见表2和表3,每个样品的基因扩增配制4个体系,即200μl(每个体系50μl)。pcr反应结束后,将反应产物在1%琼脂糖凝胶上进行电泳,80v,60min,dl2000 marker做对照,凝胶成像系统观察结果(图1)。结果显示重组蛋白22k基因扩增条带大小为585bp,与预期一致。
[0123]
表2、pcr扩增体系
[0124][0125]
表3、pcr反应程序
[0126][0127]
1-2-3、pcr产物的回收
[0128]
采用胶回收试剂盒(omega公司产品)进行pcr产物的回收,具体步骤如下:
[0129]
(1)将目的条带完整切下,置于2ml ep管中,称重,按1g/ml比例加入binding buffer。在55560℃水浴近7min,每隔253min摇晃一次,直至凝胶全部融化。
[0130]
(2)将离心柱放在收集管上,加650μl凝胶混合液到离心管中,10000
×
g离心1min,弃掉收集管中的液体,直到所有液体滤过离心柱。
[0131]
(3)加入300μl binding buffer,12000
×
g离心1min,弃掉收集管中的液体。
[0132]
(4)加入700μl spw wash buffer,12000
×
g,1min,弃掉收集液,重复此步骤两次。
[0133]
(5)将空离心管12000
×
g离心2min,干燥离心柱,将离心管盖打开静置2min,充分挥发乙醇。
[0134]
(6)将离心柱转至干净ep管中,加入30μl去离子水到柱膜中心,静置2min,最大速度离心1min,将洗脱的dna(即回收产物:22k蛋白基因dna)保存在-35℃,备用。
[0135]
1-2-4、pcr产物与克隆载体20-t vecter连接
[0136]
取4μl回收产物于ep管中,加入1μl20-t vecter,再加入5μl t4ligation mix(宝生物工程(大连)有限公司产品),轻轻混匀,16℃连接过夜(14h)。将连接产物全数加入100μl trans5αchemically competent cell,冰浴30min后,在42℃水浴热激45s,再冰浴2min,加入500μl无菌lb培养基,混匀后置于37℃摇床,200rpm培养1h,使细菌复苏。吸取200μl已转化的感受态细胞加到含氨苄青霉素(amp)、5-溴-4-氯-3-吲哚-β-d-半乳糖苷(x-gal)、异丙基-β-d-硫代半乳糖苷(iptg)的lb平板上,均匀涂开,将平板放置于37℃培养箱中,倒置平板,培养过夜。通过蓝白班筛选挑取白色菌落,接种于1ml含amp的lb培养基中,37℃,200rpm培养4h,pcr检测后,阳性菌液送生工生物测序,验证目的基因是否成功插入载体。
[0137]
1-2-5、重组质粒的提取
[0138]
将测序正确的菌液1:100稀释,接种到含amp的lb培养基中,37℃,200rpm培养过夜,采用质粒提取试剂盒(omega公司产品)提取质粒,步骤如下:
[0139]
(1)将培养过夜后的菌液4000
×
g离心10min,弃去上清。
[0140]
(2)加入500μl solution i,漩涡充分混合,将悬浮液转移至新的2ml离心管。
[0141]
(3)加入500μl solution ii,轻轻翻转离心管混匀几次,以获得清晰的裂解物。
[0142]
(4)加入700μl solution iii,立即反转混匀,直到产生白色絮状物。
[0143]
(5)室温下以12000
×
g离心10min。
[0144]
(6)将上清液转移到离心柱中,最大速度离心1min,弃去流出液,重复此步骤至所有上清液过柱。
[0145]
(7)加500μl hbc缓冲液,12000
×
g离心1min,弃去滤液,重复使用收集管。
[0146]
(8)加入700μl dna洗涤缓冲液,12000
×
g离心1min,弃液,重复两次。
[0147]
(9)空管离心2min,将离心柱干燥。
[0148]
(10)离心柱转移到新ep管中,加入100μl无菌去离子水,最大速度离心1min,测质粒浓度后-35℃保存。
[0149]
提取的重组质粒命名为20-t-22k,含有核苷酸序列为seq id no.2的重组蛋白22k基因。
[0150]
2、重组蛋白22k基因原核表达载体的构建
[0151]
按表1中选取的酶切位点(ecor i和xho i),参照宝生物工程(大连)有限公司内切酶说明书,将重组质粒20-t-22k与pet-32a(+)载体双酶切,50μl体系,37℃反应3h。酶切产物经0.8%琼脂糖凝胶电泳分离后,回收目的片段(重组蛋白22k基因)和载体骨架,目的片段和载体骨架按10:1的比例,在16℃连接过夜,将连接产物转入bl(21)de3感受态细胞,涂板培养过夜,挑取菌落进行pcr鉴定,选取阳性菌落进行双酶切鉴定(鉴定结果如图2所示,得到清晰的条带,酶切片段大小与目的基因大小一致),并送生工生物测序,测序结果用megalign软件中的clustal w方法比对分析,验证片段是否正确连接到表达载体上。测序结果经分析表明目的片段成功插入pet-32a(+)载体,重组载体构建成功。经测序鉴定后筛选得到阳性重组载体,命名为pet-32a-22k。
[0152]
重组载体pet-32a-22k是将pet-32a(+)载体的ecor i和xho i识别位点间的片段(小片段)替换为核苷酸序列是序列表中seq id no.2的dna片段,保持pet-32a(+)载体的其他核苷酸序列不变,得到的重组表达载体。重组载体pet-32a-22k表达氨基酸序列如seq id no.1所示的重组蛋白22k。
[0153]
将所述重组载体pet-32a-22k导入bl(21)de3感受态细胞得到的表达重组蛋白22k的重组细胞命名为bl(21)de3/pet-32a-22k。所述重组细胞bl(21)de3/pet-32a-22k含有seq id no.2所示的重组蛋白22k的基因。
[0154]
3、重组蛋白的诱导表达和纯化
[0155]
3-1、重组蛋白的诱导表达
[0156]
将测序无误的阳性菌液(即步骤2中测序无误的阳性菌落培养在lb液体培养基中得到的菌液)按照1%比例接种到10ml含amp的lb液体培养基中,37℃,200rpm培养14h,作为种子夜。种子液按体积比1:100的比例接种到12ml lb液体培养基扩大培养,分装至6个试管中(每个试管2ml),37℃,200rpm培养4h至d
600nm
在0.650.8之间时,加入iptg至终浓度为0.6mmol/l,诱导0h,2h,4h,6h,8h,10h,各取1ml菌液,12000
×
g,2min,弃上清,沉淀中加入100μl高效ripa裂解液(北京索莱宝科技有限公司),混匀后置于冰上裂解20min,30hz超声3min,煮沸10min,冰浴10min后离心取上清液进行sds-page电泳,65v,35min后110v,30min,sds-page电泳分析重组蛋白是否表达,电泳条带用bandscan 4.3软件进行分析,选出最佳iptg作用浓度。重复以上操作,加入iptg至终浓度分别为0mmol/l,0.2mmol/l,0.4mmol/l,0.6mmol/l,0.8mmol/l,1mmol/l,诱导4h,确定最佳诱导浓度。
[0157]
重组蛋白经iptg诱导后,得到良好表达,大小为49kda,与预期大小一致。用bandscan 4.3软件分析sds-page电泳结果表明,重组蛋白22k在诱导时间为4h时(图3,泳道4),iptg浓度为0.2mmol/l时(图4,泳道3),表达量最佳。
[0158]
3-2、重组蛋白的可溶性鉴定
[0159]
以最佳诱导条件(iptg浓度为0.2mmol/l,诱导时间4h)诱导后取2ml菌液离心,用pbs将菌泥洗两遍,加入200μl pbs重悬沉淀,加入溶菌酶(终浓度100μg/ml),在-80℃与37℃之间反复冻融三次,在冰上超声裂解至菌液澄清,12000
×
g,2min,分离上清与沉淀,沉淀用包涵体溶解液溶解,加入上样缓冲液,30μl/孔上样进行sds-page电泳,分析重组蛋白的表达形式。若表达产物在上清,为可溶性表达,若表达产物在沉淀,为包涵体表达。结果如图5所示,重组蛋白22k超声后分离沉淀上清和进行sds-page电泳分析,结果表明表达产物主
要在上清,为可溶性表达。
[0160]
3-3、重组蛋白的纯化
[0161]
蛋白纯化缓冲液配制:以20mmol/l tris-hcl(ph 7.9),5mmol/l imidazole(咪唑),0.5mol/l nacl,8mol/l尿素的比例配制binding buffer;以binding buffer为基础增加咪唑浓度,配置咪唑浓度分别为25、50、75、100、125、150、175、200、250、300、350、500mmol/l的elution buffer。
[0162]
层析柱的组装:取3ml ni-agarose resin填料到层析柱,静置分层,打开底部出液口,乙醇流出后用15ml去离子水将填料中的乙醇冲洗干净,24ml binding buffer平衡柱子。
[0163]
菌液处理及纯化:以最佳诱导条件诱导600ml菌液,10000
×
g离心10min,收集菌泥,加入20ml细菌裂解液,混匀后置于冰水中静置裂解30min,冰浴超声使菌体裂解,50hz,每超声5s间隔5s,超声至液体不再粘稠。4℃,10000
×
g离心15min,收集上清液负载上柱,与填料充分混合,置于冰上在摇摆平台混合20min,使蛋白与填料充分结合。静置分层,收集流穿液。使用15倍填料体积的binding buffer洗去杂蛋白。每个梯度用1倍柱体积的elution buffer进行洗脱,分管收集洗脱液,经过sds-page电泳分析确定纯化效果,选取纯度较高的洗脱液,测定浓度后分装保存于-80℃,最终得到纯化后的重组蛋白22k。
[0164]
经镍柱亲和层析纯化后,sds-page电泳检测纯化效果,重组蛋白22k得到单一的特异性条带,纯化效果较好(图6)。经bca蛋白浓度测定试剂盒测定重组蛋白浓度为320mg/l。
[0165]
3-4、重组蛋白的western-blot鉴定
[0166]
3-4-1、试剂配制
[0167]
(1)转膜缓冲液(100ml):称取甘氨酸(glycine)0.29g,三羟甲基氨基甲烷(tris)0.58g,加入80ml去离子水,再加入20ml甲醇,混匀备用。
[0168]
(2)封闭缓冲液:称取0.5g脱脂奶粉加入到10ml的1
×
tbst溶液(北京索莱宝科技有限公司产品,货号t1085)中,充分搅拌溶解。
[0169]
3-4-2、转膜
[0170]
sds-page电泳后将凝胶取出,切去多余部分,浸泡到转膜缓冲液中。准备好吸水纸和聚偏氟乙烯(pvdf)膜,在转膜缓冲液中浸泡10min。从下到上以“纸-膜-胶-纸”做“三明治”状转膜块,压平,排尽气泡,放入电转槽中,盖上盖子,用0.5ma电流转膜30min。转膜结束后取出膜,用5%脱脂牛奶封闭3h。
[0171]
3-4-3、免疫杂交与显色
[0172]
封闭后放入tbst溶液中,洗涤3次,每次10min,然后用tris缓冲盐溶液(tbs,北京索莱宝科技有限公司产品)洗1次,10min,震荡频率为80次/min。后续洗膜均与此相同。用0.5%脱脂牛奶(用tbst配制)按照1:200的比例稀释fadv-4阳性血清(一抗),用一次性塑封膜封闭,4℃孵育过夜。弃去一抗,洗去未结合的抗体。加入稀释好的hrp标记山羊抗鸡igg抗体作为二抗(1:2000,生工生物工程(上海)股份有限公司产品),37℃孵育1h。洗去未结合的二抗。洗膜结束后取出,将膜上有蛋白的一面朝上平整地铺在显色盒中,加入ecl工作稀释液(ecl超敏化学发光试剂盒中组件,苏州新赛美生物科技有限公司产品)覆盖膜,避光孵育155min。通过bio-rad成像系统进行曝光成像。
[0173]
重组蛋白的western-blot鉴定结果如图7所示,纯化的重组蛋白进行sds-page电
泳,转至pvdf膜,以fadv-4阳性血清作为一抗进行western-blot检测,结果显示,在49kda处,有目的条带,表明重组蛋白22k与fadv-4阳性血清有特异性反应,表明重组蛋白具有良好的反应原性(抗原性)。
[0174]
实施例2、fadv-4elisa检测条件的优化
[0175]
本发明的elisa检测为elisa间接法,其原理是将已知抗原吸附于固相载体上,加入待测样品(如含有待测抗体的动物血清),待测抗体与抗原结合,洗涤未结合抗体,再加入酶标二抗(用酶标记的能够特异性识别结合待测抗体的第二抗体),形成抗原-待测抗体-酶标二抗复合物,当进一步在反应体系中加入酶的反应底物后,有色产物的形成量与待测抗体的量成正比。
[0176]
本实施例基于实施例1中制备的抗原蛋白(重组蛋白22k)优化elisa间接法(本文中也称为22k-elisa方法)检测的条件。
[0177]
1、最佳抗原包被浓度与一抗血清最佳稀释度的确定
[0178]
将纯化的22k重组蛋白用包被液(elisa包被液(1
×
),北京索莱宝科技有限公司产品)依次稀释至32、16、8、4、2μg/ml,100μl/孔分别包被酶标板,每个浓度包被两列;将一抗血清依次稀释50、100、200、400倍,每个梯度作用一行,按常规elisa程序进行elisa检测。上酶标仪读取d
450nm
值,选取d
450nm
值接近1,p/n值(阳性血清d
450nm
/阴性血清d
450nm
)最大的孔为最佳反应孔,最佳反应孔对应的包被浓度为最佳抗原包被浓度,对应的一抗血清稀释度为一抗血清最佳稀释度。结果如表4所示,经方阵试验,得到22k-elisa方法最佳抗原包被浓度为16μg/ml,一抗血清最佳稀释度为1:100。
[0179]
表4、22k重组蛋白抗原最佳包被浓度与血清最佳稀释度的确定
[0180][0181]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0182]
2、抗原最佳包被条件的确定
[0183]
将抗原(纯化的22k重组蛋白)按最佳包被浓度稀释后包被酶标板,包被条件分别为4℃14h,25℃14h,37℃1h后4℃14h,37℃2h后4℃14h,37℃3h后4℃14h,一抗血清按最佳稀释度稀释进行elisa检测,其他反应条件如上不变,选取最佳反应孔所对应的包被条件为最佳包被条件。结果如表5所示,在37℃静置2h后4℃包被14h的条件下,阳性血清d
450nm
值接
近1,p/n值最大,因此确定22k-elisa方法的最佳包被条件为37℃2h后4℃14h。
[0184]
表5、抗原最佳包被条件的确定
[0185][0186]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0187]
3、最佳封闭时间的确定
[0188]
按步骤1的抗原最佳包被浓度及步骤2的最佳包被条件包被后,加入封闭液分别作用30min、60min、90min、120min,以最佳一抗稀释度(1:100)稀释一抗血清进行elisa反应,确定最佳封闭时间。结果如表6所示,在封闭时间为60min时,阳性血清d
450nm
值接近1,p/n值最大。确定22k-elisa方法的最佳封闭时间为60min。
[0189]
表6、最佳封闭时间的确定
[0190][0191]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0192]
4、一抗血清最佳孵育时间的确定
[0193]
按步骤1、2、3确定的最佳条件包被、封闭酶标板,加入一抗血清后分别作用30min、60min、90min、120min,其他程序不变,进行elisa检测,选取p/n值最大的反应孔对应的孵育时间为一抗血清最佳孵育时间。结果如表7所示,一抗血清孵育30min时阳性血清d
450nm
值接近1,p/n值最大,因此确定22k-elisa方法的一抗血清最佳孵育时间为30min。
[0194]
表7、一抗血清最佳孵育时间的确定
[0195][0196]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0197]
5、酶标二抗最佳稀释度和孵育时间的确定
[0198]
采用抗原最佳包被浓度和血清最佳稀释度进行,将hrp标记山羊抗鸡igg抗体分别以1:2500、1:5000、1:7500、1:10000、1:15000、1:20000稀释,进行elisa检测,确定酶标二抗
最佳稀释度。
[0199]
按已优化好的最佳反应条件,加入酶标二抗后,分别作用30min、60min、90min、120min,其他条件不变,进行elisa测定,每个时间设三个重复,选择p/n值最大孔所对应时间为酶标二抗最佳孵育时间。
[0200]
结果如表8和表9所示,当酶标二抗以1:5000稀释时,阳性血清d
450nm
值接近1,p/n值均最大,确定22k-elisa方法酶标二抗最佳稀释度为1:5000(表8)。酶标二抗孵育30min时,p/n值最大,确定22k-elisa方法酶标二抗最佳孵育时间为30min(表9)。
[0201]
表8、酶标二抗最佳稀释度的确定
[0202][0203][0204]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0205]
表9、酶标二抗最佳孵育时间的确定
[0206][0207]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0208]
6、最佳显色时间的确定
[0209]
按步骤1-5优化好的最佳反应条件进行elisa检测后,分别显色3、5、7、9、11、13、15min,确定最佳显色时间。结果如表10所示,显色11min时,22k-elisa方法p/n值最大,确定22k-elisa方法的最佳显色时间为11min。
[0210]
表10、最佳显色时间的确定
[0211][0212]
注:“+”为阳性血清;
“‑”
为阴性血清。
[0213]
7、临界值(cut-off)的确定
[0214]
用步骤1-6已优化的elisa反应程序检测100份spf鸡阴性血清样品,测定d
450nm
值,计算平均值(x)和标准差(s),求出x+3s的值为所建方法(22k-elisa方法)的临界值,d
450nm
值大于或等于临界值判定为阳性,d
450nm
值小于临界值判定为阴性。经以上判定方式,阴性、阳性临界值(cut-off)为:0.382,即当d
450nm
值大于等于0.382时,判断为阳性(说明待测样品含有fadv-4抗体);d
450nm
值小于0.382时,判断为阴性(说明待测样品不含有fadv-4抗体)。
[0215]
实施例3、fadv-4elisa检测试剂盒及检测方法
[0216]
1、fadv-4elisa检测方法:
[0217]
根据实施例2的优化,建立了如下22k-elisa方法:
[0218]
①
抗原包被酶标板:用elisa包被液(北京索莱宝科技有限公司产品,货号c1050)稀释实施例1中制备的抗原(纯化后的重组蛋白22k)后包被酶标板(每孔100μl),抗原包被浓度为16μg/ml,包被条件为:37℃静置2h后4℃包被14h;
[0219]
②
洗板:弃去酶标板内的包被抗原,在吸水纸上拍干,孔内加满洗涤液(pbst),静置2~3min,再在吸水纸上拍干,如此洗涤3次;
[0220]
③
封闭:每孔加入封闭液(5%脱脂奶)200μl,37℃条件下封闭60min;
[0221]
④
洗板:同步骤
②
;
[0222]
⑤
加待测样本:将待测样本血清(一抗血清)用稀释液(1%bsa)按照1:100的比例稀释,加入到酶标板中,每孔100μl,并设阳性血清对照、阴性血清对照和空白对照,37℃下孵育30min;
[0223]
⑥
洗板:同步骤
②
;
[0224]
⑦
加酶标二抗:用稀释液(1%bsa)将酶标二抗(hrp标记山羊抗鸡igg抗体)按照1:5000的比例稀释,加入到酶标板中,每孔100μl,37℃下孵育30min;
[0225]
⑧
洗板:同步骤
②
;
[0226]
⑨
加底物显色:每孔加入tmb显色液(北京索莱宝科技有限公司产品,货号pr1201)100μl,37℃下孵育11min;
[0227]
⑩
终止反应:每孔加终止液(2mol/l h2so4)50μl终止反应,最后通过酶标仪检测。
[0228]
结果判定:阴性、阳性临界值(cut-off)为:0.382,即当d
450nm
值大于等于0.382时,判断为阳性(说明待测样品含有fadv-4抗体);d
450nm
值小于0.382时,判断为阴性(说明待测样品不含有fadv-4抗体)。
[0229]
2、fadv-4elisa检测试剂盒
[0230]
本发明fadv-4elisa检测试剂盒中包括:包被本发明抗原(重组蛋白22k)的酶标板;标准阳性血清;标准阴性血清;hrp标记山羊抗鸡igg抗体;样品稀释液;酶标抗体稀释液;底物显色液;终止液;洗涤液。
[0231]
其中包被本发明抗原(重组蛋白22k)的酶标板的制备方法为:用elisa包被液稀释实施例1中制备的抗原(纯化后的重组蛋白22k)后包被酶标板(每孔100μl),抗原包被浓度为16μg/ml,包被条件为:37℃静置2h后4℃包被14h;用pbst洗板后每孔加入封闭液(5%脱脂奶)200μl,37℃条件下封闭60min。
[0232]
标准阳性血清为fadv-4感染鸡阳性血清。
[0233]
标准阴性血清为spf鸡阴性血清。
[0234]
样品稀释液为1%bsa溶液。
[0235]
酶标抗体稀释液为1%bsa溶液。
[0236]
底物显色液为tmb显色液。
[0237]
终止液为2mol/l h2so4。
[0238]
洗涤液为pbst(商品名1
×
pbst缓冲液,公司北京索莱宝科技有限公司,货号p1031)。
[0239]
实施例4、fadv-4elisa检测方法的验证
[0240]
1、特异性试验
[0241]
用实施例3建立的22k-elisa方法检测抗ndv、ibdv、ibv、arv、aiv-h5、aiv-h9阳性血清、fadv-4灭活苗免疫鸡血清和fadv-4感染鸡阳性血清,设spf鸡阴性血清样品为阴性对照,评估elisa方法的特异性。
[0242]
结果如图8所示,结果显示22k-elisa方法中,重组蛋白22k只与fadv-4感染鸡阳性血清特异性结合,而不与其他禽类病毒的阳性血清反应,也不与fadv-4灭活苗免疫血清反应,特异性良好。
[0243]
2、敏感性试验
[0244]
随机选择三份fadv-4感染鸡阳性血清分别以1:40,1:80,1:160,1:320,1:640,1:1280,1:2560、1:5120稀释,按elisa最佳反应程序(实施例3建立的22k-elisa方法)进行,评估elisa方法的敏感性。
[0245]
结果如图9所示,当阳性血清以1:640倍稀释时,用22k-elisa方法检测d
450nm
值仍大于其临界值,为阳性;22k-elisa方法最低检测限度为1:640,表明本发明建立的elisa检测方法具有很好的敏感性。
[0246]
3、重复性试验
[0247]
随机取fadv-4感染鸡阳性血清和spf鸡阴性血清各5份,使用同一批次制备的抗原包被板,在三个不同时间检测,每次设3个重复孔,进行批内重复性试验;在三个不同批次制备的抗原包被板上,同一时间对样品进行检测,进行批间重复性试验。结果如表11所示,用同一批次包被的酶标板在三个不同时间检测阴阳性样品各5份,22k-elisa方法的变异系数(变异系数=方差/平均数
×
100%)在1.7%54.2%之间,小于5%,说明该方法的批内重复性较好。用三个不同批次包被的酶标板在同一时间检测10份随机样品,结果显示变异系数低于5%,表明该方法的批间重复性良好。
[0248]
表11、22k-elisa方法重复性试验结果
[0249]
[0250][0251]
4、鉴别检测的验证
[0252]
用本发明建立的22k-elisa方法检测fadv-4感染鸡阳性血清样品和fadv-4灭活苗免疫鸡血清样品各50份以及spf鸡阴性血清样品100份,评估建立的方法是否可以区分感染鸡血清抗体和灭活苗免疫鸡血清抗体。结果如图10所示,用22k-elisa方法检测fadv-4感染鸡阳性血清样品和fadv-4灭活苗免疫鸡血清样品各50份和spf鸡阴性血清样品100份,结果显示检测50份fadv-4感染鸡阳性血清均为阳性,而检测50份fadv-4灭活苗免疫鸡血清和100份spf鸡阴性血清均为阴性,表明所建立方法可以区分感染血清抗体和灭活苗免疫抗体。
[0253]
5、临床样品检测结果
[0254]
用本发明建立的22k-elisa方法检测广西富凤鸡场采集的fadv-4灭活苗免疫鸡血清样品96份和未免疫鸡血清样品217份,同时以i群禽腺病毒(fadv-i)商品化试剂盒(禽腺病毒i群(fadv-i)抗体elisa试剂盒,简称fadv-i elisa试剂盒,荷兰biochek公司产品,货号ck132)进行对比检测,结果见表12,用fadv-ielisa试剂盒检测灭活苗免疫的样品(96份),均为阳性,而用22k-elisa方法检测灭活苗免疫的样品(96份)阳性率为5.2%。用fadv-i elisa试剂盒、22k-elisa方法检测非免疫的血清样品(217份),阳性率分别为44.7%和27.6%。
[0255]
表12、临床样品检测结果
[0256][0257]
从表12中可以得出,22k-elisa的阳性检出率为5.2%(od为弱阳性值)。灭活疫苗免疫鸡群中能产生针对结构蛋白的抗体,而不产生针对非结构蛋白22k的抗体;22k重组蛋白几乎不能检测出灭活疫苗免疫鸡群中的抗体,因此,22k重组蛋白能用来区别自然感染以及灭活疫苗免疫鸡群。
[0258]
由以上实施例可以得出,本发明提供的22k重组蛋白能够检测fad v-4病毒的感染,而且能够区别自然感染以及灭活疫苗免疫鸡群。
[0259]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1