一种猫杯状病毒的单克隆抗体及其应用的制作方法
1.本发明涉及抗体及其在制药领域中的应用,特别是涉及一种猫杯状病毒单克隆抗体,编码抗体的多核苷酸及其宿主细胞,以及单克隆抗体在制备治疗猫杯状病毒感染药物中的应用。
背景技术:
2.猫杯状病毒(feline calicivirus,fcv)属于杯状病毒科水疱疹病毒属成员,是感染家猫及野生猫科动物的常见病原体之一。fcv为单股、正链的rna病毒,无囊膜,直径为35~39nm,衣壳由32个中间凹陷的杯状颗粒组成,这些颗粒由90个壳粒以t=3二十面体对称形式组成。基因组大小约为7.7kb,共有三个开放阅读框(open reading frame,orf),orf1编码非结构蛋白,包括病毒蛋白酶、rna依赖性rna聚合酶,orf2大小约2.0kb,主要编码fcv的结构蛋白即衣壳蛋白,orf3编码次要结构蛋白。
3.自1957年fastier从新西兰的一只猫中首次分离得到fcv,又相继在狮子、老虎及猎豹等猫科动物体内分离到该病毒,且在欧洲、美洲、亚洲都有发现,目前已呈世界性分布。并且2009年martino等人从患有肠炎的幼犬肛拭子中也分离到该病毒,表明fcv具有跨种间传播的风险。fcv在猫群中高度流行,引起一种高度传染性的呼吸道疾病,感染后会引起发热、打喷嚏、鼻炎、结膜炎、口腔溃疡等症状。多数临床健康猫可长期向外排毒,该病发病率较高,死亡率较低。目前,疫苗接种是防治本病最有效方法,但现有疫苗的保护效果并不理想,对猫及猫科珍稀野生动物的生存和健康造成了极大的威胁。
4.目前还没有治疗fcv感染的特异性药物,临床上主要以对症治疗和支持治疗相结合的方法。亟需一种对fcv治疗具有特异性高的药物,用于治疗因fcv引起的猫杯状病毒病。
技术实现要素:
5.为解决上述不足,本发明提供了猫杯状病毒单克隆抗体及其制备方法,以及在制备用于治疗猫杯状病毒感染药物中的应用。
6.本发明首先提供了一种猫杯状病毒的单克隆抗体,其重链cdr区1-3的氨基酸序列分别如seq id no.1、2和3所示;其轻链cdr区1-3的氨基酸序列分别如seq id no.4、5和6所示。所述猫杯状病毒的单克隆抗体其重链fr区1-4的氨基酸序列分别如seq id no.7、8、9和10所示;其轻链fr区1-4的氨基酸序列分别如seq id no.11、12、13和14所示。
7.本发明中,所述猫杯状病毒的单克隆抗体包括重链和轻链,每条重链包括重链可变区(vh)和重链恒定区(ch)。每条轻链包括轻链可变区(vl)和轻链恒定区(cl)。vh区和vl区可进一步分为互补决定区(cdr),每两个互补决定区之间插有框架区(fr)。每个vh和vl包括三个cdr和四个fr,从氨基末端到羧基末端的依次连接顺序为:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4。
8.更具体地,本发明所述的单克隆抗体,其重链可变区的氨基酸序列如seq id no.15所示;其轻链可变区的氨基酸序列如seq id no.16所示。
9.本发明所述的单克隆抗体包括具有与seq id no.15氨基酸序列至少90%序列同一性的重链可变区序列,和/或包含具有与seq id no.16氨基酸序列至少90%序列同一性的轻链可变区序列。优选地,是包含具有与seq id no.15氨基酸序列至少95%,更优选地,至少98%序列同一性的重链可变区序列,和/或包含具有与seq id no.16氨基酸序列至少95%,更优选地,至少98%序列同一性的轻链可变区序列。
10.本发明中,术语“序列同一性”是指两个核酸分子或抗体蛋白之间的序列的关系,更具体地,是指经对齐的核苷酸或氨基酸序列相同匹配的比例。所述相同匹配是当比较序列中的位置被相同的碱基或氨基酸占据时,此时该位置的分子是相同的,即为相同匹配。对于本领域技术人员,可使用各种比对算法和/或程序来计算两个序列之间的同一性。例如基于clustalw计算机程序(thompson nucl.acids res.2(1994))或fastdb(brutlag comp.app.biosci.6(1990),237-245)算法计算序列之间/序列中的百分同一性的方式,或利用blast或blast 2.0计算两个序列之间的同一性。
11.导致氨基酸序列同一性的差异,包括在本发明提供的氨基酸序列的抗体基础上对抗体中某个或某些氨基酸的修饰。需要指出,本发明中,所述氨基酸修饰是指不会明显改变该抗体结合特征的氨基酸修饰。所述修饰包括氨基酸替换、添加、或缺失。氨基酸修饰可以通过本领域的常规技术手段对抗体引入修饰。具体地,所述替换包括将某种氨基酸替换为具有相似侧链的氨基酸,所述相似侧链是基于本领域技术人员常规认知所定义的,包括具有相似的碱性侧链,例如赖氨酸、精氨酸、组氨酸,相似的酸性侧链,例如天冬氨酸、谷氨酸,相似的非极性侧链或极性侧链等。氨基酸替换也可以是基于氨基酸亲/疏水性的替换,例如处于改善亲/疏水性对氨基酸的替换;或处于改善抗体蛋白序列稳定性而将实施的氨基酸替换。上述氨基酸序列的变化,也会导致表达氨基酸序列的核苷酸序列的相应变化。
12.本发明的另一方面提供了一种编码猫杯状病毒单克隆抗体的核苷酸序列,其重链cdr区1-3的核苷酸序列分别如seq id no.17、18和19所示;其轻链cdr区1-3的核苷酸序列分别如seq id no.20、21和22所示;其重链fr区1-4的核苷酸序列分别如seq id no.23、24、25和26所示;其轻链fr区1-4的核苷酸序列分别如seq id no.27、28、29和30所示。更具体地,编码猫杯状病毒单克隆抗体的多核苷酸,其重链可变区的核苷酸序列如seq id no.31所示;其轻链可变区的核苷酸序列如seq id no.32所示。
13.本发明中,所述编码抗体的多核苷酸还包含具有与seq id no.31或其反向互补序列至少80%序列同一性的重链可变区序列,和/或包含具有与seq id no.32或其反向互补序列至少80%序列同一性的轻链可变区序列。优选地,包含具有与seq id no.31或其反向互补序列至少90%序列同一性的重链可变区序列,和/或包含具有与seq id no.32或其反向互补序列至少90%序列同一性的轻链可变区序列。
14.根据上述编码猫杯状病毒单克隆抗体的多核苷酸,本发明进一步提供一种包含所述的核苷酸载体的重组宿主细胞。特别是一种杂交瘤细胞株,保藏编号为cgmcc no.45148。
15.本发明进一步提供了一种制备杂交瘤细胞的方法,具体地,将猫杯状病毒bjh13株接种至f81细胞上进行培养,获得病毒液。将病毒液纯化后注射小鼠,获得免疫小鼠。通过取小鼠脾细胞进一步与sp2/0骨髓瘤细胞进行细胞融合,经筛选克隆获得杂交瘤细胞株。
16.上述杂交瘤细胞用于制备猫杯状病毒单克隆抗体,经实验表明杂交瘤细胞连续传至p20代,抗体分泌稳定;于液氮中保存12个月,抗体分泌稳定。
17.本发明提供了一种通过猫杯状病毒单克隆抗体在制备用于治疗猫杯状病毒感染药物中的应用。所述用于治疗猫杯状病毒感染药物为注射液。通过按照1ml/kg剂量肌肉注射猫杯状病毒单克隆抗体注射液,每日1次,连用3日对病猫进行治疗,本实验室制备的猫杯状病毒单克隆抗体注射液对感染fcv试验猫治疗后临床症状明显缓解,核酸检测fcv转为阴性,精神正常、食欲恢复、无可见眼鼻分泌物、口腔溃疡创口基本愈合。
附图说明
18.图1:分离病毒在f81细胞上产生的cpe对比图;
19.图2:猫杯状病毒bjh13株的分离pcr检测结果。
20.注:图1中,a:正常的f81细胞;b:bjh13株在f81细胞产生的cpe;
21.图2中,m:marker dl2000;fcv鉴定,其中1:bjh13 f3代病毒液;2:阴性对照;3:阳性对照;fpv鉴定,其中4:bjh13 f3代病毒液;5:阴性对照;6:阳性对照;fhv鉴定,
22.其中7:bjh13 f3代病毒液;8:阴性对照;9:阳性对照。
具体实施方式
23.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
24.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
25.一、猫杯状病毒bjh13株的分离鉴定
26.1材料与方法
27.1.1病料及细胞
28.病料来源于北京某宠物医院疑似感染fcv猫的眼咽拭子;f81细胞由北京博莱得利生物技术有限责任公司传代并保存。
29.1.2试剂
30.dmem培养基,购自gibco公司;牛血清,兰州民海生物工程有限公司;胰蛋白酶,购自hyclone公司;病毒基因组dna/rna提取试剂盒、rna反转录试剂盒,购自北京全式金生物技术有限公司;pcr和rt-pcr扩增试剂盒,购自宝生物工程(大连)有限公司。
31.1.3 bjh13株的分离鉴定
32.取经pcr鉴定fcv阳性的眼咽拭子液充分震荡混匀后,经8000r/min离心8~10分钟,取上清经0.22μm过滤除菌。接种至单层f81细胞,并加入含2%牛血清的dmem培养液,置37℃、5%co2培养箱培养。收获病毒液并进行pcr鉴定。
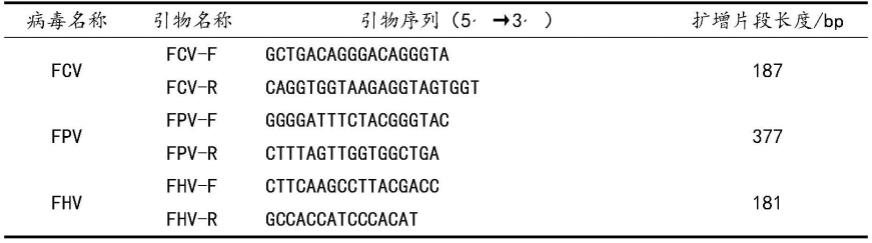
33.2结果
34.2.1细胞病变
35.将fcv bjh13株接种至f81细胞,在显微镜下可观察到细胞聚缩成团、脱落、葡萄串
样典型病变,见图1。
36.2.2 pcr鉴定
37.以bjh13株核酸为模板,经fcv、fpv、fhv特异性引物进行pcr扩增。其中fcv、fpv、fhv特异性引物如表1所示。电泳结果表明,仅fcv呈阳性,见图2。表明成功分离到一株fcv毒株,命名为bjh13。
38.表1引物信息
[0039][0040]
其中,所述的fcv-f引物以及fcv-r引物亦可用于制备猫杯状病毒检测制剂。所述制剂包括但不限于检测试剂盒。
[0041]
二、抗猫杯状病毒单克隆抗体的制备及生物学特性鉴定
[0042]
1材料
[0043]
1.1毒种
[0044]
猫杯状病毒bjh13株f5代,由北京博莱得利生物技术有限责任公司分离、鉴定并保存。
[0045]
1.2细胞
[0046]
sp2/0骨髓瘤细胞、f81细胞,由北京博莱得利生物技术有限责任公司传代并保存。
[0047]
1.3试剂
[0048]
dmem培养基,购自gibco公司;牛血清,购自兰州民海生物工程有限公司;病毒基因组dna/rna提取试剂盒、rna反转录试剂盒,购自北京全式金生物技术有限公司;pcr和rt-pcr扩增试剂盒,购自宝生物工程(大连)有限公司;弗氏完全佐剂(fca)、弗氏不完全佐剂(fia)、聚乙二醇融合剂(peg 2000)、hat、ht培养基,购自sigma公司;山羊抗猫igg-fc(hrp),购自abcam公司;sba小鼠单克隆抗体分型试剂盒(hrp标记),购自sigma公司。
[0049]
1.4实验动物balb/c小鼠,雌性,购自中国食品药品检定研究院。
[0050]
2方法
[0051]
2.1杂交瘤细胞的制备
[0052]
2.1.1抗原制备
[0053]
2.1.1.1猫杯状病毒液准备
[0054]
将猫杯状病毒bjh13 f5代病毒液接种至f81细胞上,置37℃、5%co2培养箱中培养观察,当细胞病变达到80%左右时收获,冻融2次,收获病毒液,置-70℃保存备用。
[0055]
2.1.1.2病毒纯化
[0056]
将猫杯状病毒bjh13 f5代病毒液经4℃、8000r/min、30分钟去细胞碎片离心后,细胞病毒液上清40000r/min超速离心3h,沉淀用1%原体积的pbs重悬后备用,分别配制质量浓度为60%、50%、40%、30%和20%的蔗糖溶液,从下向上依次加到5ml离心管中,各浓度
蔗糖分别加0.8ml,最后加入1ml重悬后的病毒,于4℃、40000r/min超速离心3h,收集提纯的病毒条带作为抗原,-70℃保存备用。
[0057]
2.1.2小鼠免疫
[0058]
选择6~8周龄雌性balb/c小鼠。用纯化的fcv bjh13株病毒与等体积弗氏完全佐剂(fca)乳化均匀后,腹腔注射balb/c小鼠,1001g/只;首免后第2周和第4周分别用纯化的病毒与等体积弗氏不完全佐剂(fia)乳化后进行二免和三免;三免2周后采血用间接elisa测血清抗体效价。待elisa效价达1:105以上时进行细胞融合。融合前3天,尾静脉或腹腔注射1001g不加佐剂的抗原液进行加强免疫。
[0059]
2.1.3细胞融合
[0060]
2.1.3.1脾细胞的制备
[0061]
在加强免疫后第三天取免疫小鼠,无菌取出小鼠脾脏,放入盛有10ml dmem营养液的平皿中,轻轻漂洗,除去附着的结缔组织与脂肪;用剪刀剪碎脾脏,置于200目铜网上,用注射器内芯研磨脾脏,并用dmem营养液冲洗使脾细胞全部通过网孔进入溶液中;将脾细胞溶液转入50ml离心管中,加dmem营养液至30ml,混匀,1000r/min离心5分钟,弃上清;同法离心、洗涤细胞一次,然后将细胞悬于10ml dmem营养液中混匀;取上述细胞混悬液,计数后备用。
[0062]
2.1.3.2sp2/0骨髓瘤细胞的准备
[0063]
融合前36~48h将sp2/0细胞分瓶扩大培养于75cm2细胞瓶内。融合当天,选择形态良好、呈对数生长的sp2/0细胞,将其从瓶壁上轻轻吹下,收集于50ml离心管内,1000r/min离心5分钟,然后用dmem营养液重新悬浮,用于细胞融合。
[0064]
2.1.3.3饲养细胞的制备
[0065]
细胞融合的当日或前一日,将未经免疫的balb/c小鼠(8~12周龄)眼球采血,颈椎脱臼处死,浸泡于75%酒精5分钟,置超净工作台蜡盘内,腹部向上固定;将balb/c小鼠皮肤用消毒镊子提起,小心剪开腹部皮肤,分离皮肤与腹膜,充分暴露腹膜;用无菌注射器吸取适量dmem营养液注入腹腔,按摩腹部,待腹腔细胞与注入的营养液充分混合后,轻轻吸回营养液加入无菌离心管内,重复冲洗2~3次;所得液体1000r/min离心5分钟,弃上清。向沉淀中加入10ml dmem营养液,重新吹散细胞,取上述细胞混悬液计数后,用含hat的培养液悬浮细胞,调整细胞浓度为1~2
×
105个/ml,加入96孔细胞培养板中(1001l/孔),置于37℃、5%co2的培养箱中培养备用。
[0066]
2.1.3.4细胞融合
[0067]
将免疫小鼠的脾细胞与处于对数生长期的sp2/0细胞按5~10:1比例混合于离心管内,1000r/min离心8分钟,弃上清,轻轻弹击管底,使沉淀细胞松散均匀成糊状;吸取预热至37℃的50%peg 2000(ph值8.0)溶液1ml缓慢滴入进行融合;向离心管内加入25ml dmem营养液终止融合作用;将融合后的细胞液1000r/min离心5分钟,弃上清,用37℃水浴预热的含hat培养液重悬;加入有饲养细胞的96孔培养板中,1001l/孔,置37℃、5%co2的培养箱中培养。每天记录细胞生长情况,融合后第四天,用1%hat选择培养液半量换液,约7~10天,改用1%ht选择培养液半量换液继续培养。
[0068]
2.1.4阳性杂交瘤细胞的筛选及克隆
[0069]
每天观察细胞的生长情况,融合后3~5天,可见有克隆细胞生长,待细胞集落生长
至孔底的1/3~1/2时,对其上清用间接elisa方法和中和试验法进行筛选和鉴定,对检测出含猫杯状病毒特异性抗体阳性孔的细胞,以有限稀释法克隆三次,使阳性率达100%。
[0070]
2.2单克隆抗体的大量制备及纯化
[0071]
将筛选的阳性杂交瘤细胞株采用扩大培养或同系小鼠体内诱生腹水法进行单克隆抗体的制备。
[0072]
细胞扩大培养法进行单克隆抗体的制备:采用生物反应器发酵培养法进行杂交瘤细胞的大量培养,收集培养的杂交瘤细胞上清,3000r/min离心10min,取上清或者将收集的细胞上清进行超滤浓缩。
[0073]
同系小鼠单克隆抗体腹水的制备:选择20g以上(8~10周龄)balb/c小鼠,每只腹腔内注射灭菌液体石蜡0.5ml;14~18d后,小鼠腹腔接种杂交瘤细胞(0.5~1
×
106个细胞/只);植入细胞后第7天起,每天观察小鼠腹部,待小鼠腹部明显膨大,用9
#
针头穿刺腹腔,采集腹水,一般可连续采集3~5次,将腹水以3000r/min离心10min,去除油脂和沉淀,收集上清液,测定抗体效价。
[0074]
腹水纯化:经protein a亲和层析和阴阳离子交换纯化。
[0075]
2.3单克隆抗体生物学特性的测定
[0076]
2.3.1抗体类及亚类的鉴定
[0077]
按照sba小鼠单克隆抗体分型试剂盒(hrp标记)说明书进行。
[0078]
2.3.2单克隆抗体特异性鉴定
[0079]
用间接elisa方法测定单克隆抗体与猫杯状病毒(fcv)、猫细小病毒(fpv)、猫疱疹病毒(fhv)、猫传染性腹膜炎(fipv)、犬细小病毒(cpv)、犬瘟热病毒(cdv)反应的特异性。
[0080]
2.3.3单克隆抗体分泌稳定性测定
[0081]
杂交瘤细胞连续传至p20代,并于液氮中冻存3、6、9、12个月后复苏,取培养上清按中和试验法进行中和效价测定。
[0082]
2.3.4杂交瘤细胞染色体数目检测
[0083]
向传代培养2~3d处于对数生长期的杂交瘤细胞加入80μg/ml的秋水仙素,终浓度为0.8μg/ml,37℃培养4~6小时;弃去细胞液,用胰蛋白酶消化后1000r/min离心收集细胞;弃上清,加入8.0ml 0.075mol/l kcl溶液,吹打混匀,37℃处理30分钟;滴加1/10体积固定液(甲醇﹕冰醋酸体积比为3:1),吹打均匀,室温固定10~15分钟;1000r/min离心5分钟,弃上清;重复固定1次,1000r/min离心5分钟,弃上清;加入1.0ml固定液吹打重悬细胞,滴加1~2滴细胞悬液于预冷载玻片上,室温干燥;用姬姆萨染色液染色后进行观察、记录其染色体数目并分析。
[0084]
2.3.5单克隆抗体的western-blot试验
[0085]
将提纯的fcv bjh13株和同方法提取的f81细胞对照蛋白进行sds-page电泳,转印到pvdf膜上进行蛋白免疫印迹(western-blot)分析。
[0086]
2.3.6单克隆抗体纯度的鉴定
[0087]
将纯化后的腹水用sds-page鉴定其纯度。
[0088]
2.3.7单克隆抗体的蛋白序列测序
[0089]
3结果
[0090]
3.1阳性杂交瘤细胞株筛选结果
[0091]
免疫小鼠的脾细胞和杂交瘤细胞融合后,经hat/ht选择培养,经间接elisa方法和中和试验法进行筛选鉴定,3次亚克隆化获得了1株稳定分泌抗fcv的单克隆抗体杂交瘤细胞株,命名为2g3。
[0092]
对经筛选得到的杂交瘤细胞株2g3进行微生物保藏,于2022年04月21日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.45148。
[0093]
提取2g3杂交瘤细胞株的mrna,反转录为cdna,使用可变区通用引物pcr扩增,将pcr产物片段插入到t载体中进行dna序列测定,得到2g3可变区基因序列。重链cdr区1-3的核苷酸序列为:seq id no.17、18和19;轻链cdr区1-3的核苷酸序列分别为:seq idno.20、21和22。重链可变区序列为:seq id no.31,轻链可变区序列为seq id no.32。3.2单克隆抗体与亚类鉴定结果
[0094]
经抗体分型试剂盒鉴定,其亚型为igg1,见表2。
[0095]
表2单抗亚类鉴定结果
[0096][0097]
3.3单克隆抗体特异性鉴定结果
[0098]
经间接elisa方法试验结果表明,2g3株单克隆抗体只与fcv呈阳性反应,而与fpv、fhv、fipv、cpv、cdv均不反应,见表3。
[0099]
表3elisa检测结果(od值)
[0100][0101]
3.4单克隆抗体分泌稳定性测定结果
[0102]
分别取p5、p10、p15、p20代杂交瘤细胞上清及于液氮中冻存3、6、9、12个月后复苏的杂交瘤细胞上清进行中和效价测定,中和效价约1:220~320,结果见表4、5。结果表明,杂交瘤细胞连续传至p20代,抗体分泌稳定;于液氮中保存12个月,抗体分泌稳定。
[0103]
表4不同代次的杂交瘤细胞上清中和效价测定结果
[0104][0105]
表5液氮中不同保存时间的杂交瘤细胞上清中和效价测定结果
[0106][0107]
3.5杂交瘤细胞染色体数目分析
[0108]
正常balb/c小鼠脾细胞染色体数为40条,骨髓瘤细胞染色体数目为60~70条,所以融合后的细胞染色体数目应该在100~110条之间。试验结果表明,杂交瘤细胞的染色体数在该范围内变化,平均101条,符合预期数量。
[0109]
3.6western-blot试验
[0110]
2g3单克隆抗体与fcv bjh13株病毒蛋白在约62kd处出现一条清晰并且单一的条带,与细胞对照蛋白无反应。
[0111]
3.7小鼠腹水中和效价测定结果
[0112]
经中和试验法测定,其腹水效价约1:25100。
[0113]
3.8单克隆抗体纯度的鉴定
[0114]
收集的腹水经proteina亲和层析和阴阳离子交换纯化后,进行sds-page电泳,重链分子量为50000da,轻链分子量为25000da。
[0115]
3.9抗体氨基酸序列
[0116]
对得到的2g3单克隆抗体进行氨基酸序列测序,其可变区重链cdr区1-3的氨基酸序列分别如seq id no.1、2和3所示;其轻链cdr区1-3的氨基酸序列分别如seq id no.4、5和6所示。可变区,重链fr区1-4的氨基酸序列分别如seq id no.7、8、9和10所示;其轻链fr区1-4的氨基酸序列分别如seq id no.11、12、13和14所示。
[0117]
单克隆抗体其重链可变区的氨基酸序列如seq id no.15所示;其轻链可变区的氨基酸序列如seq id no.16所示。
[0118]
三、猫杯状病毒单克隆抗体对猫杯状病毒强毒人工感染猫的疗效研究
[0119]
1材料
[0120]
1.1毒种
[0121]
猫杯状病毒bjh13株,由本实验室分离、鉴定并保存。
[0122]
1.2受试药物
[0123]
2g3猫杯状病毒单克隆抗体注射液(中和抗体效价为1:1280,性状、ph值、无菌、支原体、外源病毒检验均合格),由本实验室制备。
[0124]
1.3实验动物
[0125]
2~3月龄猫(fpv、fhv、fcv抗原阴性,fcv中和抗体效价不高于1:2),购自固安某宠物市场。
[0126]
2方法
[0127]
2.1攻毒
[0128]
取fcv bjh13株(病毒含量为10
7.0
tcid
50
/ml)通过滴鼻和口服各1.0ml攻击12只猫,攻毒后每日观察记录试验猫精神状态、食欲、有无眼、鼻分泌物和口腔溃疡等临床症状,并于攻毒后第2日起采集眼咽拭子,用于核酸检测。
[0129]
2.2分组
[0130]
按照发病标准,选出10只发病猫,随机分成2组,5只/组。第一组为实验组;第二组为对照组,不予治疗。
[0131]
发病标准为:
①
精神沉郁、食欲减退;
②
眼、鼻出现浆液性或脓性分泌物;
③
出现口腔溃疡症状:舌、硬腭部出现水泡、溃疡;
④
核酸检测fcv呈阳性。出现
④
且出现
①
、
②
和
③
中任意1项,即判为发病。
[0132]
2.3治疗
[0133]
实验组:按1ml/kg剂量肌肉注射猫杯状病毒单克隆抗体注射液,每日1次,连用3日;
[0134]
对照组:不予治疗。
[0135]
3结果
[0136]
观察至攻毒后第10日,实验组试验猫治疗3日后,治愈率100%(5/5)。对照组试验猫在攻毒后第5日起症状加重。
[0137]
4分析与讨论
[0138]
试验结果表明,本实验室制备的猫杯状病毒单克隆抗体注射液对感染fcv试验猫治疗3日后临床症状明显缓解,精神正常、食欲恢复、无可见眼鼻分泌物、口腔溃疡创口基本愈合,核酸检测fcv呈阴性,治愈率达到100%。
[0139]
尽管本发明已经参考示例性实施方案进行了描述,但应理解本发明不限于公开的示例性实施方案。在不背离本发明的范围或精神的情况下,可对本发明说明书的示例性实施方案做多种调整或变化。权利要求的范围应基于最宽的解释以涵盖所有修改和等同结构与功能。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1