一种基于单细胞微流控体系检测细菌耐药异质性的方法及其应用与流程
本发明涉及微生物,具体涉及一种基于单细胞微流控体系检测细菌耐药异质性的方法及其应用。
背景技术:
1、除多重耐药菌株会导致临床上抗生素治疗失败外,越来越多研究表明,细菌的菌群异质性也可能是抗生素治疗失败的因素之一。例如,在临床上观测到的细菌菌群耐药异质性、持留菌或者不分裂细菌等均可能逃逸抗生素的攻击处理,在条件合适时,再次恢复增殖,造成细菌二次感染,需要再次进行治疗。
2、因此,检测细菌菌群异质性在设计抗生素给药方案时尤为重要,目前,传统的检测手段大多以细菌菌群作为整个研究对象,往往忽视细菌个体之前的差异,缺乏特定的细菌个体信息指导用药方案。
技术实现思路
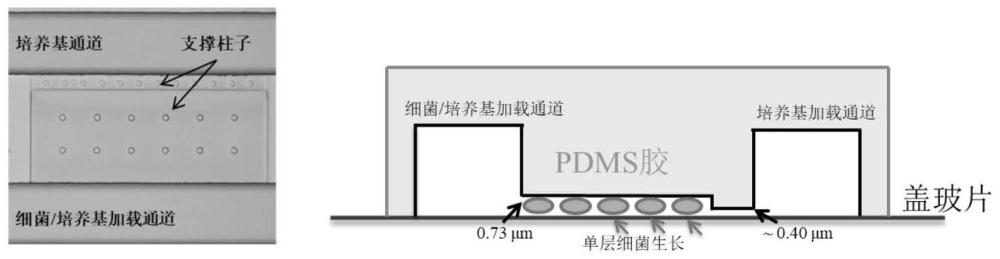
1、本发明提供一种单细胞微流控体系,其包括若干微腔室、至少两个进液通道和至少一出液口,两所述进液通道相对设置在微腔室的两侧,所述微腔室与一进液通道之间设置有止挡件,所述止挡件用于阻止细菌自微腔室流入相应的进液通道中,所述微腔室的高度与待检测单个细菌的直径相当.
2、优选地,所述微腔室的高度为亚微米。
3、根据本发明的实施方案,所述微腔室的内部设置有若干支撑柱,其用于支撑微腔室,以防微腔室在实验中坍塌。
4、根据本发明的实施方案,所述进液通道通过微流泵与外部液体相连通,在微流泵的作用下,外部液体被泵入进液通道中并流入微腔室。
5、优选地,所述外部液体包括培养基、细菌菌液、抗生素溶液、纯水、缓冲溶液。
6、根据本发明的实施方案,所述止挡件为设置在微腔室与相应进液通道之间的阶梯结构,所述阶梯结构的高度小于微腔室高度,优选地,所述阶梯结构的高度为0.4μm;所述止挡件也可以为一设置在微腔室与相应进液通道之间任意位置的挡板,更优选地,所述挡板设置在微腔室的端部,所述挡板的底部与芯片底部之间的距离为0.2~0.6μm。
7、优选地,所述微腔室结构的数量根据实际需求设置,其数量可以为任意整数,优选地,微腔室结构数量为偶数且排列为阵列结构,优选地,微腔室结构数量≥6个,优选地,微腔室结构数量≥8个。
8、例如,所述单细胞微流控体系由两个平行的通道(50μm×10μm;宽×高)和八个相同的微腔室(200μm×80μm×0.74μm;长×宽×高)组成,所述微腔室的一侧设置有阶梯结构,该阶梯结构的高度为0.4μm,以防止细菌在加载过程中直接流出微腔室。
9、优选地,所述单细胞微流控体系上还设置有加热板,所述加热板用于为微腔室提供恒温条件。
10、本发明中高度为亚微米的腔室可以很容易地实现单细胞捕获与追踪,为跟踪单细菌分裂以及实时观察在不同抗生素压力下细菌形态的变化提供了理想的平台。
11、在硅板上进行光刻获得微室和进液通道以获取模版,将pdms(聚二甲基硅氧烷)硅胶与固化剂混合并倒入模版,除泡、烘干固化后切片,得到pdms芯片,将pdms芯片与玻片键合,得到单细胞微流控体系。
12、一种单细胞微流控体系的用途,其细胞培养、细胞形态观察、细菌耐药性测试、药物筛选、给药方法筛选。
13、一种细菌耐药耐药性异质性检测的方法,包括以下步骤:先将细菌菌液导入上述单细胞微流控体系中培养至稳定,再向单细胞微流控体系中导入不同浓度的抗菌药共孵育后,检测细菌的形态和死亡率,依次判断细菌的耐药耐药性异质性。
14、一种筛选抗菌药物的方法,包括以下步骤:将细菌菌液导入上述单细胞微流控体系中培养至稳定,向单细胞微流控体系中导入不同抗菌药共孵育,检测细菌死亡率。
15、一种测试耐药异质性细菌给药时间的方法,包括以下步骤:将细菌菌液导入上述单细胞微流控体系中培养至稳定,向单细胞微流控体系中导入抗菌药进行共孵育,分离未分裂的细胞进行再次培养,确定未分裂细胞再次培养至分裂所需的时间,所述时间即为给药间隔。
16、所述抗菌药的浓度为能够使所述细菌产生抗生素压力的浓度,所述抗菌药的浓度大于300mg/l,优选地,大于400mg/l,优选地,大于500mg/l。
17、一种测定多重耐药鲍曼不动杆菌给药时间的方法,包括以下步骤:将多重耐药鲍曼不动杆菌的菌液导入上述单细胞微流控体系中培养至稳定,向单细胞微流控体系中导入靶向pbp药物进行共孵育,分离未分裂的细胞进行再次培养,确定未分裂细胞再次培养至分裂所需的时间,所述时间即为给药间隔。
18、所述靶向pbp药物包括靶向pbp1药物、靶向pbp2药物和/或靶向pbp3药物,优选地,为盐酸小檗碱、美罗培南、美西林、舒巴坦、头孢他啶和/或氨曲南;优选地,为盐酸小檗碱/美罗培南、盐酸小檗碱/美罗培南/美西林、盐酸小檗碱/ 美罗培南/舒巴坦或盐酸小檗碱/美罗培南/美西林/舒巴坦。
19、一种对抗多重耐药鲍曼不动杆菌的药物,其包括盐酸小檗碱和至少一种靶向pbp结合蛋白的抗生素。
20、优选地,包括盐酸小檗碱和至少一种靶向pbp2结合蛋白的抗生素。
21、优选地,包括盐酸小檗碱、至少一种靶向pbp2结合蛋白的抗生素、至少一种靶向pbp1结合蛋白的抗生素和/或至少一种靶向pbp3结合蛋白的抗生素。
22、优选地,包括盐酸小檗碱、一种靶向pbp2结合蛋白的抗生素、至少一种靶向pbp1结合蛋白的抗生素和/或至少一种靶向pbp3结合蛋白的抗生素。
23、优选地,包括盐酸小檗碱、一种靶向pbp2结合蛋白的抗生素、一种靶向pbp1 结合蛋白的抗生素。
24、优选地,包括盐酸小檗碱、一种靶向pbp2结合蛋白的抗生素和一种靶向 pbp3结合蛋白的抗生素。
25、优选地,包括盐酸小檗碱、一种靶向pbp2结合蛋白的抗生素、一种靶向pbp1 结合蛋白的抗生素和一种靶向pbp3结合蛋白的抗生素。
26、优选地,包括盐酸小檗碱和美罗培南;优选地,包括盐酸小檗碱和美罗培南和舒巴坦;优选地,包括盐酸小檗碱、美罗培南和氨曲南。
27、优选地,包括盐酸小檗碱和美西林;优选地,包括盐酸小檗碱、美西林和舒巴坦;优选地,包括盐酸小檗碱、美西林和氨曲南。
28、优选地,当为盐酸小檗碱和美罗培南时,优选地,所述盐酸小檗碱的浓度小于800mg/l,所述美罗培南的浓度小于64mg/l;优选地,所述盐酸小檗碱的浓度小于500mg/l,所述美罗培南的浓度小于50mg/l;最优地,所述盐酸小檗碱的浓度为256mg/l,所述美罗培南的浓度为16mg/l。
29、优选地,包括盐酸小檗碱和美西林,优选地,所述盐酸小檗碱的浓度小于 800mg/l,所述美西林的浓度小于500mg/l;优选地,所述盐酸小檗碱的浓度小于500mg/l,所述美西林的浓度小于300mg/l;最优地,所述盐酸小檗碱的浓度为256mg/l,所述美西林的浓度为256mg/l。
30、优选地,包括盐酸小檗碱、美西林和舒巴坦,优选地,所述盐酸小檗碱的浓度小于800mg/l,所述美西林的浓度小于64mg/l,所述舒巴坦的浓度小于64 mg/l;优选地,所述盐酸小檗碱的浓度小于500mg/l,,所述美西林的浓度小于50mg/l,所述舒巴坦的浓度小于50mg/l;最优地,所述盐酸小檗碱的浓度为 256mg/l,所述美西林的浓度为4mg/l,所述舒巴坦的浓度为4mg/l。
31、有益效果
32、(1)本发明中的单细胞微流控体系,其包括若干微腔室、至少两个进液通道和至少一出液口,两所述进液通道相对设置在微腔室的两侧,所述微腔室与一进液通道之间设置有止挡件,所述止挡件用于阻止细菌自微腔室流入相应的进液通道中,所述微腔室的高度与待检测单个细菌的直径相当,在进行细菌培养时,细菌逐一独立分布在微腔室内,不会发生多个细菌重叠的情况,便于实现单细胞捕获与追踪,为跟踪单细菌分裂以及实时观察在不同抗生素压力下细菌形态的变化提供了理想的平台。
33、(2)本发明利用具有单细胞捕获技术的单细胞微流控体系实时监测细菌个体在抗生素压力下的变化情况,以盐酸小檗碱/靶向pbp结合蛋白抗生素的联合用药方案为给药模型,研究了独立/联合用药下抗多重耐药鲍曼不动杆菌的生长状态,在单细菌水平揭示了细菌的耐药机理,即通过细菌形态变化来应激靶向 pbp结合蛋白的抗生素攻击,本发明中所观察到的包括细菌保持不分裂状态、生长过程中形成“圆球形”或“细丝状”等形态来应对细胞壁合成的困境。
34、申请人意外的发现,使用盐酸小檗碱/靶向pbp2结合蛋白抗生素联用效果最佳,在盐酸小檗碱、靶向pbp2结合蛋白类抗生素浓度均较小的作用下,能够达到较好的杀菌效果。
35、(3)本发明对细菌进行观察研究发现,在耐药菌群中也存在细菌个体差异,即存在耐药异质性细菌个体,如部分细菌可以在高剂量抗生素压力下保持不分裂状态,以此逃避抗生素的杀菌作用,等抗生素压力消失后恢复分裂增殖,这为抗生素的使用方案提供了借鉴,即选择合适的抗生素剂量以及合适的给药间隔用来攻击逃逸抗生素处理的“休眠细菌”,以避免再次感染,为开发新型抗生素用药研究以及抑菌机理提供一种研究平台,为临床上抗生素的使用方案提供相应的借鉴与分析。
- 还没有人留言评论。精彩留言会获得点赞!