一种EGFR酪氨酸激酶抑制剂的晶型及其制备方法和用途与流程
本发明涉及一种egfr酪氨酸激酶抑制剂的新晶型及其制备方法和医药用途。
背景技术:
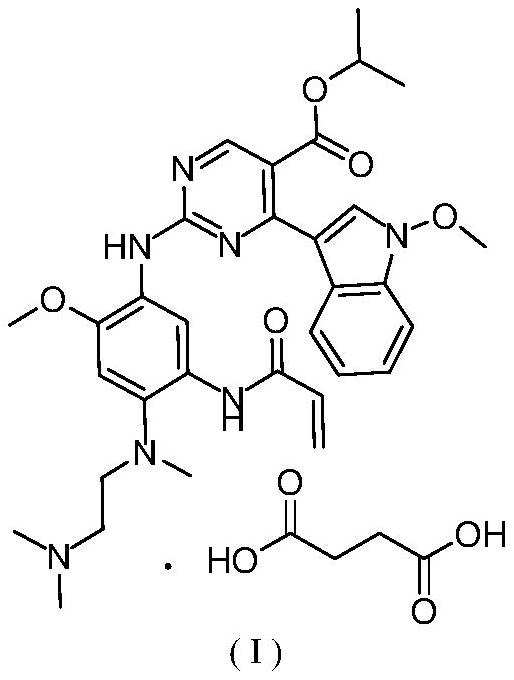
1、化合物2-((5-丙烯酰胺基-4-((2-(二甲基氨基)乙基)(甲基)氨基)-2-甲氧基苯基)氨基)-4-(1-甲氧基-1h-吲哚-3-基)嘧啶-5-羧酸异丙酯丁二酸盐(i)公开于专利申请wo2021018017a1,是一种小分子egfr/her2exon20插入突变抑制剂,其通过抑制egfr或her2exon20插入突变体的活性,从而阻断下游信号通路活化,进而达到抑制肿瘤增长的目的。该化合物作为靶向egfr/her2 exon 20插入突变的小分子抑制剂,具有靶点机制明确,临床前验证充分,成药性质良好,安全性好,生产成本低等优势,有望成为具有egfr/her2 exon 20插入突变的晚期或转移性非小细胞肺癌(nsclc)的新的治疗选择。
2、
3、药物多晶型是指药物活性成分(api)存在两种及以上不同的晶体形态。晶体形态较其它状态如无定形或液态,具有明显的物理化学性能和工艺处理的优势,具有优良的物理和化学稳定性能,能够有效排除杂质成份,具有优良的加工性能和可流动性。这些优点对于药物的质量和工艺过程都产生积极的影响。
4、本发明采用多种结晶手段和结晶条件,以期发现api可能出现的多晶型,并从结晶度、稳定性、吸湿性以及加工性出发,确定优势药用晶型。
技术实现思路
1、本发明考察了化合物2-((5-丙烯酰胺基-4-((2-(二甲基氨基)乙基)(甲基)氨基)-2-甲氧基苯基)氨基)-4-(1-甲氧基-1h-吲哚-3-基)嘧啶-5-羧酸异丙酯丁二酸盐(i)的各种结晶条件,得到两种结晶产物,对所得结晶产物进行了x射线粉末衍射和dsc检测,结果发现了结晶度、溶解性、生物利用度、稳定性良好的新型结晶。
2、因此,本发明的目的是提供一种式(i)所示化合物的a晶型,其特征在于,使用cu-kα辐射得到的x射线粉末衍射图谱包括位于5.250°±0.2°、8.867°±0.2°、13.077°±0.2°、14.201°±0.2°、16.002°±0.2°、17.612°±0.2°、19.507°±0.2°、22.473°±0.2°的2θ衍射角处的特征峰,
3、
4、在一个优选的实施方案中,所述式(i)所示化合物的a晶型,其特征在于,使用cu-kα辐射得到以2θ角度表示的x射线粉末衍射图谱包括位于5.250°±0.2°、7.932°±0.2°、8.867°±0.2°、10.393°±0.2°、13.077°±0.2°、14.201°±0.2°、16.002°±0.2°、17.612°±0.2°、19.507°±0.2°、19.821°±0.2°、20.021°±0.2°、22.473°±0.2°的2θ衍射角处的特征峰。
5、在另一个优选的实施方案中,所述式(i)所示化合物的a晶型,其特征在于,使用cu-kα辐射得到以2θ角度表示的x射线粉末衍射图谱包括位于5.250°±0.2°、7.932°±0.2°、8.542°±0.2°、8.867°±0.2°、10.393°±0.2°、11.633°±0.2°、12.106°±0.2°、13.077°±0.2°、14.201°±0.2°、16.002°±0.2°、17.612°±0.2°、18.864°±0.2°、19.507°±0.2°、19.821°±0.2°、20.021°±0.2°、21.042°±0.2°、22.473°±0.2°、25.575°±0.2°、26.390°±0.2°的2θ衍射角处的特征峰。
6、在另一个优选的实施方案中,所述式(i)所示化合物的a晶型,其特征在于使用cu-kα辐射得到x射线粉末衍射图谱中2θ角度和强度的对应值如下:
7、
8、
9、在另一个优选的实施方案中,所述式(i)所示化合物的a晶型,其特征在于,使用cu-kα辐射得到以2θ角度表示的x射线粉末衍射图谱如图1所示。
10、在另一个优选的实施方案中,所述式(i)所示化合物的a晶型,其特征在于,其dsc图谱在144.08±3℃处具有吸热峰。
11、本发明的另一目的是提供一种式(i)所示化合物的b晶型,其特征在于,使用cu-kα辐射得到的x射线粉末衍射图谱包括位于3.976°±0.2°、7.258°±0.2°、10.007°±0.2°、14.462°±0.2°、15.528°±0.2°、16.192°±0.2°、21.003°±0.2°、24.277°±0.2°的2θ衍射角处的特征峰。
12、在一个优选的实施方案中,所述式(i)所示化合物的b晶型,其特征在于,使用cu-kα辐射得到的x射线粉末衍射图谱包括位于7.258°±0.2°、10.007°±0.2°、10.450°±0.2°、14.462°±0.2°、15.528°±0.2°、16.192°±0.2°、18.651°±0.2°、20.353°±0.2°、21.003°±0.2°、24.277°±0.2°的2θ衍射角处的特征峰。
13、在另一个优选的实施方案中,所述式(i)所示化合物的b晶型,其特征在于,使用cu-kα辐射得到的x射线粉末衍射图谱包括位于3.976°±0.2°、7.258°±0.2°、10.007°±0.2°、10.450°±0.2°、14.462°±0.2°、14.891°±0.2°、15.105°±0.2°、15.528°±0.2°、16.192°±0.2°、16.736°±0.2°、18.651°±0.2°、20.353°±0.2°、21.003°±0.2°、21.420°±0.2°、24.277°±0.2°、24.552°±0.2°的2θ衍射角处的特征峰。
14、在另一个优选的实施方案中,所述式(i)所示化合物的b晶型,其特征在于,使用cu-kα辐射得到的x射线粉末衍射图谱中2θ角度和强度的对应值如下:
15、
16、
17、在另一个优选的实施方案中,所述式(i)所示化合物的b晶型,其特征在于,使用cu-kα辐射得到的以2θ角度表示的x射线粉末衍射图谱如图7所示。
18、在另一个优选的实施方案中,所述式(i)所示化合物的b晶型,其特征在于,其dsc图谱在114.45±3℃处具有吸热峰。
19、本发明还提供所述式(i)所示化合物的a晶型的制备方法,其包括以下步骤:
20、1)将任意晶型或无定型的式(i)化合物加入到良溶剂中溶解;
21、2)向步骤1)得到的溶液中加入不良溶剂,搅拌析晶或降温析晶;或者,直接将步骤1)得到的溶液降温析晶;
22、3)将步骤2)得到的晶体过滤,干燥,得到a晶型。
23、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其包括以下步骤:
24、1)将任意晶型或无定型的式(i)化合物加入到良溶剂中溶解;
25、2)向步骤1)得到的溶液中加入不良溶剂,搅拌析晶或降温析晶
26、3)将步骤2)得到的晶体过滤,干燥,得到a晶型。
27、在另一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其包括以下步骤:
28、1)将任意晶型或无定型的式(i)化合物加入到良溶剂中溶解;
29、2)将步骤1)得到的溶液降温析晶;
30、3)将步骤2)得到的晶体过滤,干燥,得到a晶型。
31、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中所述良溶剂选自醇类溶剂、酮类溶剂和醚类溶剂,所述醇类溶剂优选c1-c4醇类溶剂,更优选甲醇、乙醇、异丙醇、正丁醇、三氟乙醇;所述酮类溶剂优选丙酮、丁酮;所述醚类溶剂优选1,4-二氧六环、四氢呋喃;优选地,所述良溶剂选自甲醇、乙醇、丙酮、丁酮、四氢呋喃,更优选自乙醇、丙酮和四氢呋喃。
32、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中所述不良溶剂选自烷烃类溶剂、醚类溶剂、酯类溶剂、芳香烃类溶剂;所述烷烃类溶剂优选正庚烷、正己烷、环己烷、甲基环己烷,所述醚类溶剂优选石油醚、乙醚、甲基叔丁基醚,所述酯类溶剂优选乙酸乙酯、乙酸异丙酯、乙酸丁酯,所述芳香烃类溶剂优选甲苯;优选地,所述不良溶剂选自石油醚、正庚烷、环己烷、甲基叔丁基醚、乙酸乙酯、乙酸异丙酯、乙酸丁酯,更优选自正庚烷和环己烷。
33、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中所述良溶剂选自乙醇、丙酮和四氢呋喃,所述不良溶剂选自正庚烷和环己烷。
34、在另一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中所述良溶剂为乙醇,所述不良溶剂为正庚烷。
35、在另一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中所述良溶剂为四氢呋喃,所述不良溶剂为环己烷。
36、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中良溶剂与不良溶剂的体积比为1:1~1:30,优选1:2~1:5。
37、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中步骤1)中的溶解在0~100℃的温度进行,优选在20~80℃的温度进行,更优选在60~80℃的温度进行。
38、在一个优选的实施方案中,根据本发明所述的a晶型的制备方法,其中步骤2)中的析晶在-20~40℃的温度进行,优选在0~30℃的温度进行,更优选在10-20℃的温度进行。
39、本发明还提供第一种所述式(i)所示化合物的b晶型的制备方法,其包括:
40、1)将任意晶型或无定型的式(i)化合物加入到良溶剂中溶解;
41、2)向步骤1)得到的溶液中加入不良溶剂,搅拌析晶;
42、3)将步骤2)得到的晶体过滤,干燥,得到b晶型。
43、本发明还提供第二种所述式(i)所示化合物的b晶型的制备方法,其包括以下步骤:
44、1)将任意晶型或无定型的式(i)化合物加入到良溶剂中打浆;
45、2)将步骤1)得到的晶体过滤,干燥,得到b晶型。
46、在一个优选的实施方案中,根据本发明所述的b晶型的第一种和第二种制备方法,其中所述良溶剂为有机溶剂和水的混合溶剂,所述有机溶剂选自醇类溶剂、酯类溶剂、酮类溶剂和腈类溶剂,所述醇类溶剂优选c1-c4醇类溶剂,更优选甲醇、乙醇、异丙醇、正丁醇、三氟乙醇,所述酮类溶剂优选丙酮、丁酮,所述腈类溶剂优选乙腈,所述酯类溶剂优选乙酸乙酯、乙酸异丙酯、乙酸丁酯;优选地,所述有机溶剂选自甲醇、乙醇、丙酮、乙腈、乙酸乙酯。
47、在一个优选的实施方案中,根据本发明所述的b晶型的第一种和第二种制备方法,其中有机溶剂和水的混合溶剂中有机溶剂与水的体积比为100:0.1~1:100,优选100:1~1:10,更优选20:1~1:10。
48、在一个优选的实施方案中,根据本发明所述的b晶型的第一种制备方法,其中所述不良溶剂选自烷烃类溶剂,所述烷烃类溶剂优选正庚烷、正己烷、环己烷、甲基环己烷;优选地,所述不良溶剂选自正庚烷。
49、在一个优选的实施方案中,根据本发明所述的b晶型的第一种制备方法,其中良溶剂与不良溶剂的体积比为1:1~1:30,优选1:4~1:5。
50、在另一个优选的实施方案中,根据本发明所述的b晶型的第一种制备方法,其中所述良溶剂为c1-c4醇与水的混合溶剂,优选甲醇与水的混合溶剂或乙醇与水的混合溶剂;其中醇与水的体积比优选1:5~1:20,优选1:7~1:20;所述不良溶剂为正庚烷;优选所述良溶剂与所述不良溶剂的体积比为1:4~1:5。
51、在另一个优选的实施方案中,根据本发明所述的b晶型的第一种制备方法,其中步骤1)中的溶解在0~100℃的温度进行,优选在20~80℃的温度进行,更优选20~60℃的温度进行。
52、在另一个优选的实施方案中,根据本发明所述的b晶型的第一种制备方法,其中步骤2)中的析晶在-20~30℃的温度进行,优选在0~20℃的温度进行,更优选在10-20℃进行。
53、在另一个优选的实施方案中,根据本发明所述的b晶型的第二种制备方法,其中步骤1)中的打浆在-20~100℃的温度进行,优选在0~20℃的温度进行。
54、在另一个优选的实施方案中,根据本发明所述的b晶型的第二种制备方法,其中所述良溶剂为c1-c4醇与水的混合溶剂,优选甲醇与水的混合溶剂或乙醇与水的混合溶剂,其中醇与水的体积比优选1:5~1:20,优选1:7~1:20。
55、在另一个优选的实施方案中,根据本发明所述的b晶型的第二种制备方法,其中所述良溶剂为水饱和的乙酸乙酯。
56、在另一个优选的实施方案中,根据本发明所述的b晶型的第二种制备方法,其中所述良溶剂为丙酮与水的混合溶剂,其中丙酮与水的体积比优选1:10。
57、在另一个优选的实施方案中,根据本发明所述的b晶型的第二种制备方法,其中所述良溶剂为乙腈与水的混合溶剂,其中乙腈与水的体积比优选1:10。
58、本发明进一步涉及一种药物组合物,其含有本发明所述的式(i)所示化合物的a晶型的制备方法作为活性成分以及药学上可接受的载体。
59、本发明进一步涉及一种药物组合物,其含有本发明所述的式(i)所示化合物的b晶型的制备方法作为活性成分以及药学上可接受的载体。
60、本发明进一步涉及根据本发明所述的式(i)所示化合物的a晶型或者含有它们的药物组合物在制备用于治疗与egfr外显子20突变相关的疾病的药物中的用途,所述疾病特别是非小细胞肺癌。
61、本发明进一步涉及根据本发明所述的式(i)所示化合物的b晶型或者含有它们的药物组合物在制备用于治疗与egfr外显子20突变相关的疾病的药物中的用途,所述疾病特别是非小细胞肺癌。
62、本发明所述的式(i)化合物可以通过本领域技术人员公知的逆合成分析方法,通过常规制备方法合成得到。具体详见本发明的实施例。
63、另外,本发明使用的式(i)化合物可以为任意晶型或无定型形式。
64、本文所述的“药学上可接受的”是其有用于制备通常是安全、既无生物学上的毒性又无其它不需要的毒性的,并且对于兽医使用和人类药物使用是可接受的药物组合物。
65、本文所述的“载体”是指与化合物一起施用的稀释剂、佐剂或赋形剂。药学上可接受的载体可以是液体,例如水和油,包括石油、动物、植物或合成来源的油,例如花生油、大豆油、矿物油、菜籽油等。药学上可接受的载体也可以是生理盐水、阿拉伯树胶、明胶、淀粉糊、滑石粉、角蛋白、硅胶、尿素等。另外,还可以使用辅助剂、稳定剂、增稠剂、润滑剂和着色剂等。
66、本领域技术人员能够理解,本发明的药物组合物可以根据具体的施用方式被配制成各种本领域熟知的制剂形式,例如口服剂型(粉剂、片剂、胶囊、软胶囊、液体药物、糖浆、酏丸、散剂、囊剂、粒剂),或局部施用制剂(乳膏、软膏、洗剂、凝胶、香脂、膏药、糊剂、喷雾剂、气雾剂等),或注射制剂(溶液、悬浮剂、乳剂)。在本发明的药物组合物中,尤其可以提及的是适合于口服、胃肠外(静脉内或皮下)给药的那些,例如,片剂或糖衣丸、舌下片、明胶胶囊、锭剂、栓剂、霜剂、软膏剂、皮肤凝胶、可注射制剂、可饮用的混悬液等。
67、根据本发明的药物组合物可以包含药学上可接受的载体、佐剂或稀释剂,例如:填充剂、崩解剂、润滑剂、助悬剂、粘合剂、甜味剂、矫味剂、防腐剂、基质等。填充剂例如:淀粉、预胶化淀粉、乳糖、甘露醇、甲壳素、微晶纤维素、蔗糖等;崩解剂例如:淀粉、预胶化淀粉、微晶纤维素、羧甲基淀粉钠、交联聚乙烯吡咯、低取代羟丙纤维素、交联羧甲基纤维素钠等;润滑剂例如:硬脂酸镁、十二烷基硫酸钠、滑石粉、二氧化硅等;助悬剂例如:聚乙烯吡咯烷酮、微晶纤维素、蔗糖、琼脂、羟丙基甲基纤维素等;粘合剂例如,淀粉浆、聚乙烯吡咯烷酮、羟丙基甲基纤维素等。本发明的组合物可以通过利用本领域任何已知方法制成,以使病人用药后能提供快速、持久或缓慢释放的活性成分。
68、本发明的药物组合物通过各种途径给药至个体动物如哺乳动物(大鼠、小鼠、驯化动物或人类),所有的给药方式均是预期的,例如,给药可以是口服、局部、直肠给药或经静脉、肌肉内、经皮、鞘膜内、硬膜外或脑室内注射。
69、本发明活性成分的给药剂量可以根据个体的情况和重量、病情的性质和严重程度、药物形式、给药途径以及给药周期的不同而不同,其也可以由本领域技术人员进行选择。剂量可以在1-1500mg/天之间改变,可以每天单次给药或每天分多次给药。
70、通过x射线粉末衍射(xrpd)、差式扫描热分析(dsc)、吸湿性分析(dvs)、红外光谱(ir)图。对本发明所述的各种晶型进行测定和研究。按照本发明的方法制备的式(i)化合物的结晶具有良好的稳定性、溶解度和生物利用度,可以有利地用作医药活性成分使用。
71、以下将结合附图和具体实施例进一步阐明本发明,但应理解其仅是举例说明的作用,并不以任何方式限制本发明的范围。
- 还没有人留言评论。精彩留言会获得点赞!