双荧光标记的重组伪狂犬病病毒株及其构建方法和应用
1.本发明涉及荧光标记的重组伪狂犬病病毒株,尤其涉及基因组和囊膜蛋白双荧光标记的重组伪狂犬病病毒株及其构建方法和应用,属于荧光标记的重组伪狂犬病病毒株及其应用领域。
背景技术:
2.伪狂犬病病毒(pseudorabies virus,prv)是一种嗜神经性α疱疹病毒,可感染猪、牛、羊等多种动物。prv感染成年猪可在其三叉神经节形成潜伏感染,而感染其他宿主动物以及幼年猪,则以裂解性感染为主,导致宿主全身系统性神经症状,引发伪狂犬病。prv基因组为双链线性dna,长约143kb,基因组由70个开放阅读框组成,已鉴定出35个病毒结构蛋白,包括衣壳蛋白、基质蛋白和囊膜蛋白(pomeranz le,reynolds ae,hengartner cj.2005.molecular biology of pseudorabies virus:impact on neurovirology and veterinary medicine.microbiol mol biol rev 69:462-500.)。
3.prv的生命周期包括入侵宿主细胞、基因组复制、核衣壳组装、子代病毒粒子释放等环节,感染神经元还包括逆神经轴突、顺轴突传导以及跨神经突触之间传导过程(ekstrand mi,enquist lw,pomeranz le.2008.the alpha-herpesviruses:molecular pathfinders in nervous system circuits.trends mol med 14(3):134-140.)。荧光标记的重组prv在病毒示踪和神经环路等研究中发挥着重要作用。依据不同的研究目的,已报道有多种用于prv结构蛋白和病毒基因组标记方法。其中对病毒入侵和释放以及顺轴突传导阶段的示踪常采用荧光蛋白基因与gm、ge和us9蛋白融合标记(masse mj,a,dijkstra jm,mettenleiter tc,flamand a.1999.glycoproteins gm and gn of pseudorabies virus are dispensable for viral penetration and propagation in the nervous systems of adult mice.j virol 73(12):10503-10517;kratchmarov r,kramer t,greco tm,taylor mp,ch'ng th,cristea im,enquist lw.2013.glycoproteins ge and gi are required for efficient kif1a-dependent anterograde axonal transport of alphaherpesvirus particles in neurons.j virol87(17):9431-9440;kratchmarov r,enquist lw,taylor mp.2015.us9-independent axonal sorting and transport of the pseudorabies virus glycoprotein gm.j virol 89(12):6511-6524.)。对病毒核衣壳组装、释放以及神经轴突运行过程的示踪,主要融合标记衣壳蛋白vp26和基质蛋白ul36(hogue ib,bosse jb,engel ea,scherer j,hu jr,del rio t,enquist lw.2015.fluorescent protein approaches in alpha herpesvirus research.viruses7(11):5933-5961),而对病毒基因组增殖和运动过程的示踪技术发展较晚。近年来,cas9/grna复合物结合量子点技术应用于prv的基因组标记,可以观察prv的入侵过程,但不能观察到病毒的成熟与释放(yang yb,tang yd,hu y,yu f,xiong jy,sun mx,lyu c,peng jm,tian zj,cai xh,an tq.2020.single virus tracking with quantum dots packaged into enveloped viruses using crispr.nano lett 20(2):1417-1427)。
4.anchor系统是一种新型的核酸标记技术,该系统由荧光标记的融合蛋白(or-fp)和dna靶序列(anch)组成,or-fp蛋白可与短的非重复性dna靶序列(anch)特异性结合、聚集并扩散到相邻序列上,最终在标记的病毒基因组上积累形成特异性荧光聚集点。目前,已成功利用anchor系统标记了人类巨细胞病毒(hcmv)的基因组,用该重组病毒anchor-hcmv感染细胞,可以观察完整的病毒周期,直至细胞破碎和死亡(mariame b,kappler-gratias s,kappler m,balor s,gallardo f,bystricky k.2018.real-time visualization and quantification of human cytomegalovirus replication in living cells using the anchor dna labeling technology.j virol92(18):e00571-18.)。
5.prv是嗜神经性α疱疹病毒的典型代表,具有潜伏感染的特性,是研究α疱疹病毒入侵、潜伏感染和神经传导的理想模式病毒。对于病毒基因组增殖、病毒粒子组装和释放环节的研究较少,此外由于缺少合适的潜伏感染模型,限制了潜伏感染与再激活机制的研究。荧光标记的重组prv在病毒示踪、病毒基因功能研究、神经环路研究、跨血脑屏障药物靶向递送、抗病毒药物筛选和疫苗评价等方面发挥着重要作用。
技术实现要素:
6.本发明的目的之一是提供基因组荧光标记的重组伪狂犬病病毒株;
7.本发明的目的之二是提供基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株;
8.本发明的目的之三是将所述的荧光标记的重组伪狂犬病病毒株应用于在伪狂犬病病毒示踪、伪狂犬病病毒基因功能研究、神经环路研究、跨血脑屏障药物靶向递送、抗伪狂犬病病毒药物筛选和疫苗评价等方面。
9.本发明的上述目的是通过以下技术方案来实现的:
10.本发明的一方面是提供了基因组荧光标记的重组伪狂犬病病毒株,其构建方法包括以伪狂犬病病毒(prv)tj株为骨架,在其基因组的us9基因和us2基因之间的非编码区插入anchor3系统完整基因序列拯救得到的重组伪狂犬病病毒株。其中,所述anchor3系统完整基因的核苷酸序列为seq id no.1所示;该重组伪狂犬病病毒株经转录产生融合绿色荧光蛋白egfp的or蛋白(or-egfp),or-egfp可特异性识别并结合prv基因组中的anch3 dna序列,实现了病毒基因组的绿色荧光标记,突破了以往只能对prv结构蛋白进行荧光标记的局限。
11.本发明在us9基因和us2基因之间插入的anchor3系统包括3979bp的基因序列,所标记的重组毒株与prv tj株的生长动力学曲线无显著差异。经20代病毒传代后,外源基因pcr鉴定及测序均正确,结果表明us9基因和us2基因之间的非编码区可以兼容长于以往研究中所提到的外源基因。
12.本发明的第二方面是提供了基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株,其构建方法包括:在prv tj株的基因组us9和us2基因之间非编码区插入anchor3系统的完整序列,同时在ul10基因的终止密码子前插入红色荧光蛋白mcherry基因序列,所述红色荧光蛋白mcherry基因的核苷酸序列为seq id no.2所示,获得基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株,将其命名为rprv tj-anchor3-mcherry。
13.作为本发明一种优选的具体实施方式,本发明利用prv tj株fosmid文库,在伪狂犬病病毒基因组us9和us2基因之间非编码区插入anchor3系统的完整序列,同时在ul10基因的终止密码子前插入红色荧光蛋白mcherry基因序列,拯救获得基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株。
14.本发明将拯救获得基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株rprv tj-anchor3-mcherry提交到专利认可的机构进行保藏,其微生物保藏编号是cgmcc no.45203,分类命名是:基因组和囊膜蛋白双荧光标记的重组伪狂犬病病毒株,保藏时间是:2022年5月18日,保藏单位是:中国微生物菌种保藏管理委员会普通微生物中心,保藏地址是:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。
15.本发明在gm蛋白的c端融合mcherry不影响伪狂犬病病毒的复制,表明mcherry蛋白不影响gm和gn二聚体在病毒粒子中的定位及其糖基化位点在病毒感染过程中的正常功能;rprv tj-anchor3-mcherry与prv tj株感染小鼠各组织病毒载量和ld
50
无显著差异,表明mcherry与gm蛋白融合不改变病毒的组织嗜性,而且gm蛋白被证实不是prv感染小鼠神经系统的必要蛋白,该部分结果表明mcherry和anchor3基因的插入都不会改变prv对小鼠的致病性。
16.本发明所构建的基因组和囊膜蛋白分别标记绿色荧光和红色荧光的重组伪狂犬病病毒株rprv tj-anchor3-mcherry与亲本病毒的生长特征一致,遗传稳定性良好,表明us9和ul10(gm)插入位点对anchor3和mcherry等外源基因兼容性良好,插入外源基因不影响病毒复制。此外,rprv tj-anchor3-mcherry与亲本病毒感染小鼠的ld
50
均为10
2.5
tcid
50
,且临床症状和各组织病毒载量无显著差异,说明荧光标记物不影响病毒对宿主的致病性。
17.红色荧光蛋白mcherry和绿色荧光蛋白egfp是rprv tj-anchor3-mcherry病毒粒子两个发光基团,在活细胞和死细胞及感染组织中都能观察到荧光,而且此荧光可以与细胞核染料(hoechst)、细胞膜红色荧光探针(dii)等具有良好兼容性,证明rprv tj-anchor3-mcherry具有良好的兼容性。常规表达荧光蛋白独立阅读框的重组prv,需要感染细胞才能观察到弥散整个细胞的荧光(不特异);结构蛋白与荧光蛋白融合标记的病毒不依赖于细胞,但病毒基因组复制、入核和出核过程无法通过荧光实时观察;相比之下,本发明构建的rprv tj-anchor3-mcherry不仅克服了以上不足,同时存在以下优势,即完整病毒粒子仅显示特异的红色荧光(mcherry),脱去囊膜的病毒粒子或病毒基因组仅显示特异的绿色荧光(egfp)。因此,本发明构建的双荧光标记的重组伪狂犬病病毒株rprv tj-anchor3-mcherry可用于观察整个病毒的复制周期和细胞定位,与以往荧光标记病毒相比具有更广阔的应用前景。利用该重组病毒成功示踪了完整的prv复制周期,并评价了抗病毒药物阿昔洛韦抑制prv复制的效果,同时建立了prv体外温控可视化潜伏感染模型,可用于prv潜伏感染模型及抗病毒药物筛选、神经回路示踪、病毒和宿主蛋白功能研究等,是prv基础和应用研究的有力工具。
18.本发明的双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry筛选抗病毒药物环节,可为开发抗α疱疹病毒药物或小分子化合物提供借鉴,可以准确判定抗病毒作用发生在病毒周期的具体环节。另外利用潜伏感染的模型可以鉴定潜伏感染和再激活相关的宿主和病毒因子,能为prv及其他疱疹病毒的药物和疫苗研发提供新的靶标分子。此外,利用双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry将极大加快病毒基因功能研
究进程,而对病毒粒子的定位和量化无需额外的技术和试剂,极大地降低了成本和工作强度。最后,本发明构建的双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry还可用于体内神经环路研究、跨血脑屏障药物靶向递送、替代(简化)免疫组化流程、高效评价疫苗免疫效果,甚至用于体内示踪。
附图说明
19.图1构建双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry的模式图;a.prv tj株的基因组和prv tj株fosmid文库;b.fosmid-o-mcherry粘粒构建示意图;c.fosmid-s-anchor3粘粒构建示意图;d.用于拯救rprv tj-anchor3-mcherry重组病毒的fosmids组成。
20.图2双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry的鉴定;a:rprv tj-anchor3-mcherry和prv tj株感染n2a细胞活细胞成像效果;b.连续传20代后rprv tj-anchor3-mcherry外源基因插入pcr鉴定结果;c.rprv tj-anchor3-mcherry和prv tj株病毒粒子电镜观察结果。
21.图3双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry基因组特异性荧光标记鉴定。
22.图4双荧光标记重组伪狂犬病病毒株rprvtj-anchor3-mcherry的生长特征;
23.a:rprv tj-anchor3-mcherry和prv tj株感染pk-15细胞的噬斑形态;b.rprv tj-anchor3-mcherry和prv tj株感染pk-15细胞的一步生长曲线。
24.图5双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry感染小鼠各组织病毒载量。
25.图6双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry感染n2a细胞的病毒周期示踪。
26.图7双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry在pk-15中的活细胞成像与量化分析;a~c:rprv tj-anchor3-mcherry感染pk-15细胞后0、2、24h荧光强度量化分析结果;d.rprv tj-anchor3-mcherry感染pk-15不同时间点基因组荧光值(egfp)和对应基因组拷贝数拟合分析结果;e.rprv tj-anchor3-mcherry感染pk-15细胞不同时间点成熟病毒粒子荧光值(mcherry)量化分析结果。
27.图8双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry在vero中的活细胞成像与量化分析;a:阿昔洛韦作用下的rprv tj-anchor3-mcherry在vero细胞上的复制情况(72hpi);b:奥司他韦作用下的rprv tj-anchor3-mcherry在vero细胞上的复制情况(72hpi);c:阿昔洛韦抑制高剂量病毒(107tcid
50
)效果;d:阿昔洛韦作用下细胞感染率分析结果(107tcid
50
);e:阿昔洛韦作用下不同时间点病毒dna量化分析结果;f:阿昔洛韦作用下各时间点病毒成熟比率变化趋势。
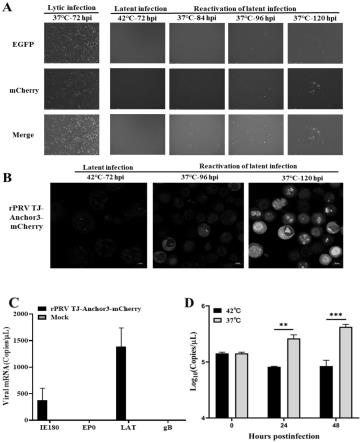
28.图9双荧光标记重组伪狂犬病病毒株rprv tj-anchor3-mcherry的n2a细胞潜伏感染模型;a:不同感染条件下rprv tj-anchor3-mcherry荧光图;b:潜伏状态和再激活状态时共聚焦显微拍照图;d:潜伏感染期病毒基因转录水平定量检测结果;c:潜伏感染和裂解感染不同时间点病毒载量差异分析。
具体实施方式
29.以下结合具体实施例来进一步描述本发明,本发明的优点和特点将会随着描述而更为清楚。但这些实施例仅是范例性的,并不对本发明的范围构成任何限制。本领域技术人员应该理解的是,在不偏离本发明的精神和范围下可以对本发明的细节和形式进行修改或替换,但这些修改和替换均落入本发明的保护范围内。
30.试验例1基因组和囊膜蛋白双荧光标记的重组伪狂犬病病毒株rprv tj-anchor3-mcherry的构建、鉴定、性能分析及应用
31.1材料和方法
32.1.1主要试剂
33.prv tj株及其fosmid文库、鼠脑神经瘤细胞(n2a细胞)、猪肾细胞(pk-15细胞)和非洲绿猴肾细胞(vero细胞)由本实验室保存;n2a、pk-15和vero细胞用含有10%胎牛血清(fbs)的dmem培养基(gibco)于37℃、5%co2环境中培养;pgem7-anchor3质粒和大肠杆菌dh10b感受态菌由本实验室保存;pmcherry-c1和pmd18-t simplevector质粒购于宝生物(takara)公司。
34.表1构建和鉴定重组病毒rprv tj-anchor3-mcherry的所用引物
[0035][0036][0037]
所用抗生素及l-阿拉伯糖(sigma a-3256)均购自sigma公司;质粒小提试剂盒购
自epigenetics公司(zr bac dna miniprep kit,d4049);质粒中提试剂盒购自tiangen公司(tianfilter plasmid midi kit,12243);x-tremegene hpdna转染试剂购自roche公司(cat.no.06366546001)。所有引物由睿博生物科技有限公司合成(表1)。
[0038]
1.2构建重组ul10同源臂mcherry中间质粒
[0039]
以pmcherryc1质粒为模板,经pcr扩增获得mcherry片段,以prv tj株基因组为模板,以gm蛋白编码基因ul10终止密码子前为插入位点,设计左右各50bp的同源臂,经pcr扩增获得mcherry-ul10-arm基因片段,并连接至pmd18-t载体上。据测序结果选择正确的克隆命名为pmd18-mcherry-ul10-arm。
[0040]
1.3构建us9同源臂anchor3中间质粒
[0041]
以pgem7-anchor3质粒为模板,经pcr扩增获得anchor3片段,以prv tj基因组为模板,以us9基因终止密码子后为插入位点,设计左右各200bp的同源臂,经pcr扩增获得us9-arm-left和us9-arm-right基因片段;anchor3、us9-arm-left和us9-arm-right基因片段经融合pcr扩增,获得anchor3-us9-arm基因片段并连接至pmd18-t载体。经测序选择正确的克隆命名为pmd18-anchor3-us9-arm。
[0042]
1.4将mcherry基因插入至prv tj株fosmid文库中含ul10的粘粒上
[0043]
利用prv tj株的fosmid文库中含ul10的粘粒进行基因重组,详细的构建方案如图1b所示。首先将fosmid-o和red/et质粒共同电转至dh10b感受态菌,取100μl转化后的细菌涂布于含氯霉素(cm
+
)和四环素(tet
+
)两种抗性的lb中,在30℃避光条件下培养30~40h;挑取单克隆菌落用于制备电转化感受态菌dh10b-fosmid-o-red/et,pcr扩增含mcherry-ul10-arm同源臂的rpsl-neo基因片段,并将rpsl-neo基因片段电转至感受态菌dh10b-fosmid-o-red/et,取100μl转化后的细菌涂布于含氯霉素(cm
+
)、四环素(tet
+
)和卡那霉素(kan
+
)的3种抗性的平板上,在30℃避光条件下培养30~40h,挑取单克隆菌落进行pcr鉴定和测序,确定rpsl-neo已成功替换插入ul10基因终止密码子前,获得重组菌dh10b-fosmid-o-rpsl;制备重组dh10b-fosmid-o-rpsl电转化感受态菌,pmd18-mcherry-ul10-arm质粒为模板,pcr扩增含有mcherry-ul10-arm片段并电转化感受态菌dh10b-fosmid-o-rpsl,取100μl转化后的菌涂布于含氯霉素(cm
+
)和链霉素(strep
+
)的双抗性平板上,在37℃中避光培养18~24h,挑取单克隆菌落进行pcr鉴定和测序,确定mcherry已成功替换rpsl-neo基因,获得重组菌dh10b-fosmid-o-mcherry。
[0044]
1.5在prv tj株fosmid文库含us9粘粒中插入anchor3基因
[0045]
以上述相同的方法将fosmid-s和red/et质粒共同电转至dh10b感受态菌,并以相同的方法构建重组菌dh10b-fosmid-s-anchor3(图1c)。1.6双荧光标记rprv tj-anchor3-mcherry的拯救
[0046]
按照x-tremegene hp dna转染试剂说明书,将纯化的粘粒fosmid-a、fosmid-f、fosmid-o-mcherry、fosmid-q和fosmid-s-anchor3共转染至细胞融合度为90%的10cm细胞培养板vero细胞中,每种粘粒的转染剂量为2μg(图1d)。待细胞病变后反复冻融细胞,收获病毒,将拯救的病毒命名为rprv tj-anchor3-mcherry。
[0047]
1.7rprv tj-anchor3-mcherry基因组的pcr鉴定
[0048]
将拯救的病毒于-80℃/37℃条件下反复冻融后,在pk-15细胞上连续传20代,提取第20代病毒的基因组,用特异性引物扩增mcherry和anchor3基因片段,并对扩增片段进行
测序分析。
[0049]
1.8rprv tj-anchor3-mcherry病毒粒子的电镜观察
[0050]
取病毒滴度为108tcid
50
的rprv tj-anchor3-mcherry和prv tj病毒液1ml,13 000r/min离心10min,收集上清液,经2%磷钨酸负染后,通过透射电子显微镜观察病毒粒子的形态。
[0051]
1.9rprv tj-anchor3-mcherry基因组荧光蛋白标记特异性的鉴定
[0052]
将vero细胞接种于共聚焦细胞培养皿,置于37℃、5%co2细胞培养箱过夜培养,加入hoechst染料,染色5min,弃掉染色液,用pbs洗细胞3次,以1μg/皿的剂量将or3-mcherry真核表达质粒转染vero细胞,于转染后24h感染rprv tj-anchor3-egfp(moi=1),以相同方式转染or3-mcherry真核表达质粒和仅感染rprv tj-anchor3-egfp的处理作为对照,于感染后24h将细胞培养皿置于共聚焦显微镜下拍照。
[0053]
1.10rprv tj-anchor3-mcherry的生长特征分析
[0054]
将病毒以moi=5的剂量接种单层的pk-15细胞,吸附1h后弃掉病毒液,pbs洗细胞3次,更换新鲜培养基,并在感染后0、6、12、24、36、48、72、96和120h收获病毒。将不同时间点收获的病毒分别用ifa测定病毒滴度并绘制出病毒的生长曲线。
[0055]
用dmem培养基将病毒原液进行10倍梯度稀释且最终体积为1ml,接种6孔细胞培养板培养的pk-15细胞,并置于37℃、5%co2细胞培养箱中培养2h弃掉病毒液;将含2%fbs、1%低熔点琼脂糖的1
×
dmem培养基在80℃的水浴锅中加热融化,熔化后置于细胞培养箱中降温至37℃左右,取2ml凝胶液覆盖单层细胞,置于室温15min左右使低熔点琼脂糖凝固后,再于37℃、5%co2细胞培养箱中继续培养72h;每孔加入600μl的4%多聚甲醛进行固定20min,并用1ml注射器针头轻轻剥离细胞表面的低熔点琼脂糖凝胶固体,然后用结晶紫染色液对细胞进行染色5~10min,吸出结晶紫染色液后用清水轻轻将细胞培养孔冲洗干净,拍照并测算蚀斑直径。
[0056]
1.11rprv tj-anchor3-mcherry对小鼠的致病性评价
[0057]
将45只6周龄spf级雌性balb/c小鼠随机分为9组,每组小鼠均分笼饲养。前4组分别接种104、103、102或101tcid
50
的prv tj株,第5~8组分别接种相同剂量的rprv tj-anchor3-mcherry,第9组接种100μldmem作为对照,接种途径均为肌肉注射。每天记录小鼠的体重和临床症状,共持续14d。同时记录小鼠发病时间、死亡时间,并计算死亡率,之后取104感染组和对照组的小鼠解剖取心、肝、脾、肺、肾、腓肠肌和脑等组织,置于-20℃保存用于检测各组织病毒载量。
[0058]
1.12rprv tj-anchor3-mcherry感染n2a细胞的病毒复制周期示踪
[0059]
将n2a细胞接种于共聚焦细胞培养皿,在37℃、5%co2细胞培养箱中过夜培养,加入hoechst染料,染色5min,弃掉染色液,用pbs洗细胞3次,感染rprv tj-anchor3-mcherry(moi=1),置于活细胞成像系统中持续培养,并连续拍照。
[0060]
1.13rprv tj-anchor3-mcherry用于实时量化病毒基因组和成熟的病毒将vero细胞接种于共聚焦细胞培养皿,置于37℃、5%co2细胞培养箱中过夜培养,加入hoechst染料,染色5min,弃掉染色液,用pbs洗细胞3次,感染rprv tj-anchor3-mcherry(moi=0.1),置于活细胞成像系统持续培养,并连续拍照。收集感染24h的样本进行病毒基因组定量,并与同期荧光强度进行线性分析。依据分析结果,确定单个病毒基因组或成熟病毒颗粒荧光值。本
tj-anchor3-egfp时,其编码的or3-egfp蛋白可以结合病毒基因组并实现绿色荧光标记。
[0069]
2.3rprv tj-anchor3-mcherry的复制特性
[0070]
相同剂量的rprv tj-anchor3-mcherry和prv tj株感染pk-15细胞,于感染后72h蚀斑染色结果显示,rprv tj-anchor3-mcherry和prv tj感染形成的单个蚀斑大小无显著差异(图4a),两个毒株在pk-15细胞上的一步生长曲线基本一致(图4b)。以上结果说明,prv tj株基因组us9基因和us2基因之间插入anchor3系统完整基因序列,以及ul10基因的终止密码子前插入mcherry基因均不影响病毒复制。
[0071]
2.4rprv tj-anchor3-mcherry对小鼠的致病性和组织嗜性分析
[0072]
取6周龄spf级雌性balb/c小鼠45只,随机分为9组,以相同方式和剂量分别接种rprv tj-anchor3-mcherry和prv tj株,接种dmem的小鼠为对照。两个104tcid
50
感染组的小鼠全部死亡,rprv tj-anchor3-mcherry株平均发病和死亡时间为2.2d和3d,prv tj株组平均发病和死亡时间为2.2d和2.9d;101tcid
50
感染组和对照组小鼠无发病,无死亡;103tcid
50
感染组死亡率高于102tcid
50
且在两个毒株之间无显著差异,发病时间和死亡时相当;根据两个毒株感染小鼠死亡率计算半数致死剂量(ld
50
)均为10
2.5
tcid
50
。以上结果说明,rprv tj-anchor3-mcherry和prv tj株对小鼠的致病性无显著差异。对两个104tcid
50
感染组的死亡小鼠的组织进行病毒载量检测,结果显示心、肝、脾、肺、肾、腓肠肌和脑等组织中两个毒株基因组拷贝数无显著差异(图5),说明anchor3和mcherry基因插入prv tj基因组不影响病毒的组织嗜性。
[0073]
表2rprv tj-anchor3-mcherry和prv tj株感染小鼠半数致死剂量测定
[0074][0075][0076]
2.5rprv tj-anchor3-mcherry感染n2a细胞的病毒复制周期示踪
[0077]
将n2a细胞接种于共聚焦细胞培养皿,以moi=1的剂量感染rprv tj-anchor3-mcherry,置于活细胞成像系统中连续拍照。从图6的结果中可观察到:红色荧光标记的病毒粒子靠近细胞膜,2min 30s时吸附在细胞膜上,于10min后病毒囊膜与细胞膜发生融合,红色荧光留在细胞膜上,褪去囊膜的病毒发绿色荧光。另有病毒粒子附着在细胞膜上,经过
25min以内吞方式进入细胞内,完整病毒粒子呈红色荧光,50min时病毒粒子接近细胞核,此时病毒褪去囊膜,病毒粒子呈绿色荧光。进入细胞核内的单个病毒基因组,经过一段时间复制后,特异性荧光点数迅速增加;在病毒基因组增殖的同时,有部分囊膜蛋白开始表达,并在细胞核附近组装成为成熟的病毒粒子(红光),紧接着细胞核附近大量积累病毒粒子到达细胞膜并释放。
[0078]
以上结果说明rprv tj-anchor3-mcherry以膜融合和内吞的方式入侵n2a细胞(本试验首次发现prv在神经细胞上通过两种途径入侵神经细胞),病毒基因组复制的同时,囊膜蛋白gm表达,并包装病毒基因组形成成熟的子代病毒粒子从细胞膜上释放,利用rprv tj-anchor3-mcherry可以示踪prv从感染到子代病毒粒子释放的完整周期。
[0079]
2.6rprv tj-anchor3-mcherry在被感染的细胞中实时量化
[0080]
将pk-15细胞接种于共聚焦细胞培养皿,以moi=1的剂量感染rprv tj-anchor3-mcherry,置于活细胞成像系统中连续拍照。从感染起始时间算起,分析以下几个时间点的荧光值:0、2、4、6、8、10、12、14、16、18、20、22、24h,分别统计分析病毒基因组(egfp)和完整病毒粒子(mcherry)荧光值,以荧光单位(fu)表示,同期定量检测相同处理方式样品的病毒基因组拷贝数。结果显示,单条病毒基因组对应的荧光值为28fu,成熟的单个病毒粒子荧光值为12fu(图7a、7b、7c)。根据荧光值和病毒基因组拷贝数,将二者拟合分析得出,病毒荧光强度值和基因组拷贝数存在相同的增长趋势(图7d)。即双荧光标记rprv tj-anchor3-mcherry可用于病毒基因组和成熟病毒粒子的实时量化分析(图7e)。
[0081]
2.7rprv tj-anchor3-mcherry对阿昔洛韦的敏感性评估结果
[0082]
将vero细胞接种于高通量活细胞成像专用96孔细胞培养皿,感染不同剂量的rprv tj-anchor3-mcherry,每隔12h利用高通量活细胞成像系统扫描、采集图像,并对细胞感染率、病毒基因组和成熟病毒进行量化分析。结果显示,阿昔洛韦(acyclovir)能够明显抑制prv基因组增殖和成熟病毒粒子形成,而奥司他韦(oseltamivir)对prv的增殖几乎没有影响(图8a、8b)。统计整个培养孔的荧光点数量随时间延长无显著增加,说明阿昔洛韦能够抑制病毒复制,并显著降低细胞感染率(图8c、8d)。
[0083]
通过对各时间点的荧光值量化分析得出,阿昔洛韦可有效降低病毒基因组复制,并延缓病毒粒子成熟(图8e、8f)。以上结果表示,rprv tj-anchor3-mcherry可用于抗prv药物(化合物)的筛选,具有直观、高效和操作简单的优势。
[0084]
2.8rprv tj-anchor3-mcherry在n2a细胞上温控潜伏感染模型特征
[0085]
将重组病毒rprv tj-anchor3-mcherry以moi=0.01感染n2a细胞,在42℃持续培养72h后绿色荧光没有明显变化,同时观察不到红色荧光,而同一病毒以相同剂量感染n2a细胞,在37℃条件培养48h,可观察到大量红色和绿色荧光,说明重组病毒rprv tj-anchor3-mcherry在42℃培养条件下不增殖(图9a、9b)。从潜伏感染的细胞样品中仅检测到lat和低水平的ie180转录本,而检测不到早期基因ep0和晚期基因gb的转录产物(图9c),定量检测在42℃持续培养24h和48h上清中的病毒基因组无显著变化(图9d)。这些均符合prv潜伏感染的特征,说明本试验已成功在42℃培养的n2a细胞中建立prv潜伏感染,温控潜伏感染模型的建立为后续prv潜伏感染再激活机制研究奠定良好的基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1