一种苯并咪唑类化合物、包含其的药物组合物及两者的用途
1.本发明属于医药领域,具体涉及一种苯并咪唑类化合物、包含其的药物组合物及两者的用途。
背景技术:
2.干扰素基因刺激因子(stimulator of interferon gene,sting)是特异性调控固有免疫系统一个关键节点蛋白。固有免疫系统作为人体内的第一道防线,能够通过模式识别受体(pattern recognition receptors,prrs)迅速识别外来病原微生物的入侵,诱导巨噬细胞(mc)和自然杀伤细胞(nk)发挥吞噬和降解功能,同时分泌大量炎症因子或趋化因子,促进树突细胞(dc)递呈抗原,激活适应性免疫(annu rev immunol,2014,32,461-488)。其中,模式识别受体包括核苷酸结合结构域样受体(nod-like receptors,nlrs)、toll样受体(toll-like receptors,tlrs)、维甲酸诱导基因ⅰ样受体(rig
‑ⅰ
like receptors,rlrs)、c型凝集素受体(c-type lectin receptors,clrs)、鸟苷酸-腺苷酸合成酶(cyclic gmp-amp synthase,cgas)等(semin immunol,2009,21,242-253)。研究表明,prrs能够识别病原分子相关模式(pathogen associated molecular patterns,pamps,如单/双链核糖核苷酸及脂多糖)或损伤相关分子模式(damage associated molecular patterns,damps)并进一步启动下游信号通路释放细胞因子,调控机体免疫反应(nature,2008,455,674-678)。
3.cgas作为细胞内dna感受器,能够识别外源性物质或自身的胞浆双链dna(dsdna),合成并释放环二核苷(cyclic dinucleotides,cdns)类物质如c-di-gmp、c-di-amp、3’,3
’‑
cgamp以及2’,3
’‑
cgamp等,使sting激活并从内质网转移到高尔基体中,进而招募细胞质中的tank结合激酶-1(tank binding kinase-1,tbk-1),介导tbk-1对干扰素调节因子-3(interferon regulatory factor-3,irf-3)的磷酸化,诱导分泌i型干扰素,同时诱导多种炎症因子tnf、il-6和cxcl10等分泌,并激活肿瘤特异性cd8
+
t细胞,进而调控机体免疫反应(science,2015,347,aaa2630;nature,2019,567,394-398)。
4.目前许多研究证明了sting激动剂能够增强肿瘤免疫效果,并能够从更广泛的层面激活、增强人体固有免疫系统和适应性免疫功能,有望治疗多种癌症,甚至用于治疗癌症之外的其它疾病。
技术实现要素:
5.本发明的目的在于提供一类含苯并咪唑结构的化合物、包含其的药物组合物及两者的用途。
6.为了实现上述目的,本发明所采用的技术方案为:
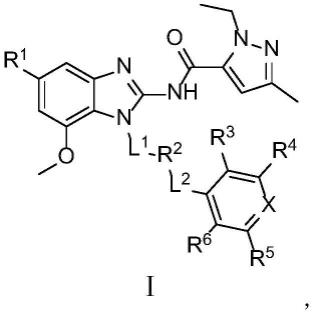
7.一种苯并咪唑类化合物,它是式ⅰ所示的化合物或其互变异构体、外消旋体、内消旋体、对映异构体、非对映异构体、药学上可接受的盐,式ⅰ为:
选自n或c;
20.r7、r8、r9、r
10
分别独立地选自氢、c1~c6烷基、c1~c6烷氧基、氰基、卤素取代的c1~c6烷基、卤素取代的c1~c6烷氧基、-c(o)nhrg、硝基、羧基、-c(o)2rh或-nhcoch3;
21.rg选自氢或c1~c6烷基;
22.rh选自c1~c6烷基。
23.作为技术方案的进一步改进,r7、r8、r9、r
10
分别独立地选自卤素、甲基或氟原子取代的甲基。
24.作为技术方案的进一步改进,r1为c(o)nrarb;r2选自-nrcc(o)nh-或-nh-;l1为-(ch2)
3-;
25.当l1为-(ch2)
3-且r2为-nhc(o)nh-时,l2选自c1~c6亚烷基或噁唑环或者l2和r3与相连接的原子一起形成3~6元环。
26.作为技术方案的进一步改进,当r
3-r
10
、r
a-rf独立地为c1~c6烷基时,所述c1~c6烷基选自甲基、乙基、正丙基、异丙基、叔丁基;当r
3-r
10
独立地为c1~c6烷氧基时,所述c1~c6烷氧基选自甲氧基、乙氧基、正丙基氧基、异丙基氧基、叔丁基氧基;当r
3-r6独立地为c3~c6杂环烷基时,所述c3~c6杂环烷基选自氮杂环丁烷基或哌啶基。
27.作为技术方案的进一步改进,它为以下任一化合物:
28.29.30.[0031][0032]
上述化合物的合成路线如下:
[0033][0034]
其中反应条件为:(a)氨水,50℃;(b)nh
2-l
1-r
2-boc,碳酸钾,n,n-二甲基甲酰胺,100℃;(c)氢气,10%钯碳,甲醇;(d)1-乙基-3-甲基-1h-吡唑-5-羧酸,o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐,n-乙基二异丙胺,n,n-二甲基甲酰胺;(e)三氟乙酸,二氯甲烷,缚酸剂,室温或110℃。当步骤(e)反应温度为110℃时,制得的化合物结构式为式ⅱ,缚酸剂优选碳酸钾等无机缚酸剂。
[0035]
因本发明的化合物能够激活sting信号通路,具有治疗与sting蛋白功能相关疾病应用前景,本发明还提供一种药物组合物,所述药物组合物包含治疗有效量的所述的化合物、其药学上可接受的晶型、水合物、溶剂化物、前药、代谢物中的一种或者混合物,还包含有药用辅料和/或药学上可接受的载体。药用辅料系指生产药品和调配处方时使用的赋形剂和附加剂,包括溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂等,优选口服药用辅料如崩解剂、助溶剂、溶剂、润滑剂等。
[0036]
药学上可接受的载体,是指能改变药物进入人体的方式和在体内的分布、控制药物的释放速度并将药物输送到靶向器官的体系,包括微囊与微球、纳米粒、脂质体等。当药物组合物用于实体瘤肿瘤疾病时,优选组合物形式为有效成分+载体。
[0037]
因本发明的化合物能够激活sting信号通路,本发明还提供一种所述的苯并咪唑类化合物或所述药物组合物在制备干扰素基因刺激因子激动剂或免疫佐剂中的用途。
[0038]
本发明还提供一种所述苯并咪唑化合物在制备与sting蛋白功能相关疾病药物中的用途,所述与sting蛋白功能相关疾病是炎症、自身免疫性疾病、感染性疾病、肿瘤相关的疾病中的一种或多种。所述炎症疾病选自寻常性痤疮、类风湿性关节炎、盆腔炎﹑哮喘﹑腹腔疾病﹑炎症性肠病、再灌注损伤、慢性前列腺炎、肾小球肾炎、结节病、血管炎、房尘螨引起的气道炎症和间质性膀胱炎。
[0039]
所述感染性疾病选自细菌和病毒性感染,特别是乙肝病毒(hbv)、丙型肝炎病毒(hcv)、鼻咽癌相关eb病毒(ebv)、人乳头瘤病毒(hpv)和人类免疫缺陷病毒(hiv)感染相关的疾病。
[0040]
所述肿瘤相关的疾病选自结肠癌﹑胃癌、乳腺癌、纤维肉瘤和鳞状细胞癌、肺癌、黑素瘤﹑卵巢癌、脑癌、脑癌和脊椎癌、肝癌、宫颈癌、头颈癌、白血病和血癌、皮肤癌、生殖系统
癌、肺癌、恶性间皮瘤、肉瘤、淋巴瘤、腺癌、甲状腺癌、心脏肿瘤、生殖细胞肿瘤、胃肠系统癌、肝和胆管癌、肾癌和膀胱癌、骨癌等癌症。
[0041]
本发明相对现有技术具有突出的实质性特点和显著的进步,具体的说,本发明的苯并咪唑化合物对干扰素基因刺激(sting)蛋白的激动作用,可用于治疗癌症,炎症,自身免疫性疾病,感染性疾病等。
附图说明
[0042]
图1为thp1细胞中化合物44和53诱导sting下游蛋白的结果图。
[0043]
图2为thp1细胞中化合物58和56诱导sting下游蛋白的结果图。
[0044]
图3为本发明诱导sting下游细胞因子ifn-β的mrna表达结果图。
[0045]
图4为本发明诱导sting下游细胞因子cxcl10的mrna表达结果图。
[0046]
图5为小鼠ct-26移植瘤模型中溶媒对照组和给药组在给药期间的相对肿瘤体积变化图。
[0047]
图6为小鼠ct-26移植瘤模型中给药期间小鼠体重变化情况图。
[0048]
图7为小鼠ct-26移植瘤模型中给药后小鼠肿瘤质量称量结果图。
具体实施方式
[0049]
下面通过具体实施方式,对本发明的技术方案做进一步的详细描述。
[0050]
本公开中实施例中未注明具体条件的实验方法,通常按照常规条件,或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
[0051]
化合物的结构是通过核磁共振(nmr)或/和高分辨质谱(hrms)来确定的,1h nmr和
13
c nmr核磁共振波谱由bruker av-300核磁共振仪测定,测定溶剂为氘代二甲基亚砜(dmso-d6)、氘代氯仿(cdcl3),内标为四甲基硅烷(tms)。高分辨质谱采用美国沃特世公司的water q-tof micro型质谱仪测定。
[0052]
化学反应采用0.25mm gf254薄层色谱硅胶板进行检测,并通过zf7型三用紫外分析仪观察。终产物的熔点由melt-tempⅱ熔点仪测定。
[0053]
实施例中如无特殊说明,反应在空气氛下进行。
[0054]
实施例中如无特殊说明,溶液是指水溶液。
[0055]
实施例中如无特殊说明,反应的温度室温为20℃~30℃。
[0056]
实施例中化合物纯度采用hplc检测,所用色谱柱为agilent c18(4.6mm
×
150mm,3.5μm)反相色谱柱,检测条件为:甲醇/水(0.1%甲酸)混合溶剂作为流动相,流速为1ml/min,通过254nm和365nm紫外吸收检测。实施例1:化合物1的制备
[0057][0058]
步骤1:合成化合物1-3a
[0059]
将化合物1-1a(5g,20.48mmol),化合物1-2a(7.82g,44.90mmol),碳酸钾(9.15g,66.33mmol)及n-甲基吡咯烷酮(15ml)加入封管中,120℃过夜加热。待反应完全后,冷却至室温,加入饱和nh4cl水溶液搅拌20min,过滤收集沉淀,水洗,真空干燥得到化合物1-3a,红色固体,收率为85%。1h nmr(300mhz,dmso-d6)δ8.18(d,j=1.9hz,1h),8.03(t,j=6.0hz,1h),7.42(d,j=1.9hz,1h),6.88(t,j=5.8hz,1h),3.90(s,3h),3.84(s,3h),3.50(q,j=6.6hz,2h),2.97(q,j=6.3hz,2h),1.66(p,j=6.7hz,2h),1.36(s,9h).
[0060]
步骤2:合成化合物1-4a
[0061]
将化合物1-3a(5g,13.05mmol)溶于无水甲醇和无水四氢呋喃(1:1)的混合溶剂中,分批加入pd/c(10%),反应体系在氢气环境下室温搅拌过夜。待反应完全后,借助硅藻土进行过滤,滤液浓缩制砂,经柱层析纯化得到棕色固体1-4a,收率为62%。1h nmr(300mhz,dmso-d6)δ7.66(s,1h),7.02(s,1h),6.90(d,j=1.8hz,1h),6.83(d,j=1.9hz,1h),4.69(s,2h),3.86
–
3.81(m,1h),3.80(s,3h),2.93(q,j=5.7hz,2h),1.45(h,j=7.3hz,2h),0.90(t,j=7.4hz,3h).
[0062]
步骤3:合成化合物1-5a
[0063]
将化合物1-4a(4g,11.33mmol)溶于甲醇后,加入溴化氰(2.26g,21.52mmol),于氮气保护下,升温至60℃反应过夜。待反应完全后,冷却至室温,浓缩除去挥发性溶剂,加入饱和k2co3溶液搅拌,有固体析出,过滤,得到的白色固体用乙醚洗涤,真空干燥得到化合物1-5a,收率为70%。1h nmr(300mhz,dmso-d6)δ7.87(s,1h),7.47(d,j=1.3hz,1h),7.17(d,j=1.4hz,1h),7.15(s,1h),6.50(s,2h),4.15(t,j=7.2hz,2h),3.95(s,3h),1.72(h,j=7.2hz,2h),0.91(t,j=7.4hz,3h).
[0064]
步骤4:合成化合物1-7a
[0065]
将化合物1-6a(0.2g,1.30mmol),hatu/o-(7-氮杂苯并三唑-1-基)-n,n,n',n'-四甲基脲六氟磷酸盐(0.49g,1.30mmol)和n,n-二异丙基乙胺(dipea)(0.60g,4.36mmol)加入到dmf溶剂中,室温搅拌30min后,再加入化合物1-5a(0.14g,1.08mmol),室温过夜反应。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nh4cl和饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物1-7a,收率为67.0%。1h nmr(300mhz,dmso-d6)δ12.95(s,1h),7.83(d,j=1.4hz,1h),7.43(d,j=1.4hz,1h),6.90(t,j=5.8hz,
1h),6.70(s,1h),4.64(q,j=7.0hz,2h),4.38(t,j=7.1hz,2h),4.03(s,3h),3.90(s,3h),3.03(q,j=5.9hz,2h),2.21(s,3h),1.97
–
1.79(m,2h),1.44
–
1.33(m,12h).
[0066]
步骤5:合成化合物1-2b
[0067]
将化合物1-1b(2g,18.52mmol)与n,n'-羰基二咪唑(3.3g,20.37mmol)加入二氯甲烷溶剂中,室温搅拌3h,待反应完全后,加水萃取,有机层用饱和nacl洗涤,无水na2so4干燥,浓缩后备用。
[0068]
步骤6:合成化合物1-8a
[0069]
在化合物1-7a(1g,2mmol)的二氯甲烷溶液(4ml)中加入1ml三氟乙酸,搅拌1h后,浓缩除去溶剂及三氟乙酸。之后加入三乙胺(0.61g,6mmol),化合物1-2b(0.45g,2.2mmol)和dmf溶剂,室温过夜反应。待反应完全后,加水萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物1-8a,收率为8.9%。熔点:210.6-212.3℃。1h nmr(300mhz,dmso-d6)δ12.95(s,1h),7.83(d,j=1.4hz,1h),7.42(d,j=1.4hz,1h),7.39
–
7.30(m,6h),6.71(s,1h),5.03(s,2h),4.64(q,j=7.0hz,2h),4.40(t,j=7.0hz,2h),3.99(s,3h),3.90(s,3h),3.12(q,j=6.3hz,2h),2.17(s,3h),2.02
–
1.82(m,3h),1.38(t,j=7.1hz,3h).
[0070]
步骤7:合成化合物1
[0071]
将化合物1-8a(0.2g,0.36mmol)溶解在meoh,h2o和thf的混合物溶液(1:1:1)中,加入lioh(143mg,5.95mmol),升温至60℃搅拌1h。待反应完全后,冷却至室温,浓缩除去挥发性溶剂,加入稀盐酸溶液搅拌,过滤,得到的沉淀用乙醚洗涤,真空干燥得到化合物1,白色固体,收率为87.5%,熔点:217.7-223.6℃。1h nmr(300mhz,dmso-d6)δ12.90(s,1h),7.83(d,j=1.3hz,1h),7.43(s,1h),7.40
–
7.31(m,6h),6.71(s,1h),5.03(s,2h),4.63(q,j=6.9hz,2h),4.40(t,j=7.1hz,2h),3.98(s,3h),3.12(q,j=6.5hz,2h),2.17(s,3h),2.02
–
1.83(m,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
n6o
6+
[m+h]
+
535.2300,found 535.2308.purity:95.48%by hplc(meoh/h2o=80:20).
[0072]
实施例2:化合物2的制备
[0073]
将化合物1(140mg,0.26mmol)和hbtu/苯并三氮唑-n,n,n',n'-四甲基脲六氟磷酸盐(150mmg,0.39mmol)溶于dmf溶剂中,冰浴条件下加入三乙胺(110ul,0.79mmol),搅拌1h后加入盐酸羟胺(27mg,0.39mmol),撤去冰浴,室温反应过夜。待反应完全后,浓缩后加入乙酸乙酯和水萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物2,收率为26.7%。熔点:196.3-201.1℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),11.26(s,1h),9.07(s,1h),7.61(s,1h),7.32(d,j=25.8hz,7h),6.69(s,1h),5.03(s,2h),4.64(q,j=7.1hz,2h),4.39(t,j=7.2hz,2h),3.97(s,3h),3.11(d,j=6.6hz,2h),2.17(d,j=4.9hz,3h),1.92(d,j=7.5hz,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
27h32
n7o
6+
[m+h]
+
550.2409,found550.2402.purity:97.53%by hplc(meoh/h2o=80:20).
[0074]
实施例3:化合物3的制备
[0075][0076]
步骤1:合成化合物3-1
[0077]
将化合物1-1a(10g,40.81mmol)加入氨水(80ml)中,该混悬液于氮气保护下,升温至60℃反应6h。待反应完全后,冷却至室温,过滤,得到的沉淀用水和乙醚洗涤,真空干燥得到化合物3-1,黄色固体,收率为68%。1h nmr(300mhz,dmso-d6)δ8.34(s,1h),8.08(d,j=1.8hz,1h),7.91(d,j=1.8hz,1h),7.84(s,1h),4.05(s,3h).
[0078]
步骤2:合成化合物3-2
[0079]
合成方法如实施例1步骤2所示,不同的是用化合物3-1替换化合物1-1a,化合物3-2收率75%。1h nmr(300mhz,chloroform-d)δ8.34(s,1h),8.18(d,j=1.9hz,1h),7.54(d,j=2.0hz,1h),7.31(s,2h),3.95(s,3h),3.79(t,j=7.0hz,2h),3.73(s,3h),2.47(t,j=7.3hz,2h),2.02(p,j=7.2hz,2h).
[0080]
步骤3:合成化合物3-3
[0081]
将化合物3-2(2g,5.43mmol)溶于dmf-dma(1.617g,13.57mmol)中,n2保护下,100℃搅拌1h,而后冷却至室温,浓缩,加入冰醋酸(8ml),再加入水合肼(10.86mmol),升至90℃反应1.5h。待反应完全后,浓缩,加水稀释,抽滤,所得红色固体用水洗涤后,真空干燥得到化合物3-3。收率53.1%。1h nmr(300mhz,dmso-d6)δ14.18(s,1h),8.27(s,1h),7.76(s,1h),7.67(s,1h),6.91(t,j=5.5hz,1h),3.95(s,3h),3.51(q,j=5.7hz,2h),2.99(q,j=6.3hz,2h),1.75
–
1.60(m,2h),1.39(s,9h).
[0082]
步骤4:合成化合物3
[0083]
由化合物3-3合成化合物3的合成步骤如实施例1中步骤3-7,最后得化合物3的收率19.2%。熔点:129.2-135.1℃。1h nmr(300mhz,dmso-d6)δ14.12(s,1h),12.85(s,1h),8.65(s,1h),7.89(s,1h),7.56(s,1h),7.35(d,j=4.6hz,6h),6.69(s,1h),5.04(s,2h),4.65(q,j=7.0hz,2h),4.40(t,j=7.2hz,2h),4.01(s,3h),3.13(q,j=6.5hz,2h),2.17(s,3h),1.96(t,j=7.0hz,2h),1.38(t,j=7.0hz,3h).hrms(esi):calcd for c
28h32
n9o
4+
[m+h]
+
558.2572,found558.2572.purity:96.92%by hplc(meoh/h2o=80:20).
[0084]
实施例4:化合物4的制备
[0085][0086]
按照实施例1中的步骤1-6合成化合物4,不同的是本实施例在步骤1中用化合物4-1a替换1-2a,用化合物3-1替换1-1a。
[0087]
化合物4-2a收率65%。1h nmr(300mhz,dmso-d6)δ8.23(d,j=1.9hz,1h),8.08(s,1h),7.77(t,j=6.1hz,1h),7.60(d,j=2.0hz,1h),7.38(s,1h),3.91(s,3h),3.90
–
3.82(m,2h),3.72(t,j=6.6hz,2h),2.81
–
2.71(m,1h),1.39(s,9h).
[0088]
化合物4-3a的收率为36.4%。1h nmr(300mhz,dmso-d6)δ7.66(s,1h),7.02(s,1h),6.90(d,j=1.9hz,1h),6.82(d,j=1.9hz,1h),4.71(s,2h),4.12
–
4.00(m,1h),3.79(s,3h),3.26(t,j=6.9hz,2h),3.02
–
2.88(m,2h),2.77(s,3h),1.60(p,j=6.8hz,2h),1.42(s,9h).
[0089]
化合物4-4a的收率为79.8%。1h nmr(300mhz,dmso-d6)δ7.85(s,1h),7.43(s,1h),7.26
–
7.06(m,2h),6.60(s,2h),4.40(d,j=7.2hz,2h),3.92(s,3h),3.88
–
3.77(m,2h),3.79
–
3.61(m,2h),3.08
–
2.88(m,1h),1.39(s,9h).
[0090]
化合物4-5a的收率为61.3%。1h nmr(300mhz,dmso-d6)δ8.05(s,1h),7.70(d,j=1.3hz,1h),7.43(d,j=1.4hz,2h),6.69(s,1h),4.69
–
4.52(m,4h),4.01(s,3h),3.97
–
3.79(m,4h),3.16
–
3.02(m,1h),2.20(s,3h),1.39(s,12h).
[0091]
化合物4的收率16.5%。熔点:127.4-132.7℃。1h nmr(300mhz,dmso-d6)δ12.92(s,1h),8.04(s,1h),7.70(s,1h),7.52
–
7.24(m,7h),6.68(s,1h),5.05(s,2h),4.70
–
4.49(m,4h),4.12
–
3.87(m,7h),3.24
–
3.09(m,1h),2.17(s,3h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
28h32
n7o
5+
[m+h]
+
546.2459,found546.2459.purity:97.04%by hplc(meoh/h2o=80:20).
[0092]
实施例5:化合物5的制备
[0093]
按照实施例4步骤合成化合物5,不同之处在于用3-(n-叔丁氧羰基-n-甲氨基)丙胺替换化合物4-1a。
[0094]
合成化合物5的收率为26.8%,熔点:100.4-103.8℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.06(s,1h),7.72(s,1h),7.49
–
7.20(m,7h),6.67(s,1h),5.07(d,j=17.6hz,2h),4.63(d,j=8.0hz,2h),4.37(d,j=7.6hz,2h),3.97(d,j=7.1hz,3h),2.93
(d,j=6.5hz,3h),2.19(s,3h),2.01(p,j=7.1hz,2h),1.37(q,j=6.6,6.1hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2618.purity:95.09%by hplc(meoh/h2o=80:20).
[0095]
实施例6:化合物6的制备
[0096][0097]
按照实施例4步骤合成化合物6,不同之处在于用n-叔丁氧羰基-1,3-丙二胺替换化合物4-1a,用化合物6-2b替换化合物1-2b。
[0098]
化合物6-1a收率32.5%。1h nmr(300mhz,dmso-d6)δ12.87(s,1h),8.05(s,1h),7.69(d,j=1.3hz,1h),7.42(d,j=1.4hz,2h),6.68(s,1h),4.64(q,j=7.1hz,2h),4.42(t,j=6.3hz,2h),4.01(s,3h),3.52(s,3h),2.40(t,j=7.0hz,2h),2.21(s,3h),2.07(t,j=6.7hz,1h),1.38(t,j=7.1hz,3h).
[0099]
化合物6的收率为14.5%,熔点:156.4-161.7℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.04(s,1h),7.69(s,1h),7.41(s,2h),7.37
–
7.22(m,6h),6.70(s,1h),5.68(q,j=6.6hz,1h),4.64(q,j=7.0hz,2h),4.37(t,j=6.4hz,2h),3.97(s,3h),3.19
–
2.94(m,2h),2.19(s,3h),1.97
–
1.83(m,2h),1.44(d,j=6.6hz,3h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2608.purity:95.57%by hplc(meoh/h2o=80:20).
[0100]
实施例7:化合物7的制备
[0101]
合成步骤同实施例6,不同的是用化合物6-1b的左旋体(s型)替换化合物6-1b。
[0102]
化合物7的收率为17.5%,熔点:141.7-144.3℃。1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.69(s,1h),7.40(s,2h),7.37
–
7.19(m,6h),6.70(s,1h),5.68(q,j=6.4hz,1h),4.63(q,j=6.7hz,2h),4.37(t,2h),3.97(s,3h),3.15
–
2.95(m,2h),2.18(s,3h),1.99
–
1.83(m,2h),1.44(d,j=6.6hz,3h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2616.purity:95.13%by hplc(meoh/h2o=80:20).
[0103]
实施例8:化合物8的制备
[0104]
合成步骤同实施例6,不同的是用化合物1-茚醇替换化合物6-1b。
[0105]
化合物8的收率为15.6%,熔点:255.6-262.3℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.03(s,1h),7.70(s,1h),7.44
–
7.12(m,7h),6.68(s,1h),6.00(dd,j=7.2,4.0hz,1h),4.73
–
4.54(m,2h),4.46
–
4.30(m,2h),3.99(s,3h),3.11(q,j=12.3,6.1hz,2h),3.05
–
2.76(m,2h),2.49
–
2.32(m,1h),2.14(s,3h),2.05
–
1.82(m,3h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
29h34
n7o
5+
[m+h]
+
560.2616,found560.2625.purity:97.12%by hplc(meoh).
[0106]
实施例9:化合物9的制备
[0107]
合成步骤同实施例6,不同的用化合物4-甲基苄醇替换化合物6-1b。
[0108]
化合物9的收率为13.6%,熔点:220.4-223.6℃,1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.69(s,1h),7.44
–
7.36(m,2h),7.30(t,j=5.9hz,1h),7.27
–
7.13(m,4h),6.69(s,1h),4.98(s,2h),4.63(q,j=7.0hz,2h),4.44
–
4.31(m,2h),3.98(s,3h),3.10(q,j=6.5hz,2h),2.31(s,3h),2.17(s,3h),2.00
–
1.87(m,2h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2625.purity:95.48%by hplc(meoh/h2o=80:20).
[0109]
实施例10:化合物10的制备
[0110]
合成步骤同实施例6,不同的是用化合物4-甲氧基苄醇替换化合物6-1b。
[0111]
化合物10的收率为19.5%,熔点:216.8-219.6℃,1h nmr(300mhz,dmso-d6)δ8.05(s,1h),7.69(s,1h),7.41(s,2h),7.33
–
7.24(m,3h),6.96
–
6.87(m,2h),6.69(s,1h),4.94(s,2h),4.63(q,j=6.1hz,2h),4.37(t,j=7.2hz,2h),3.97(s,3h),3.76(s,3h),3.09(q,j=7.0,6.4hz,2h),2.17(s,3h),1.98
–
1.85(m,2h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
28h34
n7o
6+
[m+h]
+
564.2565,found564.2569.purity:95.13%by hplc(meoh/h2o=80:20).
[0112]
实施例11:化合物11的制备
[0113]
合成步骤同实施例6,不同的是用化合物对异丙基苯甲醇替换化合物6-1b。
[0114]
化合物11的收率为14.3%,熔点:187.4-189.9℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.03(s,1h),7.69(s,1h),7.41(s,2h),7.35
–
7.17(m,5h),6.69(s,1h),4.98(s,2h),4.63(q,j=7.1hz,2h),4.38(t,j=6.6hz,2h),3.98(s,3h),3.10(q,j=6.1hz,2h),2.89(p,j=6.9hz,1h),2.16(s,3h),2.00
–
1.86(m,2h),1.37(t,j=7.0hz,3h),1.20(d,j=6.9hz,6h).hrms(esi):calcd for c
30h38
n7o
5+
[m+h]
+
576.2929,found576.2938.purity:98.50%by hplc(meoh/h2o=80:20).
[0115]
实施例12:化合物12的制备
[0116]
合成步骤同实施例6,不同的是用化合物5-羟甲基苯并-1,3-二恶环戊烷替换化合物6-1b。
[0117]
合成化合物12的收率为18.6%,熔点:191.3-196.5℃,1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.70(s,1h),7.41(d,j=8.2hz,2h),7.29(t,j=5.7hz,1h),6.87(dd,j=16.0,8.1hz,3h),6.69(s,1h),6.02(s,2h),4.92(s,2h),4.63(q,j=6.2hz,2h),4.38(t,j=6.3hz,2h),3.99(s,3h),3.10(q,j=6.2hz,2h),2.18(s,3h),1.99
–
1.85(m,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
28h32
n7o
7+
[m+h]
+
578.2358,found578.2357.purity:95.08%by hplc(meoh/h2o=80:20).
[0118]
实施例13:化合物13的制备
[0119]
合成步骤同实施例6,不同的是用化合物4-氟苄醇替换化合物6-1b。
[0120]
合成化合物13的收率为21.2%,熔点:204.2-207.4℃,1h nmr(300mhz,dmso-d6)δ
8.04(s,1h),7.71(d,j=1.3hz,1h),7.47
–
7.27(m,5h),7.27
–
7.14(m,2h),6.70(s,1h),5.01(s,2h),4.64(q,j=7.1hz,2h),4.39(t,j=7.2hz,2h),3.99(s,3h),3.11(q,j=6.6hz,2h),2.17(s,3h),1.94(p,j=7.3hz,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
fn7o
5+
[m+h]
+
552.2365,found552.2369.purity:95.17%by hplc(meoh/h2o=80:20).
[0121]
实施例14:化合物14的制备
[0122]
合成步骤同实施例6,不同的是用化合物4-氯苄醇替换化合物6-1b。
[0123]
化合物14的收率为23.5%,熔点:226.4-228.6℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.04(s,1h),7.70(s,1h),7.49
–
7.29(m,7h),6.69(s,1h),5.02(s,2h),4.64(q,j=6.9hz,2h),4.39(t,j=7.1hz,2h),3.99(s,3h),3.21
–
3.03(m,2h),2.17(s,3h),1.94(p,j=6.6hz,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
cln7o
5+
[m+h]
+
568.2070,found568.2066.purity:95.00%by hplc(meoh/h2o=80:20).
[0124]
实施例15:化合物15的制备
[0125]
合成步骤同实施例6,不同的是用化合物4-溴苄醇替换化合物6-1b。
[0126]
化合物15的收率为11.2%,熔点:237.2-239.3℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.03(s,1h),7.69(s,1h),7.57(d,j=8.1hz,2h),7.48
–
7.19(m,5h),6.68(s,1h),5.00(s,2h),4.63(q,j=7.1hz,2h),4.37(t,j=7.3hz,2h),3.98(s,3h),3.10(q,j=5.9hz,2h),2.16(s,3h),2.02
–
1.84(m,2h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
brn7o
5+
[m+h]
+
612.1565,found612.1565,614.1546.purity:97.51%by hplc(meoh/h2o=80:20).
[0127]
实施例16:化合物16的制备
[0128]
合成步骤同实施例6,不同的是用化合物4-羟甲基吡啶替换化合物6-1b。
[0129]
化合物16的收率为29.3%,熔点:147.1-148.9℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.62
–
8.53(m,2h),8.03(s,1h),7.70(s,1h),7.51(t,j=5.9hz,1h),7.46
–
7.30(m,4h),6.70(s,1h),5.10(s,2h),4.64(q,j=6.4hz,2h),4.40(t,j=6.8hz,2h),4.00(s,3h),3.20
–
3.05(m,2h),2.16(s,3h),2.03
–
1.90(m,2h),1.38(t,j=7.0hz,3h).hrms(esi):calcd for c
27h30
n9o4+[m+h]
+
544.2415,found 544.2426.purity:99.615%by hplc(meoh/h2o=80:20).
[0130]
实施例17:化合物17的制备
[0131]
合成步骤同实施例6,不同的是用化合物4-(羟甲基)苯腈替换化合物6-1b。
[0132]
化合物17的收率为17.7%,熔点:154.7-157.3℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.04(s,1h),7.92
–
7.79(m,2h),7.70(d,j=1.3hz,1h),7.60
–
7.35(m,5h),6.69(s,1h),5.12(s,2h),4.64(q,j=7.0hz,2h),4.39(t,j=7.3hz,2h),3.99(s,3h),3.20
–
3.04(m,2h),2.16(s,3h),2.02
–
1.87(m,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
28h31
n8o
5+
[m+h]
+
559.2412,found559.2408.purity:98.43%by hplc(meoh/h2o=80:20).
[0133]
实施例18:化合物18的制备
[0134]
合成步骤同实施例6,不同的是用化合物4-(三氟甲基)苯甲醇替换化合物6-1b。
[0135]
合成化合物18的收率为12.3%,熔点:223.6-226.8℃,1h nmr(300mhz,dmso-d6)δ12.90(s,1h),8.05(s,1h),7.82
–
7.67(m,3h),7.57(d,j=8.0hz,2h),7.51
–
7.35(m,3h),
6.71(s,1h),5.15(s,2h),4.65(q,j=6.7hz,2h),4.41(t,j=7.1hz,2h),4.00(s,3h),3.22
–
3.02(m,2h),2.16(s,3h),2.04
–
1.87(m,2h),1.39(t,j=7.0hz,3h).hrms(esi):calcd for c
28h31
f3n7o
5+
[m+h]
+
602.2333,found602.2334.purity:97.56%by hplc(meoh/h2o=80:20).
[0136]
实施例19:化合物19的制备
[0137]
合成步骤同实施例6,不同的是用化合物4-(三氟甲氧基)苄醇替换化合物6-1b。
[0138]
化合物19的收率为10.3%,熔点:231.5-234.7℃,1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.70(s,1h),7.53
–
7.32(m,7h),6.69(s,1h),5.06(s,2h),4.63(q,j=6.4hz,2h),4.39(t,j=6.9hz,2h),3.99(s,3h),3.11(q,j=6.5,5.9hz,2h),2.15(s,3h),2.00
–
1.86(m,2h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
28h31
f3n7o
6+
[m+h]
+
618.2282,found618.2281.purity:95.59%by hplc(meoh/h2o=80:20).
[0139]
实施例20:化合物20的制备
[0140]
合成步骤同实施例6,不同的是用化合物4-(羟甲基)苯甲酰胺替换化合物6-1b。
[0141]
化合物20的收率为17.2%,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.01(d,j=15.8hz,2h),7.88(d,j=8.0hz,2h),7.70(s,1h),7.41(d,j=8.0hz,6h),6.70(s,1h),5.09(s,2h),4.64(q,j=7.3hz,2h),4.40(t,j=7.0hz,2h),3.99(s,3h),3.21
–
3.04(m,2h),2.17(s,3h),2.06
–
1.88(m,2h),1.38(t,j=7.0hz,3h).hrms(esi):calcd for c
28h33
n8o
6+
[m+h]
+
577.2518,found577.25147.purity:98.22%by hplc(meoh/h2o=80:20).
[0142]
实施例21:化合物21的制备
[0143]
合成步骤同实施例6,不同的是用化合物2-甲基苯甲醇替换化合物6-1b。
[0144]
化合物21的收率为7.5%,熔点:131.4-132.7℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.04(s,1h),7.70(d,j=1.3hz,1h),7.44
–
7.08(m,7h),6.69(s,1h),4.99(s,2h),4.63(q,j=7.1hz,2h),4.38(t,j=7.2hz,2h),3.98(s,3h),3.11(q,j=6.3hz,3h),2.30(s,3h),2.16(s,3h),1.99
–
1.86(m,2h),1.38(t,j=5.2hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2626.purity:97.42%by hplc(meoh/h2o=80:20).
[0145]
实施例22:化合物22的制备
[0146]
合成步骤同实施例6,不同的是用化合物2-氟苄醇替换化合物6-1b。
[0147]
化合物22的收率为19.2%,熔点:206.4-209.8℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.11
–
8.00(m,1h),7.70(s,1h),7.50
–
7.36(m,4h),7.27
–
7.08(m,3h),6.70(s,1h),5.06(s,2h),4.64(q,j=6.8,6.3hz,2h),4.40(t,j=7.0hz,2h),3.99(s,3h),3.12(q,j=6.6,5.9hz,2h),2.17(s,3h),1.95(p,j=7.9,7.0hz,2h),1.38(t,j=7.0hz,3h).hrms(esi):calcd for c
27h31
fn7o
5+
[m+h]
+
552.2365,found552.2372.purity:98.635%by hplc(meoh/h2o=80:20).
[0148]
实施例23:化合物23的制备
[0149]
合成步骤同实施例6,不同的是用化合物2-氯苄醇替换化合物6-1b。
[0150]
化合物23的收率为13.5%,熔点:142.1-152.1℃,1h nmr(300mhz,chloroform-d)δ12.48(s,1h),7.45
–
7.33(m,4h),7.30
–
7.24(m,2h),6.84(s,1h),6.16(t,j=6.5hz,1h),5.27(s,2h),4.69(q,j=7.1hz,2h),4.56(t,j=6.1hz,2h),4.06(s,3h),3.20(q,j=5.6hz,2h),2.09(s,5h),1.50(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
cln7o
5+
[m+h]
+
568.2070,found568.2069.purity:%by hplc(meoh/h2o=80:20).
[0151]
实施例24:化合物24的制备
[0152]
合成步骤同实施例6,不同的是用化合物2-溴苄醇替换化合物6-1b。
[0153]
化合物24的收率为12.1%,熔点:158.8-164.0℃,1h nmr(300mhz,chloroform-d)δ12.47(s,1h),7.60(d,j=7.4hz,1h),7.41(s,1h),7.38
–
7.28(m,3h),7.21(ddd,j=8.8,6.1,3.0hz,1h),6.84(s,1h),6.18(s,1h),5.24(s,2h),4.69(q,j=7.1hz,2h),4.57(t,j=6.1hz,2h),4.06(s,3h),3.20(q,j=6.4,5.9hz,2h),2.19
–
2.03(m,5h),1.50(t,j=7.1hz,3h).hrms(esi):calcd for c
27h30
n9o
4+
[m+h]
+
544.2415,found544.2424.purity:95.09%by hplc(meoh/h2o=80:20).
[0154]
实施例25:化合物25的制备
[0155]
合成步骤同实施例6,不同的是用化合物2-甲氧基苯甲醇替换化合物6-1b。
[0156]
化合物25的收率为13.2%,熔点:122.0-125.4℃,1h nmr(300mhz,chloroform-d)δ12.45(s,1h),7.40(s,1h),7.38
–
7.31(m,2h),7.02
–
6.88(m,2h),6.85(s,1h),6.03
–
5.91(m,1h),5.22(s,2h),4.70(q,j=7.1hz,2h),4.55(t,j=6.1hz,2h),4.06(s,3h),3.86(s,3h),3.20(q,j=6.1hz,2h),2.12(d,j=9.2hz,5h),1.50(t,j=7.1hz,3h).hrms(esi):calcd for c
28h34
n7o
6+
[m+h]
+
564.2565,found564.2568.purity:95.10%by hplc(meoh/h2o=80:20).
[0157]
实施例26:化合物26的制备
[0158]
合成步骤同实施例6,不同的是用化合物2-(三氟甲基)苯甲醇替换化合物6-1b。
[0159]
化合物26的收率为22.3%,熔点:159.0-164.0℃,1h nmr(300mhz,chloroform-d)δ12.49(s,1h),7.70(d,j=7.7hz,1h),7.48(ddd,j=36.9,19.4,10.1hz,5h),6.83(s,1h),6.23(t,j=6.2hz,1h),5.36(s,2h),4.68(q,j=7.1hz,2h),4.56(t,j=6.0hz,2h),4.06(s,2h),3.19(q,j=6.2hz,2h),2.10(s,2h),2.03(s,2h),1.48(q,j=6.9hz,3h),1.40
–
1.25(m,1h),0.97
–
0.84(m,1h),0.11(s,1h).hrms(esi):calcd for c
28h31
f3n7o
5+
[m+h]
+
602.2333,found602.2342.purity:95.02%by hplc(meoh/h2o=80:20).
[0160]
实施例27:化合物27的制备
[0161]
合成步骤同实施例6,不同的是用化合物3-甲基苯甲醇替换化合物6-1b。
[0162]
合成化合物27的收率为12.2%,熔点:132.2-145.6℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.03(s,1h),7.69(d,j=1.3hz,1h),7.47
–
7.06(m,7h),6.68(s,1h),5.03(s,2h),4.64(q,j=7.0hz,2h),4.39(t,j=7.0hz,2h),3.98(s,3h),3.11(q,j=6.3hz,2h),2.30(s,3h),2.15(s,3h),1.93(p,j=7.2,6.7hz,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
28h34
n7o
5+
[m+h]
+
548.2616,found548.2614.purity:97.42%by hplc(meoh/h2o=80:20).
[0163]
实施例28:化合物28的制备
[0164]
合成步骤同实施例6,不同的是用化合物3-氟苄醇替换化合物6-1b。
[0165]
化合物41的收率为18.8%,熔点:200.6-203.7℃,1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.11
–
8.00(m,1h),7.70(s,1h),7.50
–
7.36(m,4h),7.27
–
7.08(m,3h),6.70(s,1h),5.06(s,2h),4.64(q,j=6.8,6.3hz,2h),4.40(t,j=7.0hz,2h),3.99(s,3h),3.12(q,j=6.6,5.9hz,2h),2.17(s,3h),1.95(p,j=7.9,7.0hz,2h),1.38(t,j=7.0hz,3h).hrms
(esi):calcd for c
27h31
fn7o
5+
[m+h]
+
552.2365,found552.2376.purity:97.74%by hplc(meoh/h2o=80:20).
[0166]
实施例29:化合物29的制备
[0167]
合成步骤同实施例6,不同的是用化合物3-氯苄醇替换化合物6-1b。
[0168]
化合物29的收率为11.5%,熔点:147.3-150.6℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.04(s,1h),7.70(s,1h),7.52
–
7.27(m,7h),6.69(s,1h),5.04(s,2h),4.64(q,j=7.1hz,2h),4.39(t,j=7.1hz,2h),3.99(s,3h),3.12(q,j=6.4hz,2h),2.16(s,3h),1.94(p,j=12.7,5.4hz,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
cln7o
5+
[m+h]
+
568.2070,found568.2080.purity:98.47%by hplc(meoh/h2o=80:20).
[0169]
实施例30:化合物30的制备
[0170]
合成步骤同实施例6,不同的是用化合物3-溴苄醇替换化合物6-1b。
[0171]
化合物30的收率为10.2%,熔点:130.5-133.9℃,1h nmr(300mhz,chloroform-d)δ12.47(s,1h),7.60(d,j=7.4hz,1h),7.41(s,1h),7.38
–
7.28(m,3h),7.21(ddd,j=8.8,6.1,3.0hz,1h),6.84(s,1h),6.18(s,1h),5.24(s,2h),4.69(q,j=7.1hz,2h),4.57(t,j=6.1hz,2h),4.06(s,3h),3.20(q,j=6.4,5.9hz,2h),2.19
–
2.03(m,5h),1.50(t,j=7.1hz,3h).hrms(esi):calcd for c
27h31
brn7o
5+
[m+h]
+
612.1567,found 614.1550.purity:95.29%by hplc(meoh/h2o=80:20).
[0172]
实施例31:化合物31的制备
[0173]
合成步骤同实施例6,不同的是用化合物3-甲氧基苯甲醇替换化合物6-1b。
[0174]
化合物31的收率为13.2%,熔点:180.7-187.4℃,1h nmr(300mhz,chloroform-d)δ12.48(s,1h),7.41(s,1h),7.31(dd,j=15.1,7.2hz,3h),6.99
–
6.83(m,4h),6.16
–
6.05(m,1h),5.13(s,2h),4.69(q,j=7.1hz,2h),4.55(t,j=6.1hz,2h),4.05(s,3h),3.83(s,3h),3.18(q,j=5.8hz,2h),2.15(s,3h),2.12
–
2.04(m,2h),1.50(t,j=14.2hz,3h).hrms(esi):calcd for c
28h34
n7o
6+
[m+h]
+
564.2565,found564.2578.purity:95.51%by hplc(meoh/h2o=80:20).
[0175]
实施例32:化合物32的制备
[0176]
合成步骤同实施例6,不同的是用化合物3-(三氟甲基)苯甲醇替换化合物6-1b。
[0177]
化合物45的收率为8.2%,熔点:138.9-142.2℃,1h nmr(300mhz,dmso-d6)δ12.86(s,1h),8.04(s,1h),7.75
–
7.61(m,5h),7.49
–
7.35(m,3h),6.69(s,1h),5.14(d,j=2.7hz,2h),4.63(q,j=7.3,6.9hz,2h),4.39(t,j=7.0hz,2h),3.98(s,3h),3.20
–
3.03(m,2h),2.15(s,3h),2.02
–
1.85(m,2h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
28h31
f3n7o
5+
[m+h]
+
602.2333,found602.2342.purity:95.29%by hplc(meoh/h2o=80:20).
[0178]
实施例33:化合物33的制备
[0179]
合成步骤同实施例6,不同的是用化合物3,5-二氯苯甲醇替换化合物6-1b。
[0180]
化合物33的收率为20.1%,熔点:115.3-125.3℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.04(s,1h),7.70(s,1h),7.61
–
7.55(m,1h),7.49(t,j=5.7hz,1h),7.45
–
7.31(m,4h),6.68(s,1h),5.04(s,2h),4.64(q,j=7.0hz,2h),4.41(d,j=7.2hz,2h),3.99(s,3h),3.22
–
3.02(m,2h),2.16(s,3h),2.08
–
1.80(m,2h),1.38(t,j=7.0hz,3h).hrms(esi):calcd for c
27h30
cl2n7o
5+
[m+h]
+
602.1680,found 602.1683.purity:97.71%by hplc
(meoh/h2o=80:20).
[0181]
实施例34:化合物34的制备
[0182]
合成步骤同实施例6,不同的是用化合物3,4-二氯苄醇替换化合物6-1b。
[0183]
化合物34的收率为9.2%,熔点:127.2-130.5℃,1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.04(s,1h),7.70(s,1h),7.67
–
7.61(m,2h),7.49
–
7.31(m,4h),6.68(s,1h),5.03(s,2h),4.63(q,j=6.5hz,2h),4.39(t,j=6.6hz,2h),3.99(s,3h),3.20
–
3.04(m,2h),2.16(s,3h),1.94(p,j=7.2hz,2h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
27h30
cl2n7o
5+
[m+h]
+
602.1680,found602.1681.purity:97.85%by hplc(meoh/h2o=80:20).
[0184]
实施例35:化合物35的制备
[0185]
合成步骤同实施例6,不同的是用化合物2,4-二氯苄醇替换化合物6-1b。
[0186]
化合物35的收率为11.3%,熔点:219.1-222.5℃,1h nmr(300mhz,dmso-d6)δ12.87(s,1h),8.03(s,1h),7.69(d,j=5.2hz,2h),7.53
–
7.44(m,3h),7.41(d,j=1.3hz,2h),6.69(s,1h),5.08(s,2h),4.63(q,j=6.6hz,2h),4.43
–
4.32(m,2h),3.99(s,3h),3.11(q,j=6.6,6.1hz,2h),2.16(s,3h),2.02
–
1.86(m,2h),1.37(t,j=7.0hz,3h).hrms(esi):calcd for c
27h30
cl2n7o
5+
[m+h]
+
602.1680,found602.1685.purity:95.46%by hplc(meoh/h2o=80:20).
[0187]
实施例36:化合物36的制备
[0188]
合成步骤同实施例6,不同的是用化合物2,3-二氟苄醇替换化合物6-1b。
[0189]
化合物36的收率为23.2%,熔点:209.4-211.2℃,1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.69(s,1h),7.51
–
7.35(m,4h),7.31
–
7.17(m,2h),6.68(s,1h),5.12(s,2h),4.64(q,j=6.9hz,2h),4.38(t,j=7.4hz,2h),3.99(s,3h),3.11(q,j=6.1hz,2h),2.17(s,3h),2.00
–
1.85(m,2h),1.37(t,j=7.1hz,3h).hrms(esi):calcd for c
27h30
f2n7o
5+
[m+h]
+
570.2271,found570.2271.purity:99.34%by hplc(meoh/h2o=80:20).
[0190]
实施例37:化合物37的制备
[0191][0192]
步骤1:合成化合物37-2
[0193]
将化合物37-1(2g,19.39mmol)溶于无水甲醇中,冰浴条件下,将氯化亚砜(5.768g,48.48mmol)于滴液漏斗中缓慢滴加(30min)至体系中,随后撤去冰浴,室温反应2h。待反应完全后,浓缩除去多余的甲醇和氯化亚砜,反应瓶中的固体用乙醚重悬,过滤,所得白色固体即为化合物37-2,收率为96%。1h nmr(300mhz,dmso-d6)δ8.14(s,3h),2.91
–
2.72(m,2h),2.47(t,j=7.5hz,2h),1.84(p,j=7.6hz,2h).
[0194]
步骤2:合成化合物37-3~化合物37-6
[0195]
按照实施例4步骤合成化合物37-3~化合物37-6,不同之处在于用化合物37-2替换化合物4-1a。
[0196]
化合物37-3的收率为38%,1h nmr(300mhz,chloroform-d)δ8.34(s,1h),8.18(d,j=1.9hz,1h),7.54(d,j=2.0hz,1h),7.31(s,2h),3.95(s,3h),3.79(t,j=7.0hz,2h),3.73(s,3h),2.47(t,j=7.3hz,2h),2.02(p,j=7.2hz,2h).
[0197]
化合物37-4的收率为23.1%,1h nmr(300mhz,dmso-d6)δ7.66(s,1h),7.02(s,1h),6.90(d,j=1.8hz,1h),6.83(d,j=1.9hz,1h),4.72(s,2h),3.80(s,3h),3.62(s,3h),3.44
–
3.28(m,1h),3.00(s,2h),2.46
–
2.32(m,2h),1.79
–
1.61(m,2h).
[0198]
化合物37-5的收率为52.7%,1h nmr(300mhz,dmso-d6)δ7.85(s,1h),7.44(d,j=1.4hz,1h),7.23
–
7.07(m,2h),6.48(s,2h),4.20(t,j=7.0hz,2h),3.91(s,3h),3.60(s,
3h),2.34(t,j=7.4hz,2h),1.94(p,j=7.2hz,2h).
[0199]
化合物37-6的收率为43.7%,1h nmr(300mhz,dmso-d6)δ12.86(s,1h),8.04(s,1h),7.69(s,1h),7.50
–
7.27(m,2h),6.68(s,1h),4.64(q,j=7.1hz,2h),4.42(t,j=6.5hz,2h),4.01(s,3h),3.52(s,3h),2.40(t,j=7.0hz,2h),2.21(s,3h),2.15
–
1.96(m,2h),1.38(t,j=7.1hz,3h).
[0200]
步骤3:合成化合物37-7
[0201]
按照实施例1的步骤7合成化合物37-7,不同的是用化合物37-6替换化合物1-8a。
[0202]
化合物37-7的收率为79.2%,1h nmr(300mhz,dmso-d6)δ12.86(s,1h),12.09(s,1h),8.03(s,1h),7.69(s,1h),7.45
–
7.34(m,2h),6.70(s,1h),4.64(q,j=6.8hz,2h),4.41(t,j=6.7hz,2h),4.01(s,3h),2.32(t,j=7.1hz,2h),2.20(s,3h),2.03(p,j=6.7hz,2h),1.37(t,j=7.0hz,3h).
[0203]
步骤4:合成化合物37
[0204]
在化合物37-7(0.36g,0.84mmol)的dmf溶液中加入hatu(0.32g,0.84mmol)及dipea(0.33g,2.52mmol),室温搅拌30min后,加入化合物37-8(0.11g,0.7mmol),室温过夜反应。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nh4cl溶液和饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物37。收率为32.6%,熔点:231.6-234.4℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),10.07(d,j=1.9hz,1h),9.88(s,1h),8.06(s,1h),7.70(s,1h),7.51
–
7.19(m,6h),6.70(s,1h),4.71
–
4.56(m,2h),4.42(s,2h),4.00(s,3h),3.48(s,2h),2.20(s,3h),2.10
–
1.96(m,2h),1.38(t,j=7.1hz,3h).hrms(esi):calcd for c
28h33
n8o
5+
[m+h]
+
561.2568,found561.2574.purity:95.95%by hplc(meoh/h2o=80:20).
[0205]
实施例38:化合物38的制备
[0206]
将化合物37(44mg,0.079mmol)与伯吉斯试剂(30mg,0.118mmol)的无水thf溶液至于封管中,120℃过夜反应。待反应完全后,浓缩,制砂,经柱层析纯化得到化合物52。化合物52的收率为12.1%,熔点:234.7-229.5℃。
[0207]1h nmr(300mhz,dmso-d6)δ12.95(s,1h),7.52(s,1h),7.41
–
7.22(m,7h),6.66(s,1h),4.61(q,j=7.1hz,2h),4.48(t,j=6.6hz,2h),4.15(s,2h),3.94(s,3h),2.92(t,j=7.2hz,2h),2.22(d,j=12.5hz,5h),1.36(t,j=14.0hz,3h).hrms(esi):calcd for c
28h31
n8o
4+
[m+h]
+
543.2463,found543.2463.purity:95.08%by hplc(meoh/h2o=80:20).
[0208]
实施例39:化合物39的制备
[0209]
[0210]
步骤1:合成化合物39-2b
[0211]
将化合物盐酸羟胺(1.47g,21mmol),碳酸钾(2.9g,21mmol)溶于无水乙醇中,室温搅拌30min后,加入化合物53-1b(1g,8.5mmol),加热回流过夜反应。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用稀盐酸和饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到绿色油状物,即为化合物39-2b。收率为60.9%。1h nmr(300mhz,dmso-d6)δ8.91(s,1h),7.36
–
7.20(m,5h),5.40(s,2h),3.29(s,2h).
[0212]
步骤2:合成化合物39
[0213]
将化合物37-7(201mg,0.47mmol),化合物39-2b(63mg,0.42mmol)和dmap/4-二甲氨基吡啶(4mg,0.0336mmol)放入封管中,无水乙腈作为溶剂,并于冰浴条件下,将dcc(97mg,0.47mmol)分批加入到体系中,然后撤去冰浴,室温下反应1h。随后于120℃过夜反应。待反应完全后,过滤,滤液浓缩,制砂,经柱层析纯化得到化合物39。收率为6.8%。熔点:181.0-183.1℃。1h nmr(300mhz,dmso-d6)δ12.86(s,1h),8.04(s,1h),7.78
–
7.60(m,1h),7.40(d,j=1.4hz,2h),7.36
–
7.19(m,5h),6.63(s,1h),4.62(q,j=7.0hz,2h),4.47(t,j=6.6hz,2h),4.00(s,2h),3.93(s,3h),3.02(t,j=7.1hz,2h),2.35
–
2.23(m,2h),2.19(s,3h),1.36(t,j=7.1hz,3h).hrms(esi):calcd for c
28h31
n8o
4+
[m+h]
+
543.2463,found543.2466.purity:99.39%by hplc(meoh/h2o=80:20).
[0214]
实施例40:化合物40的制备
[0215][0216]
步骤1:合成化合物40-7a
[0217]
按照实施例37步骤合成化合物40-7a,不同之处在于用化合物40-1a替换化合物37-1,用化合物40-2b替换化合物37-8。
[0218]
化合物40-2a的收率为96%。1h nmr(300mhz,dmso-d6)δ8.30(s,3h),4.12(q,j=7.1hz,2h),3.01(t,j=7.2hz,2h),2.74(t,j=7.1hz,2h),1.22(t,j=7.1hz,3h).
[0219]
化合物40-3a的收率为33.1%。1h nmr(300mhz,dmso-d6)δ8.23(d,j=1.9hz,1h),8.08(s,1h),7.82(t,j=6.3hz,1h),7.60(d,j=2.0hz,1h),7.39(s,1h),4.12
–
3.99(m,2h),3.91(s,3h),3.74(q,j=6.4hz,2h),2.64(t,j=6.4hz,2h),1.16(t,j=7.1hz,3h).
[0220]
化合物40-4a的收率为32.8%。1h nmr(300mhz,dmso-d6)δ7.69(s,1h),7.05(s,
1h),6.88(d,j=1.8hz,1h),6.80(d,j=1.8hz,1h),4.85(s,2h),4.10(q,j=7.1hz,2h),3.95(t,j=7.3hz,1h),3.78(s,3h),3.19
–
3.08(m,2h),2.55
–
2.44(m,2h),1.22(t,j=7.1hz,3h).
[0221]
化合物40-5a的收率为62.2%。1h nmr(300mhz,dmso-d6)δ7.85(s,1h),7.43(d,j=1.3hz,1h),7.15(d,j=1.3hz,1h),6.48(s,2h),4.40(t,j=7.3hz,2h),4.07(q,j=7.1hz,2h),3.90(s,3h),2.74(t,j=7.3hz,2h),1.17(t,j=7.1hz,3h).
[0222]
化合物40-6a的收率为40.1%。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.05(s,1h),7.69(s,1h),7.42(s,2h),6.65(s,1h),4.73
–
4.56(m,4h),4.04
–
3.91(m,5h),2.81(t,j=7.0hz,2h),2.20(s,3h),1.37(t,j=7.1hz,3h),1.08(t,j=7.1hz,3h).
[0223]
化合物40-7a的收率为69.3%。1h nmr(300mhz,dmso-d6)δ12.87(s,1h),8.04(s,1h),7.71(s,1h),7.42(d,j=14.6hz,2h),6.69(s,1h),4.76
–
4.53(m,4h),4.03(d,j=3.7hz,3h),2.79(t,j=7.3hz,2h),2.22(s,3h),1.41(t,j=6.2hz,3h).
[0224]
步骤2:合成化合物40-2b
[0225]
按照实施例39的步骤1合成化合物40-2b,不同的是用化合物40-1b替换化合物39-1b。
[0226]
化合物40-2b的收率为63.7%。1h nmr(300mhz,dmso-d6)δ8.81(s,1h),7.41
–
7.10(m,5h),5.47(s,2h),2.94
–
2.77(m,2h),2.38
–
2.21(m,2h).
[0227]
步骤3:合成化合物40
[0228]
按照实施例39的步骤2合成化合物40,不同的是用化合物40-2b替换化合物39-2b,用化合物40-7a替换化合物37-7。
[0229]
化合物40的收率为10.2%。熔点:182.3-188.1℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.05(s,1h),7.71(d,j=1.3hz,1h),7.39(dd,j=14.7,1.4hz,2h),7.32
–
7.13(m,7h),6.61(d,j=5.1hz,1h),4.75(t,j=6.4hz,2h),4.61(q,j=7.1hz,2h),3.96(d,j=1.4hz,3h),3.50
–
3.40(m,4h),2.79(t,j=3.8hz,2h),2.19(s,3h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
27h29
n8o
5+
[m+h]
+
545.2255,found 545.2255.purity:95.33%by hplc(meoh/h2o=80:20).
[0230]
实施例41:化合物41的制备
[0231][0232]
按照实施例37的步骤3-4合成化合物41,不同之处在于用化合物40-7a替换化合物37-7,用化合物41-1替换化合物37-8;用化合物41-2替换化合物37。
[0233]
化合物41的收率为12.3%。熔点:262.7-265.6℃。1h nmr(300mhz,dmso-d6)δ12.98(s,1h),9.89(s,1h),9.24(s,1h),7.54(s,1h),7.41(s,6h),6.70(d,j=8.3hz,1h),5.12(s,2h),4.75
–
4.45(m,4h),3.99(d,j=17.5hz,3h),2.71(t,j=9.0hz,2h),2.21(s,3h),1.38(t,j=7.2hz,3h).hrms(esi):calcd for c
28h31
n8o
4+
[m+h]
+
543.2463,found.purity:
95.215%by hplc(meoh/h2o=80:20).
[0234]
实施例42:化合物42的制备
[0235]
合成方法同实施例41,不同的是用化合物3-苯基丙酰肼替换化合物41-1。
[0236]
化合物42的收率为11.8%。熔点:251.6-253.7℃。1h nmr(300mhz,dmso-d6)δ12.96(s,1h),10.00(d,j=2.2hz,1h),9.86(d,j=2.2hz,1h),7.54(s,1h),7.40(s,1h),7.35
–
7.16(m,7h),6.71(s,1h),4.61(dd,j=13.4,6.2hz,4h),4.01(s,3h),2.85(t,j=7.7hz,2h),2.72(t,j=6.9hz,2h),2.49
–
2.42(m,2h),2.21(s,3h),1.40
–
1.35(m,3h).hrms(esi):calcd for c
28h31
n8o
4+
[m+h]
+
543.2463,found543.2469.purity:97.84%by hplc(meoh/h2o=80:20).
[0237]
实施例43:化合物43的制备
[0238][0239]
在化合物6-1a(200mg,0.4mmol)的二氯甲烷溶液(4ml)中加入1ml三氟乙酸,搅拌1h后,浓缩除去溶剂及三氟乙酸,随后加入适量甲苯再次浓缩以除去残留的溶剂。之后加入化合物43-1(66.4mg,0.295mmol),碳酸铯(384mg,1.18mmol),pd2(bda)3(2%mol),xantphos(6%mol)和无水dmf溶剂,n2保护,100℃过夜反应。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物43。收率为15.3%。熔点:251.6-253.7℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.03(s,1h),7.89(t,j=5.7hz,1h),7.81
–
7.76(m,2h),7.70(d,j=1.3hz,1h),7.55(q,j=2.9hz,3h),7.45
–
7.34(m,2h),6.67(s,1h),4.61(q,j=7.1hz,1h),4.47(t,2h),3.98(d,j=2.8hz,3h),3.37(m,2h),2.13(m,5h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
27h30
n9o
4+
[m+h]
+
544.2415,found544.2424.purity:97.12%by hplc(meoh/h2o=80:20).
[0240]
实施例44:化合物44的制备
[0241]
合成方法同实施例43,不同的是用化合物44-1替换化合物43-1。
[0242]
化合物44的收率为18.4%。熔点:244.1-249.4℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.04(s,1h),7.72(s,1h),7.52(t,j=5.9hz,1h),7.48
–
7.33(m,5h),7.25(s,1h),7.24
–
7.13(m,1h),6.68(s,1h),4.62(q,j=7.1hz,2h),4.47(t,j=7.1hz,2h),3.97(s,3h),3.34(q,j=6.6hz,2h),3.11(q,j=7.3hz,2h),2.13(d,j=14.6hz,5h),1.36(t,j=7.0hz,3h).hrms(esi):calcd for c
28h31
n8o
4+
[m+h]
+
543.2463,found543.2476.purity:96.92%by hplc(meoh).
[0243]
实施例45:化合物45的制备
[0244][0245]
步骤1:合成化合物45-3
[0246]
将化合物45-1(2g,16.13mmol),化合物45-2(3.46g,17.75mmol)和碳酸钾(4.45g,32.26mmol)溶于甲醇(40ml)中,室温搅拌3h。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物45-3。收率为74.4%。1h nmr(300mhz,dmso-d6)δ8.58(s,1h),7.81(td,j=7.7,1.9hz,1h),7.57(d,j=3.7hz,1h),7.51
–
7.32(m,3h).
[0247]
步骤2:合成化合物45-4
[0248]
将化合物45-3(0.5g,6.13mmol),化合物1,2-二溴四氟乙烷(3.19g,12.3mmol)和化合物叔丁醇锂(0.98g,12.3mmol)溶于无水dmf与无水间二甲苯(1:1)的混合溶剂中,n2保护,60℃反应1h。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物45-4。收率为40.3%。1h nmr(300mhz,dmso-d6)δ7.82(tt,j=7.7,1.8hz,1h),7.67(dd,j=3.5,1.5hz,1h),7.61
–
7.40(m,3h).
[0249]
步骤3:合成化合物45
[0250]
在化合物6-1a(200mg,0.4mmol)的二氯甲烷溶液(4ml)中加入1ml三氟乙酸,搅拌1h后,浓缩除去溶剂及三氟乙酸。随后加入化合物45-4(150mg,0.38mmol),碳酸钾(207mg,1.5mmol)和dmf溶剂,108℃反应3h。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物45。收率为38.7%。熔点:157.5-160.9℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.03(s,1h),7.75
–
7.64(m,2h),7.49
–
7.35(m,3h),7.27(pd,j=6.9,6.4,3.5hz,3h),7.13(d,j=3.8hz,1h),6.67(s,1h),4.61(q,j=7.1hz,2h),4.47(t,j=7.1hz,2h),3.97(s,3h),3.35(d,j=6.3hz,2h),2.13(s,3h),2.09(d,j=7.1hz,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
28h30
fn8o
4+
[m+h]
+
561.2369,found 561.2363.purity:94.96%by hplc(meoh/h2o=80:20).
[0251]
实施例46:化合物46的制备
[0252]
合成步骤同实施例45,不同的是用化合物3-氟苯甲醛替换化合物45-1。
[0253]
化合物46的收率为43.3%。熔点:128.6-131.3℃。1h nmr(300mhz,dmso-d6)δ8.02(s,1h),7.70(s,1h),7.61(t,j=5.8hz,1h),7.46
–
7.32(m,4h),7.31
–
7.20(m,2h),7.03(t,j=8.4hz,1h),6.67(s,1h),4.61(d,j=7.3hz,2h),4.46(t,j=7.1hz,2h),3.97(d,j=1.7hz,3h),3.32(s,2h),2.14(d,j=1.7hz,3h),2.13
–
2.05(m,2h),1.35(td,j=7.1,
1.7hz,3h).hrms(esi):calcd for c
28h30
fn8o
4+
[m+h]
+
561.2369,found 561.2368.purity:95.37%by hplc(meoh/h2o=80:20).
[0254]
实施例47:化合物47的制备
[0255]
合成步骤同实施例45,不同的是用化合物4-氟苯甲醛替换化合物45-1。
[0256]
化合物47的收率为41.2%,熔点:244.1-249.4℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.02(s,1h),7.71(d,j=1.3hz,1h),7.57
–
7.43(m,3h),7.43
–
7.33(m,2h),7.31
–
7.12(m,3h),6.67(s,1h),4.62(q,j=7.0hz,2h),4.47(t,j=7.0hz,2h),3.97(s,3h),3.35
–
3.25(m,2h),2.15(s,3h),2.14
–
2.03(m,2h),1.36(t,j=7.0hz,3h).hrms(esi):calcd for c
28h30
fn8o
4+
[m+h]
+
561.2369,found561.2373.purity:96.89%by hplc(meoh/h2o=80:20).
[0257]
实施例48:化合物48的制备
[0258]
合成步骤同实施例45,不同的是用化合物2,3-二氟苯甲醛替换化合物45-1。
[0259]
化合物48的收率为24.9%,熔点:225.8-229.2℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.02(s,1h),7.79(t,j=5.7hz,1h),7.70(d,j=1.3hz,1h),7.41(d,j=1.5hz,2h),7.33
–
7.18(m,4h),6.66(s,1h),4.61(q,j=7.0hz,2h),4.47(t,j=7.1hz,2h),3.97(s,3h),3.12(q,j=6.1hz,2h),2.14(s,3h),2.12
–
2.05(m,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
28h29
f2n8o
4+
[m+h]
+
579.2274,found579.2280.purity:95.91%by hplc(meoh/h2o=80:20).
[0260]
实施例49:化合物49的制备
[0261]
合成步骤同实施例45,不同的是用化合物2,4-二氟苯甲醛替换化合物45-1。
[0262]
化合物49的收率为34.7%。熔点:129.9-132.8℃。1h nmr(300mhz,dmso-d6)δ12.84(s,1h)8.05(s,1h),7.70(d,j=5.0hz,2h),7.50
–
7.33(m,4h),7.16(td,j=8.5,2.6hz,1h),7.10(d,j=3.8hz,1h),6.67(s,1h),4.61(q,j=7.1hz,2h),4.47(t,j=7.1hz,2h),3.97(s,3h),3.34(d,j=6.3hz,2h),2.14(s,3h),2.09(d,j=7.3hz,2h),1.36(d,j=7.0hz,3h).hrms(esi):calcd for c
28h29
f2n8o
4+
[m+h]
+
579.2274,found 579.2271.purity:95.43%by hplc(meoh/h2o=80:20).
[0263]
实施例50:化合物50的制备
[0264]
合成步骤同实施例45,不同的是用化合物2-氯苯甲醛替换化合物45-1。
[0265]
化合物50的收率为36.5%。熔点:132.7-138.6℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.02(s,1h),7.69(d,j=6.6hz,2h),7.58
–
7.48(m,2h),7.46(s,1h),7.42
–
7.33(m,3h),7.24(td,j=7.6,1.6hz,1h),6.67(s,1h),4.61(q,j=7.2hz,2h),4.47(t,j=6.9hz,2h),3.97(s,3h),3.20(s,2h),2.13(s,5h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
27h30
n9o
4+
[m+h]
+
544.2415,found 544.2414.purity:95.12%by hplc(meoh/h2o=80:20).
[0266]
实施例51:化合物51的制备
[0267]
合成步骤同实施例45,不同的是用化合物3-氯苯甲醛替换化合物45-1。
[0268]
化合物51的收率为31.9%。熔点:135.8-143.2℃。1h nmr(300mhz,dmso-d6)δ8.00(d,j=13.0hz,1h),7.70(s,1h),7.63(t,j=5.7hz,1h),7.53(d,j=2.1hz,1h),7.39(q,j=4.5,3.2hz,4h),7.25(dq,j=6.0,3.3,2.6hz,1h),6.67(s,1h),4.61(q,j=7.1hz,2h),4.46(t,j=7.0hz,2h),3.97(s,3h),3.32(s,2h),2.14(s,3h),2.11
–
2.02(m,2h),1.35(t,j
=7.1hz,3h).hrms(esi):calcd for c
28h30
cln8o
4+
[m+h]
+
577.2073,found 577.2073.purity:96.63%by hplc(meoh/h2o=80:20).
[0269]
实施例52:化合物52的制备
[0270]
合成步骤同实施例45,不同的是用化合物4-氯苯甲醛替换化合物45-1。
[0271]
化合物52的收率为42.4%。熔点:141.7-146.6℃。1h nmr(300mhz,dmso-d6)δ12.85(s,-1h),8.00(d,j=14.2hz,1h),7.70(s,1h),7.60(dt,j=12.1,5.7hz,1h),7.43(s,2h),7.42
–
7.33(m,3h),7.31(s,1h),6.66(s,1h),4.61(q,j=7.1hz,2h),4.46(t,j=7.0hz,2h),3.96(s,3h),2.14(s,3h),2.07(dd,j=13.4,6.6hz,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
28h30
cln8o
4+
[m+h]
+
577.2073,found 577.2067.purity:93.45%by hplc(meoh/h2o=80:20).
[0272]
实施例53:化合物53的制备
[0273]
合成步骤同实施例45,不同的是用化合物2-溴苯甲醛替换化合物45-1。
[0274]
化合物53的收率为28.4%,熔点:183.8-185.6℃。1h nmr(300mhz,dmso-d6)δ8.03(s,1h),7.70(tt,j=5.2,2.6hz,3h),7.57
–
7.35(m,5h),7.17(td,j=7.6,1.8hz,1h),6.67(s,1h),4.62(q,j=7.0hz,2h),4.47(t,j=7.1hz,2h),3.97(s,3h),3.35(m,2h)2.13(s,5h),1.35(t,j=7.2hz,3h).hrms(esi):calcd for c
27h30
f2n7o
5+
[m+h]
+
570.2271,found570.2271.purity:95.31%by hplc(meoh/h2o=80:20).
[0275]
实施例54:化合物54的制备
[0276]
合成步骤同实施例45,不同的是用化合物3-溴苯甲醛替换化合物45-1。
[0277]
化合物54的收率为30.6%。熔点:133.4-139.4℃。1h nmr(300mhz,dmso-d6)δ8.01(s,1h),7.73
–
7.56(m,3h),7.48
–
7.24(m,6h),6.65(s,1h),4.59(q,j=7.1hz,2h),4.44(t,j=7.2hz,2h),3.95(d,j=1.9hz,3h),3.30(d,j=7.0hz,2h),2.13(d,j=1.9hz,3h),1.92(d,j=1.7hz,2h),1.42
–
1.28(m,3h).hrms(esi):calcd for c
28h30
brn8o
4+
[m+h]
+
621.1568,found 621.1569and 623.1563.purity:96.47%by hplc(meoh/h2o=80:20).
[0278]
实施例55:化合物55的制备
[0279]
合成步骤同实施例45,不同的是用化合物4-溴苯甲醛替换化合物45-1。
[0280]
化合物55的收率为33.4%。熔点:134.6-136.7℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.02(s,1h),7.70(s,1h),7.63
–
7.53(m,3h),7.43
–
7.35(m,4h),7.33(s,1h),6.67(s,1h),4.61(q,j=7.0hz,2h),4.45(d,j=7.4hz,2h),3.97(s,3h),3.32(d,j=6.3hz,2h),2.15(s,3h),2.12
–
2.03(m,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
28h30
brn8o
4+
[m+h]
+
621.1568,found 621.1572and 623.1544.purity:96.93%by hplc(meoh/h2o=80:20).
[0281]
实施例56:化合物56的制备
[0282]
合成步骤同实施例45,不同的是用化合物2-甲基苯甲醛替换化合物45-1。
[0283]
化合物56的收率为23.1%。熔点:129.6-140.0℃。1h nmr(300mhz,dmso-d6)δ12.81(s,-1h),8.03(s,1h),7.70(s,1h),7.42(d,j=15.1hz,3h),7.33(d,j=7.8hz,2h),7.18(d,j=8.1hz,3h),6.67(s,1h),4.61(q,j=7.1hz,2h),4.45(t,j=7.2hz,2h),3.95(s,3h),3.28(d,j=6.4hz,2h),2.30(s,3h),2.14(s,3h),2.07(t,j=7.1hz,2h),1.35(t,j=7.0hz,3h).hrms(esi):calcd for c
29h33
n8o
4+
[m+h]
+
557.2619,found 557.2617.purity:
95.11%by hplc(meoh/h2o=80:20).
[0284]
实施例57:化合物57的制备
[0285]
合成步骤同实施例45,不同的是用化合物3-甲基苯甲醛替换化合物45-1。
[0286]
化合物57的收率为37.5%,熔点:235.7-240.7℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.02(s,1h),7.70(s,1h),7.48(t,j=5.8hz,1h),7.43
–
7.35(m,2h),7.30(s,1h),7.28
–
7.24(m,2h),7.23(s,1h),7.03(d,j=5.6hz,1h),6.68(s,1h),4.62(q,j=6.0hz,2h),4.47(t,j=7.0hz,2h),3.97(s,3h),3.32(m,2h),2.33(s,3h),2.15(s,3h),2.09(t,j=7.0hz,2h),1.36(t,j=7.0hz,3h).hrms(esi):calcd for c
29h33
n8o
4+
[m+h]
+
557.2619,found557.2628.purity:97.03%by hplc(meoh).
[0287]
实施例58:化合物58的制备
[0288]
合成步骤同实施例45,不同的是用化合物2-三氟甲基苯甲醛替换化合物45-1。
[0289]
化合物58的收率为43.6%。熔点:129.6-133.9℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.01(d,j=15.0hz,1h),7.80(d,j=7.9hz,1h),7.75
–
7.62(m,4h),7.48(t,j=7.2hz,1h),7.43
–
7.36(m,2h),7.15(s,1h),6.67(s,1h),4.61(q,j=7.2hz,2h),4.51
–
4.40(m,2h),3.96(d,j=2.9hz,3h),3.34(d,j=6.3hz,2h),2.12(s,3h),2.10
–
2.02(m,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
29h30
f3n8o
4+
[m+h]
+
611.2337,found 611.2335.purity:98.45%by hplc(meoh/h2o=80:20).
[0290]
实施例59:化合物59的制备
[0291]
合成步骤同实施例45,不同的是用化合物2-腈基苯甲醛替换化合物45-1。
[0292]
化合物59的收率为29.3%。熔点:153.6-158.8℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.02(s,1h),7.74
–
7.66(m,2h),7.64
–
7.55(m,2h),7.46(s,1h),7.42
–
7.33(m,3h),7.24(td,j=7.6,1.6hz,1h),6.67(s,1h),4.61(q,j=7.2hz,2h),4.47(t,j=6.9hz,2h),3.97(s,3h),3.20(s,2h),2.13(s,5h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
29h29
n9nao
4+
[m+na]
+
590.2234,found 590.2231.purity:95.90%by hplc(meoh/h2o=80:20).
[0293]
实施例60:化合物60的制备
[0294]
合成步骤同实施例45,不同的是用化合物3-腈基苯甲醛替换化合物45-1。
[0295]
化合物60的收率为34.1%。熔点:138.6-140.1℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.00(d,j=17.9hz,1h),7.92(s,1h),7.71(d,j=5.9hz,3h),7.60(dt,j=15.4,7.6hz,2h),7.48(d,j=4.5hz,1h),7.40(s,2h),6.67(s,1h),4.60(d,j=8.0hz,2h),4.46(t,j=7.0hz,2h),3.97(d,j=3.8hz,3h),2.14(s,3h),2.09(t,j=7.1hz,2h),1.34(t,j=7.0hz,3h),1.25(d,j=8.3hz,1h).hrms(esi):calcd for c
29h29
n9nao
4+
[m+na]
+
590.2235,found 590.2236.purity:97.31%by hplc(meoh/h2o=80:20).
[0296]
实施例61:化合物61的制备
[0297]
将化合物60(200mg,0.35mmol)与k2co3(34mg,0.25mmol)用dmso溶解,于冰浴条件下,滴加30%h2o2(252ul,2.5mmol),撤去冰浴,常温反应。待反应完全后,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物61。收率为28.6%。熔点:138.6-142.2℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.07
–
7.96(m,3h),7.69(dt,j=4.3,2.6hz,2h),7.59(dd,j=12.9,6.8hz,2h),7.50
–
7.37(m,4h),
7.33(s,1h),6.66(s,1h),4.62(q,j=7.1hz,2h),4.47(t,j=7.0hz,2h),3.97(s,3h),3.34(s,2h),2.13(s,3h),2.08(d,j=8.3hz,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
29h31
n9nao
5+
[m+na]
+
608.2340,found608.2335.purity:95.95%by hplc(meoh/h2o=80:20).
[0298]
实施例62:化合物62的制备
[0299][0300]
步骤1:合成化合物62-2
[0301]
合成步骤同实施例45的步骤1,不同的是用化合物4-硝基苯甲醛替换化合物45-1。
[0302]
化合物62-2的收率为70.6%。1h nmr(300mhz,dmso-d6)δ8.63(s,1h),8.39
–
8.30(m,2h),8.03(d,j=2.5hz,2h),8.00(d,j=2.0hz,1h).
[0303]
步骤2:合成化合物62-3
[0304]
将化合物62-2(1g,5.3mmol)溶于无水thf,氩气保护,-78℃条件下,加入1m lihmds的thf溶液(1.46ml,7.8mmol),搅拌45min后,再加入六氯乙烷(1.5g,6.4mmol),
[0305]
搅拌45min后,升至室温反应6h。待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物62-3。收率为86.3%。1h nmr(300mhz,dmso-d6)δ8.42
–
8.34(m,2h),8.14(s,1h),8.04
–
7.97(m,2h).
[0306]
步骤3:合成化合物62
[0307]
合成步骤同实施例45的步骤3,不同的是用化合物62-3替换化合物45-4。
[0308]
化合物62的收率为35.8%。熔点:139.7-145.6℃。1h nmr(300mhz,dmso-d6)δ12.90(s,1h),8.29
–
8.17(m,2h),8.04(s,1h),7.98(t,j=5.7hz,1h),7.74
–
7.58(m,4h),7.48
–
7.32(m,2h),6.66(s,1h),4.70
–
4.55(m,2h),4.47(t,j=6.8hz,2h),3.97(s,3h),3.36(s,2h),2.14(s,5h),1.34(t,j=7.0hz,3h).hrms(esi):calcd for c
28h29
n9nao
6+
[m+na]
+
610.2133,found 610.2134.purity:96.45%by hplc(meoh/h2o=80:20).
[0309]
实施例63:化合物63的制备
[0310]
合成步骤同实施例62,不同之处在于用化合物3-硝基苯甲醛替换化合物62-1。
[0311]
化合物63的收率为30.3%。熔点:139.7-145.6℃。1h nmr(300mhz,dmso-d6)δ12.88(s,1h),8.02(s,1h),7.74
–
7.66(m,2h),7.64
–
7.55(m,2h),7.46(s,1h),7.42
–
7.33(m,3h),7.24(td,j=7.6,1.6hz,1h),6.67(s,1h),4.61(q,j=7.2hz,2h),4.47(t,j=6.9hz,2h),3.97(s,3h),3.20(s,2h),2.13(s,5h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
28h29
n9nao
6+
[m+na]
+
610.2133,found 610.2165.purity:95.36%by hplc(meoh/h2o=80:20).
[0312]
实施例64:化合物64的制备
[0313]
合成步骤同实施例62,不同之处在于用化合物2-甲酰基苯甲酸甲酯替换化合物62-1。
[0314]
化合物64的收率为28.5%。熔点:148.6-152.2℃。1h nmr(300mhz,dmso-d6)δ12.86(s,1h),12.00(s,1h),8.01(t,j=1.8hz,2h),7.81
–
7.62(m,4h),7.52(t,j=7.8hz,1h),7.39(d,j=2.4hz,3h),6.65(s,1h),4.59(q,j=7.2hz,2h),4.44(d,j=7.5hz,2h),3.96(s,3h),3.88(s,3h),2.11(s,5h),1.34(t,j=7.1hz,3h).hrms(esi):calcd for c
30h33
n8o
6+
[m+h]
+
601.2518,found 601.2517.purity:97.83%by hplc(meoh/h2o=80:20).
[0315]
实施例65:化合物65的制备
[0316]
合成步骤同实施例62,不同之处在于用化合物3-甲酰基苯甲酸甲酯替换化合物62-1。
[0317]
化合物65的收率为32.5%。熔点:158.8-161.6℃。1h nmr(300mhz,dmso-d6)δ12.87(s,1h),8.02(t,j=1.9hz,2h),7.81
–
7.61(m,4h),7.53(t,j=7.8hz,1h),7.40(d,j=3.1hz,3h),6.65(s,1h),4.60(q,j=7.1hz,2h),4.46(t,j=7.1hz,2h),3.96(s,3h),3.89(s,3h),3.33(s,2h),2.11(s,5h),1.34(t,j=7.1hz,3h).hrms(esi):calcd for c
30h32
n8nao
6+
[m+na]
+
623.2337,found 623.2339.purity:96.46%by hplc(meoh/h2o=80:20).
[0318]
实施例66:化合物66的制备
[0319]
由化合物65合成化合物66的合成方法同实施例1的步骤7,不同的是用化合物65替换化合物1-8a。
[0320]
化合物66的收率为34.7%。熔点:240.1-244.3℃.1h nmr(300mhz,dmso-d6)δ12.87(s,1h),8.05(d,j=7.0hz,2h),7.76(d,j=7.7hz,1h),7.71
–
7.57(m,3h),7.47(d,j=7.7hz,1h),7.41(d,j=9.7hz,2h),7.35(s,1h),6.65(s,1h),4.60(q,j=7.3hz,2h),4.45(d,j=7.3hz,2h),3.95(s,3h),2.12(s,3h),2.06(d,j=7.7hz,2h),1.34(t,j=7.1hz,4h).hrms(esi):calcd for c
29h31
n8o
6+
[m+h]
+
587.2361,found 587.2359.purity:95.43%by hplc(meoh/h2o(含0.1%甲酸)=75:25).
[0321]
实施例67:化合物67的制备
[0322][0323]
步骤1:合成化合物67-2
[0324]
合成步骤同实施例62中步骤1,不同之处在于用化合物2-甲酰基苯甲酸甲酯替换化合物62-1。
[0325]
化合物67-2的收率为79.6%。1h nmr(300mhz,dmso-d6)δ8.54(s,1h),8.28(t,j=1.8hz,1h),8.01(ddt,j=20.5,7.9,1.4hz,2h),7.89(s,1h),7.68(t,j=7.8hz,1h),3.92(s,3h).
[0326]
步骤2:合成化合物67-3
[0327]
将化合物67-2(2g,9.84mmol)溶解在meoh,h2o和thf的混合物溶液(1:1:1)中,加入lioh(1.97g,49.20mmol),室温搅拌3h。待反应完全后,浓缩除去挥发性溶剂,加入稀hcl溶液搅拌,过滤,真空干燥,得到白色固体,收率为89.3%。1h nmr(300mhz,dmso-d6)δ13.29(s,1h),8.53(s,1h),8.27(t,j=1.6hz,1h),7.98(ddt,j=14.9,7.9,1.5hz,2h),7.87(d,j=1.4hz,1h),7.64(td,j=7.8,1.7hz,1h).
[0328]
步骤3:合成化合物67-4
[0329]
将化合物67-3(1.26g,6.67mmol),盐酸二甲胺(0.82g,10mmol),pybop(3.47g,6.67mmol)及三乙胺(5.6ml,40.02mmol)溶于dmf溶剂中,室温反应过夜,待反应完全后,浓缩,加水和乙酸乙酯萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物67-3,收率为50.7%。
[0330]
步骤4:合成化合物67
[0331]
由化合物67-4合成化合物67的合成方法同实施例62中步骤2和3,不同之处在于用化合物67-4替换化合物62-2,用化合物67-5替换化合物62-3。
[0332]
化合物67的收率为24.6%。熔点:156.9-159.3。℃1h nmr(300mhz,dmso-d6)δ12.79(s,1h),7.94(s,1h),7.61(s,1h),7.48(t,j=5.8hz,1h),7.42
–
7.35(m,2h),7.34(d,j=1.4hz,1h),7.30(dd,j=7.1,2.5hz,2h),7.27(s,1h),7.11(dt,j=7.2,1.5hz,1h),6.57(s,1h),4.51(d,j=7.3hz,2h),4.36(d,j=7.3hz,2h),3.87(s,3h),3.21(s,2h),2.88(d,j=24.6hz,6h),2.01(d,j=13.7hz,5h),1.26(t,j=7.2hz,3h).hrms(esi):calcd for c
31h35
n9nao
5+
[m+na]
+
636.2653,found 636.2651.purity:96.75%by hplc(meoh/h2o=90:10).
[0333]
实施例68:化合物68的制备
[0334]
合成步骤同实施例45,不同的是用化合物4-吡啶甲醛替换化合物45-1。
[0335]
化合物68收率为36.8%。熔点:237.1-244.2℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.56
–
8.47(m,2h),8.03(s,1h),7.85(t,j=5.8hz,1h),7.71(s,1h),7.61(s,1h),7.47
–
7.31(m,4h),6.66(s,1h),4.62(q,j=7.0hz,2h),4.48(t,j=7.1hz,2h),3.97(s,3h),3.53(d,j=7.5hz,2h),2.15(s,5h),1.37(d,j=7.3hz,3h).hrms(esi):calcd for c
27h30
n9o
4+
[m+h]
+
544.2415,found 544.2414.purity:95.12%by hplc(meoh/h2o=80:20).
[0336]
实施例69:化合物69的制备
[0337]
由化合物6-1a合成化合物69的合成步骤同实施例45的步骤3,不同的是用化合物4-苯基-2-氯嘧啶替换化合物45-4。
[0338]
化合物69的收率为19.3%。熔点:140.9-143.1℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.35(d,j=5.1hz,1h),8.02(s,3h),7.70(s,1h),7.48(s,3h),7.39(s,2h),7.31(q,j=6.0hz,1h),7.14(d,j=5.2hz,1h),6.64(s,1h),4.60(q,j=7.2hz,2h),4.48(s,2h),3.93(s,3h),3.46(s,2h),2.08(d,j=24.7hz,5h),1.33(t,j=7.0hz,3h).hrms(esi):calcd for c
29h32
n9o
3+
[m+h]
+
554.2623,found 554.2622.purity:94.68%by hplc(meoh/h2o=80:20).
[0339]
实施例70:化合物70的制备
[0340]
合成步骤同实施例45,不同的是用化合物2-甲氧基苯甲醛替换化合物45-1。
[0341]
化合物70的收率为31.2%。熔点:149.2-150.4℃。1h nmr(300mhz,dmso-d6)δ8.04(s,1h),7.70(d,j=1.3hz,1h),7.50(t,j=5.8hz,1h),7.39(dd,j=9.3,1.6hz,3h),7.26
–
7.11(m,2h),7.11
–
7.03(m,1h),6.98(td,j=7.5,1.1hz,1h),6.68(s,1h),4.61(q,j=7.1hz,2h),4.46(t,j=7.1hz,2h),3.96(s,3h),3.90(s,3h),3.19(s,2h),2.14(s,3h),2.08(t,j=7.2hz,2h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
29h33
n8o
5+
[m+h]
+
573.2568,found 573.2558.purity:97.35%by hplc(meoh/h2o=80:20).
[0342]
实施例71:化合物71的制备
[0343]
合成步骤同实施例45,不同的是用化合物3-甲氧基苯甲醛替换化合物45-1。
[0344]
化合物71的收率为33.9%。熔点:123.2-133.0℃。1h nmr(300mhz,dmso-d6)δ12.83(s,-1h),7.70(s,1h),7.40(s,2h),7.28(d,j=7.4hz,2h),7.07
–
6.99(m,2h),6.84
–
6.75(m,1h),6.67(s,1h),4.62(q,j=7.1hz,2h),4.46(t,j=7.1hz,2h),3.97(s,3h),3.79(s,3h),2.15(s,3h),2.08(t,j=7.3hz,2h),1.36(t,j=7.0hz,3h).hrms(esi):calcd for c
29h33
n8o
5+
[m+h]
+
573.2568,found 573.2566.purity:96.48%by hplc(meoh/h2o=80:20).
[0345]
实施例72:化合物72的制备
[0346]
合成步骤同实施例45,不同的是用化合物3-叔丁氧基苯甲醛替换化合物45-1。
[0347]
化合物72的收率为29.8%。熔点:158.3-163.9℃。1h nmr(300mhz,dmso-d6)δ12.89(s,1h),8.06(s,1h),7.73(s,1h),7.51
–
7.33(m,5h),7.16(d,j=2.0hz,1h),7.05
–
6.96(m,2h),6.70(s,1h),4.64(d,j=7.4hz,2h),4.49(s,2h),4.00(s,3h),2.16(s,3h),2.13
–
2.03(m,2h),1.34(d,j=1.8hz,12h).hrms(esi):calcd for c
32h39
n8o
5+
[m+h]
+
615.3038,found 615.3042.purity:95.31%by hplc(meoh/h2o=80:20).
[0348]
实施例73:化合物73的制备
[0349]
合成步骤同实施例45,不同的是用化合物3-(三氟甲氧基)苯甲醛替换化合物45-1。
[0350]
化合物73的收率为32.1%。熔点:126.6-135.0℃。1h nmr(300mhz,dmso-d6)δ12.91(s,1h),8.04(s,1h),7.77(t,j=5.9hz,1h),7.71(s,1h),7.56(dd,j=5.8,3.8hz,1h),7.50
–
7.31(m,5h),7.14(s,1h),6.68(s,1h),4.68
–
4.55(m,2h),4.46(d,j=7.2hz,2h),3.97(d,j=2.4hz,3h),3.36(s,2h),2.10(d,j=20.5hz,5h),1.35(t,j=7.1hz,3h).hrms(esi):calcd for c
29h30
f3n8o
5+
[m+h]
+
627.2286,found 627.2280.purity:95.12%by hplc(meoh/h2o=80:20).
[0351]
实施例74:化合物74的制备
[0352][0353]
步骤1:合成化合物74-2
[0354]
合成步骤同实施例45的步骤1,不同的是用化合物3-硝基苯甲醛替换化合物45-1。
[0355]
化合物74-2的收率为78.5%。1h nmr(300mhz,dmso-d6)δ8.56(s,1h),8.26(t,j=1.8hz,1h),8.06(dt,j=7.9,1.5hz,1h),7.92
–
7.82(m,2h),7.71(t,j=7.8hz,1h).
[0356]
步骤2:合成化合物74-3
[0357]
将化合物74-2(2g,10.52mmol)溶于无水甲醇和无水四氢呋喃(1:1)的混合溶剂中,分批加入pd/c(10%),反应体系在氢气环境下室温搅拌过夜。待反应完全后,借助硅藻土进行过滤,滤液浓缩,真空干燥。随后称取1g(6.25mmol)溶于无水dcm溶液中,冰浴条件下,加入乙酰氯(0.54g,6.88mmol)及三乙胺(0.76g,7.5mmol),撤去冰浴,室温反应6h。待反应完全后,加水和dcm萃取,有机层用饱和nacl洗涤,无水na2so4干燥,真空干燥,制砂,经柱层析纯化得到化合物74-3,收率为53.8%。1h nmr(300mhz,dmso-d6)δ10.13(s,1h),8.49(s,1h),8.04(s,1h),7.66(s,1h),7.59
–
7.53(m,1h),7.43(d,j=6.6hz,2h),2.10(s,3h).
[0358]
步骤3:合成化合物74-4
[0359]
合成步骤同实施例62的步骤2,不同的是用化合物74-3替换化合物62-2。
[0360]
化合物74-4的收率为41.9%。1h nmr(300mhz,dmso-d6)δ10.16(s,1h),7.99(d,j=2.8hz,1h),7.77(d,j=2.6hz,1h),7.59(dq,j=7.1,2.3hz,1h),7.49
–
7.38(m,2h),2.10(d,j=2.6hz,3h).
[0361]
步骤4:合成化合物74
[0362]
合成步骤同实施例45的步骤3,不同的是用化合物74-4替换化合物45-4。
[0363]
化合物74的收率为24.6%。熔点:146.2-148.1℃。1h nmr(300mhz,dmso-d6)δ10.11(s,1h),8.07(d,j=16.2hz,1h),7.77(d,j=11.1hz,2h),7.69
–
7.57(m,1h),7.49
–
7.29(m,5h),7.24
–
7.17(m,2h),6.69(d,j=7.6hz,1h),4.68(q,j=6.7hz,2h),4.50(s,2h),4.01(s,3h),3.36(s,2h),2.19(s,3h),2.13(s,5h),1.40(t,j=7.0hz,3h).
[0364]
实施例75:基于293-dual
tm hsting r232细胞测定化合物对sting信号通路的激动活性。
[0365]
实验原理:本实验是通过检测化合物对irf的激活、化合物与干扰素刺激反应元件(interferon stimulated response element,isre)的结合以及干扰素β的表达来评价化合物对sting信号通路的激活。293t-dual
tm hsting-r232细胞(invivogen:293d-r232)是通过在293-dual
tm null(isg/ki-ifnβ)细胞中稳定转染hsting的r232亚型而得到的。它能够稳定表达两种诱导型报告基因:分泌型胚胎碱性磷酸酶(seap)报告基因与分泌型lucia荧光素酶报告基因,其中可以通过使用quanti-blue
tm
试剂(invivogen:rep-qbs,rep-qbs2)读取620nm处的光密度值(od值)来测量seap的水平,进而评估干扰素调节因子(irf3)的诱导激活;还可以通过使用quanti-luc
tm
试剂(invivogen:rep-qlc1,rep-qlc2)读取相对光单位(rlu)来测定lucia荧光素酶的水平,进而评估ifn-β的诱导表达。
[0366]
实验步骤:将293-dual
tm hsting-r232细胞用含penicillin,streptomycin,normocin
tm
,blasticidin,hygromycin及zeocin
tm
抗生素的dmem培养基(加10%胎牛血清fbs)于37℃、5%co2的孵箱中培养至80%-90%密度时,消化离心(1000rpm)收集,而后使用含10%胎牛血清的dmem培养基进行稀释,然后以100μl/孔,每孔1
×
105细胞,接种至96孔透明细胞培养板中,并于37℃孵育18-24h,待细胞达到60-70%贴壁后,将剩余的培养基吸走,加入待测化合物的梯度稀释溶液(按照实验需求稀释10个浓度,设3个重复孔)100μl/孔,于
37℃孵育24h。然后每孔吸取10μl细胞上清液至新的96孔细胞培养板中,再避光加入90μl quanti-blue
tm
溶液,于37℃孵育3h,使用酶标仪读取620nm处的光密度值(od值)来测量seap的水平,进而评估干扰素调节因子(irf3)的诱导激活;另外每孔吸取20μl细胞上清液至白色96孔细胞培养板中,再避光加入50μl quanti-luc
tm
溶液,立即使用发光光度计读取相对光单位(rlu)来测定lucia荧光素酶的水平,进而评估干扰素-β(ifn-β)的诱导表达。半最大效应浓度(ec
50
)通过graphpad prism软件log(激动剂)vs响应-可变斜率拟合计算。
[0367]
实验结果如表1所示,以先导化合物(leadcompound)的活性数据作为对照。先导化合物的结构式为
[0368][0369]
表1.本发明部分化合物对sting信号通路的激动活性
[0370][0371]
由表1可见,本发明的部分化合物能够明显的激活sting信号通路。
[0372]
实施例76:本发明部分化合物激活sting信号通路的机制学研究(一)
[0373]
采用western-blot实验考察本发明部分化合物对sting下游蛋白表达水平的影响。
[0374]
实验步骤:将thp1细胞(human acute monocytic leukemia,invivogen)用含10%胎牛血清的rpmi 1640培养基于37℃、5%co2的孵箱中培养至80%-90%密度时,1000rpm离心收集细胞,稀释后以每孔5
×
104细胞接种至96孔透明细胞培养板中,经待测化合物处理一定的时间后,1000rpm离心收集细胞,pbs洗涤三次后,加入ripa裂解液、蛋白酶抑制剂及磷酸酶抑制剂,冰上裂解15min。裂解完成后,12000rpm离心10min,取上清,使用bca(thermo,waltham,ma)试剂盒测定蛋白浓度。在上清液中加入5
×
loading buffer(体积比(4:1)),混匀后于100℃煮10min,制好的样品可储存于-20冰箱中。将40ug样品分别加入15孔sds-page凝胶上,60v等压运行30min后切换为120v,跑胶完成后将其转至pvdf膜(perkinelmer,northwalk,ct,usa)上,转膜仪等流0.3a运行。随后将pvdf膜经1%bsa封闭1h,再按需求于4℃下过夜孵育相应的抗体,孵育完成后使用tbst洗涤pvdf膜三次,再于室温下与dylight 800标记的二抗孵育1h,孵育完成后再次使用tbst洗涤pvdf膜三次,最后使用ecl发光液显色,并使用odyssey infrared imaging system(li-cor;lincoln,ne)仪器扫描条带,保存并分析。
[0375]
所用抗体信息如下:
[0376]
gapdh(proteintech,1e6d9),sting(cell signaling technology,13647s),p-sting(cell signaling technology,19781s),irf3(proteintech,11312-1-ap),p-irf3(ser386)(abcam,ab76493),tbk1(proteintech,2d7b1),p-tbk1(abcam,ab109272).
[0377]
结果如图1和图2所示,在thp1细胞中,本发明代表化合物能够诱导sting下游蛋白sting,irf3及tbk1的磷酸化,激活sting信号通路。
[0378]
实施例77:本发明部分化合物激活sting信号通路的机制学研究(二)
[0379]
本实验采用实时荧光定量pcr(rt-qpcr)检测sting下游细胞因子的mrna水平变化来评估化合物在细胞水平对sting蛋白的激动作用。
[0380]
实验步骤:将thp1细胞(human acute monocytic leukemia,invivogen)用含10%胎牛血清的rpmi 1640培养基于37、℃5%co2的孵箱中培养至80%-90%密度时,1000rpm离心收集细胞,稀释后以2
×
106细胞/ml密度接种至6孔透明细胞培养板中,并用待测化合物处理一定的时间。孵育结束后,收集细胞,尽可能地除去培养基,然后按照说明书使用rna抽提试剂盒(天根生物,货号dp419)提取rna,再使用hiscript iii rt supermix(gdna wiper)试剂盒(vazyme,货号r323-01)将rna逆转录为cdna,再用chamq sybr qpcr master mix(vazyme,q341-02/03)和引物(以gapdh作为内参)进行rt-qpcr分析,并采用2-δδct
法分析ifn-β及cxcl10 mrna的水平变化来评估化合物在细胞水平对sting蛋白的激动作用。
[0381]
引物序列如下:gapdh-f:aaggctgtgggcaaggtcatc,gapdh-r:aggtggaggagtgggtgtcg;cxcl10-f:atttgctgccttatctttctg,cxcl10-r:cttgatggccttcgattctg;ifnβ-f:cattacctgaaggccaagga,ifnβ-r:agcaattgtccagtcccaga。
[0382]
结果如图3和图4,在thp1细胞中,本发明代表化合物能够诱导sting下游细胞因子ifn-β和cxcl10的mrna表达,激活sting信号通路。
[0383]
实施例78:本发明代表化合物在大鼠体内药代动力学测试
[0384]
实验步骤:将购买的28只sd雌性大鼠,5-6周,体重180-220g(北京斯贝福生物科技
有限公司)随机分为7组(三组静脉注射、两组腹腔注射、两组口服给药),每组4只。各组分别于给药后0.044、0.083、0.167、0.333、0.5、1、2、4、6、8、10、24h取血至少200μl放入含20μl肝素钠ep管内。所有样品在4℃条件下,3000rpm离心10min,吸取上清液得血浆样品,置于-80℃中保存,用于lc-ms/ms分析,每次进样1μl,处理数据得到化合物的pk数据,结果见表2。
[0385]
表2.本发明代表化合物在大鼠体内药代动力学性质
[0386][0387]
由表2可见,静脉及腹腔给药时,实施例58的半衰期显著高于先导物,清除率也显著低于先导化合物lead compound;且相对于先导化合物lead compound的口服无效,实施例58在口服给药方式上占据一定的优势。
[0388]
实施例79:基于ct-26鼠源结肠癌细胞小鼠移植瘤模型的体内药效学研究
[0389]
实验步骤:在蚌埠依诺佳生物科技有限公司订购spf级balb/c小白鼠50只,周龄为6-7周,性别为雌性。将培养好的ct-26细胞清洗并重悬于冰浴的pbs缓冲液中,将细胞悬液经皮下注射于balb/c鼠右侧腋下(0.1ml/只)。待肿瘤体积长至约150mm3时将其随机分为五组(n=6)。分组后的第1,3,5天给药,其中空白对照组瘤内注射给予溶媒(10%etoh+40%peg 400+50%生理盐水),先导化合物lead compound-it组瘤内注射给予0.2mg/kg,实施例58(it组瘤内注射给予0.2mg/kg、i.p.组腹腔注射给予2.5mg/kg、p.o.组瘤口服给予5mg/kg),给药期间每天对小鼠进行称重,量取肿瘤长宽并进行记录。给药结束后,颈部脱臼处死小鼠并解剖,保留肿瘤组织和心肝脾肺肾,分别保存在4%多聚甲醛和-80℃中,用于后续实验。
[0390]
图5给出了溶媒对照组和给药组在给药期间的相对肿瘤体积变化。给药期间测量
肿瘤的长径a、短径b,肿瘤体积按照公式v=a
×
b2/2计算,*p《0.05(n=6)。图6标明了给药期间小鼠体重变化情况,从图7可以看出给药后小鼠肿瘤质量称量结果,*p《0.05。
[0391]
从图5-图7可以看出,实施例58表现出较为明显的体内抗肿瘤效果,it组、i.p.组及p.o.组的肿瘤体积均与空白对照组存在显著性差异(p《0.05),同时给药组小鼠的体重与空白对照组相比无显著差异,表明该化合物耐受性较好。
[0392]
最后应当说明的是:以上实施例仅用以说明本发明的技术方案而非对其限制;尽管参照较佳实施例对本发明进行了详细的说明,所属领域的普通技术人员应当理解,依然可以对本发明的具体实施方式进行修改或者对部分技术特征进行等同替换;而不脱离本发明技术方案的精神,其均应涵盖在本发明请求保护的技术方案范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1