一种絮凝蛋白的提取方法及应用
1.本发明涉及生物工程领域,尤其涉及一种絮凝蛋白的提取方法及应用。
背景技术:
2.絮凝蛋白是负责将细胞粘附至细胞或将细胞粘附至非生物表面的蛋白质,在酿酒酵母(sacchadromyces cerevisiae)和粟酒裂殖酵母(schizosaccharomyces pombe)中分别由flo家族基因和pfl家族基因编码。
3.絮凝蛋白通常包含三个结构域:包含特异性糖残基结合位点的氨基末端结构域、包含糖基磷脂酰肌醇(glycosylphosphatidylinositol,gpi)连接位点的羧基末端结构域、以及富含丝氨酸和苏氨酸串联重复序列的中央蛋白结构域。絮凝蛋白的结构使其具有以下特性:1)能与糖残基特异性结合;2)结合作用受钙离子调控;3)富含羟基等具有还原性的氨基酸。这些特性为絮凝蛋白的应用奠定了基础。絮凝蛋白本身是安全有效的絮凝剂,可以通过外源添加的方式实现目标细胞的可控收集;此外,其与糖类(如甘露糖或半乳糖)的特异性结合能力使其可用于特异性糖类的分离纯化。絮凝蛋白中富含带有还原性基团的丝氨酸和苏氨酸,具有较强的保湿性和抗氧化能力,可用于护肤品行业。
4.目前并没有准确的原位提取絮凝蛋白的方法。常用的胞壁蛋白提取方法包括等电点沉降法、表面活性剂提取法、缓冲液法等等,这些方法较为广谱,无法特异性地分离絮凝蛋白。
5.因此,本领域技术人员致力于研究一种特异性高的原位提取絮凝蛋白的方法。
技术实现要素:
6.为实现上述目的,本发明提供了一种絮凝蛋白提取方法,利用絮凝蛋白在钙离子存在下与絮凝细胞胞壁的糖残基特异性结合的特点,高效分离絮凝蛋白。
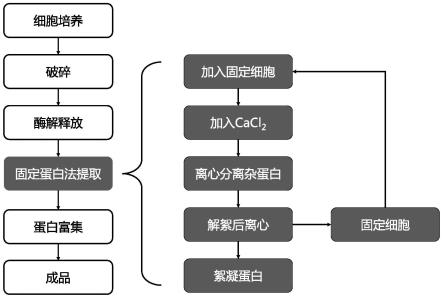
7.本发明的第一个方面是提供一种絮凝蛋白提取方法,主要包含以下步骤:
8.s1细胞培养:培养含有絮凝蛋白的菌株;
9.s2细胞破碎:收集新鲜菌体,使用包括但不限于组织研磨、高压破碎的方法进行细胞破碎;将得到的细胞破碎液进行离心,得到破碎上清体系和破碎沉淀体系;
10.s3释放蛋白:向s2的破碎沉淀体系中加入糖基磷脂酰肌醇(glycosylphosphatidylinositol,gpi)切割酶或细胞裂解液。其中gpi切割酶可以特异性作用于磷脂酰肌醇的磷酸二脂键,将带有gpi连接位点的絮凝蛋白从细胞膜或细胞壁上释放出来。细胞裂解液可以破坏细胞壁碎片和细胞膜结构从而释放目标蛋白。离心后,目标蛋白存于上清体系中。
11.s4“固定细胞法”分离絮凝蛋白:本方法将解絮凝后的新鲜完整的絮凝细胞作为固定细胞,通过絮凝蛋白特异性结合固定细胞表面糖残基的原理来分离絮凝蛋白和其他杂蛋白。
12.固定细胞先使用gpi切割酶进行酶解处理,以去除固定细胞本身的絮凝蛋白。
13.之后,在s2得到的破碎上清体系和s3得到的上清体系中分别加入固定细胞,再加入含有钙离子的絮凝剂,促使固定细胞特异性地吸附体系中游离的目标蛋白,通过离心收集携带目标蛋白的细胞,加入解絮剂使目标蛋白与细胞分离,从而获得含有目标蛋白的溶液;
14.s5浓缩富集:将s4中获得的目标蛋白溶液进行干燥,提高蛋白浓度,获得成品。
15.优选地,步骤s1中的菌株可以是一切含有絮凝蛋白的细胞,包括但不限于絮凝酵母spsc01(cgmcc 0587)、栗酒裂殖酵母flo-dut以及一切经过分子改造后能生产絮凝蛋白的重组菌株等,提取的絮凝蛋白称为对应细胞的絮凝蛋白。
16.进一步地,步骤s2中,所述的细胞破碎方法包括但不限于组织研磨破碎、高压破碎法。
17.其中高压破碎的条件为:800bar以上的压力破碎1min以上,重复3~5次。
18.组织研磨破碎的条件为:频率60.00hz以上,运行时间30s以上,间隔时间5s以上,循环次数不少于10次。
19.进一步地,所述步骤s3、s4中所述gpi切割酶可以是任何能释放被gpi锚定于膜中的蛋白质的酶,例如:磷酸肌醇磷脂酶c(brenda:ec4.6.1.14,brenda:ec4.6.1.13,ec 3.1.4.47,ec 3.1.4.1)等。
20.进一步,优选地,步骤s4中所述金属螯合剂选自摩尔浓度大于1mol的edta或摩尔浓度大于1mol的柠檬酸钠溶液。
21.进一步地,步骤s4中所述絮凝剂为钙离子为阳离子的可溶性溶液。
22.进一步优选地,步骤s4中固定细胞与絮凝剂孵育的生物量比例为1od细胞加入包含0.3mol以上的ca
2+
的絮凝剂,所述解絮剂摩尔量与ca
2+
摩尔量的比例≥1:1。
23.本发明的第二个方面是提供利用所述提取方法获得的絮凝蛋白。
24.本发明的第三个方面是提供所述絮凝蛋白在引发絮凝作用、分离特异性糖类以及在食品和护肤品中的应用。
25.本发明的有益效果在于:
26.1)利用絮凝蛋白在钙离子存在下与细胞壁糖残基特异性结合的特点,从絮凝细胞中高效分离絮凝蛋白。与基于分子改造的蛋白异源表达和纯化方法相比,本发明具有提取工艺简单、可操作性强、可扩展性高等优势;与化学提取法相比,本发明利用絮凝蛋白特异性结合能力进行提取,具有提取条件温和、蛋白纯度高等优势;
27.2)本发明中提取的絮凝蛋白具有粘附作用,是细胞发挥絮凝作用的基本,在工业生产中,细胞絮凝是非常优良的特性,对简化生产工艺、降低生产成本、提高产品品质具有重要意义;
28.因此,本发明提取的絮凝蛋白可以用作外源添加的絮凝剂,作为细胞絮凝的开关,以实现游离细胞的絮凝收集,具有安全性高、可控性强等优势。
29.3)本发明中提取的絮凝蛋白对不同糖类有特异性识别作用,可用于对应糖类的特异性分离纯化。例如酿酒酵母spsc01的絮凝蛋白可用于末端带有甘露糖的化合物、蛋白质的分离纯化;栗酒裂殖酵母flo-dut的絮凝蛋白可用于末端带有半乳糖的化合物、蛋白质的分离纯化。
30.4)本发明中提取的絮凝蛋白中富含带有还原性基团的丝氨酸和苏氨酸,具有较强
的保湿性和抗氧化能力,可用于护肤品行业。
31.5)本发明中用于特异性固定游离絮凝蛋白的固定细胞可以重复利用,从而降低了提取成本。
32.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
33.图1是本发明的操作流程示意图;
34.图2是本发明步骤s4固定细胞法在实施例1中的流程示意图;
35.图3是本发明步骤s4固定细胞法在实施例5中的流程示意图。
具体实施方式
36.以下参考说明书附图介绍本发明的多个优选实施例,使其技术内容更加清楚和便于理解。本发明可以通过许多不同形式的实施例来得以体现,本发明的保护范围并非仅限于文中提到的实施例。
37.实施例1:
38.本实施例提供了一种酿酒酵母spsc01菌株的絮凝蛋白的提取方法。
39.菌株选择:本实施例中选取含有絮凝蛋白的自絮凝酵母spsc01(cgmcc 0587)进行培养。絮凝酵母spsc01为栗酒裂殖酵母(schizosaccharomyces pombe flo-dut)和酿酒酵母(sacchadromyces cerevisiae cicc-1445)的融合株,于2001年5月20日保藏在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc,中国,北京),登录号为cgmcc 0587(见专利cn1436851a)。该菌株具有出色的自絮凝能力,是提取絮凝蛋白的良好材料。
40.解絮剂选择:本实施例中选择1m edta作为解絮剂,其原理为螯合游离的ca
2+
以解除絮凝蛋白与细胞壁糖残基的结合。配制方法为:800ml去离子水中加入372.2g乙二胺四乙酸二钠盐,使用磁力搅拌器进行搅拌,使用naoh调节溶液ph至8.0,然后定容至1l。
41.絮凝剂选择:本实施例中选择1m氯化钙溶液作为絮凝剂,其原理为提供絮凝蛋白与细胞壁糖残基结合所必须的ca
2+
。配制方法为:称取147.02g二水合氯化钙,加入800ml去离子水,使用磁力搅拌器进行搅拌,定容至1l。
42.本实施例包括如下步骤:
43.s1细胞培养。
44.在ypd种子培养液(10g/l酵母提取物,10g/l蛋白胨,20g/l葡萄糖,121℃灭菌20min)中接入少量-80℃冰箱保藏的spsc01冻存液,在30℃,150rpm条件下培养约12小时,进行菌株活化。将复苏后的细胞以10%的初始接种量接种至氮源丰富的培养液中(10g/l酵母提取物,20g/l蛋白胨,20g/l葡萄糖,121℃灭菌20min)进行菌体培养。检测培养液在600nm下的光密度(od
600
)以表征酵母细胞的生物量;使用聚焦光束反射测量技术(focused beam reflectance measurement,fbrm)在线监测细胞絮凝颗粒的大小和数量;使用尿糖试纸或hplc检测培养液中的糖浓度。在酵母细胞生长达到稳定期、絮凝颗粒数量达到最大、培养液中的糖未曾耗尽时收集菌体。由于该细胞为自絮凝细胞,收集时不需要离心操作,直接静止2-3min后倒去上层培养液即可。使用解絮液(1m edta)清洗菌体2-3次,5200rpm离心
3min收集菌体并分为两份,其中一份用于s2的细胞破碎,另一份做为s4中的固定细胞使用。
45.s2细胞破碎。
46.本实施例中选取高压均质仪(型号uh-24)进行菌体破碎,先后使用20%的乙醇和pbs缓冲液清洗管道。清洗后,加入菌液,使用800bar的压力破碎1min,重复破碎3-5次。破碎完毕后,缓慢卸压至0bar,收取细胞破碎的匀浆液。将细胞破碎液离心,得到破碎上清体系和破碎沉淀体系分别用于后续的提取
47.s3释放蛋白:
48.向s2的破碎沉淀体系中加入磷脂酶c,在30℃和150rpm条件下震荡裂解10min以上(ph≈7.4);酶的添加量和蛋白量的摩尔比至少为1:1。离心后,收集含有目标蛋白的上清体系。
49.s4“固定细胞法”分离目的蛋白:
50.在s2收获的破碎上清体系和s3收获的上清体系中加入解絮凝的新鲜完整的絮凝细胞(固定细胞),之后加入1m cacl2溶液,促使细胞特异性地吸附体系中游离的目标蛋白,离心收集携带目标蛋白的细胞,加入1m edta溶液使目标蛋白与细胞分离,离心后收获含有目标蛋白的上清液,沉淀中的固定细胞可重复s4操作进行循环使用。
51.优选的是,s4中加入的cacl2量与固定细胞生物量比例为:1od细胞加入0.3~0.5mol的cacl2。
52.优选的是,s4中加入的edta摩尔量与cacl2摩尔量的比例为1:1~1.2:1。
53.s5浓缩富集:将s4中获得的目标蛋白溶液进行冷冻真空干燥或喷雾干燥,提高蛋白浓度,得到提纯的目标蛋白产品。
54.优选的是,s2中的细胞应选用新鲜收集的细胞,表1列出了新鲜细胞与-80℃放置一周的细胞破碎后蛋白含量对比。表明新鲜细胞具有更高的蛋白含量,有利于目标蛋白的提取。
55.表1不同破碎样品中的蛋白含量及浓度
[0056] spsc01-新鲜spsc01-非新鲜含量μg/20μl7.943.80浓度μg/μl0.400.19
[0057]
实施例2:
[0058]
本实施例与实施例1的不同之处仅在于,本实施例的步骤s2中使用组织研磨机进行细胞破碎,将研磨机装样盒放入-20℃冰箱中提前预冷30min,用封口膜密封装有菌液的离心管口。破碎条件为:60.00hz,运行时间30s,间隔时间5s,循环次数10次。
[0059]
实施例3:
[0060]
本实施例与实施例1的不同之处仅在于,在s3中,向s2的破碎沉淀体系和s2的破碎上清体系都加入gpi切割酶以释放目标蛋白,在30℃和150rpm条件下震荡裂解10min以上(ph≈7.4)。离心后,收集含有目标蛋白的上清体系。
[0061]
实施例4:
[0062]
本实施例与实施例1的不同之处仅在于,本实施例的步骤s3中的gpi切割酶处理替换为含有sds和triton的细胞裂解液处理,以进一步破坏细胞壁残片并溶解细胞膜,释放目标蛋白。在30~40℃和150rpm条件下震荡裂解0.5~2h。离心后,收集含有目标蛋白的上清
体系。
[0063]
实施例5:
[0064]
本实施例与实施例1的不同之处在于,在s4开始之前,使用gpi切割酶预处理s4中的完整的固定细胞,在30℃和150rpm条件下震荡裂解10min以上(ph≈7.4),以提前释放固定细胞上的絮凝蛋白,解除游离絮凝蛋白与固定细胞上糖残基结合时的竞争性抑制,从而提高目标蛋白的提取效率。
[0065]
以上详细描述了本发明的较佳具体实施例,且上述实施例1至5中的技术特征可进行任意组合,且组合而成的技术方案均属于本发明的保护范围。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1