一种β-半乳糖苷酶基因及其编码酶的应用
一种
β-半乳糖苷酶基因及其编码酶的应用
技术领域
1.本发明涉及一种β-半乳糖苷酶基因及其编码酶的应用,具体涉及一种产低聚半乳糖的β-半乳糖苷酶基因及其应用方法,属于基因工程和酶工程技术领域。
背景技术:
2.β-低聚半乳糖(β-galactooligosaccharides,β-gos)是一种聚合度为2~8的功能性低聚糖,即以半乳糖或葡萄糖为还原端,通过β-糖苷键连接1~7个半乳糖分子,其中的糖苷键可能为β-1,1、β-1,3、β-1,4或β-1,6-糖苷键。β-gos口感好、甜度低、溶解度高、保湿性强,是一种优良的食品甜味剂。
3.重要的是,β-gos具有良好的抗消化特性,能够抵抗小肠中消化酶的降解,保持相对完整的结构到达大肠,从而发挥诸多益生功能。具体表现为:(1)能够选择性地促进肠道有益菌的增殖,特别是双歧杆菌与乳酸杆菌,同时能够抑制腐败菌(如部分梭状芽孢杆菌)的生长。(2)改善肠道屏障功能,缓解结肠炎。在生命早期补充β-gos能够帮助婴儿建立健康的结肠环境,增加肠道中短链脂肪酸(scfas)含量,降低结肠炎风险;同时β-gos的膳食补充也可加速伤口愈合,有利于结肠炎的术后恢复。(3)提高新陈代谢,延缓衰老。含有β-gos的合生元能够缓解肠道菌群失调,并显著增强肝脏的抗氧化能力,通过肝-肠轴发挥抗衰老的作用。(4)改善糖尿病症状。由于出色的抗氧化能力与平衡肠道菌群的功效,β-gos也被证实能够降低血液中糖尿病相关标志物含量,延缓ii型糖尿病的发展。此外,毒理学研究表明β-gos对于不同年龄段机体或不同生物均无任何不良影响,安全可靠。因此,β-gos作为富有营养价值的益生元,可应用于婴幼儿食品或特殊病人饮食治疗的膳食补充剂中,在食品及医药健康领域具有广阔的应用前景。我国在2008年批准将β-gos作为食品添加剂使用,随着其应用市场的逐年增加,对β-gos功能性的开发与生产技术的研究具有重要意义。
4.工业上,β-gos的生产主要依靠酶法工艺,即利用具有转糖苷活性的β-半乳糖苷酶作用于高浓度乳糖而成。早在1988年,日本制备得到了第一个β-gos商业化产品,随后其制备工艺引入欧洲,二者垄断了现阶段高纯度β-gos的生产。与此相比,我国的β-gos生产起步较晚,工业上尚未达到千吨规模。主要限制因素在于缺少性质优良的β-半乳糖苷酶。目前,商业化制备β-gos的β-半乳糖苷酶主要有以下3个来源:米曲霉(aspergillus oryzae)、乳酸克鲁维酵母(kluyveromyces lactis)和环状芽孢杆菌(bacillus circulans)。其中,米曲霉来源的β-半乳糖苷酶价格相对较低,转化率约为30%,主产物为低聚半乳三糖(约18%);乳酸克鲁维酵母来源的β-半乳糖苷酶最高转化率同样约为30%,产物中二糖含量最高,但二糖的益生活性尚未被证实;环状芽孢杆菌来源的β-半乳糖苷酶转化率较高,可达40%左右,产物以三糖为主(约26%)。可见,目前的β-gos生产用酶存在转化率低、且主产物比例低的问题。同时,β-半乳糖苷酶的转苷产物组成复杂,包含不同类型的糖苷键,导致后续分离难度增加,且不利于不同结构β-gos的功能性研究。因此,为降低制备及分离成本,寻找转苷效率高、产物专一性强的β-半乳糖苷酶是重要的研究方向。
技术实现要素:
5.本发明的目的在于弥补目前酶法合成β-gos的不足之处,提供了一种编码β-半乳糖苷酶的基因,该基因来源于paenibacillus macquariensis,核苷酸序列如seq id no.1所示。
6.本发明还提供了一种上述核苷酸序列编码的β-半乳糖苷酶,其氨基酸序列如seq id no.2所示。
7.本发明还提供了一种携带上述β-半乳糖苷酶基因的重组质粒。
8.在一种实施方式中,所述重组质粒以大肠杆菌表达质粒pet-20b(+)为载体。
9.本发明还提供了一种携带上述β-半乳糖苷酶的基因,或所述重组质粒的微生物细胞。
10.在一种实施方式中,所述微生物细胞是重组大肠杆菌。
11.优选地,所述重组大肠杆菌以escherichia coli bl21(de3)为表达宿主。
12.在一种实施方式中,所述重组大肠杆菌的构建方法为:利用无缝克隆的方法,将核苷酸序列为seq id no.1所示的β-半乳糖苷酶基因拼接到表达载体pet-20b(+)上,构建重组质粒pmgal/pet-20b(+),并将其转化至e.coli bl21(de3)中。
13.本发明还提供一种生产β-半乳糖苷酶的方法,所述方法是以乳糖为底物,利用氨基酸序列如seq id no.2所示的β-半乳糖苷酶催化底物生成低聚半乳糖。
14.在一种实施方式中,按照不少于500u/g底物的量添加所述β-半乳糖苷酶。
15.优选地,按照500~1000u/g底物的量添加所述β-半乳糖苷酶。
16.更优选地,按照1000u/g底物的量添加所述β-半乳糖苷酶。
17.在一种实施方式中,所述底物为乳糖,乳糖浓度为200~400g/l。
18.优选地,所述乳糖浓度为400g/l。
19.在一种实施方式中,在45~55℃、ph 5.0~7.0下反应48~72h。
20.优选地,在50℃下反应。
21.更优选地,在ph 6.5,50℃下反应60h。
22.在一种实施方式中,将seq id no.1所示的核苷酸连接至表达载体上,转入大肠杆菌中获得重组大肠杆菌。
23.在一种实施方式中,所述发酵是将一定量的重组细胞或重组大肠杆菌接入含有氨苄青霉素的lb培养基中,于37℃培养至对数生长期,制备得种子液,利用种子液进行发酵。
24.在一种实施方式中,将种子液按照2%~5%(v/v)的接种量接种至含有氨苄青霉素及0~15%(w/v)乳糖的tb培养基中,于25~37℃摇瓶培养24~72h,离心得上清液即为β-半乳糖苷酶粗酶液。
25.本发明还提供所述β-半乳糖苷酶基因、含有所述β-半乳糖苷酶基因的重组质粒、表达所述β-半乳糖苷酶的大肠杆菌在生产β-低聚半乳糖中的应用,所述应用是以β-半乳糖苷酶或含有该酶的酶制剂为催化剂,以乳糖溶液为底物,将乳糖转化为功能性低聚半乳糖。
26.在一种实施方式中,所述酶制剂是所述β-半乳糖苷酶粗酶液或经分离纯化后得到的纯酶,以溶液或干粉的形式添加至反应体系中。
27.在一种实施方式中,所述乳糖溶液的浓度为200~400g/l。
28.本发明的有益效果在于:
29.(1)本发明筛选到了一种特定氨基酸序列的β-半乳糖苷酶,并且成功实现了在大肠杆菌中的异源表达,可应用于食品及药品生产中,所表达β-半乳糖苷酶催化活力可达12378.6u/mg;
30.(2)本发明的β-半乳糖苷酶与目前报道的同类酶相比,该酶比酶活高于现有报道的大多数同类酶,且在较宽的温度范围内均能保持较高活力,可适应不同的反应温度条件;
31.(3)本发明的β-半乳糖苷酶与现有报道的大多数同类酶相比,制备低聚半乳糖的优势明显,底物转化率较高,产物专一性较强,可有效提高低聚半乳糖的产率,降低其制备难度以及后续分离纯化成本,底物转化率可达70.9%,产物中低聚半乳糖含量约占总糖的63.1%,转化率和低聚半乳糖含量均达到现有技术中的最高水平,具有较高的工业应用价值。
附图说明
32.图1为纯化重组β-半乳糖苷酶的sds-page分析。
33.图2为重组β-半乳糖苷酶的热稳定性。
34.图3为ph对重组β-半乳糖苷酶热稳定性的影响。
35.图4为应用重组β-半乳糖苷酶制备低聚半乳糖时的hpaec-pad分析。
具体实施方式
36.下述实例中所涉及的β-半乳糖苷酶酶活测定方法如下:
37.以2-硝基苯基-β-d-吡喃半乳糖苷(onpg)为底物评价β-半乳糖苷酶的水解活力:
38.以k2hpo
4-kh2po4缓冲液(20mmol/l,ph 5.5)配制10mmol/l onpg溶液作为底物,在0.9ml底物中加入0.1ml酶液,于55℃下反应15min后,加入1ml 1m na2co3溶液终止反应,并于420nm下测定吸光值。根据邻硝基苯酚(onp)标准曲线计算反应体系中onp含量。
39.酶活定义为:在一定条件下,以β-半乳糖苷酶每分钟水解onpg释放1μmol onp的酶量为一个酶活单位(u)。
40.底物转化率计算方法:以10~50μg/ml的乳糖溶液为标品,利用hpaec-pad分析酶解前后体系中的乳糖含量。乳糖转化率(%)=100%
×
(反应前乳糖质量-反应后乳糖质量)/反应前乳糖质量。
41.低聚半乳糖百分含量计算方法:低聚半乳糖含量(%)=100%
×
产物中低聚半乳糖的质量/产物中所有糖的质量。其中,低聚半乳糖质量为转移二糖~五糖的质量总和。
42.实施例1:大肠杆菌分泌表达系统的构建
43.基因合成如seq id no.1所示的核苷酸序列,采用同源重组的方法将上述序列连接至pet-20b(+)载体。其中涉及的pcr扩增程序为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸5min,重复35个循环;最后72℃保温10min。同源重组反应体系为:纯化的β-半乳糖苷酶片段(50ng/μl)1μl,纯化的pet-20b(+)载体pcr片段(50ng/μl)1μl,5
×
ceⅱbuffer 4μl,exnaseⅱ2μl,ddh2o 12μl。将上述同源重组体系在37℃下反应30min后,转化e.coli jm109,涂布含有氨苄青霉素的lb平板,挑取单菌落活化、测序、获得重组质粒pmgal/pet-20b(+);将上述重组质粒转化e.coli bl21(de3),得到基因工程菌pmgal/pet-20b(+)/e.coli bl21(de3)。
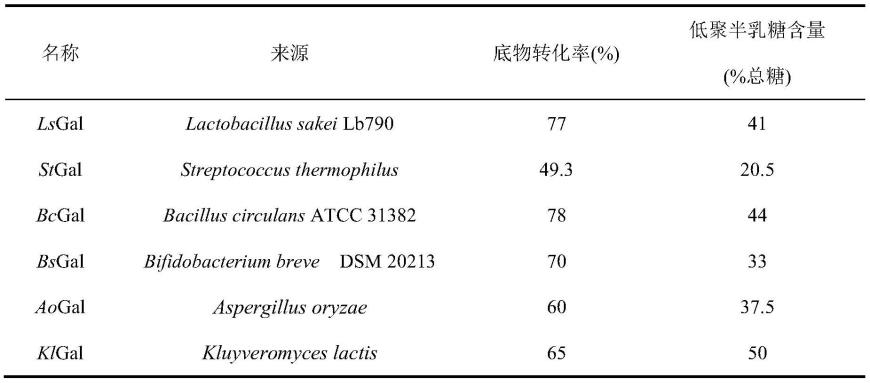
44.实施例2:重组β-半乳糖苷酶的表达与分离纯化
45.具体步骤如下:
46.(1)将实施例1中制备得到的基因工程菌保存液接种于含有100μg/ml氨苄青霉素的lb液体培养基中,与37℃下培养8~10h,制备得种子液;
47.将上述种子液按2%~5%(v/v)的接种量转移至含有100μg/ml氨苄青霉素及0~15%(w/v)乳糖的tb培养基中,在25~37℃、200r/min条件下培养24~72h,收集上清液即为β-半乳糖苷酶粗酶液,其酶活为11397.1u/ml。
48.(2)粗酶液过0.45μm水系膜后,经镍离子亲和层析柱纯化,缓冲液分别为a(10mmol/l tris-hcl、500mmol/l nacl,ph 7.5)和b(10mmol/l tris-hcl、500mmol/l nacl、500mmol/l咪唑,ph 7.5),流速为2ml/min。用25~30ml缓冲液a平衡镍柱至稳定后,上样,再以缓冲液a洗脱纯化柱中的未结合蛋白。待洗脱曲线平衡后,以35%(v/v)缓冲液b进行梯度洗脱,收集洗脱液进行鉴定,如图1所示。得到的β-半乳糖苷酶纯酶液测定蛋白浓度,并计算得比酶活为12378.6u/mg。
49.实施例3:重组β-半乳糖苷酶的稳定性
50.分别测定实施例2中制备得重组β-半乳糖苷酶纯酶的热稳定性及ph对热稳定性的影响,具体步骤如下:
51.(1)重组β-半乳糖苷酶纯酶的热稳定性测定方法如下:将纯酶稀释于10mmol/l k2hpo
4-kh2po4缓冲液(ph 6.0)中,于50℃、55℃、60℃保温60min,在不同时间点取样,测定酶活力,以未保温时的活力为100%,计算不同时间的相对残余酶活。结果如图2所示,该酶在50℃下的半衰期约为50min。
52.(2)分析ph对重组β-半乳糖苷酶纯酶的热稳定性的影响,测定方法如下:分别用10mmol/l的ch3cook-ch3cooh缓冲液(ph 3.0~5.0)、k2hpo
4-kh2po4缓冲液(ph 5.0~8.0)和naoh-gly缓冲液(ph 8.0~10.0)配制10mmol/l onpg作为底物,将纯酶在50℃下保温1h,于不同时间点取样测定残余酶活力,以未保温时的酶活为100%,计算不同ph下的相对酶活力。结果显示,该酶在ph 5.0~6.0均可保持95%以上的活性,如图3所示。
53.实施例4:重组β-半乳糖苷酶的应用
54.利用重组β-半乳糖苷酶制备低聚半乳糖,其反应过程如下:配制200~400g/l乳糖为底物,调节ph至5.0~7.0,加入500~1000u/g底物的纯酶,于50℃下48~72h(反应至溶液中残余乳糖不再继续降解)。取部分反应液沸水浴10min终止反应后,8000r/min离心5min,取上清液稀释适当倍数,过0.22μm水系滤膜待测。
55.利用hpaec-pad测定酶解液中各组分含量。采用三元梯度洗脱程序,洗脱液a为0.25m氢氧化钠,洗脱液b为1.0m醋酸钠,洗脱液c为超纯水。流速0.5ml/min,柱温35℃,进样量10μl,以糖四电位波形检测。
56.色谱分析结果如图4所示,底物转化率约为58%~70%,低聚半乳糖含量约为46%~63%(%总糖)。特别地,在最佳条件下(ph 6.5,50℃,400g/l乳糖,加酶量1000u/g底物,反应60h)底物转化率约为70.9%,产物中低聚半乳糖含量约占总糖的63.1%。
57.对比例
58.具体实施方式同实施例1~2及实施例4,区别在于,将来源于paenibacillus macquariensis的基因替换成现有报道的、其他来源的β-半乳糖苷酶基因,按照实施例1~2
中的方法构建基因工程菌,并培养制备得到纯酶液,按照实施例4中的方法分析产物情况。对比结果如表1所示。由表中数据可知,seq id no.1所示基因编码的β-半乳糖苷酶在底物转化率和低聚半乳糖产率方面均优于现有报道中大多数β-半乳糖苷酶,具有十分广阔的应用前景。
59.表1不同来源的β-半乳糖苷酶的产物情况
[0060][0061]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1