成纤维细胞向毛乳头样细胞转分化的方法及其应用与流程
1.本发明涉及生物技术的技术领域,尤其是涉及一种成纤维细胞向毛乳头样细胞转分化的方法及其应用。
背景技术:
2.脱发是一种常见的疾病,由包括疾病、年龄、精神压力等各种因素造成,是困扰全球数十亿男性和女性的亚健康问题。脱发虽然不会导致直接的生命危险,但会严重影响到个人的心理状态,降低生活质量。药物治疗和毛发移植是迄今为止主要的治疗手段。尽管毛发移植是目前最有效的方法,但供体毛囊的稀缺成为了其主要的限制。此外,药物治疗的效果甚微,且具有严重的副作用。因此,当前治疗的有限功效和副作用促使人们寻找可用于临床实践的替代疗法。
3.近年来,随着组织工程和再生医学的快速发展,通过基于细胞的毛囊再生为脱发提供了新的替代疗法。毛乳头(dp)细胞是位于毛囊底部的一群特化的间充质细胞群,在毛囊的胚胎发育和周期循环中发挥重要作用,是毛囊再生的潜在细胞来源。然而,分离提取的dp细胞在体外培养中很快丧失其毛发诱导能力。仅原代分离的dp细胞不足以用于开发治疗脱发的替代疗法,需要寻求有效和可靠的方法来生产大量具有毛发诱导能力的dp细胞。
4.有鉴于此,特提出本发明。
技术实现要素:
5.本发明的第一目的在于提供一种成纤维细胞向毛乳头样细胞转分化的方法,缓解了现有技术中存在的原代分离的毛乳头细胞不足以用于开发治疗脱发的替代疗法的问题。
6.本发明的第二目的在于提供一种采用上述方法得到的毛乳头样细胞。
7.本发明的第三目的在于提供一种能够诱导成纤维细胞转分化为毛乳头样细胞的培养基。
8.本发明的第四目的在于提供上述成纤维细胞向毛乳头样细胞转分化的方法、上述毛乳头样细胞或上述诱导培养基的应用。
9.为解决上述技术问题,本发明特采用如下技术方案:
10.根据本发明的一个方面,本发明提供了一种成纤维细胞向毛乳头样细胞转分化的方法,包括使用peficitinib诱导成纤维细胞,使成纤维细胞向毛乳头样细胞转分化。
11.优选地,所述方法包括使用诱导培养基培养成纤维细胞,所述诱导培养基中含有peficitinib;
12.优选地,诱导培养基中peficitinib的浓度为2~10μm,优选为10μm;
13.优选地,所述诱导培养基为含有peficitinib的基础培养基,所述基础培养基为含有血清的高糖dmem。
14.优选地,使用所述诱导培养基培养成纤维细胞6~10天;
15.优选地,使用所述诱导培养基培养成纤维细胞8天;
16.优选地,每两天更新一次诱导培养基;
17.优选地,将成纤维细胞接种后24h更换为所述诱导培养基。
18.优选地,所述成纤维细胞来源于人;
19.优选地,所述成纤维细胞来源于皮肤组织;
20.优选地,所述成纤维细胞来源于头皮组织或包皮组织。
21.优选地,所述成纤维细胞为原代成纤维细胞;
22.优选地,所述原代成纤维细胞的分离方法包括:将清洗后的皮肤组织使用分散酶消化后分离真表皮,真表皮使用胶原酶消化后分离成纤维细胞;
23.优选地,采用3d培养的方式继续培养成纤维细胞转分化成的毛乳头样细胞;
24.优选地,3d培养24~48h。
25.根据本发明的另一个方面,本发明还提供了一种采用上述方法得到的毛乳头样细胞,该毛乳头样细胞具有毛乳头细胞特异的分子标签;所述毛乳头细胞特异的分子标签包括α-sma和vcan;
26.优选地,所述毛乳头细胞特异的分子标签还包括nog。
27.根据本发明的另一个方面,本发明还提供了一种用于诱导成纤维细胞向毛乳头样细胞转分化的诱导培养基,该诱导培养基含有工作浓度为2~10μm的peficitinib;
28.优选地,包含工作浓度为10μm的peficitinib;
29.优选地,所述诱导培养基为含有peficitinib的基础培养基,所述基础培养基为含有血清的高糖dmem。
30.根据本发明的另一个方面,本发明还提供了上述成纤维细胞向毛乳头样细胞转分化的方法,上述毛乳头样细胞,或上述诱导培养基在非诊断和治疗目的的毛囊再生中的应用。
31.根据本发明的另一个方面,本发明还提供了上述成纤维细胞向毛乳头样细胞转分化的方法,上述毛乳头样细胞,或上述诱导培养基在制备用于毛囊再生的产品中的应用。
32.根据本发明的另一个方面,本发明还提供了一种用于毛囊再生的产品,该产品包含上述毛乳头样细胞,或上述诱导培养基。
33.与现有技术相比,本发明具有如下有益效果:
34.本发明提供的成纤维细胞向毛乳头样细胞转分化的方法,包括使用peficitinib诱导成纤维细胞,使成纤维细胞向毛乳头样细胞转分化。
35.本发明提供的方法,转分化的初始细胞为成纤维细胞,成纤维细胞的具有高可用性、可以很容易地从皮肤组织中分离出来,此外,成纤维细胞的培养、繁殖和低温保存特性在营养需求和培养活力方面也具有培养上的优势。
36.诱导成纤维细胞向毛乳头样细胞转分化的功效成分采用peficitinib,peficitinib是一种新型的口服小分子janus激酶抑制剂,本发明发现peficitinib能够诱导成纤维细胞向毛乳头样细胞转分化,实现了从体外直接获取具有诱导毛囊再生和毛发生长能力的毛乳头样细胞。peficitinib作为一种小分子具有化学成分清晰、纯度高、批次间差异小的优点,还具有作用快速和剂量依赖性生物活性的特点。本发明基于小分子诱导成纤维细胞命运转分化的方法,可在体外获得大量具有诱导毛囊再生和毛发生长能力的毛乳头样细胞,对于替代基于毛乳头细胞的毛囊再生方法具有重要应用价值。
附图说明
37.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
38.图1a为实施例1中提取的原代人包皮成纤维细胞的形态;
39.图1b为实施例1中提取的原代人包皮成纤维细胞荧光染色鉴定结果图;
40.图2a为实施例2中小分子药物peficitinib诱导人包皮成纤维细胞的形态改变及alp染色结果;
41.图2b为实施例2中qrt-pcr检测dp标志基因alpl表达的结果;
42.图2c为实施例2中qrt-pcr检测dp标志基因vcan表达的结果;
43.图2d为实施例2中qrt-pcr检测dp标志基因α-sma表达的结果;
44.图2e为实施例2中peficitinib诱导后细胞免疫荧光染色结果;
45.图3a为实施例3中原代人头皮毛囊dp细胞的形态;
46.图3b为实施例3中原代人头皮毛囊dp细胞alp染色结果;
47.图3c为实施例3中原代人头皮毛囊dp细胞免疫荧光染色鉴定结果图;
48.图4a为实施例3中qrt-pcr比较原代dp(p2)与peficitinib诱导人包皮成纤维细胞中dp标志基因α-sma的表达结果图;
49.图4b为实施例3中qrt-pcr比较原代dp(p2)与peficitinib诱导人包皮成纤维细胞中dp标志基因nog的表达结果图;
50.图4c为实施例3中qrt-pcr比较原代dp(p2)与peficitinib诱导人包皮成纤维细胞中dp标志基因vcan的表达结果图;
51.图4d为实施例3中qrt-pcr比较原代dp(p2)与peficitinib诱导人包皮成纤维细胞中dp标志基因sox2的表达结果图;
52.图4e为实施例3中qrt-pcr比较原代dp(p2)与peficitinib诱导人包皮成纤维细胞中dp标志基因lef1的表达结果图;
53.图5a为实施例3中对peficitinib诱导前后的人包皮成纤维细胞进行3d培养,体内毛囊重建检测诱导后3d细胞球的毛发诱导能力结果图;
54.图5b为体内毛囊重建检测peficitinib诱导后3d细胞球的毛发诱导能力结果图;
55.图6a为实施例5中提取的原代人头皮成纤维细胞的形态;
56.图6b为实施例5中提取的原代人头皮成纤维细胞免疫荧光染色鉴定结果图;
57.图7a为实施例6中peficitinib诱导人头皮成纤维细胞的形态改变以及alp染色结果;
58.图7b为实施例6中qrt-pcr检测不同浓度peficitinib诱导人头皮成纤维细胞后dp标志基因alpl表达;
59.图7c为实施例6中qrt-pcr检测不同浓度peficitinib诱导人头皮成纤维细胞后dp标志基因vcan表达;
60.图7d为实施例6中qrt-pcr检测不同浓度peficitinib诱导人头皮成纤维细胞后dp标志基因α-sma表达;
61.图8为实施例7中peficitinib诱导前后的人头皮成纤维细胞进行3d培养后体内毛囊重建结果图。
具体实施方式
62.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
63.根据本发明的一个方面,本发明提供了一种成纤维细胞向毛乳头样细胞转分化的方法,该方法包括使用peficitinib诱导成纤维细胞,使成纤维细胞向毛乳头样细胞转分化。需要说明的是,本发明提供的成纤维细胞向毛乳头样细胞转分化的方法是非诊断和治疗目的的。
64.转分化是指从某种特定的体细胞,而不经过多能干细胞阶段直接重编程为目的细胞。具有效率更高,安全性更好的优点。目前,已成功使用小分子诱导成纤维细胞向功能性心肌细胞和神经细胞的转分化。通过基于细胞的方法,可以在实验室环境中产生类似毛发的结构,或在其原生生态位中操纵细胞(体内谱系重编程)以重建毛囊。然而,在培养的人类毛细胞功能丧失、供体毛发短缺的情况下,诱导非毛细胞来源以及确定培养条件的发展方面仍然存在具有挑战性的问题。成纤维细胞的高可用性、可以很容易地从皮肤组织中分离出来,此外,成纤维细胞的培养、繁殖和低温保存特性在营养需求和培养活力方面也具有培养上的优势。
65.peficitinib(培西替尼,cas no.:944118-01-8)是一种新型的口服小分子janus激酶抑制剂,由astellas pharma开发,peficitinib用于治疗对常规疗法反应不足的类风湿性关节炎(包括预防结构性关节损伤)。peficitinib可抑制jak1、jak2、jak3和tyk2,并通过抑制各种炎性细胞因子信号通路来抑制类风湿性关节炎患者滑膜炎症和关节破坏中涉及的炎性细胞的活化和增殖。
66.本发明从fda批准药物库中筛选发现peficitinib能够诱导成纤维细胞向毛乳头样细胞转分化,实现了从体外直接获取具有诱导毛囊再生和毛发生长能力的毛乳头样细胞。peficitinib作为一种小分子具有化学成分清晰、纯度高、批次间差异小的优点,还具有作用快速和剂量依赖性生物活性的特点。此外,小分子peficitinib的适当靶向递送和控制释放可以在空间和时间上调节它们的体内作用。本发明基于小分子peficitinib诱导成纤维细胞命运转分化的方法,可在体外获得大量具有诱导毛囊再生和毛发生长能力的毛乳头样细胞,对于替代基于毛乳头细胞的毛囊再生方法具有重要应用价值。
67.本发明成纤维细胞经诱导后得到的细胞具有诱导毛囊再生和毛发生长能力,同时能够表达毛乳头细胞的特异性标志基因α-sma和vcan,在由人包皮成纤维细胞转分化成的细胞中还表达毛乳头细胞的特异性标志基因nog,但是由人包皮成纤维细胞转分化成的细胞的sox2和lef1的表达水平远低于原代人毛乳头细胞,因此虽然本技术诱导成纤维细胞转分化成的细胞具有诱导毛囊再生和毛发生长能力,也表达部分毛乳头细胞的特异性标志基因,但是与原代毛乳头细胞并非完全一致,因此本发明将经peficitinib诱导的成纤维细胞转分化成的细胞命名为毛乳头样细胞。
68.研究中培养的细胞是解决复杂生物学问题的一种简单而方便的工具,不同来源的细胞系通常被用于研究以及药物开发,是研究人类健康和疾病的重要模型,但它们可能不一定能有效反映体内发生的情况。因此作为转分化的起始细胞优选为原代成纤维细胞,直接从人类样本中分离出来的原代成纤维细胞,保留着其起源组织的形态和功能特征,且没有经过任何基因操纵,有助于解决这一限制。成纤维细胞可以从多种组织中分离出来,本发明对成纤维细胞来源的组织不做限制,但与其他来源相比,人体皮肤组织更易于获取、侵入性较小、伦理争议也较少。
69.从皮肤组织中分离出来的成纤维细胞表现出广泛的应用潜力,为不同的研究提供了丰富的材料。皮肤组织例如可以为但不限于为头皮组织或包皮组织。包皮环切术是全世界执行最多的外科手术之一,去除后的包皮通常大部分被当作生物废物丢弃。包皮含有多种细胞,但成纤维细胞是其真皮中最丰富的细胞。因此,包皮是分离人类原代成纤维细胞的重要来源。
70.原代成纤维细胞的分离方法优选包括:将清洗后的皮肤组织使用分散酶消化后分离真表皮,真表皮使用胶原酶消化后分离成纤维细胞。优选使用含有抗生素的缓冲液清洗皮肤组织;分离成纤维细胞优选包括使用70μm细胞筛过滤收集细胞。
71.分散酶优选为0.2~0.5%w/v分散酶dispase ii,分散酶的消化条件优选为2~6℃消化12~24h;分散酶工作浓度例如可以为但不限于为0.2、0.25、0.3、0.35、0.4、0.45、0.5%w/v;消化温度例如可以为但不限于为2、3、4、5或6℃,消化时间例如可以为但不限于为16、17或18h。优选地分散酶消化条件为:0.25%w/v分散酶dispase ii于4℃冰箱中过夜消化16~18h。
72.胶原酶优选为0.2~0.5%w/v的i型胶原酶,消化条件优选为35~38℃消化2~4h。胶原酶工作浓度例如可以为但不限于为0.2、0.25、0.3、0.35、0.4、0.45、0.5%w/v;消化温度例如可以为但不限于为35、36、37或38℃;消化时间例如可以为但不限于为2、3或4h。优选地胶原酶消化条件为:0.25%w/v的i型胶原酶于37℃消化2~4h。
73.用于培养成纤维细胞的培养基可选地为本领域可接受的常用的细胞培养基,本发明对此不做限制,在一些可选地实施例中采用含有血清的高糖dmem,具体的实例如含有体积百分比为10%胎牛血清的高糖dmem。当成纤维细胞来源于人体废弃皮肤组织,属于原代细胞,在培养前期可添加本领域可接受的抗生素,例如链霉素和/或青霉素。
74.在使用peficitinib诱导成纤维细胞向毛乳头样细胞转分化的步骤中,优选使用含有peficitinib的诱导培养基培养成纤维细胞,使成纤维细胞向毛乳头样细胞转分化。诱导培养基中peficitinib的浓度优选为2~10μm,例如可以为但不限于为2、3、4、5、6、7、8、9或10μm,优选为10μm。peficitinib的浓度经过了实验验证得到,浓度过低会导致转分化的效果变差,过高会造成严重的细胞毒性,且实验发现浓度为10μm时诱导转分化效果最佳。
75.诱导培养基中除去peficitinib外,还可以含有本领域可接受的常规的用于培养细胞的基础培养基,本发明对此不做限制,在一些可选地实施例中采用含有血清的高糖dmem,具体的实例如含有体积百分比为10%胎牛血清的高糖dmem。诱导培养的优选方式如下:
76.(a)将成纤维细胞接种在细胞培养皿上,采用基础培养基培养,将细胞置于37℃、5%co2培养箱中培养;
77.(b)24h后,弃基础培养基,更换诱导培养基,继续诱导培养6~10天,优选诱导培养8天,其中每两天更换一次新的诱导培养基,获得从成纤维细胞中转分化的毛乳头样细胞。
78.在一些优选的实施方式中,所述制备方法还包括采用碱性磷酸酶染色和检测相关毛乳头特异性标志基因的表达情况判断成纤维细胞是否向毛乳头样细胞转分化成功,将转分化成功的毛乳头样细胞继续进行3d培养。
79.采用碱性磷酸酶染色是由于毛囊是高度再生并且已知表达alp的,以往的报道表明,毛乳头在整个毛囊周期中都存在高水平的alp活性,毛乳头细胞中alp高表达的特征已被用作在整个毛囊周期中区分毛乳头与其他毛囊结构的一种简单可靠的方法。mcelwee等人发现高表达alp活性的低代次毛乳头细胞在移植到受体的耳部皮肤伤口时可以诱导毛囊形成,而高代次失去alp活性的毛乳头细胞不能产生毛囊。由此可见,在毛囊中,alp活性不仅是一种特异性的毛乳头细胞标志物,也是反映其毛发诱导能力的关键标志物。检测相关毛乳头特异性标志基因的表达情况可以鉴定转分化后得到的细胞的基本特征,可采用提取总rna进行qrt-pcr的方式检测。
80.目前体外培养dp细胞的主要目的之一是用于研究它们在毛发生长和再生中的作用。然而,2d培养的dp细胞在体外继代培养过程中逐渐丢失其毛发诱导能力。而3d球体的形成可显著增强体外培养dp细胞的毛发诱导能力。研究表明3d培养形成的球体可部分恢复体内dp细胞的基因表达特征,进而恢复其相关的毛发诱导特性。因此进一步对peficitinib诱导后的细胞进行3d培养并通过体内毛囊重建验证其毛发诱导能力。3d培养的培养时间优选为培养24~48h,例如可以为但不限于为24、30、36、42或48h。
81.根据本发明的另一个方面,本发明还提供了一种采用上述方法得到的毛乳头样细胞,采用上述方法制备得到的毛乳头样细胞,具有诱导毛发生长的能力,且表达毛乳头细胞的特异性标志基因α-sma和vcan。在由人包皮成纤维细胞转分化成的毛乳头样细胞中还表达毛乳头细胞的特异性标志基因nog。
82.根据本发明的另一个方面,本发明还提供了一种诱导成纤维细胞分化成毛乳头样细胞的诱导培养基,所述诱导培养基中含有工作浓度为2~10μm的peficitinib,优选为10μm。诱导培养基中除去peficitinib外,还含有本领域可接受的常规的用于培养细胞的物质,例如用于供给细胞营养和促使细胞生殖增殖的基础物质,以及用于维持细胞生长环境的物质;具体的实例例如可以为但不限于为糖、氨基酸、缓冲物质、抗生素、生长因子、维生素、无机离子和血清中的一种或多种。本发明提供的诱导培养基可以诱导成纤维细胞转分化为具有诱导毛囊再生和毛发生长能力的毛乳头样细胞。
83.基于本发明提供的成纤维细胞向毛乳头样细胞转分化的方法的有益效果,以及基于该发明构思获得的毛乳头样细胞和诱导培养基,本发明还提供了上述的成纤维细胞向毛乳头样细胞转分化的方法,上述毛乳头样细胞,或上述诱导培养基在非诊断和治疗目的的毛囊再生中的应用,或在制备用于毛囊再生的产品中的应用。通过本发明体外转分化获得的毛乳头样细胞可以获得大量的用于毛囊再生的细胞,为毛囊再生的研究提供了大量的原料;降低了制备用于毛囊再生的产品的成本。
84.根据本发明的另一个方面,本发明还提供了一种用于毛囊再生的产品,所述产品包含上述毛乳头样细胞,或上述诱导培养基。
85.下面结合优选实施例进一步说明本发明的技术方案和技术效果。
86.下述实施例中如无其他说明,使用的基础培养基为含有10%胎牛血清的高糖dmem;诱导培养基为在基础培养基的基础上添加目标浓度的peficitinib。
87.实施例1
88.人包皮成纤维细胞的提取及鉴定:
89.新鲜的人包皮组织取自实施常规包皮环切手术患者,术中切下的包皮组织放入含生理盐水或pbs的离心管中置于冰中带回实验室并立即开始处理。使用含2%双抗的无菌pbs反复冲洗包皮组织3~5遍后,在体式解剖镜下尽量剔除多余的脂肪组织。用无菌剪刀将包皮组织剪成小块,加入0.25%分散酶(dispase ii)于4℃冰箱中过夜消化16~18h,分离真表皮,将真皮部分使用无菌剪刀剪成小块,使用0.25%的i型胶原酶于37℃消化2~4h。将含有细胞的消化液通过70μm细胞筛进行过滤,离心,pbs清洗2~3次后,使用完全培养基(dmem+10%fbs+1%双抗)重悬细胞,将细胞转移至培养皿中,放置于37℃、5%co2培养箱中培养,每3天换液一次,直到细胞长满进行传代。将分离提取的原代人包皮成纤维细胞接种至细胞爬片中,使用免疫荧光染色对其进行鉴定。
90.结果如图1a所示,所分离出来的细胞具有典型的成纤维细胞形态:细胞细长、呈纺锤体、具有明显的细胞边界;继续生长直至完全汇合,汇合区域的细胞以平行排列的方式彼此靠近生长。成纤维细胞合成细胞外基质和胶原蛋白,其中i型和iii型胶原蛋白(collagen i和collagen iii)在皮肤成纤维中高表达。此外,成纤维细胞特异性蛋白1(fsp-1)是成纤维细胞标记物,也被称为s100a4,是细胞内蛋白s100超家族的成员。免疫荧光染色(图1b)显示几乎所有细胞都高水平表达s100a4、collagen i和collagen iii,进一步验证了从包皮中分离培养的细胞为成纤维细胞。
91.实施例2
92.为了探索小分子在诱导成纤维细胞向毛乳头细胞命运改变的潜在作用,对fda批准上市的药物库中的小分子进行了系统的筛选和分析。将实施例1中制备的原代人包皮成纤维细胞接种于96孔板中,24h贴壁后,更换含有10μm浓度待测小分子的培养基,每四天换液一次,第8天进行alp染色。以dmso处理作为对照的人包皮成纤维细胞在染色后不显示蓝紫色,而能显示蓝紫色的小分子被筛选出来。为了进一步确认可诱导人成纤维细胞向毛乳头细胞转分化的小分子,利用qrt-pcr方法检测多个毛乳头细胞标志基因的表达情况,可对初筛得到的alp染色阳性小分子进行复筛,最终筛选得到小分子药物peficitinib,并对其浓度进行了进一步的筛选。
93.结果如图2a所示,peficitinib诱导后细胞形态发生改变,并显示出强烈的碱性磷酸酶活性;如图2b~2d所示,alpl、vcan和α-sma等毛乳头细胞特异性标志基因表达上调;且在10μm浓度诱导下,毛乳头标志基因alpl、vcan和α-sma的表达量最高,为其最佳诱导浓度;如图2e免疫荧光染色结果显示,peficitinib诱导后毛乳头体外培养的标志基因(a-sma)的表达。
94.实施例3
95.为了验证peficitinib诱导人包皮成纤维细胞向dp细胞转分化效率,进一步分离提取原代人头皮毛囊dp细胞作为阳性对照。采用酶消化结合显微切割的方法对dp进行分离提取。取植发手术患者后枕部的头皮毛囊用于dp细胞的提取,将毛囊标本放入含无菌生理盐水的离心管中,置于冰上带回实验室立即进行处理。在体式解剖镜下小心去除毛囊周围
的皮肤组织和脂肪组织。剪取毛囊下段包含dp的毛球部,转移到含0.25%i型胶原酶的15ml离心管中,37℃消化2~3h。消化完成后,在体视解剖镜下收集完全脱离的dp,若dp未完全脱离,可使用1ml注射器针头轻轻剥下dp使其完全分离。分离后的dp使用pbs清洗2次。于6孔板中加入2ml dp商业培养基,每孔中放置2~3个dp进行培养。静置3天,观察dp贴壁情况,贴壁后细胞从dp中迁出。迁出的dp细胞长满后,取一孔进行alp染色,其余传代培养后用于免疫荧光染色(p1)和rna提取(p2)。
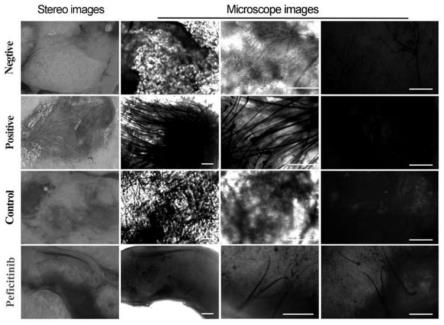
96.如图3a所示,处理前的单个毛囊末端带有完整的火焰状dp结构。培养3天后,dp贴壁,周围开始有呈多角形或短梭形细胞迁出;培养第6天,细胞以dp为中心呈放射性生长;培养第18天,dp细胞融合后,呈多层聚集性生长。为了进一步鉴定分离得到的dp细胞。首先对提取的dp细胞进行alp染色。如图3b所示,细胞外植体生长(p0)的dp细胞中心显示出强烈的alp活性。免疫荧光染色结果如图3c所示,所分离出来的原代dp细胞(p1)(原代的dp细胞传代1次后的细胞)表达特异性标志物(a-sma、vim、vcan以及sox2)。
97.通过qrt-pcr检测peficitinib诱导后的人包皮成纤维细胞和p2代dp细胞中特异性标志基因的表达,进一步评估peficitinib诱导人包皮成纤维细胞向dp细胞的转分化效率。如图4a~4e所示(其中,hdp为原代人头皮毛囊dp细胞;con为原代人包皮成纤维细胞;peficitinib为实施例2中peficitinib诱导后的原代人包皮成纤维细胞),a-sma、nog、vcan、sox2和lef1在p2代次的dp细胞中的表达均显著高于原代人包皮成纤维细胞。而在peficitinib诱导后的人包皮成纤维细胞中,α-sma、nog的表达显著高于原代dp细胞;vcan的表达提高至与原代dp细胞相当的水平,与原代dp细胞无显著性差异;而sox2和lef1的表达水平仍然远低于原代dp细胞。这些结果表明peficitinib诱导人包皮成纤维细胞与原代dp细胞并不完全一致,因此,可将这种peficitinib诱导人包皮成纤维细胞后得到的细胞称为dp样细胞。
98.实施例4
99.收集peficitinib诱导后的人包皮成纤维细胞,按照10000cells/孔的细胞密度接种于圆底超低附着96孔板中进行3d培养,dmso处理的人包皮成纤维细胞同样进行3d培养作为对照。为了更好的使细胞形成一个完整的球体,将接种后的细胞在96孔板中进行短暂的低速离心。结果如图5a所示,离心后的细胞聚集在孔中心位置呈一个巨大的圆形,随着培养时间,细胞聚集成一个立体的球形。
100.人包皮成纤维细胞经peficitinib诱导与3d培养后,采用patch assay进行体内毛囊重建实验,收集3d培养的细胞球与新生鼠角质细胞混合,通过皮下注射的方式将细胞混合物移植至裸鼠背部皮下。新生鼠成纤维细胞和新生鼠角质细胞的混合作为阳性对照,单独新生鼠角质细胞作为阴性对照,细胞注射部位可产生肉眼可见的鼓包。由于该方法形成的毛囊位于皮肤内侧,不易观察毛发生长的部位。为了追踪移植细胞的部位,将dmso处理和peficitinib诱导后的细胞在3d培养前使用荧光染料dii进行标记。dii即diic18(3),全称为1,1'-dioctadecyl-3,3,3',3'-tetramethylindocarbocyanine perchlorate,是最常用的细胞膜荧光探针之一,呈现橙红色荧光。dii作为一种亲脂性膜染料,在进入细胞膜后可以侧向扩散从而使整个细胞的细胞膜逐渐被染色。如图5a所示,dii标记后的细胞经过3d培养后在荧光显微镜下呈现为一个鲜艳的红色球体。
101.细胞移植四周后,取细胞移植部位在体式解剖镜和显微镜下观察毛发的生长情
况。结果如图5b所示(其中,negtive组为单独新生鼠角质细胞;positive为新生鼠成纤维细胞和新生鼠角质细胞的混合;control为dmso处理后的人包皮成纤维细胞与新生鼠角质细胞混合;peficitinib为peficitinib诱导后的人包皮成纤维细胞与新生鼠角质细胞混合),与预期结果一致的是,移植新生鼠成纤维细胞混合物的阳性对照长出大量的毛发,而移植单独角质细胞的阴性对照无毛发生长。dmso处理的人包皮成纤维细胞在3d培养后无毛发生长,而peficitinib诱导后的人包皮成纤维细胞结合3d培养能够诱导产生完整的毛发结构。
102.实施例5
103.人头皮成纤维细胞的提取及鉴定。新鲜的人头皮标本取自毛发移植手术中废弃的头皮组织,将其收集在生理盐水的离心管中,置于冰盒中带回实验室并立即处理。使用含2%双抗的无菌pbs反复冲洗头皮组织3~5遍。由于废弃的头皮组织很小,清洗后直接放入含有0.25%分散酶(dispase ii)的15ml离心管中,在4℃冰箱中过夜消化16~18h。在体式解剖镜下将头皮的表皮层从真皮层中撕下,留下真皮部分,放入含0.25%i型胶原酶的15ml离心管中,于37℃培养箱中消化2~4h。每隔30min观察一次消化情况并摇晃离心管,当消化溶液变得浑浊,真皮组织几乎消化不见时,表示已消化完成,加入含有血清的完全培养基(dmem+10%fbs+1%双抗)终止消化。将包含有细胞的消化液经过70μm细胞筛进行过滤后,转移至15ml离心管中。1000rpm离心5min后弃上清,pbs重悬后离心,重复2次。使用完全培养基(dmem+10%fbs+1%双抗)重悬细胞,转移至培养皿中,放置于37℃、5%co2培养箱培养,每3天换液一次,直到细胞长满进行传代。将分离提取的原代人头皮成纤维细胞接种至细胞爬片中,使用免疫荧光染色对其进行鉴定。
104.结果如图6所示,所分离的细胞来自毛囊周围紧贴表皮下方的乳头状真皮层,表现出典型的成纤维细胞形态。免疫荧光染色结果显示出s100a4、collagen i和collagen iii的高水平表达,从形态学和免疫荧光染色鉴定出从头皮组织中所分离的组织为成纤维细胞。
105.实施例6
106.为了进一步评估小分子药物对人头皮成纤维细胞的诱导效率,同样以原代dp细胞(p2)(原代的dp细胞传代2次后的细胞)为对照,通过qrt-pcr检测小分子药物peficitinib诱导后人头皮成纤维细胞和原代dp细胞中dp标志基因的表达情况。结果如图7所示,peficitinib诱导后细胞形态发生改变,alp活性增强,且显著增强了dp细胞标志基因的表达,与原代dp细胞相比,具有更高的表达水平。进一步对peficitinib诱导人头皮成纤维细胞的浓度进行优化,在10μm浓度下可诱导人头皮成纤维细胞中alp、vcan和α-sma的表达显著高于原代dp细胞。与包皮成纤维细胞一致,10μm的浓度同样是peficitinib诱导人头皮成纤维细胞的最佳浓度。
107.实施例7
108.为了进一步探究peficitinib诱导人头皮成纤维细胞结合3d培养的毛发诱导能力,分别收集dmso处理和peficitinib诱导后的人头皮成纤维细胞,使用dil细胞膜探针标记后,按照10000cells/孔的细胞密度接种于圆底超低附着96孔中进行3d培养。48小时内收集细胞球体与新生鼠角质细胞混合注射至裸鼠背部皮内,新生鼠成纤维细胞与新生鼠角质细胞的混合作为阳性对照,单独角质细胞注射作为阴性对照。4周后,取皮观察毛发生长情况。体内毛囊重建结果显示,阳性对照生长出大量的毛发,而单独注射角质细胞的阴性对照
无毛发生长,确保了实验组结果的可靠性。如图8所示,dmso处理的人头皮成纤维细胞经过3d培养后在裸鼠体内诱导产生了黑色团状的毛囊样结构和色素沉着,但无完整毛发结构产生,可能是由于所分离的头皮成纤维是与毛乳头细胞具有共同成纤维祖细胞来源的乳头状真皮成纤维细胞。而3d培养结合peficitinib诱导后的人头皮成纤维细胞组产生了具有完整结构的毛发;表明peficitinib成功诱导人头皮成纤维细胞转分化为具有毛发诱导能力的dp样细胞。
109.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1