一种用于间充质干细胞迁移筛选的肿瘤微流控芯片及其制备和应用方法
本发明属于生物,涉及一种间充质干细胞的肿瘤趋化性的监测装置,尤其涉及一种用于间充质干细胞迁移筛选的肿瘤微流控芯片及其制备和应用方法。
背景技术:
1、恶性肿瘤是目前严重威胁全人类健康的世界性难题,据美国癌症协会报道的数据显示2020年全球分别有将近1930万新确诊肿瘤患者和1000万肿瘤死亡的患者。铂类等化疗药物已广泛用于肿瘤治疗,但易引起全身毒性和耐药,因此,建立一种精准靶向地药物递送平台对实现肿瘤精准治疗具有重要意义。
2、间充质干细胞(mesenchymal stem cells,mscs)是一类具有自我更新和多向分化潜能的细胞群。mscs组织来源广泛,易扩增,免疫原性低,且研究已证明mscs对恶性肿瘤组织具有独特的迁移趋化性,表明mscs是一种理想的药物靶向递送的载体。然而,尽管不同组织来源的mscs具有相似的形态和免疫表型,它们在增殖、细胞因子分泌以及细胞迁移能力等生物学行为上存在差异。因此,比较并筛选出拥有最强肿瘤迁移趋化能力的mscs尤为重要。
3、评价细胞迁移特性的模型分为体内和体外模型。体外细胞迁移模型较体内模型成本低、操作简单,可避免动物实验涉及的伦理问题,也可避免人类与实验动物种属特异性差异造成实验结果不一致的现象。传统的体外模型主要依赖于划痕实验法和transwell实验法,但划痕实验重复性较差,且易损伤细胞,transwell实验操作复杂且不适合实时动态监测。
4、微流控芯片技术因其结构设计灵活和规模集成的优势,已在细胞操控和分析领域得到迅速发展。微流控芯片的管道尺寸在微米量级,细胞和试剂消耗少,且能较好地模拟体内微环境,不损伤细胞,适合动态观察。然而,目前用于监测细胞迁移的多为单通道芯片,具有通量低,集成度差,实验重复性差等缺陷。此外,在同一块微流控芯片上同时实现多种mscs对肿瘤细胞迁移趋化性的监测和筛选的研究分析还处于空白阶段。
技术实现思路
1、本发明针对上述现有技术的不足,提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片及其制备和应用方法,该肿瘤微流控芯片实现了多种类型间充质干细胞和肿瘤细胞的同步共培养,操作简单,降低了实际样品的用量,并模拟人间充质干细胞对肿瘤细胞的趋化性并同步比较差异,能够为筛选肿瘤靶向治疗高效药物载体提供理论依据。
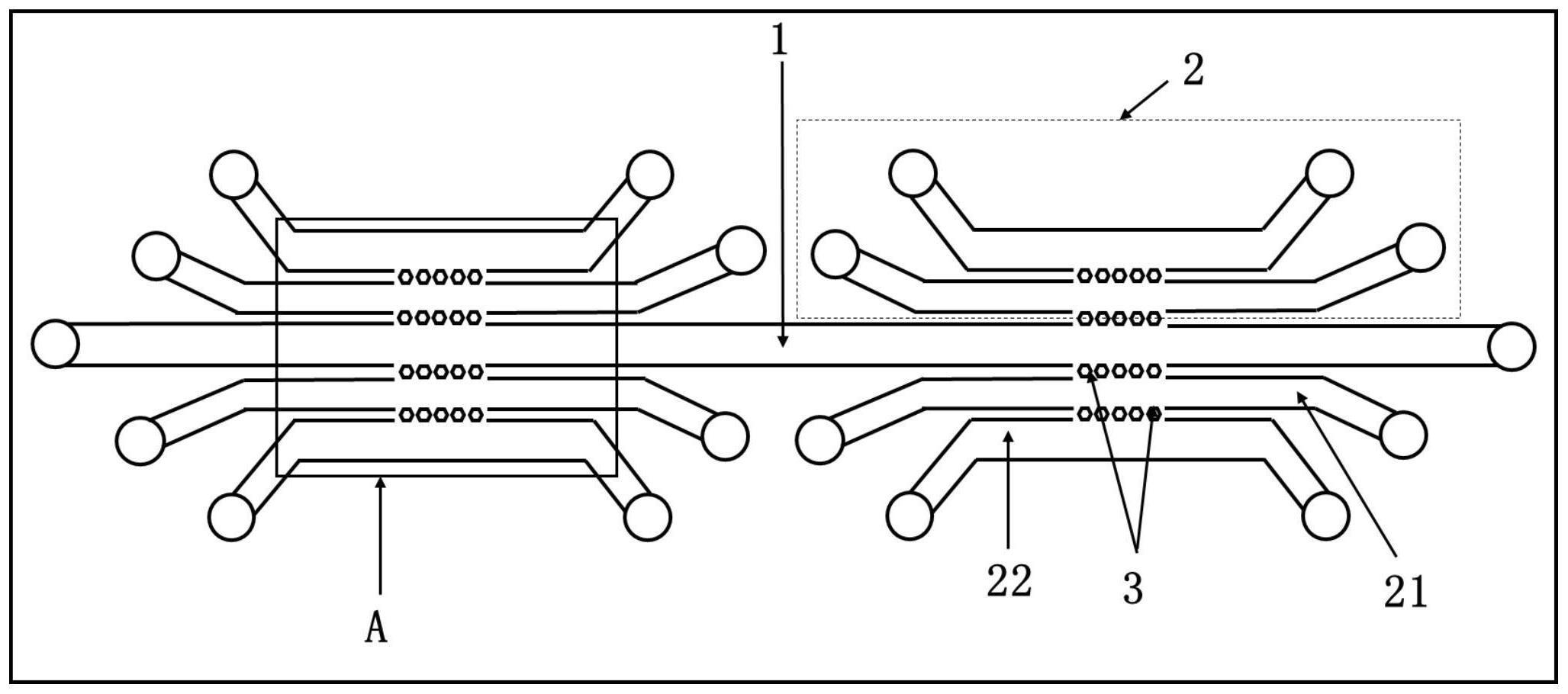
2、为实现上述目的,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,具有这样的特征:包括表面加工出微结构通道的芯片主体和紧密贴合在芯片主体上的基板;芯片主体上的微结构通道包括一条中央细胞培养通道和若干个对称排列在中央细胞培养通道两侧的相互独立的细胞迁移单元;所述细胞迁移单元包括一条内侧的基质胶灌注通道和一条外侧的迁移细胞培养通道;中央细胞培养通道和各基质胶灌注通道、迁移细胞培养通道的两端均具有进样口和出样口;所述中央细胞培养通道用于肿瘤细胞的培养;基质胶灌注通道用于基质胶的填充;若干迁移细胞培养通道用于不同组织来源间充质干细胞的培养;所述中央细胞培养通道与各细胞迁移单元的基质胶灌注通道之间、以及同一细胞迁移单元的基质胶灌注通道与迁移细胞培养通道之间均设有截流结构,截流结构由若干间隔设置的柱状结构构成,中央细胞培养通道与各细胞迁移单元的基质胶灌注通道、以及同一细胞迁移单元的基质胶灌注通道与迁移细胞培养通道通过截流结构进行细胞之间的信号传输和相互作用以及细胞迁移。
3、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,还可以具有这样的特征:其中,所述细胞迁移单元中,基质胶灌注通道和迁移细胞培养通道的两端均向外侧方向弯折。
4、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,还可以具有这样的特征:其中,所述芯片主体的材料为聚二甲基硅氧烷、聚甲基丙烯酸甲酯或聚碳酸酯;所述基板的材料为玻璃或硅片。
5、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,还可以具有这样的特征:其中,所述芯片主体与基板通过等离子体键合工艺实现两者之间的紧密贴合。
6、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,还可以具有这样的特征:其中,所述中央细胞培养通道和迁移细胞培养通道培养肿瘤细胞和间充质干细胞前涂覆有培养基质,培养基质为明胶、壳聚糖、丝素蛋白、鼠尾胶原蛋白、纤维蛋白胶、基质胶中的一种或几种。
7、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片,还可以具有这样的特征:其中,所述芯片主体的中央细胞培养通道和各基质胶灌注通道、迁移细胞培养通道均位于同一平面,且宽度和高度均相同,分别为1000μm和100μm;基质胶灌注通道的长度为1.0cm,迁移细胞培养通的长度为0.8cm,中央细胞培养通道的长度根据细胞迁移单元的数量而定;所述截流结构由5个六棱柱结构等间距排列而成,各六棱柱结构的边长为100μm,六棱柱结构之间的间距为50μm。
8、本发明还提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片的制备方法,具有这样的特征:包括以下步骤:步骤一、用计算机辅助软件设计和绘制所述芯片主体的微结构通道图形;步骤二、通过微加工技术制备具有微结构通道的芯片主体,通过手动打孔器制备中央细胞培养通道和各基质胶灌注通道、迁移细胞培养通道的进样口及出样口;步骤三、将芯片主体和基板用无水乙醇清洗后,进行高压灭菌处理,最后进行等离子体键合,得到微流控芯片。
9、本发明还提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片的应用方法,具有这样的特征:包括以下步骤:
10、步骤一、微流控芯片的预处理:取三个微流控芯片,分别为实验用微流控芯片、正常细胞对照用微流控芯片和空白对照用微流控芯片;涂覆培养基质:对于各微流控芯片,向所述中央细胞培养通道和各迁移细胞培养通道填充培养基质溶液,然后将微流控芯片置于37℃恒温箱中1小时,使中央细胞培养通道和各迁移细胞培养通道的表面涂覆上培养基质;恢复疏水性:对于各微流控芯片,用无菌水冲洗中央细胞培养通道和各迁移细胞培养通道中多余的培养基质溶液,将微流控芯片置于80℃的烘箱中1-2小时,使微流控芯片干燥并恢复疏水性;
11、步骤二、荧光标记细胞:取生长状态良好的肿瘤细胞株、与肿瘤细胞同器官来源的正常细胞株和不同组织来源间充质干细胞,用活细胞示踪剂分别标记肿瘤细胞、与肿瘤细胞同器官来源的正常细胞和各间充质干细胞,其中,标记肿瘤细胞、与肿瘤细胞同器官来源的正常细胞的活细胞示踪剂的颜色与标记间充质干细胞的活细胞示踪剂的颜色不同;
12、步骤三、接种及培养细胞:对于各微流控芯片,将基质胶注入基质胶灌注通道,将微流控芯片放入37℃培养箱30分钟,促进基质胶固化;将活细胞示踪剂标记的肿瘤细胞和与肿瘤细胞同器官来源的正常细胞分别加入培养基配制成细胞悬液,然后分别种植于实验用微流控芯片和正常细胞对照用微流控芯片的中央细胞培养通道;将培养基灌入空白对照用微流控芯片的中央细胞培养通道;将各活细胞示踪剂标记的间充质干细胞分别加入培养基配制成细胞悬液,然后分别种植于各微流控芯片的不同细胞迁移单元的移细胞培养通道,三个微流控芯进行相同的种植;将三个微流控芯片放入培养箱孵育;
13、步骤四、观察和监测细胞的迁移:待间充质干细胞贴壁后,取出微流控芯片在倒置荧光显微镜下观察并记录不同间充质干细胞在各基质胶灌注通道的迁移情况,记为0小时;继续培养n小时后,取出微流控芯片在倒置荧光显微镜下观察并记录不同间充质干细胞在相应基质胶灌注通道的迁移情况,记为n小时;用软件测量并比较n小时内不同间充质干细胞向肿瘤细胞、与肿瘤细胞同器官来源的正常细胞及培养基的趋化迁移的迁移面积和最大迁移距离。
14、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片的应用方法,还可以具有这样的特征:其中,涂覆培养基质前,对微流控芯片进行无菌处理;无菌处理方法为:用75%酒精(体积分数)润洗中央细胞培养通道和各基质胶灌注通道、迁移细胞培养通道,然后将微流控芯片置于紫外光照射下灭菌过夜,待75%酒精完全挥发后再涂覆培养基质。
15、进一步,本发明提供一种用于间充质干细胞迁移筛选的肿瘤微流控芯片的应用方法,还可以具有这样的特征:其中,步骤三中,种植于中央细胞培养通道的肿瘤细胞和与肿瘤细胞同器官来源的正常细胞的细胞悬液的细胞密度为2×106/ml;种植于移细胞培养通道的间充质干细胞的细胞悬液的细胞密度为1×106/ml。
16、本发明的有益效果在于:本发明从mscs特异的肿瘤趋化性出发,依托微流控芯片技术,提供了一种用于间充质干细胞迁移筛选的肿瘤微流控芯片及其制备和应用方法,该微流控芯片实现了多种类型mscs和肿瘤细胞的同步共培养,并可实现同步比较不同类型mscs趋化性的差异。具体的:
17、一、本发明的微流控芯片包含多个通道,所有通道尺寸均在微米量级,细胞和试剂消耗量极少,降低成本,减少细胞损伤;
18、二、本发明涉及的微流控芯片包含一条用于肿瘤细胞培养的中央细胞培养通道和多个对称排列在中央细胞培养通道两侧的独立的细胞迁移单元集成度高,能够同时实现对多种组织来源mscs迁移特性的观察和监测,和划痕实验及transwell实验相比,降低了成本,提高实验效率,且实验重复性更好;
19、三、本发明的微流控芯片的各细胞迁移单元均包含一条基质胶灌注通道,可在三维层面观测不同mscs的迁移能力;
20、四、本发明的微流控芯片实现了多种类型mscs和肿瘤细胞的同步共培养,操作简单,降低了实际样品的用量,并模拟人间充质干细胞对肿瘤细胞的趋化性并同步比较差异,能够为筛选肿瘤靶向治疗高效药物载体提供理论依据。
- 还没有人留言评论。精彩留言会获得点赞!