适用于停滞棒杆菌的启动子及应用
1.本发明属于生物工程技术领域,具体涉及适用于停滞棒杆菌的启动子及应用。
背景技术:
2.基因表达是指基因经过转录、翻译等,产生有生物活性的rna或蛋白,表现出其储存的遗传信息的过程,受多个水平不同因素的调控。无论在真核生物体内还是在原核生物体内,大多数的调控事件发生在转录水平。转录不仅是基因表达的第一步,还是控制基因活动的关键步骤;而启动子是转录水平调控的重要参与者。
3.启动子(promoters)是rna聚合酶识别、结合开始转录启动的一段dna序列,它含有rna聚合酶特异性结合和转录起始所需的保守序列,多数位于结构基因转录起始点的上游。这样的启动子本身不被转录,但有一些启动子(如trna启动子)位于转录起始点的下游,这些dna序列也可以被转录。启动子的活性受到多种因素的影响,而在基因的异源表达中,常常需要根据实际需求选择不同活性的启动子
4.棒状杆菌属微生物是一类重要的细菌属,很多的棒状细菌作为工业生产模式菌株,很多被作为蛋白与优良代谢产物生产的宿主,目前实现了多种蛋白、氨基酸、代谢物等的高效生产,然而,依旧存在在棒状杆菌中代谢物、蛋白表达难、表达效率低的问题。
技术实现要素:
5.为了克服现有技术的不足,本发明提供适用于停滞棒杆菌的启动子,以解决现有技术中的棒状杆菌中代谢物、蛋白表达难、表达效率低的问题。
6.本发明的目的是提供适用于停滞棒杆菌的启动子,所述的启动子序列为seq id no:5、seq id no:6和seq id no:7中的任意一个。
7.适用于停滞棒杆菌的启动子在高效表达目的蛋白中的应用,将本发明的启动子导入停滞棒杆菌中,可提高停滞棒杆菌生产目的蛋白的能力。
8.为达到上述目的,本发明采取以下技术措施:
9.为得到适用于停滞棒杆菌的启动子,构建启动子文库,所述启动子文库模板核心区域-35、-10来源于谷氨酸棒杆菌atcc13032丙酮酸羧化酶(pyc)启动子序列,其启动子核心序列如下所示:
10.nnnnnnttgattnnnnnnnnnnnnnnntannatnnnnnn
11.适用于停滞棒杆菌的启动子,所述的启动子序列为seq id no:5所示;或seqidn:6所示;或seq id no:7所示:
12.seq id no.5:
13.aaccggttgatttaaagatccttaggatatcattcaatt;
14.seq id no.6:
15.tgaaaattgatttaaacttgggcatgttaagataagtgg;
16.seq id no.7:
17.agattattgattttccgtgttagccgttatcatagtagc;
18.适用于停滞棒杆菌的启动子在提高停滞棒杆菌目的蛋白表达量中的应用,将本发明提供的启动子,导入地衣芽孢杆菌中,可提高蛋白表达;将所述的启动子启动目的基因的表达可提高蛋白表达量。
19.以上所述的应用中,优选的,所述目的蛋白为绿色荧光蛋白和α-淀粉酶;
20.以上所述的应用中,优选的,所述停滞棒杆菌为停滞棒杆菌atcc6872。
21.以上实施例所提供的适用于停滞棒杆菌的启动子及其在高效表达目的产物的应用具有以下有益效果:
22.1、本发明通过将启动子导入至棒杆菌内,实现停滞棒杆菌目的蛋白的高水平表达,克服了现有启动子强度低、棒状细菌中代谢物、蛋白表达难、表达效率低的问题,从而达到进一步提高目的蛋白合成的目的,实现了比现有棒杆菌psod启动子高2.63倍与2.36倍的gfp蛋白及α-淀粉酶表达水平。
23.2、通过确定所述启动子的核心区的-35区(6bp)、-10区(6bp)、核心间隔区(15-18bp),从而挑选出全新的具有表达功能的启动子,运用于停滞棒杆菌基因表达与目的蛋白产生中,进一步使启动子介导表达的基因在整个发酵周期都能有效表达,而且所用的启动子核心区域来源于谷氨酸棒杆菌atcc13032丙酮酸羧化酶(pyc)启动子序列,因此所述启动子能受谷氨酸棒杆菌中σ因子识别的结构域,从而实现导入的启动子可以提高停滞棒状杆菌目的蛋白的产量。
24.3、在构建启动子文库中,在保证启动子核心区固定情况下人工的为启动子两端设计添加bsaⅰ酶切位点及延伸保护序列组成启动子模板,在启动子两端设计添加bsaⅰ酶切位点不仅灵活实用,适合于构建所有简单和复杂的表达载体,而且后续载体构建工作快捷、高效,加快了对本发明启动子对停滞棒杆菌目的蛋白产量水平的研究。
附图说明
25.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图示出的结构获得其他的附图。
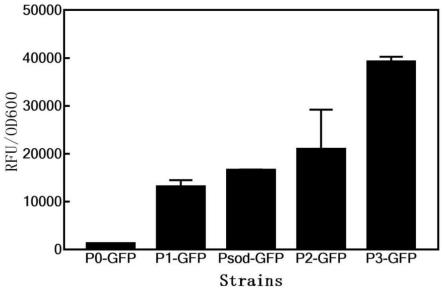
26.图1为在seq id no:5-7启动子调控下,对gfp分泌表达影响示意图;
27.图2为在seq id no:5-7启动子调控下,对α-淀粉酶分泌表达影响示意图。
具体实施方式
28.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
29.需要说明,若本发明实施例中有涉及方向性指示(诸如上、下、左、右、前、后
……
),则该方向性指示仅用于解释在某一特定姿态下各部件之间的相对位置关系、运动情况等,如果该特定姿态发生改变时,则该方向性指示也相应地随之改变。
30.另外,若本发明实施例中有涉及“第一”、“第二”等的描述,则该“第一”、“第二”等的描述仅用于描述目的,而不能理解为指示或暗示其相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有“第一”、“第二”的特征可以明示或者隐含地包括至少一个该特征。另外,若全文中出现的“和/或”或者“及/或”,其含义包括三个并列的方案,以“a和/或b”为例,包括a方案、或b方案、或a和b同时满足的方案。另外,各个实施例之间的技术方案可以相互结合,但是必须是以本领域普通技术人员能够实现为基础,当技术方案的结合出现相互矛盾或无法实现时应当认为这种技术方案的结合不存在,也不在本发明要求的保护范围之内。
31.本发明的棒状杆菌为停滞棒状杆菌atcc6872。
32.lb培养基(g/l):胰蛋白胨10g/l、酵母抽提物5g/l、nbcl10g/l。
33.lbb培养基(g/l):胰蛋白胨10g/l、酵母抽提物5g/l、nbcl10g/l、bhi10g/l。
34.lbhis培养基(g/l):蛋白胨5g/l、酵母提取物2.5g/l、nbcl5g/l、bhi18.5g/l、山梨醇91g/l、琼脂16g/l。
35.gfp表达水平检测的测定方法:
36.将0.2ml菌株发酵液加入至ep管中,再往ep管中加入1.8ml去离子水,混合均匀后,使用可见光分光光度计测生物量,再用酶标仪检测荧光强度并记录对应荧光值3次。
37.α-淀粉酶(bmye)表达水平检测方法:
38.将菌株接种于2ml的lbb培养基(抗性菌株添加终浓度为20μg/ml的卡那霉素)中过夜培养后,再转接于10mllbb培养基中在30℃、220rpm培养24小时,获得细胞发酵液。淀粉酶活性的测定方法采用enzchek
tm
淀粉酶检测试剂盒(货号e33651)。反应底物为细胞破碎后的上清液,上清液由细胞破碎发酵液离心获得,离心条件为6000rpm。酶活性的一个单位(u/ml)定义为在20℃、ph值6.9、3分钟内从淀粉中释放1毫克麦芽糖所需的酶量。每株菌做三次生物学重复。
39.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
40.本发明所述技术方案,如未特别说明,均为本领域的常规方案;所述试剂或材料,如未特别说明,均来源于商业渠道。
41.其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性地与其他实施例互相排斥的实施例。
42.实施例1
43.适用于停滞棒杆菌的启动子的获得
44.本发明的启动子,是通过来自于谷氨酸棒杆菌atcc13032丙酮酸羧化酶(pyc)启动子序列,确定其核心区域-35、-10区,生成的启动子文库,其文库序列为:
45.tagctnnnnnnatnntannnnnnnnnnnnnnnaatcaannnnnncaggt
46.进一步,于启动子两端设计添加bsbⅰ酶切位点及延伸保护序列组成模板(启动子文库由金唯智生物科技有限公司合成)。所述的启动子核苷酸序列文库如下所述:
47.aaaggtctctagctnnnnnnatnntannnnnnnnnnnnnnnaatcaannnnnncaggtgagacccgtgagcta
48.s1:使用引物promoter-f(seq id no.1)对得到的启动子文库进行退火扩增,得到启动子双链片段。用nbnodropspectrophotometer进行核酸浓度检测,70ng/μl待用。
49.s2:将得到的启动子双链片段与p19_ptp_kbnr_bsbi质粒载体(seq id no.2)在t4连接酶、bsbⅰ限制性内切酶进行goldengbte,得到含有启动子的重组质粒p19_promoter_gfp。
50.s3:将得到的重组质粒p19_promoter_gfp化转进入大肠杆菌dh5α,涂布于含40μl/ml卡那霉素的lb固体培养基中过夜培养后,将生长于平板上的菌落用2ml含40μl/ml卡那霉素lb液体培养基洗入试管中再次隔夜培养后提取质粒,用nbnodropspectrophotometer进行浓度检测并于201ng/μl,-20℃保存。
51.s4:将从s3中得到的启动子质粒,通过电转将p19_promoter_gfp导入停滞棒杆菌atcc6872中,涂布于lbhis固体培养基上,以卡那霉素作为筛选标记,得到在蓝光下显荧光的重组菌株。
52.s5:将从s4中得到的重组菌株共计挑选出101株,接入含lbb液体培养基的孔板中,800rpm/min培养22小时,取发酵液加水稀释20倍,分别测od600和荧光强度(激发波长485nm,发射波长515nm)。标准化的gfp表达水平以荧光强度比od600表示,最终确定三株重组菌株分别命名为c.stb_p1_gfp、c.stb_p2_gfp、c.stb_p3_gfp,用引物p-f(seq id no.3)p-r(seq id no.4)进行菌落pcr,测序得到启动子p1、p2、p3其核苷酸序列如seq id no.5、seq id no.6、seq id no.7所示。
53.实施例2:启动子p1-p3在停滞棒杆菌中表达gfp外源蛋白的表达量
54.ss1:使用引物psod-f(seq id no.8)和psod-r(seq id no.9)扩增出含有谷氨酸棒杆菌超氧化物歧化酶的启动子psod编码序列的核苷酸片段如seq id no.10所示。
55.ss2:将得到的启动子双链片段与p19_ptp_kbnr_bsbi质粒载体在t4连接酶、bsbⅰ限制性内切酶进行goldengbte,得到含有psod启动子的重组质粒p19_psod_gfp。
56.ss3:将ss2得到的重组质粒p19_psod_gfp转入停滞棒杆菌atcc6872中,涂布于lbhis固体培养基,以卡那霉素作为筛选标记,得到在蓝光下显荧光的重组菌株c.stb-gfp-psod。
57.ss4:重组菌株种子活化:以带有空载质粒的停滞棒杆菌c.stb_p0_gfp为阴型对照、重组菌株c.stb-gfp-psod、c.stb_p1_gfp、c.stb_p2_gfp、c.stb_p3_gfp接种于2mllbb液体培养基(20μl/ml卡那霉素)于30℃、转速220rpm中培养12小时,得到种子培养液。
58.所述发酵培养基为lbb培养基。
59.ss5:将ss4中的种子培养液以相同初始od接种于装有10mllbb发酵培养基的50ml三角瓶中,于30℃、转速220rpm的摇床中发酵培养24小时,得到发酵菌液。
60.ss6:gfp表达水平检测:将0.2ml菌株发酵液加入至ep管中,再往ep管中加入1.8ml去离子水,混合均匀后,使用可见光分光光度计测生物量(od600),再用酶标仪检测荧光强度并记录对应荧光值3次。标准化的gfp表达水平以荧光强度比od600表示。
61.ss7:请参阅图1,实验证明:以带有空载质粒的停滞棒杆菌c.stb_p0_gfp为阴型对照,相对荧光强度为1.19
×
103,启动子p1介导表达的gfp相对荧光强度为1.30
×
104;启动子p2的介导表达的gfp相对荧光强度为2.09
×
104;启动子p3的介导表达的gfp相对荧光强度为3.92
×
104;启动子psod介导的gfp相对荧光强度为1.66
×
104,启动子p3效果最佳,相较于
启动子psod介导的gfp荧光强度提高2.63倍。
62.实施例3:启动子p1-p3在提高停滞棒杆菌中α-淀粉酶蛋白的表达量
63.s101:使用引物bmy-f(seq id no.11)和bmy-r(seq id no.12)以枯草芽孢杆菌(bbcillussubtilis)基因组为模板扩增出含有α-淀粉酶(α-bmylbseec3.2.1.1)的基因序列如seq id no.13所示。
64.s102:用p19-frb1-r(seq id no.14)和p19-frb1-f(seq id no.15)对p19_ptp_kbnr_bsbipcr获得片段1,p19-frb2-f(seq id no.16)和p19-frb2-r(seq id no.17)对p19_ptp_kbnr_bsbipcr获得片段2,将得到的片段1和片段2两个片段和seq id no.13的的基因片段进行gibson组装,得到p19-ptp-bmy-kbnr_bsbi再分别将启动子psod、p1、p2、p3和p19_ptp_bmy_kbnr_bsbi进行goldengbte,分别得到质粒p19_psod_bmy、p19_p1_bmy、p19_p2_bmy、p19_p3_bmy。
65.s103:将s102得到的重组质粒转入停滞棒杆菌atcc6872中,涂布于lbhis固体培养基,以卡那霉素作为筛选标记,通过测序得到重组菌株c.stb_psod_amy、c.stb_p1_amy、c.stb_p2_amy、c.stb_p3_amy。
66.s104:重组菌株种子活化:以带有空载质粒的c.stb_p0_bmy菌株为阴性对照,重组菌株c.stb_psod_amy、c.stb_p1_amy、c.stb_p2_amy、c.stb_p3_amy接种于2mllbb液体培养基(20μl/ml卡那霉素)于30℃、转速220rpm中培养12小时,得到种子培养液。
67.所述发酵培养基为lbb培养基。
68.s105:将s103中的种子培养液以同一初始od接种于装有10mllbb发酵培养基的50ml三角瓶中,于30℃、转速220rpm的摇床中发酵培养24小时,得到发酵菌液。
69.s106:α-淀粉酶(bmye)表达水平检测:淀粉酶活性的测定方法采用enzchektm淀粉酶检测试剂盒(货号e33651)。将发酵菌液经过细胞破碎后离心取上清液,离心条件为6000rpm。酶活性的一个单位(u/ml)定义为在20℃、ph值6.9、3分钟内从淀粉中释放1毫克麦芽糖所需的酶量,每株菌做三次生物学重复。
70.s107:请参阅图2,实验证明:带有空载质粒的停滞棒杆菌α淀粉酶的酶活4.3u/ml;启动子p1的介导表达的重组菌株α淀粉酶的酶活6.99u/ml;启动子p2的介导表达的重组菌株α淀粉酶的酶活8.7u/ml;启动子p3的介导表达的重组菌株α淀粉酶的酶活为17.91u/ml;启动子psod介导的重组菌株α淀粉酶的酶活为7.59u/ml,启动子p3效果最佳,相较于启动子psod介导的α淀粉酶的酶活提高2.36倍。
71.以上所述仅为本发明的优选实施例,并非因此限制本发明的专利范围,凡是在本发明的发明构思下,利用本发明说明书及附图内容所作的等效结构变换,或直接/间接运用在其他相关的技术领域均包括在本发明的专利保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1