邻苯二甲酰亚胺基离子液体制备及利用其催化合成α-烷基不饱和环状碳酸酯的方法
邻苯二甲酰亚胺基离子液体制备及利用其催化合成
α-烷基不饱和环状碳酸酯的方法
技术领域
1.本发明属于环境友好催化技术领域,具体涉及一种新型邻苯二甲酰亚胺基离子液体、制备方法和利用该离子液体催化二氧化碳(co2)与丙炔醇反应合成α-烷基不饱和环状碳酸酯的方法。
背景技术:
2.随着大气中co2含量的增加以及其所造成的温室效应,大规模碳捕获和碳储存是实现碳减排及应对全球变暖的主要方法。co2是一种廉价、无毒、可再生的c1资源。通常使用路易斯碱性链烷醇胺水溶液,如2-羟基乙胺、n-甲基二乙醇胺以及1,1,3,3-四甲基胍、邻苯二甲酰亚胺等作为co2捕获剂。由于co2具有热力学稳定及动力学惰性的特点,所以此类一般都需要在高温高压的条件下催化该反应,反应条件比较苛刻。co2可以转化为多种高附加值化合物,如甲醇、尿素、喹唑啉二酮、环状碳酸酯和α-烷基不饱和环状碳酸酯等。同时,这也符合绿色可持续发展的要求。
3.利用离子液体催化co2与丙炔醇的环加成反应是目前最有效及应用最广泛的方法。但大多数离子液体都存在一种或多种不足,如:催化活性低、重复使用效果不好、反应条件苛刻等。因此,有必要探索一种可以在温和条件下、具有高催化活性及重复使用性的离子液体。
技术实现要素:
4.为了解决现有合成α-烷基不饱和环状碳酸酯方法中存在催化活性低、重复使用效果不好、反应条件苛刻等技术缺陷问题,本发明旨在提供一种新型邻苯二甲酰亚胺基离子液体,利用该离子液体催化合成α-烷基不饱和环状碳酸酯可以在常温常压下进行,催化活性高且重复使用效果好。
5.本发明还提供了上述新型邻苯二甲酰亚胺基离子液体的制备方法及利用其催化合成α-烷基不饱和环状碳酸酯的方法。
6.为达到上述目的,本发明采用以下技术方案:
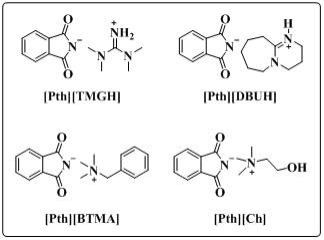
7.新型邻苯二甲酰亚胺基离子液体,其具有如下所示的任一结构式:
[0008][0009]
本发明提供了一种上述新型邻苯二甲酰亚胺基离子液体的制备方法,其包括如下步骤:
[0010]
邻苯二甲酰亚胺与1,1,3,3-四甲基胍、1,8-二氮杂双环[5.4.0]十一碳-7-烯、苄基三甲基氢氧化铵或氢氧化胆碱在溶剂存在条件下,室温反应6~18h,反应结束后,经旋蒸、洗涤、干燥即得。
[0011]
上述新型邻苯二甲酰亚胺基离子液体的合成路线如下所示:
[0012][0013]
上述新型邻苯二甲酰亚胺基离子液体的制备方法,具体的,所述邻苯二甲酰亚胺与1,1,3,3-四甲基胍、1,8-二氮杂双环[5.4.0]十一碳-7-烯、苄基三甲基氢氧化铵或氢氧化胆碱的摩尔比为1∶1~1.2;所述溶剂为甲醇或乙醇等。
[0014]
本发明还提供了一种利用上述邻苯二甲酰亚胺基离子液体催化合成α-烷基不饱和环状碳酸酯的方法,其具体为:将邻苯二甲酰亚胺基离子液体与丙炔醇按一定摩尔比加入反应釜中,封闭反应釜并通入co2,在一定反应压强、一定反应温度条件下进行环加成反应,即合成得到α-烷基不饱和环状碳酸酯。
[0015]
上述利用邻苯二甲酰亚胺基离子液体催化合成α-烷基不饱和环状碳酸酯的方法,所述丙炔醇可以为下述任一结构的化合物:所述丙炔醇可以为下述任一结构的化合物:
[0016]
为了获得较高的收率,上述利用邻苯二甲酰亚胺基离子液体催化合成α-烷基不饱和环状碳酸酯的方法,进一步优选的,邻苯二甲酰亚胺基离子液体与丙炔醇的摩尔比为0.5~7∶100,进一步优选的为1~7∶100,最优选为2~5∶100。环加成反应的反应压强为0.1~1mpa。环加成反应的反应温度为30
±
5℃。环加成反应的反应时间为3~11h,优选7~11h。在该条件下,产物α-烷基不饱和环状碳酸酯的收率约98.7%,选择性>99%。
[0017]
进一步的,上述利用邻苯二甲酰亚胺基离子液体催化合成α-烷基不饱和环状碳酸酯的方法,还可以在环加成反应过程中加入助催化剂(如agoac、ag2co3、agbr或agi等),助催化剂与丙炔醇的摩尔比为0.5~5∶100,优选0.7~1∶100。
[0018]
本发明提供了一种利用新型邻苯二甲酰亚胺基离子液体催化co2和丙炔醇制备α-烷基不饱和环状碳酸酯的方法,即以新型邻苯二甲酰亚胺基离子液体为催化剂,在温和条件下,不使用溶剂,使co2和丙炔醇通过环加成反应合成α-烷基不饱和环状碳酸酯。co2与丙炔醇通过环加成反应制备α-烷基不饱和环状碳酸酯的反应方程式如下:
[0019][0020]
式中r和r'构成以下结构的底物:
[0021][0022]
和现有技术相比,本发明的有益效果如下:
[0023]
1)本发明所提供的四种新型邻苯二甲酰亚胺基离子液体[pth][tmgh]、[pth][dbuh]、[pth][btma]和[pth][ch]能够在温和、无有机溶剂条件下高效地催化co2和丙炔醇生成α-烷基不饱和环状碳酸酯。该催化剂能够催化不同丙炔醇与co2的环加成反应,且表现出了优异的普适性;
[0024]
2)本发明解决了现有利用co2和丙炔醇合成α-烷基不饱和环状碳酸酯的方法中存在催化剂性能不高、反应条件苛刻、使用有机溶剂等缺陷问题,以新型邻苯二甲酰亚胺基离子液体为催化剂,在0.1~1mpa、30
±
5℃下催化丙炔醇和co2进行环加成反应生成α-烷基不饱和环状碳酸酯,最高产率可达98.7%;
[0025]
3)本发明新型邻苯二甲酰亚胺基离子液体催化co2和丙炔醇能够循环使用多次,催化生成α-烷基不饱和环状碳酸酯后可以在加入正己烷条件下很容易分离出来,经过简单的洗涤和干燥即可重新得到固体状的离子液体,循环利用性能较好,降低了成本。该催化剂催化co2与丙炔醇的环加成反应中活性高、反应条件温和、无溶剂、操作安全性高,有非常好的工业应用前景。
附图说明
[0026]
图1和图2分别为实施例1中制备的[pth][tmgh]催化剂的核磁共振氢谱和碳谱;
[0027]
图3和图4分别为实施例1中制备的[pth][dbuh]催化剂的核磁共振氢谱和碳谱;
[0028]
图5和图6分别为是实施例1中制备的[pth][btma]催化剂的核磁共振氢谱和碳谱;
[0029]
图7和图8分别为是实施例1中制备的[pth][ch]催化剂的核磁共振氢谱和碳谱。
具体实施方式
[0030]
本发明将结合具体实施方式作进一步详细说明,以下实施例只用于说明本发明,
并不是本发明的限定。
[0031]
下述实施例中,如无特殊说明,所用原料均为本领域可以直接购买到的普通市售产品。所述室温指代25
±
5℃。
[0032]
实施例1
[0033]
本实施例制备的新型邻苯二甲酰亚胺基离子液体催化剂结构式如下所示:
[0034][0035]
通过以下步骤合成离子液体[pth][tmgh]:
[0036]
在100ml单口瓶中,将0.03mol(4.4g)邻苯二甲酰亚胺和0.03mol(3.5g)1,1,3,3-四甲基胍(tmg)溶解于30ml溶剂甲醇中,在室温条件下搅拌反应12h。反应结束后,旋蒸除去甲醇,然后用乙酸乙酯洗涤,在50℃条件下干燥12h,得到白色固体[pth][tmgh]。其核磁共振氢谱、碳谱分别见图1和2。
[0037]
参考上述方法,将第一步反应中的原料tmg分别替换为1,8-二氮杂双环[5.4.0]十一碳-7-烯、苄基三甲基氢氧化铵和氢氧化胆碱,最终分别得到新型邻苯二甲酰亚胺基离子液体[pth][dbuh]、[pth][btma]和[pth][ch];其核磁共振氢谱、碳谱分别见图3、4,图5、6,和图7、8。
[0038]
图1和2数据如下:[pth][tmgh]:1h nmr(300mhz,deuterium oxide)δ7.63
–
7.37(m,4h),2.88(d,j=0.7hz,12h).
13
c nmr(101mhz,dmso)δ179.71,163.05,137.22,131.86,120.86。
[0039]
图3和4数据如下:[pth][dbuh]:1h nmr(300mhz,deuterium oxide)δ7.64
–
7.43(m,4h),3.61
–
3.46(m,4h),3.31(t,j=5.9hz,2h),2.61(dd,j=7.3,3.1hz,2h),2.08
–
1.93(m,2h),1.70(dt,j=12.9,4.5hz,6h).
13
c nmr(101mhz,dmso)δ181.19,164.63,137.93,131.80,120.84,53.32,48.21,39.08,32.65,28.96,26.96,24.51,20.18。
[0040]
图5和6数据如下:[pth][btma]:1h nmr(400mhz,dmso-d6)δ7.62
–
7.46(m,5h),7.46
–
7.28(m,4h),4.62(s,2h),3.08(s,9h).
13
c nmr(101mhz,dmso)δ185.46,139.90,133.33,130.70,130.57,129.34,128.94,119.80,68.11,52.15,40.63,40.43,40.22,40.01,39.80,39.59,39.38。
[0041]
图7和8数据如下:[pth][ch]:1h nmr(400mhz,dmso-d6)δ7.72
–
7.63(m,1h),7.37
–
7.26(m,2h),7.21(ddd,j=7.8,6.5,2.2hz,1h),3.84(dt,j=5.4,2.6hz,2h),3.44
–
3.38(m,2h),3.11(s,9h).
13
c nmr(101mhz,dmso)δ172.61,169.38,143.67,130.99,129.56,128.76,127.94,125.84,67.00,55.05,53.12,39.93,39.72,39.51,39.30,39.09。
[0042]
从图1至8的核磁共振氢谱、碳谱图及相应的核磁数据分析中可知:所合成的催化剂为目标催化剂。
[0043]
实施例2
[0044]
在50ml带有数显压力表的不锈钢反应釜中,加入实施例1制备的0.15mmol[pth][tmgh]主催化剂、0.05mmol agoac和5mmol丙炔醇(3-甲基丁炔-3-醇),主催化剂和助催化剂agoac占丙炔醇的摩尔含量分别为3mol%、1mol%,缓慢通入co2排除反应釜内残留空气,封闭反应釜并控制温度为30℃,持续通入co2气体保持压强为0.1mpa,环加成反应9h,反应结束后,产物经气相色谱分析,测得产物α-烷基不饱和环状碳酸酯收率为93.2%,选择性>99%。
[0045]
实施例3
[0046]
具体实验过程与检测方法同实施例2,区别仅在于所使用的主催化剂为[pth][dbuh],测得产物收率为93.6%,选择性>99%。
[0047]
实施例4
[0048]
具体实验过程与检测方法同实施例2,区别仅在于所使用的主催化剂为[pth][btma],测得的产物收率为98.7%,选择性>99%。
[0049]
实施例5
[0050]
具体实验过程与检测方法同实施例2,区别仅在于所使用的主催化剂为[pth][ch],测得的产物收率为1.8%,选择性>99%。
[0051]
实施例6
[0052]
具体实验过程与检测方法同实施例4,区别仅在于未使用助催化剂agoac,测得的产物收率为2.2%,选择性>99%。
[0053]
实施例7
[0054]
具体实验过程与检测方法同实施例4,区别仅在于未使用主催化剂,测得的产物收率为0%,选择性为0%。
[0055]
实施例8
[0056]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂为ag2co3,测得的产物收率为97.2%,选择性>99%。
[0057]
实施例9
[0058]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂为agbr,测得的产物收率为59.7%,选择性>99%。
[0059]
实施例10
[0060]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂为agi,测得的产物收率为26.6%,选择性>99%。
[0061]
实施例11
[0062]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂占丙炔醇摩尔含量为0.5mol%,测得的产物收率为83.4%,选择性>99%。
[0063]
实施例12
[0064]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂占丙炔醇摩尔含量为0.7mol%,测得的产物收率为90.5%,选择性>99%。
[0065]
实施例13
[0066]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂占丙炔醇摩尔含量为3mol%,测得的产物收率为73.7%,选择性>99%。
[0067]
实施例14
[0068]
具体实验过程与检测方法同实施例4,区别仅在于使用的助催化剂占丙炔醇摩尔含量为5mol%,测得的产物收率为13.1%,选择性>99%。
[0069]
实施例15
[0070]
具体实验过程与检测方法同实施例4,区别仅在于主催化剂占丙炔醇摩尔含量为1mol%,测得的产物收率为45.7%,选择性>99%。
[0071]
实施例16
[0072]
具体实验过程与检测方法同实施例4,区别仅在于主催化剂占丙炔醇摩尔含量为2mol%,测得的产物收率为94.3%,选择性>99%。
[0073]
实施例17
[0074]
具体实验过程与检测方法同实施例4,区别仅在于主催化剂占丙炔醇摩尔含量为5mol%,测得的产物收率为92.5%,选择性>99%。
[0075]
实施例18
[0076]
具体实验过程与检测方法同实施例4,区别仅在于主催化剂占丙炔醇摩尔含量为7mol%,测得的产物收率为85.6%,选择性>99%。
[0077]
实施例19
[0078]
具体实验过程与检测方法同实施例4,区别仅在于反应时间为3h,测得的产物收率为83.7%,选择性>99%。
[0079]
实施例20
[0080]
具体实验过程与检测方法同实施例4,区别仅在于反应时间为5h,测得的产物收率为88.7%,选择性>99%。
[0081]
实施例21
[0082]
具体实验过程与检测方法同实施例4,区别仅在于反应时间为7h,测得的产物收率为93.9%,选择性>99%。
[0083]
实施例22
[0084]
具体实验过程与检测方法同实施例4,区别仅在于反应时间为11h,测得的产物收率为98.7%,选择性>99%。
[0085]
实施例23
[0086]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为3-甲基-1-戊烯-4-炔-3-醇,测得的产物收率为95.3%,选择性>98%。
[0087]
本实验反应方程式为:
[0088][0089]
实施例24
[0090]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为3,5-二甲基-1-己炔-3-醇,测得的产物收率为94.4%,选择性>99%。
[0091]
本实验反应方程式为:
[0092][0093]
实施例25
[0094]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为3-甲基-1-戊炔-3-醇,测得的产物收率为87.6%,选择性>99%。
[0095]
本实验反应方程式为:
[0096][0097]
实施例26
[0098]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为1-乙炔基-1-环戊醇,测得的产物收率为99.2%,选择性>99%。
[0099]
本实验反应方程式为:
[0100][0101]
实施例27
[0102]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为1-乙炔基环己醇,测得的产物收率为66.5%,选择性>99%。
[0103]
本实验反应方程式为:
[0104][0105]
实施例28
[0106]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为3-苯基-2-丙炔-1-醇,测得的产物收率为0%,选择性0%。
[0107]
本实验反应方程式为:
[0108][0109]
实施例29
[0110]
具体实验过程与检测方法同实施例4,区别仅在于使用的丙炔醇为乙基乙炔基甲醇,反应压力为1mpa,测得的产物收率为46.2%,选择性>99%。
[0111]
本实验反应方程式为:
[0112][0113]
实施例30-37
[0114]
具体实验过程与检测方法同实施例4,区别仅在于使用的催化剂为实施例4中回收的[pth][btma]催化剂,在相同条件下进行8次循环回收实验,所得结果见表1。具体回收方法如下:反应结束后,用正己烷(4
×
15ml)萃取反应混合物;上层除去溶剂得到产物,下层由醋酸银和[pth][btma]组成,在60℃真空干燥12h,即可得到回收的[pth][btma]。
[0115]
表1实施例30-37催化剂回收使用催化结果
[0116][0117]
由表1可以看出:8次循环回收后,催化剂仍然具有较好的活性,产品收率在96.2%,选择性为99.6%,催化性能良好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1