一种高效培养赤红球菌的方法及其应用与流程
1.本发明属于生物医药及微生物培养技术领域,尤其涉及一种高效培养赤红球菌的方法及其应用。
背景技术:
2.红球菌属是一类革兰氏阳性菌,广泛分布于自然界的土壤、海底沉积物和食草动物中。目前,红球菌因其具有较好的生物降解、生物修复活性等功能,在石油污染的生物修复和污水处理的环境治理方面有及其重要的应用,在有机染料、农药降解及天然色素等领域也有潜在价值。从红球菌的应用范围来看,主要用于环境治理方面,随着研究深入,现已延伸到生物能源、医药健康等领域。如risa等人开展红球菌对黄曲霉毒素的降解活性研究,发现有18种红球菌对黄曲霉的降解率达到了90%以上,表明红球菌在真菌毒素生物解毒效果显著;又如kuyukina等阐述了红球菌中含多种海藻糖脂类化合物的结构,其中海藻糖单霉菌酸酯、海藻糖双霉菌酸酯具有较强的免疫调节和抗肿瘤活性,不同于分枝杆菌产生的衍生物,其细胞低毒性,更适合于临床应用,这些产物的发现有望从红球菌挖掘得到新颖生物活性分子。
3.赤红球菌作为红球菌中的一员,同样具有广泛的应用领域。如中国专利cn1519312a公开的赤红球菌产生生物乳化剂,明显促进烷烃及多环芳烃的降解,可用于含油废水的生物处理和石油污染的土壤的生物修复。又如中国专利cn103627653a公开了赤红球菌作为降解苯酚的专性菌,可高效去除苯酚,对于解决污水中高浓度酚类污染物有实用意义。又如中国专利cn106434466a公开的用于产天然红色素的赤红球菌,可大规模工业化发酵生产,有巨大的发展潜力。又如中国专利cn105820982a公开的赤红球菌微生物制剂具有修复农药污染土壤及防病促生效果显著,环境安全性好。
4.福建省微生物研究所从海南文昌八门湾红树表层底泥中分离筛选出的产红色素的菌株fim-12,经鉴定,分类属于赤红球菌(rhodococcus ruber),其培养菌体细胞产量为3.5%,所制备的赤红球菌提取物具有毒性低、能显著提高免疫活性及抑瘤作用的功能(详见中国专利cn110184215a),具有很好的潜在应用开发价值。福建省微生物研究所通过对其发酵工艺进行优化,其菌体产量可达4.48-5.08%(详见中国专利cn110184216a),同时诱变育种获得高产菌株rhodococcus ruber fim-12-23,培养该诱变菌株菌体细胞产量达到5.56%(详见中国专利cn110106118a),为其工业化生产奠定了基础,但仍无法满足工业化生产的需求。
5.赤红球菌提取物系赤红球菌菌株经生物发酵、细胞破碎和溶媒处理后的提取物。目前,诸多技术人员尝试通过对菌株的驯化加强其工业利用度,或改善发酵条件增强菌株生物合成能力以提高赤红球菌提取物的产量,但效果并不理想。可见,寻找并解决赤红球菌大规模化生产的技术瓶颈,以实现赤红球菌的高效培养以及下游工艺的优化,对于赤红球菌提取物的广泛开发与推广具有积极的意义。
技术实现要素:
6.为此,本发明所要解决的技术问题在于提供一种高效培养赤红球菌菌体细胞的方法,以解决现有技术中赤红球菌菌体细胞培养量较低的问题;
7.本发明所要解决的第二个技术问题在于提供一种赤红球菌提取物的制备方法。
8.为解决上述技术问题,本发明所述的一种高效培养赤红球菌的方法,包括将赤红球菌发酵菌株接种至发酵培养基,并采用气升式发酵罐进行发酵培养的步骤。
9.具体的,所述高效培养赤红球菌的方法,所述发酵培养步骤的条件包括:控制罐压0.04
±
0.02mpa,通气量0.1-0.5vvm,于30-32℃进行发酵培养48-72h。
10.具体的,所述高效培养赤红球菌的方法,所述发酵培养步骤的通气量控制包括:在发酵前期控制通气量0.1-0.2vvm,当菌体浓度达到10-11%时,提升通气量至0.2-0.5vvm。
11.更优选的,所述发酵培养步骤的条件为:以10%的接种量进行接种,控制罐压0.03mpa,发酵前期控制通气0.1vvm,随着合成菌体细胞增多,当菌体细胞浓度达到10%时,开始提高至0.3vvm。
12.具体的,所述高效培养赤红球菌的方法,所述发酵培养基包括如下质量含量的组分:糊精2.5-4.5%、葡萄糖0.5-1.0%、酵母提取物2.0-3.5%、蛋白胨0.8-1.5%、海盐0.6-1.2%、df103 0.05-1.0%,调ph值7.0-7.5。
13.优选的,所述发酵培养基包括如下质量含量的组分:糊精3.5%、葡萄糖0.8%、酵母提取物3.0%、蛋白胨1.0%、海盐0.9%、df103 0.1%,调ph值7.2,自来水配制。
14.具体的,所述高效培养赤红球菌的方法,所述方法还包括将所述赤红球菌发酵菌株接种于种子培养基中进行种子液培养的步骤;
15.所述种子培养基包括如下质量含量的组分:葡萄糖0.5-1.5%、酵母提取物1.0-2.0%、海盐0.6-1.2%、df103 0.05-1.0%,调ph值7.0-7.5;
16.优选的,所述种子培养基包括如下质量含量的组分:葡萄糖1.0%、酵母提取物1.5%、海盐0.9%、df103 0.1%,调ph值7.2,自来水配制。
17.优选的,所述种子液以2-20%的接种量接种至所述发酵培养基中进行发酵培养。
18.具体的,所述高效培养赤红球菌的方法,所述种子液培养步骤包括摇瓶种子液培养及种子罐种子液培养步骤;
19.所述摇瓶种子液培养步骤条件包括:在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.1-0.5%量接入所述种子培养基的摇瓶中,于27-29℃、控制转速150-200r/min培养32-40h,得到摇瓶种子培养液;
20.优选的,所述摇瓶种子液的培养步骤为:在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,28℃、180r/min培养36h得到摇瓶种子培养液;
21.所述种子罐种子液培养步骤条件包括:将培养好的摇瓶种子培养液以0.2-1.0%的接种量接种到所述种子培养基的种子罐中,控制罐压0.02-0.04mpa、通气量0.8-1vvm、控制转速150-200r/min、温度27-29℃,发酵24-36h,得到所需种子罐种子液;
22.优选的,所述种子罐的培养步骤为:将培养好的摇瓶种子以0.5%的接种量接种于所述种子培养基的种子罐中,培养温度28℃,罐压0.03mpa,通气0.8vvm,在培养期间控制转速180r/min,培养30h至种子成熟。
23.具体的,所述高效培养赤红球菌的方法,所述方法还包括将所述赤红球菌发酵菌
株接种于营养琼脂斜面培养基进行活化培养的步骤;
24.所述固体斜面培养基包括如下质量含量的组分:玉米浆粉0.8-1.2%、牛肉膏0.2-0.4%、nacl 0.3-0.6%、琼脂1.8-2.0%、调ph值7.0-7.4;
25.优选的,所述固体斜面培养基包括如下质量含量的组分:玉米浆粉1.0%、牛肉膏0.3%、nacl 0.5%、琼脂2.0%,调ph值7.2,自来水配制。
26.具体的,所述高效培养赤红球菌的方法,所述赤红球菌发酵菌株包括赤红球菌fim-12-23,其分类命名为赤红球菌rhodococcus ruber,已保藏于中国微生物菌种保藏管理委员会普通微生物中心,其保藏编号为cgmcc no.17526。
27.本发明还公开了一种制备赤红球菌提取物的方法,包括按照所述方法培养赤红球菌菌体的步骤,以及,收集所述赤红球菌菌体并进行提取物制备的步骤。
28.具体的,所述制备赤红球菌提取物的方法,包括如下步骤:
29.(1)按照所述方法培养并收集所述赤红球菌菌体细胞;
30.(2)将所述菌体细胞加水混匀,经反复冻融后,溶解并进行超声波破碎,经分步离心处理,得到细胞壁碎片;优选的,所述分步离心包括低速离心收集上清液的步骤,以及,取上清液高速离心收集细胞壁碎片的步骤;
31.(3)在所述细胞壁碎片中加入磷酸缓冲液、胰蛋白酶和糜蛋白酶混合进行酶解处理,收集酶解物经高速得到细胞壁沉淀物;
32.(4)在所述细胞壁沉淀物中加入含链霉蛋白酶的tris-hcl缓冲液进行酶解处理,收集酶解物经离心得到赤红球菌初提物;
33.(5)将所述赤红球菌初提物进行提纯处理,得到赤红球菌提取物。
34.具体的,所述制备赤红球菌提取物的方法,包括如下步骤:
35.按1:3-6的细胞与水的比例将纯水加入菌体细胞,反复冻融(-80℃、30min后再37-40℃、30min)3-5次后,搅拌溶解进行超声波破碎,镜检跟踪观察细胞破碎情况,经低速离心收集上液,再经高速离心收集细胞壁碎片;
36.以1:3-8比例在细胞壁中加0.07m ph7.6-7.8磷酸缓冲夜(p.b.s)溶解,加入胰蛋白酶(胰凝乳蛋白酶,不低于800u/mg)和糜蛋白酶(1:250,即250u/mg)各40-80mg,控制温度25℃搅拌酶解24-36小时,高速离心弃上液后将收集的细胞壁沉淀用p.b.s洗一次,0.1m ph7.2-7.5 tris-hcl液洗1次,高速离心并收集细胞壁沉淀;
37.按1:3-8比例在细胞壁沉淀中加含20-40mg链霉蛋白酶(810u)的tris-hcl缓冲液,控制温度37℃搅拌酶解24-36小时,高速离心并弃上液后,分别以tris-hcl液,n.s及纯水洗涤,高速离心收集赤红球菌初提物;
38.在赤红球菌初提物中按1:3-7比例分别以乙醇、氯仿、石油醚振荡提取,离心并加乙醇洗涤后于60℃减压干燥,得到赤红球菌提取物。
39.本发明所述高效培养赤红球菌菌体细胞的方法,通过对发酵培养基进行优化,并采用降低剪切力、提高传质能力的气升式发酵培养方式控制空气流量,建立了适应于赤红球菌菌株高产细胞菌体的培养工艺,可促进菌体快速生长,大幅提升赤红球菌菌体细胞的合成能力及细胞量;尤其是,本发明所述方法通过培养发酵方式的优化,在提高微生物菌体细胞产量的同时,所收获的菌体细胞主要形态为长杆状细胞,更有利于菌体细胞的破碎,从而为下游赤红球菌提取物的规模化制备提供基础。
40.本发明所述高效培养赤红球菌菌体细胞的方法,在赤红球菌菌株rhodococcus ruber fim-12-23发酵过程中,惊喜的发现,赤红球菌产量的提高及菌体细胞的易破碎有利于赤红球菌提取物的高效制备,解决了赤红球菌提取物制备技术的瓶颈。当培养菌体的形态为杆状特别是长杆状细胞态时,尤其有利于下游工艺菌体细胞的破碎,可以简化细胞提取物的制备步骤,具有操作简单、成本低、便于大规模工业生产的优势,对赤红球菌提取物制备的工业化研究具有重要的意义。
41.本发明所述高效培养赤红球菌菌体细胞的方法,在赤红球菌菌株rhodococcus ruber fim-12-23发酵过程中,通过发酵培养基及发酵方式的优化,在60l发酵罐发酵实验中合成细胞菌体产量达136.2g/l,大幅提高菌体细胞的合成能力,提高幅度达到139.0%,从而为赤红球菌菌体细胞及其提取物的规模化制备提供基础。
附图说明
42.为了使本发明的内容更容易被清楚的理解,下面根据本发明的具体实施例并结合附图,对本发明作进一步详细的说明,其中,
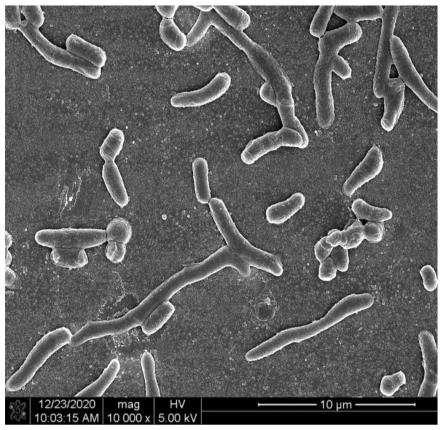
43.图1为本发明实施例2中菌株rhodococcus ruber fim-12-23的60l气升式发酵罐发酵培养菌体细胞形态图;
44.图2为本发明对比例2中菌株rhodococcus ruber fim-12-23的50l搅拌式发酵罐发酵培养菌体细胞形态图。
具体实施方式
45.为了更好地理解本发明,以下通过具体几个实施例对本发明进行进一步地阐述说明,但并不对本发明的保护范围构成任何限制。
46.本发明下述实施例中,涉及赤红球菌菌体细胞发酵培养的菌株为赤红球菌rhodococcus ruber fim-12-23,保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,其保藏编号为cgmcc no.17526,保藏日期为2019年4月3日。
47.实施例1摇瓶发酵
48.将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
49.在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入所述摇瓶种子培养基,28℃、200r/min培养36h,得到摇瓶种子培养液。
50.将所培养的摇瓶种子液按10%接种量接种于摇瓶发酵培养基,于32℃、200r/min培养72h后放瓶,收集菌体细胞,并观察菌体形态。
51.所述种子培养基配制方法:葡萄糖10g、酵母提取物15g、海盐9g、df103 1g,自来水1l,调ph值为ph7.2。
52.所述发酵培养基配制方法:糊精35g、葡萄糖8g、酵母提取物3.0g、蛋白胨10g、海盐9g、df103 1g,自来水1l,调ph值为ph7.2。
53.对比例1
54.本对比例所述发酵赤红球菌菌体细胞的培养方法同实施例1,其区别仅在于,所述
摇瓶发酵培养基使用中国专利cn110106118a中的发酵培养基。
55.所述发酵培养基配制方法:葡萄糖10g,酵母提取物10g,自来水1l,调ph值为ph7.2。
56.上述实施例1及对比例1中摇瓶发酵放瓶后,收集菌体测定细胞量及菌体细胞形态观察,结果见下表1。
57.表1实施例与对比例摇瓶发酵菌体产量/产率与形态的比较
[0058][0059][0060]
表1结果显示,实施例1中三批发酵培养的赤红球菌菌体细胞平均产量126.9g.l-1
,计算产率为42.3g.l-1
.d-1
,其主要细胞形态为短杆;对比例1中三批发酵培养的赤红球菌菌体细胞平均产量56.2g.l-1
,计算产率18.7g.l-1.d-1
,其主要细胞形态为球形。
[0061]
本发明所述方法通过优化发酵培养基发酵,可显著提高赤红球菌菌体细胞的合成能力,其产量较对比例1提高了125.8%,且所培养的菌体细胞主要形态为杆状,有利于后期赤红球菌提取物的分离制备工作。
[0062]
实施例2 60l气升式发酵罐发酵
[0063]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0064]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入所述摇瓶种子培养基,28℃、200r/min培养36h得到摇瓶种子培养液。
[0065]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为ph7.2。
[0066]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,罐压0.02-0.04mpa,通气0.8vvm,转速200r/min,控制温度28℃,培养30h,得到所需种子液。
[0067]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0068]
将上述培养好的种子液以10%的接种量接种到60l气升式发酵罐中,发酵罐培养基装量45l,控制罐压0.03mpa,发酵温度32℃,发酵前期控制通气0.1vvm,随着合成菌体细胞增多,当菌体细胞浓度达到10%时,开始提高至0.3vvm,发酵60h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0069]
上述发酵培养基成分及配制方法:糊精1575g、葡萄糖360g、酵母提取物135g、蛋白胨450g、海盐405g、df103 45g,加自来水,调ph值为7.2,消后培养基量45l。
[0070]
对比例2
[0071]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0072]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,控制转200r/min,28℃培养36h得到摇瓶种子培养液。
[0073]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为7.2。
[0074]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,罐压0.02-0.04mpa,通气0.8vvm,控制转速200r/min,温度28℃,培养30h得到所需种子液。
[0075]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0076]
将上述培养好的种子液以10%的接种量接种到50l(带搅拌叶)发酵罐中,发酵罐培养基装量40l,发酵温度32℃,罐压0.03mpa,通气量为0.8-1.0vvm,控制转速150-200r/min,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0077]
上述发酵培养基成分及配制方法:糊精1400g、葡萄糖320g、酵母提取物120g、蛋白胨400g、海盐360g、df103 40g,加自来水,调ph值为7.2,消后培养基量40l。
[0078]
对比例3
[0079]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0080]
在无菌条件下用接种环将赤红球菌rhodococcus ruber fim-12-23新鲜斜面上的菌层刮下1环的孢子接入摇瓶种子培养基,28℃、200r/min培养36h,得到摇瓶种子培养液。
[0081]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为7.2。
[0082]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,控制温度28℃,罐压0.02-0.04mpa,控制转速200r/min,培养30h得到所需种子液。
[0083]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0084]
将上述培养好的种子液以10%的接种量接种到100l(带搅拌叶)发酵罐中,发酵罐培养基装量70l,发酵温度32℃,罐压0.03mpa,通气量为0.8-1.0vvm,控制转速150-200r/min,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0085]
上述发酵培养基成分及配制方法:糊精2450g、葡萄糖560g、酵母提取物210g、蛋白胨700g、海盐630g、df103 70g,加自来水,调ph值为7.2,消后培养基量70l。
[0086]
对比例4
[0087]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0088]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,28℃、200r/min培养36h,得到摇瓶种子培养液。
[0089]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,
自来水1l,调ph值为ph7.2。
[0090]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,罐压0.02-0.04mpa,通气0.8vvm,控制转速200r/min,控制温度28℃,培养30h得到所需种子液。
[0091]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0092]
将上述培养好的种子液以10%的接种量接种到50l(带搅拌叶)发酵罐中,发酵罐培养基装量35l,罐压0.03mpa,控制通气量为0.8-1.0vvm,发酵温度32℃,转速150-200r/min,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0093]
上述发酵培养基成分及配制方法:葡萄糖350g、酵母提取物350g、df103 35g,加自来水,调ph值为7.2,消后培养基量35l。
[0094]
对比例5
[0095]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0096]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,28℃、200r/min培养36h得到摇瓶种子培养液。
[0097]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为ph7.2。
[0098]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,控制温度28℃,罐压0.02-0.04mpa,通气0.8vvm,控制转速200r/min,培养30h得到所需种子液。
[0099]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0100]
将上述培养好的种子液以10%的接种量接种到100l(带搅拌叶)发酵罐中,发酵罐培养基装量65l,罐压0.03mpa,控制通气0.8-1.0vvm,转速150-200r/min,发酵温度32℃,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0101]
上述发酵培养基成分及配制方法:葡萄糖650g、酵母提取物650g、df103 65g,加自来水,调ph值为7.2,消后培养基量65l。
[0102]
上述实施例2及对比例2-5中发酵罐放罐后,收集菌体测定细胞量及菌体细胞形态观察,结果见下表2,实施例2及对比例2中细胞形态结果见附图1-2所示。
[0103]
表2实施例与对比例罐发酵菌体产量/产率与形态的比较
[0104][0105]
由表2及附图1-2中结果显示,实施例2中三批发酵培养的赤红球菌菌体细胞平均产量136.2g.l-1
,计算产率54.5g.l-1
.d-1
,其主要细胞形态为长杆;而对比例2中三批发酵培养的赤红球菌菌体细胞平均产量仅为114.7g.l-1
,计算产率38.2g.l-1
.d-1
,其菌体形态为球形或短杆;对比例3中三批发酵培养的赤红菌菌体细胞平均产量为108.1g.l-1
,计算产率36.0g.l-1
.d-1
,其菌体形态为球形或短杆;对比例4中三批发酵培养的赤红球菌菌体细胞平均产量53.5g.l-1
,计算产率17.8g.l-1
.d-1
,其菌体形态为球形或短杆;对比例5中三批发酵培养的赤红球菌菌体细胞平均产量53.4g.l-1
,计算产率17.8g.l-1
.d-1
,其菌体主要形态为球形或短杆。
[0106]
可见,本发明所述方法通过优化发酵培养基结合气升式发酵罐控制空气流量培养赤红球菌,降低剪切作用,提高氧传递能力,促进菌体快速生长,其产量提高到136.2g/l、产率较对比4提高两倍(206%),且所培养的菌体细胞主要形态为长杆状,大大利于后期的细胞破碎、高效分离制备赤红球菌提取物。
[0107]
实施例3赤红球菌提取物制备
[0108]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0109]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,控制转200r/min,28℃培养36h,得到摇瓶种子培养液。
[0110]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为7.2。
[0111]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,罐压0.02-0.04mpa,通气0.8vvm,控制转速200r/min,温度28℃,培养30h,得到所需
种子液。
[0112]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0113]
将上述培养好的种子液以10%的接种量接种到50l(带搅拌叶)发酵罐中,发酵罐培养基装量40l,发酵温度32℃,罐压0.03mpa,通气量为0.8-1.0vvm,控制转速150-200r/min,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0114]
上述发酵培养基成分及配制方法:糊精1400g、葡萄糖320g、酵母提取物120g、蛋白胨400g、海盐360g、df103 40g,加自来水,调ph值为7.2,消后培养基量40l。
[0115]
按1:4的细胞与水的比例将纯水加入菌体细胞,反复冻融(-80℃、30min后再37-40℃、30min)3-5次后,搅拌溶解进行超声波破碎(vcx1600美国sonics超声波破碎仪,30-60min),镜检跟踪观察细胞破碎情况,经低速离心(allegra x-15r美国beckman离心机,800*g,15-20min)收集上液,再经高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收集细胞壁碎片。
[0116]
以1:5比例在细胞壁中加0.07m ph7.6-7.8磷酸缓冲夜(p.b.s)溶解,加入胰蛋白酶(胰凝乳蛋白酶,不低于800u/mg)和糜蛋白酶(1:250,即250u/mg)各60mg,控制温度25℃搅拌酶解30小时,高速离心(avanti j-26xpi美国beckman离心机16000rpm*15-20min),弃上液后将收集的细胞壁沉淀用p.b.s洗一次,0.1m ph7.2-7.5tris-hcl液洗1次,高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收集细胞壁沉淀。
[0117]
按1:5比例在细胞壁沉淀中加含30mg链霉蛋白酶(810u)的tris-hcl缓冲液,控制温度37℃搅拌酶解30小时,高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),弃上液后,分别以tris-hcl液,n.s及纯水洗涤,高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收集赤红球菌初提物。
[0118]
在赤红球菌初提物中按1:5比例分别以乙醇、氯仿、石油醚振荡提取,离心(allegra x-15r美国beckman离心机,15℃,3000rpm*10-15min),乙醇洗涤后于60℃减压干燥,得到赤红球菌提取物。
[0119]
对比例6
[0120]
将保存的赤红球菌rhodococcus ruber fim-12-23于营养琼脂固体培养基上28℃培养7d,得到赤红球菌rhodococcus ruber fim-12-23的新鲜斜面。
[0121]
在无菌条件下用n.s洗下新鲜斜面上的菌苔,按0.2%量接入种子培养基,控制转200r/min,28℃培养36h,得到摇瓶种子培养液。
[0122]
上述种子培养基成分及配制方法:葡萄糖10g、酵母提取物15g、海盐9g,df103 1g,自来水1l,调ph值为7.2。
[0123]
将培养好的摇瓶种子培养液以0.5%的接种量接种到10l种子罐中,种子罐培养基装量7l,罐压0.02-0.04mpa,通气0.8vvm,控制转速200r/min,温度28℃,培养30h,得到所需种子液。
[0124]
上述种子培养基成分及配制方法:葡萄糖70g、酵母提取物105g、海盐63g、df103 7g,加自来水,调ph值为7.2,消后培养基量7l。
[0125]
将上述培养好的种子液以10%的接种量接种到50l(带搅拌叶)发酵罐中,发酵罐培养基装量40l,发酵温度32℃,罐压0.03mpa,通气量为0.8-1.0vvm,控制转速150-200r/
min,发酵72h时发酵终止,放罐收集菌体细胞,并观察菌体形态。
[0126]
上述发酵培养基成分及配制方法:糊精1400g、葡萄糖320g、酵母提取物120g、蛋白胨400g、海盐360g、df103 40g,加自来水,调ph值为7.2,消后培养基量40l。
[0127]
按1:4的细胞与水的比例将纯水加入菌体细胞,反复冻融(-80℃、30min后再37-40℃、30min)3-5次后,搅拌溶解进行超声波破碎(vcx1600美国sonics超声波破碎仪,30-60min),镜检跟踪观察细胞破碎情况;经低速离心(allegra x-15r美国beckman离心机,800*g,15-20min)收集上液,再经高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收集细胞壁碎片。
[0128]
以1:5比例在细胞壁中加0.07m ph7.6-7.8磷酸缓冲夜(p.b.s)溶解,加入胰蛋白酶(胰凝乳蛋白酶,不低于800u/mg)和糜蛋白酶(1:250,即250u/mg)各60mg,控制温度25℃搅拌酶解24-36小时,高速离心(avanti j-26xpi美国beckman离心机16000rpm*15-20min),弃上液后将收集的细胞壁沉淀用p.b.s洗一次,0.1m ph7.2-7.5tris-hcl液洗1次,高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收获细胞壁沉淀。
[0129]
按1:5比例在细胞壁沉淀物中加含30mg链霉蛋白酶(810u)的tris-hcl缓冲液,控制温度37℃搅拌酶解30小时,高速离心(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),弃上液后,分别以tris-hcl液,n.s及纯水洗涤,高速离(avanti j-26xpi美国beckman离心机,16000rpm*15-20min),收集赤红球菌初提物。
[0130]
在赤红球菌初提物中按1:5比例分别以乙醇、氯仿、石油醚振荡提取,离心(allegra x-15r美国beckman离心机,15℃,3000rpm*10-15min),乙醇洗涤后于60℃减压干燥,得到赤红球菌提取物。
[0131]
分别将上述实施例3及对比例6放罐收集菌体,细胞破碎与细胞壁碎片收集,细胞壁酶解后溶媒提取赤红球菌初提物,得到类白色赤红球菌提取物,检测结果见下表3。
[0132]
表3实施例与对比例菌体细胞形态与破碎率/赤红球菌提取物收率的比较
[0133][0134]
*收率以100g湿细胞制备赤红球菌提取物量计
[0135]
由表3中结果显示,实施例3中三批发酵的赤红球菌菌体细胞平均破碎率达93.6%,且100g赤红球菌湿菌体细胞平均可制备11.87g赤红球菌提取物;而对比例6赤红球菌菌体细胞平均破碎率低于44.7%,其赤红球菌湿菌体细胞100g平均仅可制备赤红球菌提取物3.51g。
[0136]
可见,本发明所述方法通过优化发酵培养基结合气升式发酵罐控制空气流量培养赤红球菌,可高效生产赤红球菌细胞,菌体生长快且其培养周期短,为赤红球菌提取物的规模化制备奠定基础;同时,发酵培养的菌体呈长杆形态更利于后期的细胞破碎,其菌体细胞
制备赤红球菌提取物的产量大幅度提高。
[0137]
显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1