用于合成黄嘌呤氧化酶抑制剂的中间体的制备方法与流程
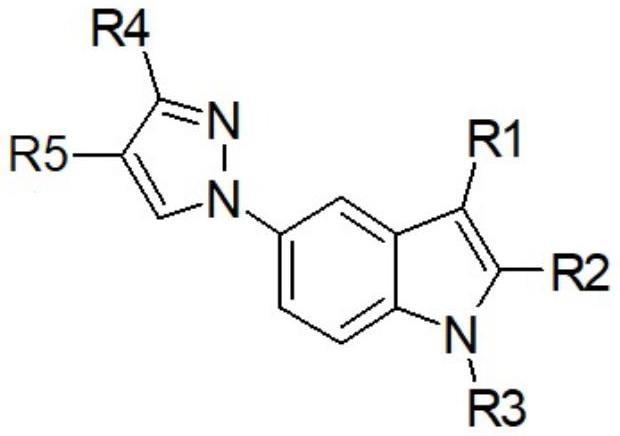
本发明涉及一种用于合成黄嘌呤氧化酶抑制剂的关键中间体的制备方法,更具体地,涉及一种使用廉价的起始材料和c-n偶联反应制备以下化学式2的中间体的新方法:[化学式2]其中r1是氢;r2是氢、卤素、c1-c7烷基、c1-c7烷氧基-c1-c7烷基或苯基;r3是氢;未取代或被选自卤素、c3-c7环烷基或o-r6的取代基取代的c1-c7烷基,其中r6表示c1-c4烷基;c3-c7环烷基;或(其中w表示o或s,r7表示氢或c1-c4烷基,n是0至3的整数);r4是氢、卤素或c1-c7烷基;并且r5是-c(o)or8,其中r8是氢、c1-c7烷基或c3-c7环烷基。
背景技术:
1、已知黄嘌呤氧化酶是一种将次黄嘌呤转化成黄嘌呤并将所形成的黄嘌呤转化成尿酸的酶。由于大多数哺乳动物体内存在的尿酸酶并不存在于人类和黑猩猩体内,因此认为被称为尿酸的物质是嘌呤代谢的最终产物(s.p.bruce,ann.pharm.,2006,40,2187-2194)。血液中尿酸浓度过高会引起多种疾病,痛风就是一个代表性示例。
2、如上所述,痛风是一种由体内尿酸水平过高引起的疾病,并且是指尿酸晶体在关节软骨、韧带和周围组织中积累,从而引起严重的炎症和疼痛的疾患。痛风是一种炎症性关节疾病,在过去的40年中,其发病率稳步上升(n.l.edwards,arthritis&rheumatism,2008,58,2587-2590)。
3、纵观20世纪60年代至90年代中期,西方国家痛风患者的数量惊人地增长了约200%至300%,而且痛风患者以男性为主。肥胖、衰老、肾功能下降、高血压等被认为是痛风患者发病率上升的原因。痛风的发病率为约1.4/1000人,但也因尿酸水平而异。换言之,血液中尿酸水平为7.0mg/dl以上的患者的痛风发病率为0.5%,而血液中尿酸水平为9.0mg/dl以上的患者的痛风发病率为5.5%(g.nuki,medicine,2006,34,417-423)。从发病率可见,血液中的尿酸浓度是导致痛风的重要因素。此外,饮食习惯、酒精、脂质、肥胖等也可能是导致痛风的重要因素。近来,许多研究人员积极进行了对尿酸与心力衰竭、高血压、糖尿病、肾脏疾病和心血管疾病之间的相关性的研究,尿酸管理的重要性日益增加(d.i.feig等,n.eng.j.med,2008,23,1811-1821)。此外,已知黄嘌呤氧化酶抑制剂别嘌呤醇对溃疡性结肠炎有效(aliment.pharmacol.ther.2000,14,1159-1162;wo 2007/043457)。
4、别嘌呤醇是过去40年来唯一用于治疗痛风的药物,直到2009年非布司他在美国被批准作为治痛风药(brain tomlinson,current opin.invest.drugs,2005,6,1168-1178)。已知别嘌呤醇是参与嘌呤和嘧啶代谢的多种酶的非特异性抑制剂,并且对黄嘌呤氧化酶的ki为700nm(y.takano等,life sciences,2005,76,1835-1847)。别嘌呤醇被黄嘌呤氧化酶直接氧化并转化为氧嘌呤醇,已知这种代谢物是非常强的黄嘌呤氧化酶抑制剂。
5、然而,已知别嘌呤醇会引起胃肠道副作用和皮疹,并且长期服用时依从性差。特别地,在服用别嘌呤醇的患者中,有报告称史蒂文斯-约翰逊综合征的不可预测的致命副作用以低比率发生(felix arellano等,ann.pharm.,1993,27,337-43)。已知这种副作用是一种严重的副作用,会导致皮肤和口腔粘膜细胞坏死,如果治疗不当,会导致约25%的病例死亡。
6、因此,已经进行了各种研究以开发新的黄嘌呤氧化酶抑制剂,韩国专利公开号10-2011-0037883公开了一种以下化学式1的新型化合物,该化合物是有效的黄嘌呤氧化酶抑制剂:
7、[化学式1]
8、
9、在化学式1中,
10、a选自以下取代基a-i、a-ii、a-iii、a-iv、a-v、a-vi、a-vii和a-viii,
11、
12、其中
13、j表示氢、卤素或者未取代或被卤素取代的c1-c6-烷基,
14、x是o或s,并且
15、z是c或n,
16、e表示氢、卤素、氰基、硝基、取代或未取代的c1-c6-烷基、或者取代或未取代的c1-c6-烷氧基,
17、d表示氢、卤素、氰基、硝基、未取代或者被卤素取代的c1-c6-烷基、-cho或-ch=n-oh,
18、q选自以下取代基q-i、q-ii和q-iii-1至q-iii-9
19、(q-i)氢;
20、(q-ii)取代或未取代的直链、支链或环状饱和或不饱和烷基;
21、(q-iii-1)
22、
23、(其中w表示o或s,r7表示氢或者取代或未取代的低级烷基,n是0至3的整数);
24、(q-iii-2)
25、
26、(其中w表示o或s,r8和r9各自独立地表示氢或低级烷基,m是1至3的整数);
27、(q-iii-3)
28、
29、(其中r8和r9各自独立地表示氢或低级烷基,m是1至3的整数);
30、(q-iii-4)
31、
32、(其中r10和r11各自独立地表示氢、卤素、低级烷氧基或低级烷基,m是1至3的整数);
33、(q-iii-5)
34、
35、(其中r12表示取代或未取代的低级烷基或芳族基团,n是0至3的整数);
36、(q-iii-6)
37、
38、(其中r13和r14各自独立地表示取代或未取代的低级烷基,或可以形成含n的3元至7元杂环,n是0至3的整数);
39、(q-iii-7)
40、
41、(其中r15表示取代或未取代的低级烷基,m是1至3的整数),
42、(q-iii-8)
43、
44、(其中m是1至3的整数);以及
45、(q-iii-9)
46、
47、(其中r15表示取代或未取代的低级烷基,m是1至3的整数),
48、y表示氢、卤素、取代或未取代的直链、支链或环状饱和或不饱和烷基、取代或未取代的c1-c6-烷氧基、取代或未取代的芳族或杂芳族基团,并且
49、g表示氢或者取代或未取代的直链、支链或环状饱和或不饱和烷基。
50、在该文献的一个具体实施例中,公开了根据以下方案1制备1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸。
51、[方案1]
52、
53、在方案1的第一步中,将1h-吡唑-4-甲酸乙酯和1h-吲哚-5-基硼酸溶解在n,n-二甲基甲酰胺(dmf)中,加入乙酸铜(ii)和吡啶,将混合物室温搅拌3天,以制备1-(1h-吲哚-5-基)吡唑-4-甲酸乙酯。
54、然而,在该方法中,使用吲哚基硼酸作为起始材料,但该材料是一种昂贵的材料,并且有报告称在该材料与1g 1h-吡唑-4-甲酸乙酯反应时,1-(3-氰基-1-异丙基-吲哚-5-基)吡唑-4-甲酸的收率是77%,以及当该化合物按比例放大至18.4g时,收率降至50%,因此存在该方法不优选应用于按比例放大工艺的问题。
技术实现思路
1、技术问题
2、因此,本发明的技术目标是提供一种适合以较低成本批量生产化学式2的化合物的方法,所述化合物是合成优良黄嘌呤氧化酶抑制剂的关键中间体。
3、技术方案
4、为了实现所述目标,本发明提供了一种通过在铜催化剂、碱和配体存在下、在有机溶剂中使化学式3的化合物与化学式4的化合物进行c-n偶联反应来制备化学式2的化合物的方法。
5、[化学式2]
6、
7、[化学式3]
8、
9、[化学式4]
10、
11、在所述化学式中,
12、x是f、cl、br或i,
13、r1是氢;
14、r2是氢、卤素、c1-c7烷基、c1-c7烷氧基-c1-c7烷基或苯基;
15、r3是氢;未取代或被选自卤素、c3-c7环烷基或o-r6的取代基取代的c1-c7烷基,其中r6表示c1-c4烷基;c3-c7环烷基;或(其中w表示o或s,r7表示氢或c1-c4烷基,n是0至3的整数);
16、r4是氢、卤素或c1-c7烷基;并且
17、r5是-c(o)or8,其中r8是氢、c1-c7烷基或c3-c7环烷基。
18、下文将更详细地描述本发明。
19、在本发明中,通过化学式3的化合物与化学式4的化合物的c-n偶联反应,合成了化学式2的中间化合物。
20、在根据本发明的一个实施方式中,可以使用例如选自二甲苯、甲苯、二甲基甲酰胺(dmf)或二甲亚砜(dmso)的一种或多种作为所述方法中的有机溶剂。
21、在根据本发明的另一个实施方式中,可以使用例如选自cui、cu(oac)2、cu、cu2o或cuo的一种或多种作为所述方法中的铜催化剂。
22、在根据本发明的一个实施方式中,可以使用例如选自碳酸钾(k2co3)、碳酸铯(cs2co3)、磷酸三钾(k3po4)、三乙胺(et3n)或叔丁醇钠(naotbu)的一种或多种作为所述方法中的碱。
23、在根据本发明的一个实施方式中,可以使用例如选自1,2-环己二胺、n,n'-二甲基-1,2-环己二胺、n,n'-二甲基乙二胺、1,10-菲咯啉、脯氨酸、肟配体或四齿配体的一种或多种作为所述方法中的配体。
24、有益效果
25、在本发明的制备方法中,由于引入了容易大量商购的化学式3的化合物并且简化了工艺,使得可以按比例扩大,因此能以高收率批量生产化学式2的中间体。
- 还没有人留言评论。精彩留言会获得点赞!
- 一锅法合成托匹司他的方法
- 草本水杨梅在制备黄嘌呤氧化酶抑制剂中的应用
- 5-芳基吡唑并嘧啶衍生物的合成方法
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 2-(5-(4-氟苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺)戊二酸二乙酯的合成方法
- 一种黄嘌呤脱氢酶截断体及其应用
- 5-(4-氟苯基)-N–(3-(二甲基氨基)丙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 一种5-芳基吡唑并[1,5-a]嘧啶衍生物的合成方法