前庭支持细胞启动子和其用途的制作方法
背景技术:
1、前庭功能障碍是重大公共健康问题,其对生活质量有深远影响。大约35%的40岁及以上的美国成年人表现出平衡障碍,并且这个比例随年龄增长而显著增加,导致日常活动中断、情绪和认知下降以及老年人跌倒的盛行率增加。前庭功能障碍通常是获得性的,并且具有多种病因,包括疾病或感染、头部创伤、耳毒性药物和衰老。前庭功能障碍病因中的常见因素是内耳前庭毛细胞损伤。因此,旨在恢复毛细胞功能的疗法将有益于患有前庭功能障碍的患者。已知前庭支持细胞在损伤后自发分化为毛细胞,并因此可用作适于恢复毛细胞功能的治疗靶标。
技术实现思路
1、本发明提供了促进目标基因(例如促进或改进毛细胞或支持细胞功能、再生、成熟、增殖或存活的基因)在特定细胞类型中的表达的组合物和方法。本文所述的组合物和方法涉及可用于诱导转基因在内耳前庭支持细胞(vsc)中的表达的溶质载体家族6成员14(slc6a14)启动子序列。本文所述的slc6a14启动子序列可以可操作地连接至转基因,并且可施用于患者以治疗前庭功能障碍(例如眩晕、头晕、失衡、双侧前庭病、双侧前庭功能低下、振动幻视或平衡障碍)。本文所述的slc6a14启动子序列通过驱动可操作地连接的转基因在前庭支持细胞中的高表达(在其他内耳细胞类型如毛细胞中的表达要低得多)而显示出高的细胞类型特异性。
2、在第一方面,本发明提供了核酸载体,其包含与seq id no:1具有至少85%序列同一性(例如85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同一性)的多核苷酸。在一些实施方案中,多核苷酸具有seq idno:1的至少90%序列。在一些实施方案中,多核苷酸具有seq id no:1的至少95%序列。在一些实施方案中,多核苷酸具有seq id no:1的序列。
3、在一些实施方案中,多核苷酸可操作地连接至转基因。在一些实施方案中,转基因是异源转基因。在一些实施方案中,转基因编码蛋白质(例如治疗蛋白或报告蛋白)、短发夹rna(shrna)、反义寡核苷酸(aso)、核酸酶(例如crispr相关蛋白9(cas9)、转录激活因子样效应物核酸酶(talen)、锌指核酸酶(zfn)或向导rna(grna)),或微小rna。在一些实施方案中,转基因编码蛋白质。
4、在一些实施方案中,多核苷酸引导蛋白质(例如治疗蛋白或报告蛋白)、shrna、aso、核酸酶或微小rna在哺乳动物vsc中的前庭支持细胞(vsc)特异性表达。在一些实施方案中,vsc是人类vsc。
5、在一些实施方案中,由可操作地连接至多核苷酸的转基因编码的蛋白质是婆罗双树样转录因子2(sall2)、钙调蛋白结合转录激活因子1(camta1)、具有yrpw基序2的hes相关家族bhlh转录因子(hey2)、gata结合蛋白2(gata2)、具有yrpw基序1的hes相关家族bhlh转录因子(hey1)、神经酰胺合酶2(lass2)、sry盒10(sox10)、gata结合蛋白3(gata3)、cut样同源异形盒1(cux1)、核受体亚家族2f组成员(nr2f1)、hes相关家族bhlh转录因子(hes1)、rar相关孤儿受体b(rorb)、jun原癌基因ap-1转录因子亚基(jun)、锌指蛋白667(zfp667)、lim同源异形盒3(lhx3)、无义螺旋-环-螺旋1(nhlh1)、max二聚化蛋白4(mxd4)、miz-1型锌指(zmiz1)、髓磷脂转录因子1(myt1)、信号转导子和转录激活因子3(stat3)、barh样同源异形盒1(barhl1)、胸腺细胞选择相关的高迁移率族盒(tox)、prospero同源异形盒1(prox1)、核因子ia(nfia)、甲状腺激素受体β(thrb)、mycl原癌基因bhlh转录因子(mycl1)、赖氨酸去甲基酶5a(kdm5a)、camp反应元件结合蛋白3样4(creb3i4)、ets变体1(etv1)、父系表达的3(peg3)、btb结构域和cnc同源物2(bach2)、isl lim同源异形盒1(isl1)、锌指和含btb结构域的38(zbtb38)、肢芽和心脏发育(lbh)、tubby二分转录因子(tub)、泛素c(hmg20)、re1沉默转录因子(rest)、锌指蛋白827(zfp827)、af4/fmr2家族成员3(aff3)、pbx/有节的1同源异形盒2(pknox2)、富含at的相互作用结构域3b(arid3b)、mlx相互作用蛋白(mlxip)、锌指蛋白(zfp532)、ikaros家族锌指2(ikzf2)、婆罗双树样转录因子1(sall1)、six同源异形盒2(six2)、婆罗双树样转录因子3(sall3)、lin-28同源物b(lin28b)、调节因子x7(rfx7)、脑源性神经营养因子(bdnf)、生长因子非依赖性1转录阻遏子(gfi1)、pou4类同源异形盒3(pou4f3)、myc原癌基因bhlh转录因子(myc)、β-连环蛋白(ctnnb1)、sry盒2(sox2)、sry盒4(sox4)、sry盒11(sox11)、tea结构域转录因子2(tead2)、无调bhlh转录因子1(atoh1)或atoh1变体。
6、在一些实施方案中,由可操作地连接至多核苷酸的转基因编码的蛋白质是atoh1或atoh1变体。在一些实施方案中,atoh1变体具有相对于seq id no:4的一个或多个选自由以下组成的组的氨基酸取代:s328a、s331a、s334a、s328a/s331a、s328a/s334a、s331a/s334a和s328a/s331a/s334。在一些实施方案中,蛋白质是atoh1(例如人类atoh1)。在一些实施方案中,atoh1蛋白包含seq id no:4的序列或其具有一个或多个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个)保守氨基酸取代的变体。在一些实施方案中,atoh1蛋白包含seq id no:6的序列或其具有一个或多个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个)保守氨基酸取代的变体。在一些实施方案中,atoh1蛋白变体中不超过10%(10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少)的氨基酸是保守氨基酸取代。在一些实施方案中,atoh1蛋白具有seq id no:4的序列。在一些实施方案中,atoh1蛋白是由seq id no:5的序列编码。在一些实施方案中,atoh1蛋白具有seq id no:6的序列。在一些实施方案中,atoh1蛋白是由seq id no:7的序列编码。
7、在一些实施方案中,核酸载体还包括反向末端重复序列(itr)。在核酸载体包括可操作地连接至转基因的本发明多核苷酸的实施方案中,核酸载体包括多核苷酸5'的第一itr序列和转基因3'的第二itr序列。在一些实施方案中,itr是aav2 itr。在一些实施方案中,itr与aav2 itr具有至少80%序列同一性(例如至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)。
8、在一些实施方案中,核酸载体还包括多聚腺苷酸化(poly(a))序列。在一些实施方案中,poly(a)序列是牛生长激素(bgh)poly(a)信号序列。在核酸载体包括可操作地连接至转基因的本发明多核苷酸的实施方案中,poly(a)序列定位于转基因的3'。在核酸载体包括第一和第二itr序列以及可操作地连接至转基因的本发明多核苷酸的实施方案中,poly(a)序列定位于转基因的3'和第二itr序列的5'。
9、在一些实施方案中,核酸载体还包括土拨鼠(woodchuck)转录后调节元件(wpre)。在一些实施方案中,wpre具有seq id no:8或seq id no:9的序列。在核酸载体包括可操作地连接至转基因的本发明多核苷酸的实施方案中,wpre定位于转基因的3'。在核酸载体包括可操作地连接至转基因的本发明多核苷酸和poly(a)序列的实施方案中,wpre定位于转基因的3'和poly(a)序列的5'。
10、在一些实施方案中,核酸载体含有包含seq id no:10的核苷酸219-3831的序列的多核苷酸序列。
11、在一些实施方案中,核酸载体含有包含seq id no:11的核苷酸219-3822的序列的多核苷酸序列。
12、在一些实施方案中,本发明的核酸载体包括slc6a14启动子(例如seq id no:1的多核苷酸),其可操作地连接至编码人类atoh1(人类atoh1蛋白=refseq登录号np_005163(seq id no:4);mrna序列=refseq登录号nm_005172)的多核苷酸序列。在一些更具体实施方案中,本发明的核酸载体包括seq id no:1的slc6a14启动子,其可操作地连接至编码人类atoh1的多核苷酸序列(例如编码seq id no:4的多核苷酸序列,例如seq id no:5的多核苷酸序列)。在一些甚至更具体实施方案中,核酸载体以5'至3'顺序包括第一反向末端重复;seq id no:1的slc6a14启动子;可操作地连接至slc6a14启动子的编码人类atoh1的多核苷酸序列;多聚腺苷酸化序列;和第二反向末端重复。在其他更具体实施方案中,核酸载体以5'至3'顺序包括第一反向末端重复;seq id no:1的slc6a14启动子;可操作地连接至slc6a14启动子的编码人类atoh1的多核苷酸序列;wpre;多聚腺苷酸化序列;和第二反向末端重复。在甚至更具体实施方案中,核酸载体包括侧接有反向末端重复的seq id no:10的核苷酸219-3831。在甚至更具体实施方案中,核酸载体包括侧接有反向末端重复的seq idno:10的核苷酸219-3831,其中5'反向末端重复与seq id no:10的核苷酸1-130具有至少80%序列同一性(例如至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性);并且其中3'反向末端重复与seq id no:10的核苷酸3919-4048具有至少80%序列同一性(例如至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)。
13、在一些实施方案中,本发明的核酸载体包括slc6a14启动子(例如seq id no:1的多核苷酸),其可操作地连接至编码鼠类atoh1(鼠类atoh1蛋白=uniprot p48985(seq idno:6);mrna序列=refseq登录号nm_007500.5)的多核苷酸序列。在一些更具体实施方案中,本发明的核酸载体包括seq id no:1的slc6a14启动子,其可操作地连接至编码鼠类atoh1的多核苷酸序列(例如编码seq id no:6的多核苷酸序列,例如seq id no:7的多核苷酸序列)。在一些甚至更具体实施方案中,核酸载体以5'至3'顺序包括第一反向末端重复;seq id no:1的slc6a14启动子;可操作地连接至slc6a14启动子的编码鼠类atoh1的多核苷酸序列;多聚腺苷酸化序列;和第二反向末端重复。在其他更具体实施方案中,核酸载体以5'至3'顺序包括第一反向末端重复;seq id no:1的slc6a14启动子;可操作地连接至slc6a14启动子的编码鼠类atoh1的多核苷酸序列;wpre;多聚腺苷酸化序列;和第二反向末端重复。在甚至更具体实施方案中,核酸载体包括侧接有反向末端重复的seq id no:11的核苷酸219-3822。在甚至更具体实施方案中,核酸载体包括侧接有反向末端重复的seq idno:11的核苷酸219-3822,其中5'反向末端重复与seq id no:11的核苷酸1-130具有至少80%序列同一性(例如至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性);并且其中3'反向末端重复与seq id no:11的核苷酸3910-4039具有至少80%序列同一性(例如至少80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性)。
14、在一些实施方案中,核酸载体是病毒载体、质粒、粘粒或人工染色体。在一些实施方案中,核酸载体是选自包括腺相关病毒(aav)、腺病毒和慢病毒的组的病毒载体。在一些实施方案中,病毒载体是aav载体。在一些实施方案中,aav载体具有aav1、aav2、aav2quad(y-f)、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav10、aav11、rh10、rh39、rh43、rh74、anc80、anc80l65、dj/8、dj/9、7m8、php.b、php.eb或php.s衣壳。在一些实施方案中,aav载体具有aav1衣壳。在一些实施方案中,aav载体具有aav9衣壳。在一些实施方案中,aav载体具有aav6衣壳。在一些实施方案中,aav载体具有aav8衣壳。在一些实施方案中,aav载体具有anc80衣壳。在一些实施方案中,aav载体具有anc80l65衣壳。在一些实施方案中,aav载体具有dj/9衣壳。在一些实施方案中,aav载体具有7m8衣壳。在一些实施方案中,aav载体具有aav2衣壳。在一些实施方案中,aav载体具有php.b衣壳。在一些实施方案中,aav载体具有aav2quad(y-f)衣壳。在一些实施方案中,aav载体具有php.s衣壳。在一些实施方案中,aav载体具有php.eb衣壳。在一些实施方案中,aav载体具有aav3衣壳。在一些实施方案中,aav载体具有aav4衣壳。在一些实施方案中,aav载体具有aav5衣壳。在一些实施方案中,aav载体具有aav7衣壳。
15、本领域的普通技术人员应理解,产生本发明的病毒载体通常需要使用本发明的质粒以及提供适合的病毒包装和活力所需的元件的额外质粒(例如对于aav,提供适当的aavrep基因、cap基因和其他基因(例如e2a和e4)的质粒)。产生细胞系中那些质粒的组合产生病毒载体。然而,本领域技术人员应理解,对于用于产生病毒载体的本发明转移质粒中的任何给定对的反向末端重复序列,病毒载体中的相应序列可因itr在重组期间采取“翻转(flip)”或“倒转(flop)”取向而改变。因此,转移质粒中itr的序列不必为在从其制备的病毒载体中发现的相同序列。
16、在另一方面,本发明提供了含有本发明核酸载体的组合物。在一些实施方案中,组合物还包括药学上可接受的载体、稀释剂或赋形剂。
17、在另一方面,本发明提供了与可操作地连接至转基因的seq idno:1具有至少85%序列同一性(例如85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同一性)的多核苷酸。在一些实施方案中,多核苷酸具有seqid no:1的序列。
18、在一些实施方案中,转基因是异源转基因。在前述方面的一些实施方案中,转基因编码蛋白质(例如治疗蛋白或报告蛋白)、shrna、aso、核酸酶(例如cas9、talen、zfn或grna),或微小rna。在一些实施方案中,转基因编码蛋白质。
19、在一些实施方案中,蛋白质是sox9、sall2、camta1、hey2、gata2、hey1、lass2、sox10、gata3、cux1、nr2f1、hes1、rorb、jun、zfp667、lhx3、nhlh1、mxd4、zmiz1、myt1、stat3、barhl1、tox、prox1、nfia、thrb、mycl1、kdm5a、creb314、etv1、peg3、bach2、isl1、zbtb38、lbh、tub、hmg20、rest、zfp827、aff3、pknox2、arid3b、mlxip、zfp532、ikzf2、sall1、six2、sall3、lin28b、rfx7、bdnf、gfi1、pou4f3、myc、ctnnb1、sox2、sox4、sox11、tead2、atoh1或atoh1变体(例如具有一个或多个选自由以下组成的组的氨基酸取代的atoh1变体:s328a、s331a、s334a、s328a/s331a、s328a/s334a、s331a/s334a和s328a/s331a/s334)。在一些实施方案中,蛋白质是atoh1(例如人类atoh1)。在一些实施方案中,atoh1蛋白包含seq id no:4的序列或其具有一个或多个(例如1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个或更多个)保守氨基酸取代的变体。在一些实施方案中,atoh1蛋白变体中不超过10%(10%、9%、8%、7%、6%、5%、4%、3%、2%、1%或更少)的氨基酸是保守氨基酸取代。在一些实施方案中,atoh1蛋白具有seq id no:4的序列。在一些实施方案中,atoh1蛋白是由seq id no:5的序列编码。
20、在另一方面,本发明提供了包括前述方面和实施方案中任一者的多核苷酸或核酸载体的细胞(例如哺乳动物细胞,例如人类细胞,例如vsc)。在一些实施方案中,细胞是哺乳动物vsc。在一些实施方案中,哺乳动物vsc是人类vsc。在一些实施方案中,多核苷酸与seqid no:1具有至少85%序列同一性(例如85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更大的序列同一性)。
21、在另一方面,本发明提供了通过使哺乳动物vsc与前述方面和实施方案中任一者的核酸载体或组合物接触而在哺乳动物vsc中表达转基因的方法。在一些实施方案中,转基因在vsc中特异性表达(例如,在比观察到表达的一种或多种其他内耳细胞(例如毛细胞)的百分比高至少2倍、5倍、10倍、50倍、100倍、200倍、300倍、400倍、500倍或更大百分比的vsc中表达)。在一些实施方案中,哺乳动物vsc是人类vsc。
22、在另一方面,本发明提供了通过向患有前庭功能障碍或具有患上前庭功能障碍的风险的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来治疗受试者的方法。在一些实施方案中,前庭功能障碍是眩晕、头晕、失衡、双侧前庭病(也称为双侧前庭功能低下)、振动幻视或平衡障碍。在一些实施方案中,前庭功能障碍是年龄相关的前庭功能障碍、头部创伤相关的前庭功能障碍、疾病或感染相关的前庭功能障碍或耳毒性药物诱导的前庭功能障碍。在一些实施方案中,前庭功能障碍与遗传突变相关。在一些实施方案中,前庭功能障碍是特发性前庭功能障碍。
23、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来诱导或增加受试者的前庭毛细胞再生的方法。
24、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来诱导或增加受试者的vsc增殖的方法。
25、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来诱导或增加受试者的前庭毛细胞增殖的方法。
26、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来诱导或增加受试者的前庭毛细胞成熟的方法。在一些实施方案中,前庭毛细胞是再生前庭毛细胞。
27、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来增加受试者的vsc存活的方法。
28、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来增加受试者的前庭毛细胞存活的方法。
29、在另一方面,本发明提供了通过向有需要的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来诱导或增加受试者的前庭毛细胞神经支配的方法。
30、在前述方面中任一者的一些实施方案中,受试者患有前庭功能障碍(例如头晕、眩晕、失衡、双侧前庭病(双侧前庭功能低下)、振动幻视或平衡障碍)或具有患上前庭功能障碍的风险。
31、在另一方面,本发明提供了通过向患有双侧前庭病或具有患上双侧前庭病的风险的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来治疗受试者的方法。在一些实施方案中,双侧前庭病是耳毒性药物诱导的双侧前庭病。
32、在前述方面中任一者的一些实施方案中,耳毒性药物选自由以下组成的组:氨基糖苷、抗肿瘤药物、依他尼酸(ethacrynic acid)、呋塞米(furosemide)、水杨酸盐和奎宁。
33、在另一方面,本发明提供了通过向患有振动幻视或具有患上振动幻视的风险的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来治疗受试者的方法。
34、在另一方面,本发明提供了通过向患有平衡障碍(例如失衡)或具有患上平衡障碍(例如失衡)的风险的受试者的内耳施用有效量的前述方面和实施方案中任一者的核酸载体或组合物来治疗受试者的方法。
35、在前述方面中任一者的一些实施方案中,所述方法还包括在施用核酸载体或组合物之前评估受试者的前庭功能。在一些实施方案中,所述方法还包括在施用核酸载体或组合物之后评估受试者的前庭功能。
36、在前述方面中任一者的一些实施方案中,核酸载体或组合物是局部施用的。在一些实施方案中,核酸载体或组合物被施用于半规管。在一些实施方案中,核酸载体或组合物是经鼓室或鼓室内(例如经由经鼓室或鼓室内注射)施用的。在一些实施方案中,核酸载体或组合物被施用于外淋巴或内淋巴,例如经由卵圆窗、圆窗或半规管(例如外半规管),例如施用于前庭支持细胞。在一些实施方案中,本发明的核酸载体或组合物被施用于外淋巴中。在一些实施方案中,本发明的核酸载体或组合物被施用于内淋巴中。在一些实施方案中,本发明的核酸载体或组合物被施用于卵圆窗或经由卵圆窗施用。在一些实施方案中,本发明的核酸载体或组合物被施用于圆窗或经由圆窗施用。
37、在前述方面中任一者的一些实施方案中,核酸载体或组合物是以足以预防或减轻前庭功能障碍、延迟前庭功能障碍的发生、减缓前庭功能障碍的进展、改进前庭功能、增加前庭毛细胞数、增加前庭毛细胞成熟、增加前庭毛细胞增殖、增加前庭毛细胞再生、增加前庭毛细胞神经支配、增加vsc增殖或增加vsc数的量施用。
38、在前述方面中任一者的一些实施方案中,受试者是人类。
39、在另一方面,本发明提供了含有本发明核酸载体或本发明组合物的试剂盒。
40、定义
41、如本文所用,“施用”是指通过任何有效途径提供或给予受试者治疗剂(例如含有可操作地连接至转基因的溶质载体家族6成员14(slc6a14)启动子的核酸载体)。下文阐述示例性施用途径。
42、如本文所用,短语“向内耳施用”是指通过允许内耳细胞转导的任何途径向受试者提供或给予本文所述的治疗剂。向内耳施用的示例性途径包括施用到外淋巴或内淋巴中,例如到达或通过卵圆窗、圆窗或半规管(例如,水平管),或通过经鼓膜或鼓室内注射,例如施用到前庭,例如施用到前庭支持细胞。
43、如本文所用,术语“细胞类型”是指共享基于基因表达数据在统计学上可分离的表型的细胞群。例如,常见细胞类型的细胞可共享相似的结构和/或功能特征,例如相似的基因活化模式和抗原呈递谱。常见细胞类型的细胞可包括从常见组织(例如上皮组织、神经组织、结缔组织或肌肉组织)分离的那些细胞和/或从常见器官、组织系统、血管或生物体中的其他结构和/或区域分离的那些细胞。
44、如本文所用,术语“保守突变”、“保守取代”和“保守氨基酸取代”是指用一个或多个氨基酸取代一个或多个表现出相似物理化学性质(例如极性、静电荷和空间体积)的不同氨基酸。二十种天然存在氨基酸中每一者的这些性质汇总于下表1中。
45、表1.天然存在氨基酸的代表性物理化学性质
46、
47、
48、根据此表应了解,保守氨基酸家族包括(i)g、a、v、l和i;(ii)d和e;(iii)c、s和t;(iv)h、k和r;(v)n和q;以及(vi)f、y和w。因此,保守突变或取代是用一种氨基酸取代同一氨基酸家族的成员者(例如用ser取代thr或用lys取代arg)。
49、如本文所用,本文所述的术语组合物、载体构建体或病毒载体的“有效量”、“治疗有效量”和“足量”是指在施用于受试者(包括哺乳动物,例如人类)时足以实现有益或期望结果(包括临床结果)的量,并且因此“有效量”或其同义词取决于应用其的情形。例如,在治疗前庭功能障碍的情形中,其是与未施用组合物、载体构建体或病毒载体时获得的反应相比,足以实现治疗反应的组合物、载体构建体或病毒载体的量。将对应于此量的本文所述的给定组合物的量将根据多种因素而变化,例如给定剂、药物制剂、施用途径、疾病或病症的类型、受试者的身份(例如年龄、性别、体重)或所治疗的宿主等,但仍可以常规方式由本领域技术人员确定。此外,如本文所用,本公开的组合物、载体构建体或病毒载体的“治疗有效量”是与对照相比在受试者中产生有益或期望结果的量。如本文所定义,本公开的组合物、载体构建体或病毒载体的治疗有效量可容易地由本领域的普通技术人员通过本领域中已知的常规方法来确定。可调整给药方案以提供最佳治疗反应。
50、如本文所用,术语“内源”阐述天然存在于特定生物体(例如人类)或生物体内的特定位置(例如器官、组织或细胞,例如人类细胞,例如人类前庭支持细胞)中的分子(例如多肽、核酸或辅因子)。
51、如本文所用,术语“表达”是指以下事件中的一者或多者:(1)从dna序列产生rna模板(例如通过转录);(2)rna转录物的加工(例如通过剪接、编辑、5'帽形成和/或3'端加工);(3)将rna翻译成多肽或蛋白质;以及(4)多肽或蛋白质的翻译后修饰。
52、如本文所用,术语“外源”阐述并非天然存在于特定生物体(例如人类)或生物体内的特定位置(例如器官、组织或细胞,例如人类细胞,例如人类前庭支持细胞)中的分子(例如多肽、核酸或辅因子)。外源材料包括从生物体的外部来源或从其提取的培养物提供的那些材料。
53、如本文所用,术语“外显子”是指基因编码区内的区域,其核苷酸序列决定相应蛋白质的氨基酸序列。术语外显子也指rna的从基因转录的相应区域。外显子转录成前mrna,并且可包括在成熟mrna中,这取决于基因的替代剪接。在加工后包括在成熟mrna中的外显子被翻译成蛋白质,其中外显子的序列决定蛋白质的氨基酸组成。
54、如本文所用,术语“异源”是指非天然元件的组合。例如,异源转基因是指并非由与其可操作地连接的启动子天然表达的转基因。
55、如本文所用,术语“增加”和“减少”是指调节分别产生度量的功能、表达或活性相对于参照更大或更小的量。例如,在本文所述的方法中施用组合物后,受试者中如本文所述度量(例如转基因表达)的标志物的量相对于施用前标志物的量可增加或减少至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%或更大。通常,度量是在施用后施用已具有所列举效应时(例如在治疗方案开始后至少一周、一个月、3个月或6个月)进行测量。
56、如本文所用,“局部地”或“局部施用”意指旨在用于局部效应而非全身效应的身体特定位点处的施用。局部施用的实例是皮上、吸入、关节内、鞘内、阴道内、玻璃体内、子宫内、病灶内施用、淋巴结施用、肿瘤内施用、施用于中耳或内耳和施用于受试者的粘膜,其中施用旨在具有局部效应而非全身效应。
57、如本文所用,术语“可操作地连接”是指接合至第二分子的第一分子,其中所述分子如此排列以使得第一分子影响第二分子的功能。两种分子可为或可不为单个邻接分子的一部分并且可为或可不为相邻的。例如,如果启动子调节目标可转录多核苷酸分子在细胞中的转录,则启动子可操作地连接至可转录多核苷酸分子。另外,如果接合转录调节元件的两部分使得一部分的转录活化功能不因另一部分的存在而受到不利影响,则所述两部分彼此可操作地连接。两个转录调节元件可借助于接头核酸(例如间插的非编码核酸)彼此可操作地连接或者可在不存在间插的核苷酸时彼此可操作地连接。
58、如本文所用,术语“质粒”是指额外dna区段可连接至其中的染色体外环状双链dna分子。质粒是一种载体,其是能够运输与其连接的另一核酸的核酸分子。某些质粒能够在引入其的宿主细胞中自主复制(例如具有细菌复制起点的细菌质粒和游离型哺乳动物质粒)。其他载体(例如非游离型哺乳动物载体)可在引入至宿主细胞中后整合至宿主细胞的基因组中,并由此与宿主基因组一起复制。某些质粒能够引导与其可操作地连接的基因的表达。
59、如本文所用,术语“多核苷酸”是指核苷的聚合物。通常,多核苷酸由天然存在于通过磷酸二酯键接合的dna或rna中的核苷(例如腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)组成。所述术语涵盖包含含有经化学或生物修饰的碱基、经修饰主链等的核苷或核苷类似物的分子,无论是否发现于天然存在的核酸中,并且此类分子对于某些应用可为优选的。当此应用涉及多核苷酸时应理解,提供dna、rna和在每种情况下单链和双链形式(和每个单链分子的补体)。如本文所用的“多核苷酸序列”可指多核苷酸材料自身和/或生物化学表征特定核酸的序列信息(即用作碱基的缩写的字母串)。除非另有指示,否则本文所呈现的多核苷酸序列是以5'至3'方向呈现。
60、如本文所用,术语“启动子”是指dna上由rna聚合酶结合的识别位点。聚合酶驱动转基因的转录。
61、相对于参照多核苷酸或多肽序列的“序列同一性百分比(%)”定义为在比对序列和引入空位(如果需要)以实现最大序列同一性百分比后,候选序列中与参照多核苷酸或多肽序列中的核酸或氨基酸同一的核酸或氨基酸的百分比。出于确定核酸或氨基酸序列同一性百分比的目的,比对可以本领域技术人员的能力范围内的各种方式来实现,例如使用可公开获得的计算机软件,例如blast、blast-2或megalign软件。本领域技术人员可确定适用于比对序列的参数,包括在所比较序列的全长范围内实现最大比对所需的任何算法。例如,序列同一性百分比值可使用序列比较计算机程序blast来产生。作为说明,给定核酸或氨基酸序列a相对于(to)、与(with)或针对(against)给定核酸或氨基酸序列b的序列同一性%(替代地可表达为相对于、与或针对给定核酸或氨基酸序列b具有特定序列同一性%的给定核酸或氨基酸序列a)计算如下:
62、100×(分数x/y)
63、其中x是在a与b的程序比对中由序列比对程序(例如blast)评定为同一性匹配的核苷酸或氨基酸的数量,并且其中y是b中核酸的总数。应了解,当核酸或氨基酸序列a的长度不等于核酸或氨基酸序列b的长度时,a相对于b的序列同一性%将不等于b相对于a的序列同一性%。
64、如本文所用,术语“药物组合物”是指含有治疗剂、任选地与一种或多种药学上可接受的赋形剂、稀释剂和/或载体组合的混合物,有待施用于受试者(例如哺乳动物,例如人类)来预防、治疗或控制侵袭或可能侵袭受试者的特定疾病或疾患。
65、如本文所用,术语“药学上可接受”是指适于与受试者(例如哺乳动物,例如人类)的组织接触而无过度毒性、刺激性、过敏反应和其他问题并发症并且与合理益处/风险比相称的那些化合物、材料、组合物和/或剂型。
66、如本文所用,术语“转录调节元件”是指至少部分地控制目标基因的转录的核酸。转录调节元件可包括启动子、增强子和控制或帮助控制基因转录的其他核酸(例如多聚腺苷酸化信号)。转录调节元件的实例阐述于例如lorence,recombinant gene expression:reviews and protocols(humanapress,newyork,ny,2012)中。
67、如本文所用,术语“转染”是指常用于将外源dna引入原核或真核宿主细胞中的众多种技术中的任一者,例如电穿孔、脂转染、磷酸钙沉淀、deae聚葡萄糖转染、nucleofection、挤压穿孔、声致穿孔、光学转染、磁性转染、刺穿转染等。
68、如本文所用,术语“受试者”和“患者”是指动物(例如哺乳动物,例如人类)。有待根据本文所述的方法治疗的受试者可为已经诊断患有前庭功能障碍(例如头晕、眩晕或失衡)的受试者或具有患上这些疾患的风险的受试者。诊断可通过本领域中已知的任何方法或技术来实施。本领域技术人员应理解,有待根据本公开治疗的受试者可能已经受标准测试或者可能在无检查的情况下已经鉴定为因存在一种或多种与疾病或疾患相关的风险因子而具有风险的受试者。
69、如本文所用,术语“转导(transduction)”和“转导(transduce)”是指将载体构建体或其一部分引入细胞中的方法。其中载体构建体含于病毒载体(例如aav载体)中,转导是指用病毒感染细胞并随后将载体构建体或其一部分转移和整合至细胞基因组中。
70、如本文所用,关于疾病或疾患的“治疗(treatment)”和“治疗(treating)”是指用于获得有益或期望结果(例如临床结果)的方法。有益或期望结果可包括(但不限于)缓和或改善一种或多种症状或疾患;降低疾病或疾患的程度;稳定(即不恶化)疾病、病症或疾患的状态;防止疾病或疾患的扩散;延迟或减缓疾病或疾患的进展;改善或减轻疾病或疾患;以及缓解(无论部分或完全),无论可检测或不可检测。“改善”或“减轻”疾病或疾患意指与无治疗时的程度或时程相比,减小疾病、病症或疾患的程度和/或不期望临床表现和/或减缓或延长进展的时程。“治疗”也可意指与未接受治疗时的预期存活相比提供存活。需要治疗的那些包括已患有疾患或病症的那些以及易患疾患或病症的那些或待预防疾患或病症的那些。
71、如本文所用,术语“载体”包括核酸载体,例如dna载体,例如质粒、粘粒或人工染色体、rna载体、病毒或任何其他适宜复制子(例如病毒载体)。已开发出多种载体用于将编码外源蛋白质的多核苷酸递送至原核或真核细胞中。此类表达载体的实例阐述于例如gellissen,production of recombinant proteins:novel microbial and eukaryoticexpression systems(john wiley&sons,marblehead,ma,2006)。适用于本文所述组合物和方法的表达载体含有多核苷酸序列以及例如用于表达蛋白质和/或将这些多核苷酸序列整合至哺乳动物细胞的基因组中的额外序列元件。可用于表达如本文所述转基因的某些载体包括含有引导基因转录的调节序列(例如启动子和增强子区域)的载体。可用于表达转基因的其他载体含有增强转基因的翻译速率或改进源自基因转录的mrna的稳定性或核输出的多核苷酸序列。这些序列元件包括例如5'和3'非翻译区和引导表达载体上所携带基因的有效转录的多聚腺苷酸化信号位点。适用于本文所述组合物和方法的表达载体也可含有编码用于选择含有这种载体的细胞的标志物的多核苷酸。合适的标志物的实例包括编码抗生素(例如氨苄青霉素(ampicillin)、氯霉素(chloramphenicol)、卡那霉素(kanamycin)或诺尔丝菌素(nourseothricin))抗性的基因。
72、如本文所用,术语“前庭支持细胞”和“vsc”是指内耳的前庭系统中参与前庭毛细胞发育、存活、功能、死亡和吞噬作用的特化上皮细胞的集合。vsc通过将前庭毛细胞锚定在感觉上皮中并释放对于毛细胞神经支配至关重要的神经营养因子来为所述前庭毛细胞提供结构支持。
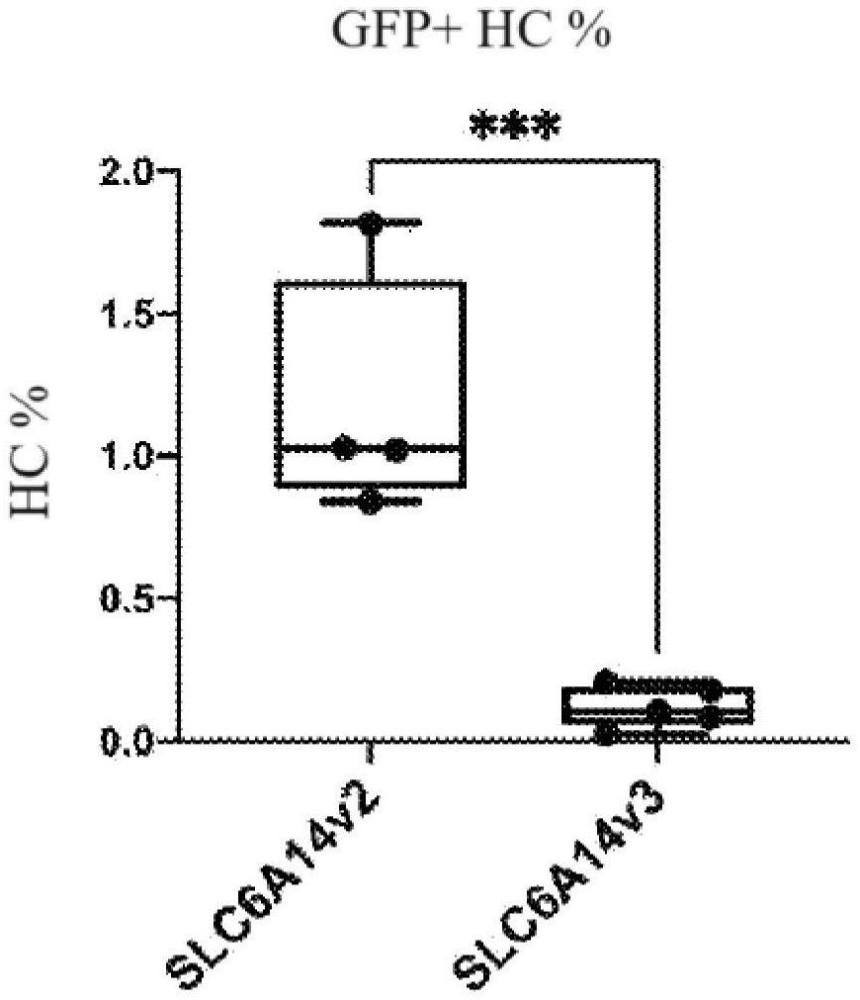
73、如本文所用,术语“前庭支持细胞特异性表达”和“vsc特异性表达”是指与内耳的其他细胞类型(例如前庭毛细胞、耳蜗毛细胞、耳蜗支持细胞、神经胶质或其他内耳细胞类型)相比,主要在前庭支持细胞内产生rna转录物或多肽。转基因的vsc表达可通过使用任何标准技术(例如定量rt pcr、免疫组织化学、蛋白质印迹分析(western blot analysis)或测量可操作地连接至启动子的报告基因(例如gfp)的荧光)比较内耳的各种细胞类型之间(例如vsc对非vsc细胞)的转基因表达(例如rna或蛋白质表达)来确认。诱导vsc特异性表达的启动子(“vsc特异性启动子”)是这样的启动子,其(i)在vsc中诱导的与其可操作地连接的转基因的表达(例如rna或蛋白质表达)大至少50%(例如大50%、75%、100%、125%、150%、175%、200%或更大),或(ii)在vsc中诱导的与其可操作地连接的转基因的表达大至少2倍(例如大5倍、10倍、50倍、100倍、200倍、300倍、400倍、500倍或更大),各自与以下内耳细胞类型中的至少3者(例如3者、4者、5者、6者、7者、8者、9者、10者或更多者)相比:前庭神经节细胞、前庭器官的非感觉上皮细胞、前庭器官的暗细胞、前庭器官的间充质细胞、螺旋神经节细胞、边缘细胞、内指细胞、内柱细胞、外柱细胞、第一排戴特氏细胞(first rowdeiter cell)、第二排戴特氏细胞、第三排戴特氏细胞、亨森氏细胞(hensen's cell)、克劳氏细胞(claudius cell)、内沟细胞、外沟细胞、螺旋突细胞、根细胞、齿间细胞、血管纹基底细胞、血管纹中间细胞、血管纹缘细胞、内毛细胞、外毛细胞、前庭毛细胞和施旺细胞(schwann cell)。
74、如本文所用,术语“野生型”是指在给定生物体中具有特定基因的最高频率的基因型。
- 还没有人留言评论。精彩留言会获得点赞!