自动化细胞培养系统的制作方法
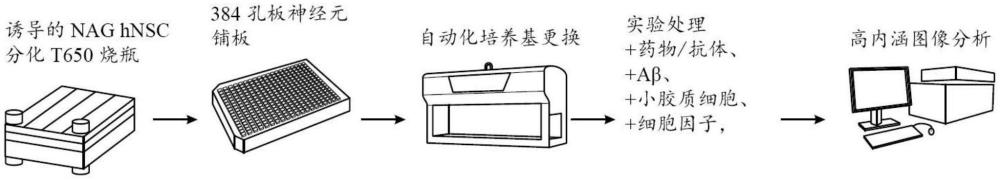
本公开整体涉及自动化培养系统,使用自动化培养系统生成完全分化的子代细胞的同质群体和神经系统疾病模型的方法,以及改进的用于模拟神经系统病症和疾病的系统。
背景技术:
1、目前的啮齿动物阿尔茨海默病(ad)模型再现了淀粉样蛋白斑块相关联的病理,但是,针对淀粉样蛋白介导的tau病理和神经元丢失尚未建立稳健的模型,妨碍了对aβ-诱导的tau病理事件的研究以及将其转化至人类患者。转化药物开发需要开发能够稳健地模拟ad病理生理学的临床前模型。人诱导多能干细胞(ipsc)神经元和小胶质细胞分化方案的进展为使用生理相关细胞进行临床前人类疾病建模创造了新的可能性,并且能够与强大的遗传和分子工具相结合以发现新靶点和药物筛选。但是,ipsc分化和培养方案冗长且多变,为保持一致性带来了挑战。此外,尽管已经生成了许多ipsc模型,但尚未观察到稳健的淀粉样蛋白斑块形成、磷酸化tau或神经元丢失表型。在这里,我们生成了自动化、一致且长期的人ipsc神经元、星形胶质细胞和小胶质细胞培养平台,用于高通量、高内涵成像和疾病建模。使用该平台,我们生成了人ipsc ad模型,该模型在一种模型中表现出多种关键的人ad病理标志,包括淀粉样蛋白-β(aβ)斑块、斑块周围营养不良的神经突、突触丢失、树突回缩、轴突断裂、磷酸化tau诱导和神经元细胞死亡。使用该模型,我们展示了人ipsc小胶质细胞内化并且压缩aβ,以生成并且包围斑块,从而赋予一定的神经保护作用。尽管斑块形成增加,但这种保护作用在神经炎性培养条件下消失。抗aβ抗体保护神经元免受这些病变的影响,并且在ptau诱导之前最有效。我们进行了重点筛选,并且鉴别出ad信号通路中的若干已知激酶,诸如gsk3、dlk、fyn,指示病理信号传导事件在该系统中得以保留。总而言之,这些结果表明该模型可用于靶点发现和药物开发。
技术实现思路
1、在一些方面,本公开提供了一种用于促进神经元分化和/或促进长期神经元生长的自动化细胞培养系统,其中该自动化细胞培养系统包括一轮或多轮自动化培养基更换;并且其中该自动化细胞培养系统维持神经元细胞的分化、成熟和/或生长至少约以下任一者:30天、60天、80天、90天、120天或150天。在一些实施例中,自动化培养基更换包括自动化培养基抽吸和自动化培养基补充;并且/或者细胞培养系统包括一个或多个96孔板;或一个或多个384孔板。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:在抽吸之前、期间和/或之后,吸移器吸头的远端位于孔的底表面上方约1mm处。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:在抽吸之前、期间和/或之后,吸移器吸头与孔的底表面成约90°的角度。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:在抽吸之前、期间和/或之后,吸移器吸头具有距孔的中心的不超过0.1mm的位移;任选地,其中在抽吸之前、期间和/或之后,吸移器吸头位于孔的中心处(无位移)。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:(a)培养基抽吸的速度不超过约7.5μl/s;并且/或者(b)在吸移器吸头置于孔的底表面上方1mm后约200ms开始培养基抽吸。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:(a)在抽吸之前,将吸移器吸头以约5mm/s的速度插入孔中;并且/或者(b)在抽吸之后,将吸移器吸头以约5mm/s的速度从孔中抽出。在一些实施例中,细胞培养系统包括384孔板;进一步,其中自动化细胞培养系统包括在每轮培养基抽吸之后自动化丢弃用过的384吸移器吸头架并且自动化接合新的384吸移器吸头架。在一些实施例中,细胞培养系统包括一批或多批384孔板,其中每批包括最多二十五个布置成5列和5行的384孔板;进一步,其中:自动化细胞培养系统包括在每轮培养基抽吸之后自动化丢弃最多25个对应的用过的384吸移器吸头架并且自动化接合最多25个对应的新的384吸移器吸头架。
2、在根据本文所述的细胞培养系统中任一者的一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:(a)在分配之前,吸移器吸头的远端位于孔的底表面上方约1mm处;并且/或者(b)在分配期间,将吸移器吸头以约1mm/s的速度从孔中抽出。在一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:在分配之前和/或期间,吸移器吸头与孔的底表面成约90°的角度。在一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:在分配之前和/或期间,吸移器吸头具有距孔的中心的不超过0.1mm的位移,任选地,其中在分配之前和/或期间,吸移器吸头位于孔的中心处(无位移)。在一些实施例中,细胞培养系统包括384孔组织板;其中自动化培养基补充包括用吸移器吸头分配培养基,其中:(a)吸移器吸头以约100mm/s的速度在孔的底部上方约12.40mm的高度处移位,以在第一方向上距中心1mm接触孔的第一侧;并且/或者(b)吸移器吸头以约100mm/s的速度移位,以在孔的底部上方约12.40mm的高度处在第二方向上距中心1mm接触孔的第二侧,任选地,其中第一方向与第二方向成约180°的角度。在一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:(a)培养基分配的速度不超过约1.5μl/s;(b)培养基分配的加速度为约500μl/s2;(c)培养基分配的减速度为约500μl/s2;并且/或者(d)在吸移器吸头置于孔的底表面上方1mm后约200ms开始培养基分配。在一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:(a)在分配之前,将吸移器吸头以约5mm/s的速度插入孔中;并且/或者(b)在分配之后,将吸移器吸头以约5mm/s的速度从孔中抽出。在一些实施例中,细胞培养系统包括384孔板;进一步,其中自动化细胞培养系统包括在每轮培养基分配之后自动化丢弃用过的384吸移器吸头架并且自动化接合新的384吸移器吸头架。在一些实施例中,细胞培养系统包括一批或多批384孔板,其中每批包括最多二十五个布置成5列和5行的384孔板;进一步,其中自动化细胞培养系统包括在每轮培养基分配之后自动化丢弃最多25个对应的用过的384吸移器吸头架并且自动化接合最多25个对应的新的384吸移器吸头架。
3、在根据本文所述的细胞培养系统中任一者的一些实施例中,两轮培养基更换之间的时间间隔为约以下任一者:1天、2天、3天、4天、5天、6天、7天、8天、9天或10天。在一些实施例中,两轮培养基更换之间的时间间隔为约3天或4天。在一些实施例中,在一轮或多轮培养基更换中,更换培养基中的约以下任一者:30%、40%、50%、60%、70%或80%。在一些实施例中,在每轮培养基更换中,更换培养基中的约以下任一者:30%、40%、50%、60%、70%或80%。在一些实施例中,在一轮或多轮培养基更换中,更换培养基中的约50%。在一些实施例中,在每轮培养基更换中,更换培养基中的约50%。
4、在一些方面,本公开提供了一种从多能干细胞产生同质且终末分化的神经元的方法,该方法包括:(a)在诱导型系统下产生表达ngn2和ascl1的多能干细胞(psc)衍生的神经干细胞(nsc)系;(b)将nsc系在诱导ngn2和ascl1表达的条件下与细胞周期抑制剂组合培养至少约7天,从而产生psc衍生的神经元;(c)在原代人星形胶质细胞存在下重新铺板psc衍生的神经元;(d)在自动化细胞培养系统中使psc衍生的神经元分化和成熟至少约60天至约90天。
5、在一些方面,本公开提供了一种衍生自多能干细胞的终末分化的神经元的同质群体,其中神经元中的至少95%表达:map2;突触蛋白1和/或突触蛋白2;以及β-iii微管蛋白。在一些方面,提供了一种衍生自多能干细胞的终末分化的神经元的同质群体,其中:(a)神经元中的至少95%表达一种或多种选自vglut2、突触蛋白1和突触蛋白2的突触前标志物;并且/或者(b)神经元中的至少95%表达一种或多种选自以下的突触后标志物:psd95、shank、panshank、glur1、glur2、pansapap和nr1;并且/或者(c)神经元的至少100个突触后末梢与其他神经元的突触前末梢重叠,并且/或者该神经元的至少100个突触前末梢与其他神经元的突触后末梢重叠。在一些实施例中,神经元中的至少95%表达:两种或更多种选自以下的突触前标志物:vglut2、突触蛋白1和突触蛋白2;和/或两种或更多种选自以下的突触后标志物:psd95、shank、panshank、glur1、glur2、pansapap和nr1。在一些实施例中,神经元中的至少95%表达一种或多种上层皮质神经元标志物,任选地其中神经元中的不超过5%表达一种或多种下层皮质神经元标志物。在一些实施例中,神经元中的至少95%表达cux2,任选地其中神经元中的不超过5%表达ctip2或satb2。在一些实施例中,从多能干细胞衍生终末分化的神经元的过程包括:(a)在诱导型系统下产生表达ngn2和ascl1的多能干细胞(psc)衍生的神经干细胞(nsc)系;(b)将nsc系在表达ngn2和ascl1的条件下与细胞周期抑制剂组合培养至少约7天,从而产生psc衍生的神经元;(c)在原代人星形胶质细胞存在下重新铺板psc衍生的神经元;(d)在自动化细胞培养系统中使psc衍生的神经元分化和成熟至少约60天至约90天。在一些实施例中,神经元以高度可复现的方式表达树突、胞体、轴突和突触的代表性标志物。在一些实施例中,神经元中的树突标志物map2、胞体标志物cux2、轴突标志物tau和突触标志物突触蛋白1/2的表达在重复实验中是高度可复现的,其中map2、cux2、tau和突触蛋白1/2中的每一者的z因子为至少0.4。
6、在一些方面,本公开提供了一种在对神经退行性疾病建模中使用的多能干细胞衍生的神经元培养系统,其中培养系统包括基本上确定的培养基,并且其中培养系统适用于以下的模块化和可调的输入:一种或多种疾病相关组分和/或一种或多种神经保护组分。在一些实施例中,神经退行性疾病为阿尔茨海默病,其中:(a)疾病相关组分包含可溶性aβ物质;(b)疾病相关组分包含突变app的过表达,任选地其中疾病相关组分包含突变app的诱导型过表达;(c)疾病相关组分包含促炎性细胞因子;(d)神经保护组分包含抗aβ抗体;(e)神经保护组分包含dlk抑制剂、gsk3β抑制剂、cdk5抑制剂和/或fyn激酶抑制剂;并且/或者(f)神经保护组分包含小胶质细胞。在一些实施例中,系统不包含人工基膜。在一些实施例中,系统包含完全确定的培养基和/或基质。在一些实施例中,可溶性aβ物质包含可溶性aβ寡聚物和/或可溶性aβ原纤维。
7、在根据本文所述的神经元培养系统中任一者的一些实施例中,神经元培养系统包含含有可溶性aβ物质的所述疾病相关组分,其中:神经元培养物中的tau蛋白在s396/404、s217、s235、s400/t403/s404和t181残基中的一者或多者是过度磷酸化的。在一些实施例中,培养系统包含含有可溶性aβ物质的一种或多种疾病相关组分,其中:该神经元培养系统与不包含可溶性aβ物质的对应神经元培养系统相比,表现出增加的神经元毒性。在一些实施例中,神经元培养系统包含含有可溶性aβ物质的疾病相关组分,其中:该培养系统与不包含可溶性aβ物质的对应神经元培养系统相比,表现出map2阳性神经元的减少。在一些实施例中,神经元培养系统包含含有可溶性aβ物质的疾病相关组分,其中:该培养系统与不包含可溶性aβ物质的神经元培养系统相比,表现出突触蛋白阳性神经元的减少。在一些实施例中,神经元培养系统包含含有可溶性aβ物质的疾病相关组分,其中:该神经元培养系统与不包含可溶性aβ物质的神经元培养系统相比,表现出神经元中tau磷酸化的增加,其中aβ的浓度不小于第一浓度;该神经元培养系统与不包含可溶性aβ物质的神经元培养系统相比,表现出突触蛋白阳性神经元的减少,其中aβ的浓度不小于第二浓度;该培养系统与不包含可溶性aβ物质的神经元培养系统相比,表现出cux2阳性神经元的减少,其中aβ的浓度不小于第三浓度;并且该培养系统与不包含可溶性aβ物质的神经元培养系统相比,表现出map2阳性神经元的减少,其中aβ的浓度不小于第四浓度。在一些实施例中,第一浓度高于第二浓度、第三浓度和第四浓度;并且/或者第二浓度高于第三浓度和第四浓度;并且/或者第三浓度高于第四浓度。在一些实施例中,第一浓度为约5μm,第二浓度为约2.5μm,第三浓度为约1.25μm,并且第四浓度为约0.3μm。
8、在根据本文所述的神经元培养系统中任一项所述的一些实施例中,神经元培养系统包含含有可溶性aβ物质的所述疾病相关组分,其中:该神经元培养系统进一步包含共培养的星形胶质细胞,其中星形胶质细胞与在不包含可溶性aβ物质的神经元培养系统中共培养的星形胶质细胞相比,表现出增加的gfap表达和/或表现出增加的gfap断裂。在一些实施例中,神经元培养系统包含含有可溶性aβ物质的疾病相关组分,其中:神经元培养系统表现出甲氧基x04阳性aβ斑块或斑块样结构。在一些实施例中,神经元培养系统表现出神经炎性营养不良。在一些实施例中,甲氧基x04阳性aβ斑块或斑块样结构的至少一个子集被神经突包围,任选地其中神经突由神经丝重链(nfl-h)轴突肿胀和/或磷酸化tau(s235)阳性起泡标记,进一步任选地,其中神经突是营养不良的。在一些实施例中,被神经突包围的所述斑块或斑块样结构表现出:定位于淀粉样斑块中的apoe表达和/或神经突的膜中的app。
9、在根据本文所述的神经元培养系统中任一者的一些实施例中,培养系统包含:含有可溶性aβ物质的疾病相关组分、含有神经炎性细胞因子的疾病相关组分以及含有小胶质细胞的神经保护组分。在一些实施例中,小胶质细胞为ipsc衍生的小胶质细胞并且表达以下一者或多者:trem2、tmem 119、cxcr1、p2ry12、pu.1、mertk、cd33、cd64、cd32和iba-1。在一些实施例中,包含(1)可溶性aβ物质和(2)小胶质细胞的神经元培养系统与不包含小胶质细胞的对应神经元培养系统相比,表现出降低的神经元毒性。在一些实施例中,包含(1)可溶性aβ物质和(2)小胶质细胞的神经元培养系统与不包含小胶质细胞的对应神经元培养系统相比,表现出增加的小胶质细胞-aβ斑块缔合和/或增加的aβ斑块形成。在一些实施例中,包含(1)可溶性aβ物质、(2)神经炎性细胞因子和(3)小胶质细胞的神经元培养系统与不包含小胶质细胞的对应神经元培养系统相比,表现出小于10%的神经元毒性变化。在一些实施例中,包含(1)可溶性aβ物质、(2)神经炎性细胞因子和(3)小胶质细胞的神经元培养系统与不包含小胶质细胞的对应神经元培养系统相比,表现出增加的小胶质细胞-saβ斑块缔合和/或增加的saβ斑块形成。在一些实施例中,神经元培养系统包含疾病相关组分,该疾病相关组分包含(1)含有可溶性aβ物质的疾病相关组分和(2)含有小胶质细胞的神经保护组分。在一些实施例中,神经元表现出dlk、gsk3、cdk5和fyn激酶信号传导中的一者或多者。
10、在根据本文所述的神经元培养系统中任一者的一些实施例中,神经元培养物包含来自多能干细胞的同质且终末分化的神经元,其中来自多能干细胞的同质且终末分化的神经元在包括以下步骤的过程中产生:(a)在诱导型系统下产生表达ngn2和ascl1的多能干细胞(psc)衍生的神经干细胞(nsc)系;(b)将nsc系在诱导ngn2和ascl1表达的条件下与细胞周期抑制剂组合培养至少约7天,从而产生psc衍生的神经元;(c)在原代人星形胶质细胞存在下重新铺板psc衍生的神经元;(d)在自动化细胞培养系统中使psc衍生的神经元分化和成熟至少约60天至约90天。
11、在根据本文所述的同质群体、方法或神经元培养系统中任一者的一些实施例中,使psc衍生的神经元分化和成熟的步骤包括一轮或多轮自动化培养基更换;并且其中自动化细胞培养系统维持神经元细胞的分化、成熟和/或生长至少约以下任一者:30天、60天、80天、90天、120天或150天。在一些实施例中,自动化培养基更换包括自动化培养基抽吸和自动化培养基补充;并且/或者其中细胞培养系统包括一个或多个384孔板。在一些实施例中,自动化培养基抽吸包括用吸移器吸头抽吸,其中:(a)在抽吸之前、期间和/或之后,吸移器吸头的远端位于孔的底表面上方约1mm处;(b)在抽吸之前、期间和/或之后,吸移器吸头与孔的底表面成约90°的角度;(c)在抽吸之前、期间和/或之后,吸移器吸头具有距孔的中心的不超过0.1mm的位移;任选地,其中在抽吸之前、期间和/或之后,吸移器吸头位于孔的中心处(无位移);(d)培养基抽吸的速度不超过约7.5μl/s;(e)在吸移器吸头置于孔的底表面上方1mm后约200ms开始培养基抽吸;(f)在抽吸之前,将吸移器吸头以约5mm/s的速度插入孔中;并且/或者(g)在抽吸之后,将吸移器吸头以约5mm/s的速度从孔中抽出。
12、在根据本文所述的同质群体、方法或神经元培养系统中任一者的一些实施例中,自动化培养基补充包括用吸移器吸头分配培养基,其中:(a)在分配之前,吸移器吸头的远端位于孔的底表面上方约1mm处;(b)在分配期间,将吸移器吸头的远端以约1mm/s的速度从孔中抽出;(c)在分配之前和/或期间,吸移器吸头与孔的底表面成约90°的角度;(d)在分配之前和/或期间,吸移器吸头具有距孔的中心的不超过0.1mm的位移,任选地,其中在分配之前和/或期间,吸移器吸头位于孔的中心处(无位移);(e)吸移器吸头以约100mm/s的速度在孔的底部上方约12.40mm的高度处移位,以在第一方向上距中心约1mm接触孔的第一侧;(f)吸移器吸头以约100mm/s的速度在孔的底部上方约12.40mm的高度处移位,以在第二方向上距中心约1mm接触孔的第二侧,任选地,其中第一方向与第二方向成约180°的角度;(g)培养基分配的速度不超过约1.5μl/s;(h)培养基分配的加速度为约500μl/s2;(i)培养基分配的减速度为约500μl/s2;(j)在吸移器吸头置于孔的底表面上方1mm后约200ms开始培养基分配;(k)在分配之前,将吸移器吸头以约5mm/s的速度插入孔中;并且/或者(l)在分配之后,将吸移器吸头以约5mm/s的速度从孔中抽出。
13、在根据本文所述的同质群体、方法或神经元培养系统中任一者的一些实施例中,细胞培养系统包括384孔板;进一步,其中:(a)自动化细胞培养系统包括在每轮培养基抽吸之后自动化丢弃用过的384吸移器吸头架并且自动化接合新的384吸移器吸头架;并且/或者(b)自动化细胞培养系统包括在每轮培养基分配之后自动化丢弃用过的384吸移器吸头架并且自动化接合新的384吸移器吸头架。在一些实施例中,细胞培养系统包括一批或多批384孔板,其中每批包括最多二十五个布置成5列和5行的384孔板;进一步,其中:(a)自动化细胞培养系统包括在每轮培养基抽吸之后自动化丢弃最多25个对应的用过的384吸移器吸头架并且自动化接合最多25个对应的新的384吸移器吸头架;并且/或者(b)自动化细胞培养系统包括在每轮培养基分配之后自动化丢弃最多25个对应的用过的384吸移器吸头架并且自动化接合最多25个对应的新的384吸移器吸头架。
14、在根据本文所述的同质群体、方法或神经元培养系统中任一者的一些实施例中,(a)两轮培养基更换之间的时间段为约以下任一者:1天、2天、3天、4天、5天、6天、7天、8天、9天或10天;并且/或者(b)在一轮或多轮培养基更换中,更换培养基中的约以下任一者:30%、40%、50%、60%、70%或80%。在一些实施例中,(a)两轮培养基更换之间的时间段为约3天或4天;并且/或者(b)在一轮或多轮培养基更换中,更换培养基中的约50%。
15、在一些方面,一种筛选增加神经保护的化合物的方法,该方法包括:使化合物与所述神经元培养系统中任一者的神经元培养物接触,以及定量对神经保护的改善。在一些实施例中,对神经保护的改善包括:增加神经元培养物中的树突、突触、细胞计数和/或轴突中的一者或多者的量。在一些实施例中,方法包括对神经元培养物中的树突、突触、细胞计数和/或轴突中的一者或多者的量的增加进行定量,其中:(a)树突的量是通过神经元培养物中的map2的含量来测量的;(b)突触的量是通过神经元培养物中的突触蛋白1和/或突触蛋白2的含量来测量的;(c)细胞计数的量是通过神经元培养物中的cux2的含量来测量的;并且/或者(d)轴突的量是通过神经元培养物中的βiii微管蛋白的含量来测量的。在一些实施例中,选择化合物用于进一步测试与未接触该化合物的对应神经元培养物相比,是否发生:(a)神经元培养物中的map2的含量增加≥30%;(b)突触蛋白1或突触蛋白2的含量增加≥30%;(c)cux2的含量增加≥30%;和/或(d)βiii微管蛋白的含量增加≥30%。在一些实施例中,如果与未接触化合物的对应神经元培养物相比满足以下条件,则确定该化合物具有神经保护作用:(a)神经元培养物中的map2的含量增加≥30%;(b)突触蛋白1或突触蛋白2的含量增加≥30%;(c)cux2的含量增加≥30%;和/或(d)βiii微管蛋白的含量增加≥30%。
- 还没有人留言评论。精彩留言会获得点赞!