一种体外快速合成环状DNA的方法
本发明涉及基因工程,具体涉及一种体外快速合成环状dna的方法。
背景技术:
1、染色体外环状dna(extrachromosomal circμlar dna,eccdna)是真核生物中一类特殊的环状dna,最早的报道见于1965年,是部分基因组dna在一定条件下从染色体上脱落,通过一系列复杂机制成环,形成的环状dna,其大小从100bp到数百万bp不等,可来源于基因组的不同位点。eccdna能通过多种途径在生理及病理过程中发挥重要的作用,一些研究认为许多重要的原癌基因主要以eccdna为载体进行扩增,表明它与肿瘤细胞癌基因拷贝数增加和基因转录水平提高相关,同时与肿瘤的异质性,转移,耐药以及不良预后相关。然而,单个eccdnas的功能在很大程度上是未知的。主要问题之一是缺乏有效和稳定的方法来在体外合成单个eccdna用于下游测定以探索其功能。
2、目前,体外合成eccdna可以通过使用taq dna连接酶(参考文献:du,q.,kotlyar,a.and vologodskii,a.(2008)kinking the double helix by bendingdeformation.nucleicacidsres,36,1120-1128.)和t4 dna连接酶(参考文献:kuhn,h.andfrank kamenetskii,m.d.(2005)template-independent ligation of single-strandeddnaby t4 dnaligase.thefebsjournal,272,5991-6000.)等方法合成。长度为84~106bp的小环可通过taq dna连接酶合成。这种方法受dna长度的限制,而合成长链dna(>100bp)的价格昂贵。后来,引入了一种非模板连接方法,通过t4 dna连接酶将hindⅲ粘性末端的dna自连接成环,这种连接反应需要0.1-10nm范围内的非常低的dna浓度来抑制分子间连接,因此产量非常低。henrik devitt et al.最近研究表明(参考文献:h.d.,lin,l.,xiang,x.,petersen,t.s.,huang,j.,yang,l.,kjeldsen,e.,jensen,u.b.,zhang,x.and liu,x.et al..(2018)crispr-c:circμlarization of genes and chromosome bycrispr in human cells.nucleicacidsres.),crispr-c可以从基因间和基因位点生成eccdna,大小范围从几百个碱基对到207kb不等,但这种方法需要一个特定的基因编辑系统,耗时且复杂。是否能深入研究特定序列eccdna的功能,迫切需要开发一种快速、稳定的方法来合成长度范围广的eccdnas。
技术实现思路
1、本发明的目的在于提出一种体外快速合成环状dna的方法,通过pcr方法提供一种体外简单快速合成eccdna的方法。该方法成功的解决了以往合成eccdna的长度限制以及浓度限制的两大关键问题,为eccdna的分子机制研究提供了可能方案。
2、本发明的技术方案是这样实现的:
3、本发明提供一种体外快速合成环状dna的方法,包括以下步骤:
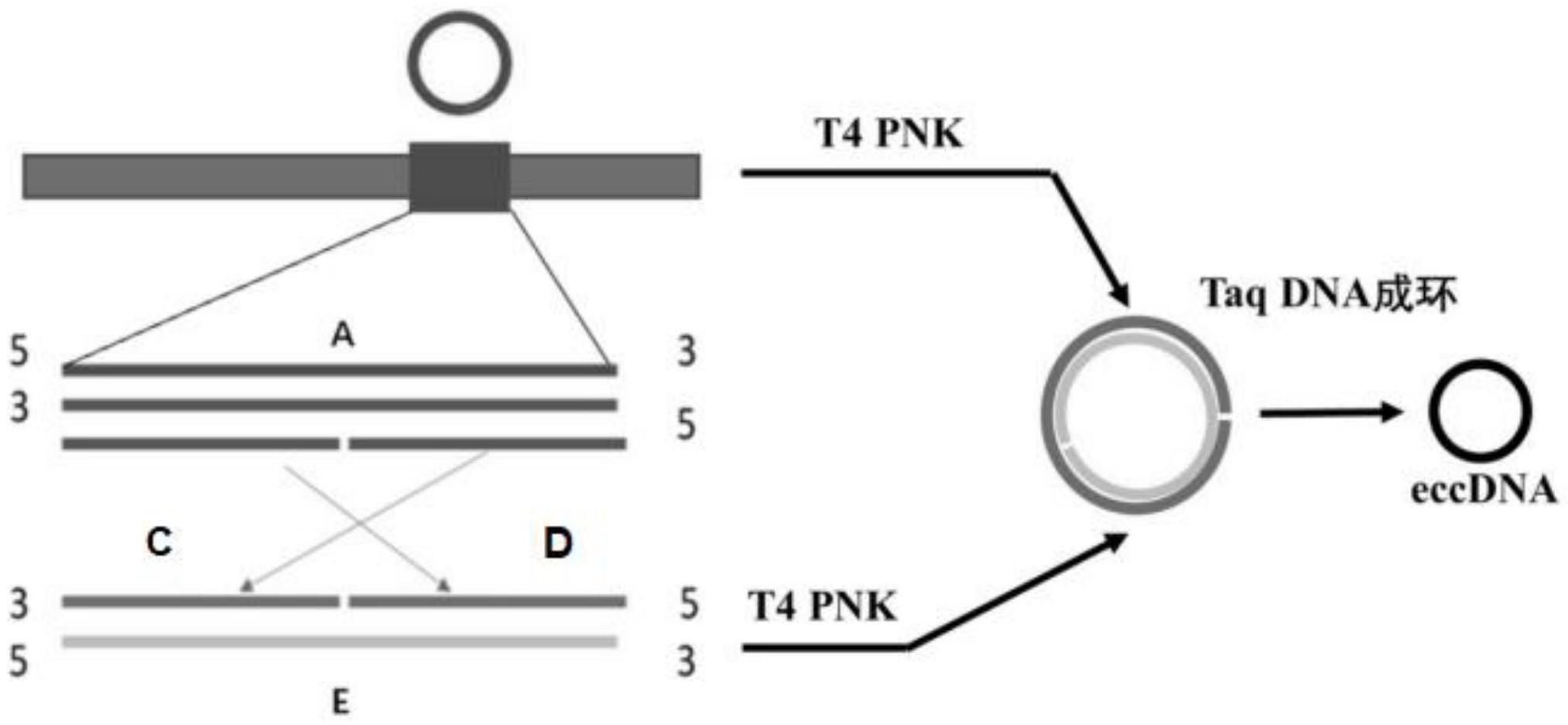
4、s1.以基因组为模板,针对所需合成环状dna对应的线性dna片段分别设计正向引物和反向引物进行pcr,产生线性dna-a片段;
5、s2.以步骤s1制得的dna-a片段为模板,分别设计引物产生1/2a片段,分别为dna-c片段和dna-d片段;
6、s3.将步骤s2制得的1/2a片段进行梯度退火,产生黏性dna-c片段和dna-d片段;
7、s4.用t7连接酶连接步骤s3制得的黏性dna-c片段和dna-d片段;
8、s5.以步骤s4制得的dna片段为模板,再进行pcr,产生dna-e片段;
9、s6.将dna-a片段和dna-e片段经过taq dnaligase试剂进行成环反应,制得环状dna。
10、作为本发明的进一步改进,设计1/2a片段的引物设计为互补结构。
11、作为本发明的进一步改进,步骤s1中所述pcr体系如下:2*pcr缓冲液for kodfx20-30μl,2mmdntps 8-12μl,f-primer 1-2μl,r-primer 1-2μl,genomic dna 180-220ng,kodfx 0.5-1.5μl,ddh2o加至50μl。
12、作为本发明的进一步改进,步骤s1中所述pcr反应条件为:90-96℃,2min;95-100℃,10s,50-60℃,30s,65-75℃,3min,30循环;3-5℃,∞。
13、作为本发明的进一步改进,步骤s2和步骤s4的反应体系和反应条件与步骤s1相同。
14、作为本发明的进一步改进,步骤s3的反应体系如下:dna-c片段20μl,dna-c’片段20μl,5*dnaannealing缓冲液10μl,总计50μl。
15、作为本发明的进一步改进,步骤s3的反应条件如下:90-100℃,3min;85-95℃,3min;80-90℃,3min,以每下降5℃维持3min,梯度降温至25℃。
16、作为本发明的进一步改进,步骤s4的反应体系如下:dnaligase reaction缓冲液10μl,黏性dna-c片段5μl,黏性dna-d片段5μl,dnaliagse1μl,总计21μl;反应条件:25℃,30min-1h,失活:65℃,20min。
17、作为本发明的进一步改进,步骤s6的反应体系如下:dna-a片段400-600ng,dna-e片段400-600ng,taq dnaligase reaction缓冲液6-8μl,taq dnaligase1-3μl,ddh2o补足至50μl。
18、作为本发明的进一步改进,步骤s6的反应条件如下:90-100℃,3min,55-65℃,10min,35-40℃,5min,10循环。
19、本发明具有如下有益效果:本发明采用pcr方法体外快速合成环状dna,如图1所示。第一步:以基因组为模板,针对所需合成环状dna对应的线性dna片段分别设计正向引物和反向引物进行pcr,产生浓度较高的线性dna-a片段,确保构建eccdna的dna片段是研究所需,无碱基更换或删减。第二步:以第一步骤dna-a片段为模板,分别设计引物产生1/2a片段(c,d),应注意设计1/2a片段的引物设计需要互补。第三步:1/2a片段进行梯度退火,产生黏性1/2a片段,设计引物时应注意产生两个1/2a片段的引物需要互补,退火后才可以产生黏性1/2a片段。第四步:t7连接酶连接黏性1/2a片段。第五步:以第四步产物为模板,再进行pcr,产生dna-e片段,e片段。经过前面五个步骤后形成的dna-e片段与dna-a片段的区别是碱基顺序发生了改变。第六步:dna-a和dna-e片段经过taq dnaligase试剂进行成环反应。经酶切消化验证后如图2(以ecclimd1为例)所示,lane1:limd1-a序列dna,lane2:limd1-e序列dna,lane3:limd1-pa,lane4:limd1-pe,lane5:ecclimd1,lane6:limd1-a使用消化线性dna的酶(atp-dnase)处理,lane7:ecclimd1使用消化线性dna的酶(atp-dnase)处理,lane8:limd1-a序列使用内切酶hincⅱ和bsai进行酶切处理,lane9:ecclimd1经atp-dnase、hincⅱ和bsai进行酶切处理。
20、dna环接头处进行测序处理,结果如图3所示。该方法能通过简单的pcr反应进行快速成环,效率高,成本低。
21、目前的成环方法有crispr-c方法和t4 dna连接酶方法,crispr-c可以从基因间和基因位点生成eccdna,大小范围从几百个碱基对到207kb不等,但这种方法需要一个特定的基因编辑系统,耗时且复杂。t4 dna连接酶将hindⅲ粘性末端的dna自连接成环,这种连接反应需要0.1-10nm范围内的非常低的dna浓度来抑制分子间连接,因此产量非常低。本发明通过pcr方法快速构建环状dna,且浓度高,为研究具体eccdna的功能和分子机制提供了有利技术支撑。
- 还没有人留言评论。精彩留言会获得点赞!