基因编辑系统在制备SMN1基因突变的脊髓性肌萎缩症模型猪核移植供体细胞中的应用的制作方法
本发明属于生物,具体属于基因编辑,更具体涉及基因编辑系统在制备smn1基因突变的脊髓性肌萎缩症模型猪核移植供体细胞中的应用。
背景技术:
1、脊髓性肌萎缩症(spinal muscular atrophy,sma)又称脊肌萎缩症,是一类由脊髓前角运动神经元变性导致肌无力、肌萎缩的常染色体隐性遗传病。本病临床表现差异较大,根据患者起病年龄和临床病程,将sma由重到轻分为4型,共同特点是脊髓前角细胞变性,临床表现为进行性、对称性的以肢体近端为主的广泛性、弛缓性麻痹与肌萎缩,智力发育及感觉均正常,发病越早,预后越差。
2、脊髓性肌萎缩症可由多种基因突变引起,其中运动神经元存活基因1(smn1)的基因突变是该病最主要的诱发原因。smn1基因的单拷贝失活(无症状)现象在亚洲人群中大约是1/50,这就造成了1/10000左右的新生儿发病率。smn1基因编码的运动神经元生存蛋白1是剪接体的重要组成部分,剪接体复合物在小核糖核蛋白的组装中起着催化剂的作用,因此smn1基因在pre-mrna的剪接中起着重要的作用。
3、研究脊髓性肌萎缩症的发生发展机制及研发相应的药物均需要在动物模型的基础上进行,目前常用的动物模型为小鼠模型,然而小鼠不论从体型、器官大小、生理、病理等方面都与人相差巨大,不能真实地模拟人类正常的生理、病理状态。猪作为大动物,其体型大小和生理功能与人类近似,易于大规模繁殖饲养,而且在伦理道德及动物保护等方面要求较低,是理想的人类疾病模型动物。
4、基因编辑是近年来不断取得重大发展的一种生物技术,其包括从基于同源重组的基因编辑到基于核酸酶的zfn、talen、crispr/cas9等编辑技术,其中crispr/cas9技术是当前最先进的基因编辑技术。目前,基因编辑技术被越来越多地应用到动物模型的制作上。
技术实现思路
1、本发明的目的是提供基因编辑系统在制备smn1基因突变的脊髓性肌萎缩症模型猪核移植供体细胞中的应用。
2、本发明提供了smn1-grna3、smn1-grna4和ncn蛋白在制备试剂盒中的应用。
3、本发明还提供了smn1-grna3、smn1-grna4和proncn蛋白在制备试剂盒中的应用。
4、本发明还提供了smn1-grna3、smn1-grna4和特异质粒在制备试剂盒中的应用。
5、本发明提供了一种试剂盒,包括smn1-grna3、smn1-grna4和ncn蛋白。
6、本发明还提供了一种试剂盒,包括smn1-grna3、smn1-grna4和proncn蛋白。
7、本发明还提供了一种试剂盒,包括smn1-grna3、smn1-grna4和特异质粒。
8、以上任一所述试剂盒还包括猪细胞。
9、以上任一所述试剂盒的用途为如下(a)或(b)或(c):(a)制备重组猪细胞;(b)制备脊髓性肌萎缩症模型猪;(c)制备脊髓性肌萎缩症细胞模型或脊髓性肌萎缩症组织模型或脊髓性肌萎缩症器官模型。
10、本发明提供了一种制备重组猪细胞的方法,包括如下步骤:将smn1-grna3、smn1-grna4和ncn蛋白共转染猪细胞,得到重组猪细胞。
11、所述共转染具体采用电击转染的方式。
12、电击转染的参数设置具体可为:1450v、10ms、3pulse。
13、所述共转染具体可采用哺乳动物核转染试剂盒(neon kit,thermofisher)与neontm transfection system电转仪。
14、smn1-grna3、smn1-grna4和ncn蛋白的配比依次为:0.8-1.2μg smn1-grna3:0.8-1.2μg smn1-grna4:3-5μg ncn蛋白。
15、smn1-grna3、smn1-grna4和ncn蛋白的配比依次为:1μg smn1-grna3:1μg smn1-grna4:4μg ncn蛋白。
16、猪细胞、smn1-grna3、smn1-grna4和ncn蛋白的配比依次为:10万个猪细胞:0.8-1.2μg smn1-grna3:0.8-1.2μg smn1-grna4:3-5μg ncn蛋白。
17、猪细胞、smn1-grna3、smn1-grna4和ncn蛋白的配比依次为:10万个猪细胞:1μgsmn1-grna3:1μg smn1-grna4:4μg ncn蛋白。
18、以上任一所述smn1-grna3为sgrna,其靶序列结合区如seq id no:16中第3-22位核苷酸所示。
19、具体的,所述smn1-grna3如seq id no:16所示。
20、具体的,所述smn1-grna3如seq id no:12所示。
21、以上任一所述smn1-grna4为sgrna,其靶序列结合区如seq id no:17中第3-22位核苷酸所示。
22、具体的,所述smn1-grna4如seq id no:17所示。
23、具体的,所述smn1-grna4如seq id no:13所示。
24、以上任一所述ncn蛋白为cas9蛋白或具有cas9蛋白的融合蛋白。
25、具体的,所述ncn蛋白如seq id no:3所示。
26、以上任一所述猪细胞为猪成纤维细胞。
27、以上任一所述猪细胞为猪原代成纤维细胞。
28、以上任一所述猪细胞为获自初生猪的猪原代成纤维细胞。
29、所述ncn蛋白的制备方法包括如下步骤:
30、(1)将质粒pkg-ge4导入大肠杆菌bl21(de3),得到重组菌;
31、(2)采用液体培养基30℃培养所述重组菌,然后加入iptg并进行25℃诱导培养,然后收集菌体;
32、(3)将收集的菌体进行菌体破碎,收集粗蛋白溶液;
33、(4)采用亲和层析从所述粗蛋白溶液中纯化具有his6标签的融合蛋白;
34、(5)采用具有his6标签的肠激酶酶切具有his6标签的融合蛋白,然后采用ni-nta树脂去除具有his6标签的蛋白,得到纯化的ncn蛋白;
35、质粒pkg-ge4中具有seq id no:1中第5209-9852位核苷酸所示的融合基因。
36、所述ncn蛋白的制备方法具体包括如下步骤:
37、(1)将质粒pkg-ge4导入大肠杆菌bl21(de3),得到重组菌。
38、(2)将步骤(1)得到的重组菌接种至含氨苄青霉素的液体lb培养基,振荡培养;
39、(3)将步骤(2)得到的菌液接种至液体lb培养基,30℃、230rpm振荡培养至od600nm值=1.0,然后加入iptg并使其在体系中的浓度为0.5mm,然后25℃、230rpm振荡培养12小时,然后离心收集菌体;
40、(4)取步骤(3)得到的菌体,用pbs缓冲液洗涤;
41、(5)取步骤(4)得到的菌体,加入粗提缓冲液并悬浮菌体,然后进行菌体破碎,然后离心收集上清液,采用0.22μm孔径滤膜过滤,收集滤液;
42、(6)采用亲和层析从步骤(5)得到的滤液中纯化具有his6标签的融合蛋白(seq idno:2所示的融合蛋白);
43、(7)取步骤(6)收集的过柱后溶液,使用超滤管浓缩,然后用25mm tris-hcl(ph8.0)稀释;
44、(8)将具有his6标签的重组牛肠激酶加入到步骤(7)得到的溶液中,酶切;
45、(9)将完成步骤(8)的溶液与ni-nta树脂混匀,孵育,然后离心收集上清液;
46、(10)取步骤(9)得到的上清液,使用超滤管浓缩,然后加入酶贮存液中,即为ncn蛋白溶液。
47、采用亲和层析从步骤(5)得到的滤液中纯化具有his6标签的融合蛋白的具体方法如下:
48、首先采用5个柱体积的平衡液平衡ni-nta琼脂糖柱(流速为1ml/min);然后上样50ml步骤(5)得到的滤液(流速为0.5-1ml/min);然后用5个柱体积的平衡液洗涤柱子(流速为1ml/min);然后用5个柱体积的缓冲液洗涤柱子(流速为1ml/min),以去除杂蛋白;然后用10个柱体积的洗脱液以0.5-1ml/min的流速洗脱,收集过柱后溶液(90-100ml)。
49、以上任一所述proncn蛋白自上游至下游依次包括如下元件:信号肽、分子伴侣蛋白、蛋白标签、蛋白酶酶切位点、核定位信号、cas9蛋白、核定位信号。
50、所述信号肽的功能为促进蛋白分泌表达。所述信号肽可选自大肠杆菌碱性磷酸酶(phoa)信号肽、金黄色葡萄球菌蛋白a信号肽、大肠杆菌外膜蛋白(ompa)信号肽或任何其他原核基因的信号肽,优选为碱性磷酸酶信号肽(phoa signal peptide)。碱性磷酸酶信号肽用来引导目的蛋白分泌表达至细菌周质腔中,从而与细菌胞内蛋白分离,且分泌到细菌周质腔中的目的蛋白为可溶性表达,可被细菌周质腔中的信号肽酶裂解。
51、所述分子伴侣蛋白的功能为增加蛋白的可溶性。所述分子伴侣可为任何帮助形成二硫键的蛋白,优选为硫氧还原蛋白(trxa蛋白)。硫氧还原蛋白,其能作为分子伴侣帮助所共表达的目的蛋白(例如cas9蛋白)形成二硫键,提高蛋白的稳定性、折叠的正确性,增加目的蛋白的溶解性及活性。
52、所述蛋白标签的功能为用于蛋白纯化。所述标签可为his标签(his-tag,his6蛋白标签)、gst标签、flag标签、ha标签、c-myc标签或其他任何蛋白标签,进一步优选为his标签。his标签能与ni柱结合,可以通过一步法ni柱亲和层析纯化目的蛋白,可极大地简化目的蛋白的纯化流程。
53、所述蛋白酶酶切位点的功能为纯化后用于切除非功能区段,以释放天然形式cas9蛋白。所述蛋白酶可选自肠激酶(enterokinase)、因子xa(factor xa)、凝血酶(thrombin)、tev蛋白酶(tev protease)、hrv 3c蛋白酶(hrv 3c protease)、welqut蛋白酶或任何其他内切蛋白酶,进一步优选为肠激酶。ek为肠激酶酶切位点,便于使用肠激酶切除所融合的trxa-his区段,得到天然形式的cas9蛋白。本技术使用带his标签的商品肠激酶酶切融合蛋白后,可通过一次亲和层析除去trxa-his区段及带his标签的肠激酶,得到天然形式的cas9蛋白,避免了多次纯化透析对目的蛋白的伤害和损耗。
54、所述核定位信号可为任何核定位信号,优选为sv40核定位信号和/或nucleoplasmin核定位信号。nls为核定位信号,在cas9的n端及c端分别设计了一个nls位点,使cas9能更有效地进入细胞核进行基因编辑。
55、所述cas9蛋白可为sacas9或spcas9,优选为spcas9蛋白。
56、proncn蛋白具体如seq id no:2所示。
57、以上任一所述特异质粒自上游至下游依次包括如下元件:启动子、操纵子、核糖体结合位点、proncn蛋白的编码基因、终止子。
58、所述启动子具体可为t7启动子。t7启动子为原核表达强启动子,能高效驱动外源基因的表达。
59、所述操纵子具体可为lac操纵子。lac操纵子为乳糖诱导表达的调控元件,可在细菌生长至一定数量后,再用iptg在低温下诱导目的蛋白的表达,可避免目的蛋白过早表达对宿主菌生长的影响,低温下诱导表达也显著提高所表达的目的蛋白的可溶性。
60、所述核糖体结合位点是蛋白翻译时的核糖体结合位点,对蛋白质的翻译是必要的。
61、所述终止子具体可为t7终止子。t7终止子可在目的基因的末端有效终止基因转录,避免目的基因之外的其他下游序列得到转录和翻译。
62、对于spcas9蛋白的密码子,本技术对其密码子进行了优化,使之完全适应本技术所选用的大肠杆菌高效表达菌株e.coli bl21(de3)的密码子偏好,从而提高cas9蛋白的表达水平。
63、t7启动子如seq id no:1中第5121-5139位核苷酸所示。
64、lac操纵子如seq id no:1中第5140-5164位核苷酸所示。
65、核糖体结合位点如seq id no:1中第5178-5201位核苷酸所示。
66、碱性磷酸酶信号肽的编码序列如seq id no:1中第5209-5271位核苷酸所示。
67、trxa蛋白的编码序列如seq id no:1中第5272-5598位核苷酸所示。
68、his-tag的编码序列如seq id no:1中第5620-5637位核苷酸所示。
69、肠激酶酶切位点的编码序列如seq id no:1中第5638-5652位核苷酸所示。
70、核定位信号的编码序列如seq id no:1中第5656-5670位核苷酸所示。
71、spcas9蛋白的编码序列如seq id no:1中第5701-9801位核苷酸所示。
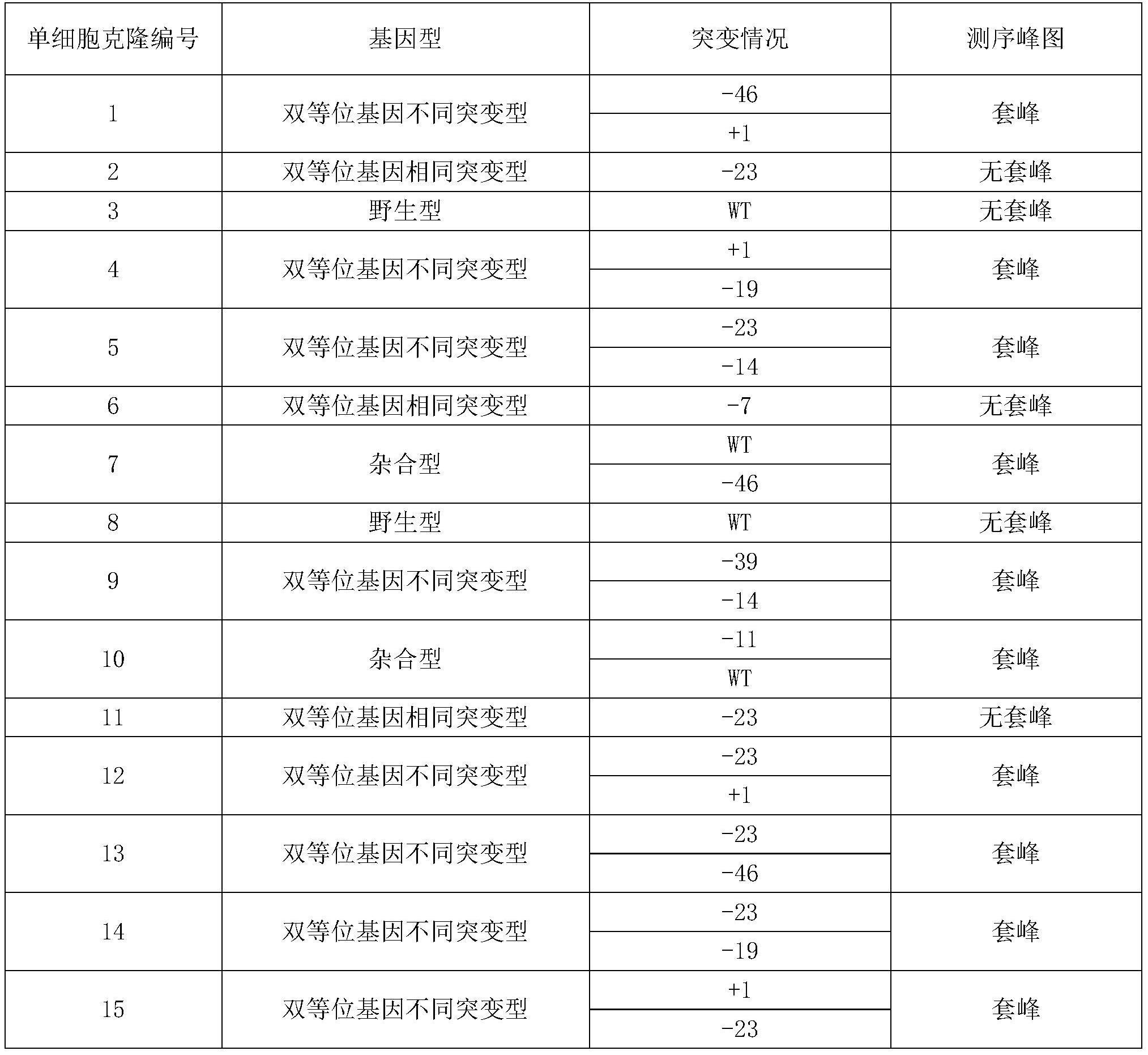
72、核定位信号的编码序列如seq id no:1中第9802-9849位核苷酸所示。
73、t7终止子如seq id no:1中第9902-9949位核苷酸。
74、具体的,所述特异质粒为质粒pkg-ge4。
75、质粒pkg-ge4中具有seq id no:1中第5121-9949位核苷酸所示的dna分子。
76、具体的,以上任一所述质粒pkg-ge4如seq id no:1所示。
77、本发明还保护以上任一所述方法制备得到的重组猪细胞。
78、所述重组猪细胞为smn1基因发生突变的重组猪细胞。
79、所述重组猪细胞具体可为表1中基因型为杂合型、双等位基因相同突变型或双等位基因不同突变型的单细胞克隆。
80、本发明还保护所述重组猪细胞在制备脊髓性肌萎缩症模型猪中的应用。
81、将所述重组猪细胞作为核移植供体细胞进行体细胞克隆,可以得到克隆猪,即为脊髓性肌萎缩症模型猪。
82、本发明还保护利用所述重组猪细胞制备的模型猪的猪组织,即脊髓性肌萎缩症组织模型。
83、本发明还保护利用所述重组猪细胞制备的模型猪的猪器官,即脊髓性肌萎缩症器官模型。
84、本发明还保护利用所述重组猪细胞制备的模型猪的猪细胞,即脊髓性肌萎缩症细胞模型。
85、本发明还保护所述重组猪细胞、所述脊髓性肌萎缩症组织模型、所述脊髓性肌萎缩症器官模型、所述脊髓性肌萎缩症细胞模型或者所述脊髓性肌萎缩症模型猪的应用,为如下(d1)或(d2)或(d3)或(d4):
86、(d1)筛选治疗脊髓性肌萎缩症的药物;
87、(d2)进行脊髓性肌萎缩症药物的药效评价;
88、(d3)进行脊髓性肌萎缩症的基因治疗和/或细胞治疗的疗效评价;
89、(d4)研究脊髓性肌萎缩症的发病机制。
90、以上任一所述猪具体可为从江香猪。
91、以上任一所述猪具体可为初生从江香猪。
92、以上任一所述猪具体可为巴马香猪。
93、以上任一所述猪具体可为初生巴马香猪。
94、以上任一所述脊髓性肌萎缩症是由smn1基因突变引起的。
95、猪smn1基因信息:运动神经元存活基因1;位于16号染色体;gene id为100170853,sus scrofa。
96、猪smn1基因编码的蛋白质的氨基酸序列如seq id no:8所示。
97、猪smn1基因具有seq id no:9所示的dna区段。
98、以上任一所述突变为一个或多个核苷酸的缺失和/或插入和/或替换。
99、以上任一所述突变为一个或多个核苷酸的缺失。
100、以上任一所述突变为一个或多个核苷酸的插入。
101、以上任一所述突变为一个或多个核苷酸的缺失和插入。
102、与现有技术相比,本发明至少具有如下有益效果:
103、(1)本发明研究对象(猪)比其他动物(大小鼠、灵长类)具有更好的应用性。
104、大小鼠等啮齿类动物不论从体型、器官大小、生理、病理等方面都与人相差巨大,无法真实地模拟人类正常的生理、病理状态。研究表明,95%以上在大小鼠中验证有效的药物在人类临床试验中是无效的。就大动物而言,灵长类是与人亲缘关系最近的动物,但其体型小、性成熟晚(6-7岁开始交配),且为单胎动物,群体扩繁速度极慢,饲养成本很高。另外,灵长类动物克隆效率低、难度大、成本高。
105、而猪作为模型动物就没有上述缺点,猪是除灵长类外与人亲缘关系最近的动物,其体型、体重、器官大小等与人相近,在解剖学、生理学、免疫学、营养代谢、疾病发病机制等方面与人类极为相似。同时,猪的性成熟早(4-6个月),繁殖力高,一胎多仔,在2-3年内即可形成一个较大群体。另外,猪的克隆技术非常成熟,克隆及饲养成本也较灵长类低得多。因此猪是非常适合作为人类疾病模型的动物。
106、(2)本发明所构建的载体,使用了能够高效表达目的蛋白的强启动子t7-lac来进行目的蛋白的表达,用细菌周质蛋白碱性磷酸酶(phoa)的信号肽来引导目的蛋白分泌表达至细菌周质腔中,从而与细菌胞内蛋白分离,且分泌到细菌周质腔中的目的蛋白为可溶性表达。同时还采用硫氧还原蛋白trxa与cas9蛋白融合表达,trxa能帮助所共表达的目的蛋白形成二硫键,提高蛋白的稳定性、折叠的正确性,增加目的蛋白的溶解性及活性。为了方便目的蛋白的纯化,设计了his标签,可以通过一步法ni柱亲和层析纯化目的蛋白,极大地简化了目的蛋白的纯化流程。同时在his标签后设计了一个肠激酶酶切位点,便于切除所融合的trxa-his多肽片段,得到天然形式的cas9蛋白。利用带his标签的肠激酶酶切融合蛋白后,可通过一次亲和层析除去trxa-his多肽片段及带his标签的肠激酶,得到天然形式的cas9蛋白,避免了多次纯化透析对目的蛋白的伤害和损耗。同时,本发明也在cas9的n端及c端分别设计了一个nls位点,使cas9能更有效地进入细胞核进行基因编辑。另外,本发明选择了e.coli bl21(de3)菌株为目的蛋白表达菌株,该菌株可高效表达克隆于含有噬菌体t7启动子的表达载体(如pet-32a)的外源基因。同时,对于cas9蛋白的密码子,本发明进行了密码子优化,使之完全适应表达菌株的密码子偏好,从而提高目的蛋白的表达水平。另外,本发明在细菌生长至一定数量后,再用iptg在低温下诱导目的蛋白的表达,可避免目的蛋白过早表达对宿主菌生长的影响,低温下诱导表达也显著提高所表达的目的蛋白的可溶性。经过上述各项优化设计及实验实施,所得到的cas9蛋白活性比商品cas9蛋白有了极显著的提高。
107、(3)采用本发明构建并表达的cas9高效蛋白联合体外转录的grna进行基因编辑,并对cas9和grna的最佳用量配比进行了优化,最终获得基因编辑单细胞克隆的比率高达93.8%,远高于常规的基因编辑效率(10-30%)。
108、(4)利用本发明所得到的靶基因敲除单细胞克隆株进行体细胞核移植动物克隆可直接得到靶基因敲除的克隆猪,并且该基因变异可稳定遗传。
109、在小鼠模型制作中采用的受精卵显微注射基因编辑材料后再进行胚胎移植的方法,因其直接获得基因突变后代的概率比较低,需要进行后代的杂交选育,不太适用于妊娠期较长的大动物(如猪)模型制作。因此,本发明采用技术难度大、挑战性高的原代细胞体外编辑以及cas9蛋白和双grna切割并筛选阳性编辑单细胞克隆的方法,后期再通过体细胞核移植动物克隆技术直接获得相应疾病模型猪,可大大缩短模型猪制作周期并节省人力、物力、财力。
110、本发明采用crispr/cas9技术联合双grna编辑进行了smn1基因的敲除,模拟脊髓性肌萎缩症的遗传特征,并获得了smn1基因敲除的单细胞克隆,为后期通过体细胞核移植动物克隆技术培育脊髓性肌萎缩症模型猪奠定了基础。本发明将有助于研究并揭示由smn1基因功能异常所导致的脊髓性肌萎缩症的发病机制,也可用于进行药物筛选、药效评价、基因治疗及细胞治疗等研究,能够为进一步的临床应用提供有效的实验数据,进而为成功治疗人类脊髓性肌萎缩症提供有力的实验手段。本发明对于脊髓性肌萎缩症药物的研发及揭示该病的发病机制具有重大应用价值。
- 还没有人留言评论。精彩留言会获得点赞!