一种原代肝细胞共培养三维肝微球模型及其制备方法和应用与流程
本发明属于细胞微球,涉及一种原代肝细胞共培养三维肝微球模型及其制备方法和应用。
背景技术:
1、癌症的治疗是目前医学领域备受关注的领域,近年来,纳米药物(尺寸1~100nm)在肿瘤治疗方面取得一系列重大突破,然而目前研究人员无法有效将该药物运输到患者体内发挥作用,仅有大约0.7%的化疗纳米药物才能顺利抵达患者机体患处靶向作用肿瘤细胞,剩余的药物全被机体其它细胞吸收了,包括肝脏、肾脏和脾脏等,当药物在这些器官中积累时,就会产生毒性和副作用,比如药物诱导性肝损伤(dili)仍然是其药物研发失败的常见原因。
2、纳米颗粒的肝胆清除一般是通过以下几种途径:肝窦、窦周隙、肝细胞、胆管和肠道排出体外,有研究发现纳米颗粒与肝非实质细胞(例如库普弗细胞和肝窦内皮细胞)的相互作用导致纳米粒子的低内在清除和肝胆清除的主要2个重要关键障碍(参见wilson poonet al.elimination pathways of nanoparticles.acs nano 2019)。因此,预测评估纳米药物在体内肝脏渗透积累或清除是其临床转化成功的关键,也是临床前阶段,对纳米药物的安全性、局限性和治疗潜力的综合体外测定必不可少的步骤。故迫切需要建立和使用一个有临床相关性的肝脏体外模型来正确预测纳米药物在肝脏中的渗透,积累和排除。
3、由于二维肝细胞模型在培养过程中肝细胞特异性表型的丢失,以及其本身缺乏复杂的体内生理环境,所以目前的二维肝模型系统通常无法预测化学诱导的肝毒性。对于更具预测性的体外模型,肝细胞必须维持在允许极化和细胞间接触的三维环境中。近年来肝细胞的体外三维(3d)球体模型因其具有3d空间排列,与2d模型相比能够更好地模拟生物体内细胞环境,重现肝功能,延长细胞培养时间而备受关注。然而,建立良好的三维肝脏细胞模型除了选择培养形式外,选择合适的细胞来源和细胞类型对于药物的肝毒性预测同样重要,即使有一定肝脏表征的永生化的肝源细胞已用于体外肝脏3d模型的构建,但是它们的适用性受到其相对代谢活性低和敏感性水平低的阻碍(参见:gerets hhj etal.characterization of primary human hepatocytes,hepg2 cells,and heparg cellsat the mrna level and cyp activity in response to inducers and theirpredictivity for the detection of human hepatotoxins.cell biol toxicol,2012)。而且通常建立和使用的是简单的仅包含原代肝实质细胞或永生化的heparg肝细胞或hepg2肝癌细胞系的3d球体模型(christopher r.cox et al.2020),或采用永生化人肝癌细胞系(hepg2)和人肝星形细胞系(lx-2)共培养构建肝细胞聚球体模型(wang ying etal.2019)。
4、综上所述,目前简单型的3d肝脏模型与体内肝组织细胞组成和微环境相比依然存在很大的缺陷,不能完全反应真实体内的多细胞类型生理环境,因此,开发适用于纳米药物筛选的更复杂、更具生物相关性和预测性的体外3d肝脏细胞模型是纳米药物发展领域亟需解决的问题之一。
技术实现思路
1、针对现有技术的不足和实际需求,本发明提供一种原代肝细胞共培养三维肝微球模型及其制备方法和应用,能够有效模拟体内多细胞类型环境,为药物研发提供体外评估模型。
2、为达上述目的,本发明采用以下技术方案:
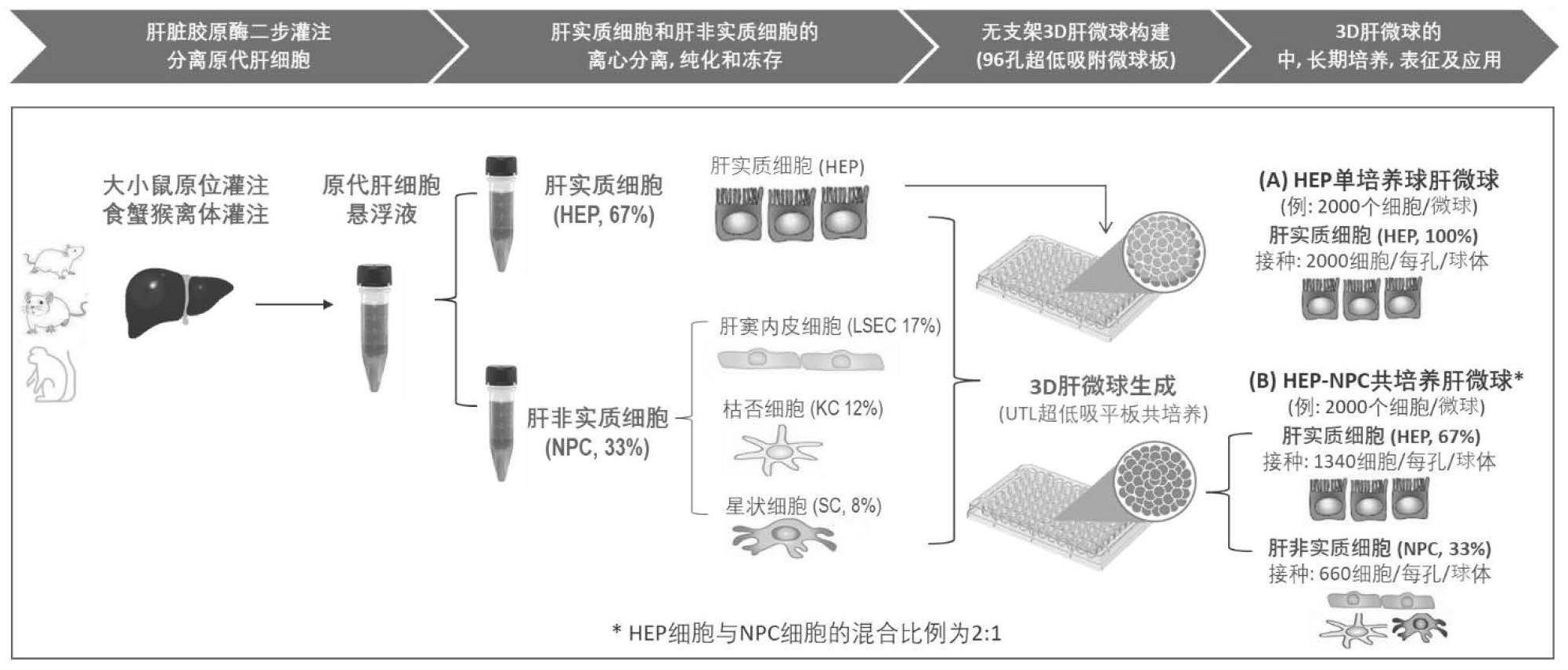
3、第一方面,本发明提供一种原代肝细胞共培养三维肝微球模型,所述三维肝微球模型呈球体状,所述三维肝微球模型含有肝实质细胞和肝非实质细胞,所述肝非实质细胞包括肝窦内皮细胞、枯否细胞和肝星状细胞,所述三维肝微球模型中肝实质细胞与肝非实质细胞的接种浓度百分比为(67±5)%:(33±5)%。
4、本发明中,构建一种新型的原代肝细胞共培养三维(3d)肝微球模型,由特定的肝实质细胞(hep)和非实质细胞(npc)共同组成构建。能够更好地模拟体内环境和对药物治疗的反应,够进行更长时间的共培养,并且能够维持数周的细胞活性、代谢活性和相关的肝细胞功能,肝非实质细胞稳定的和功能性的整合于共培养3d肝微球中,共培养肝微球体细胞高度极化和形成毛细胆管以及具有功能型外排型药物转运体介导的跨膜转运。
5、本发明由原代肝实质/非实质细胞构建的体外共培养3d肝微球模型可用于临床前高通量筛选评估药物诱导性肝毒性,以及预测纳米药物在肝脏组织的渗透,积累风险,以便在药物开发的早期阶段正确测试药物的有效性和局限性,具有提高药物临床应用转化价值。
6、可选地,所述三维肝微球模型中肝窦内皮细胞、枯否细胞和肝星状细胞的接种浓度百分比为(17±4)%:(12±4)%:(8±4)%。
7、可选地,所述三维肝微球模型中细胞数量为500~3000个细胞,包括但不限于501个细胞、502个细胞、510个细胞、550个细胞、1000个细胞、1500个细胞、2000个细胞、2500个细胞、2600个细胞、2800个细胞或2900个细胞。
8、可以理解,本领域常用的药物研究实验动物的肝脏细胞均适用于本发明。
9、可选地,所述肝实质细胞和肝非实质细胞的来源包括人、大鼠、小鼠、比格犬、猴等种属。
10、可选地,所述三维肝微球模型的球直径为150~250μm,包括但不限于151μm、152μm、160μm、170μm、180μm、190μm、220μm、240μm或249μm。
11、第二方面,本发明提供一种第一方面所述的原代肝细胞共培养三维肝微球模型的制备方法,所述方法包括:
12、按肝脏细胞体内生理比例将肝实质细胞、肝窦内皮细胞、枯否细胞和肝星状细胞配制为混合细胞悬浮液;将混合细胞悬浮液接种到超低吸附孔板中,进行培养,得到所述原代肝细胞共培养三维肝微球模型。
13、所述方法具体包括:
14、进行肝实质细胞和肝非实质细胞的富集、纯化和冻存,按2:1比例将肝实质细胞和肝非实质细胞配制为混合细胞悬浮液;将混合细胞悬浮液接种到超低吸附孔板中,进行培养,得到所述原代肝细胞共培养三维肝微球模型。
15、优选地,所述肝非实质细胞包括大鼠肝非实质细胞、小鼠肝非实质细胞和食蟹猴肝非实质细胞。
16、优选地,所述大鼠肝非实质细胞或小鼠肝非实质细胞的富集、纯化方法包括:
17、将含有大鼠肝非实质细胞或小鼠肝非实质细胞悬液于50×g、4℃离心3min,离心两次,每次离心后,吸取上清,弃去沉淀物,然后将每次离心后收集的上清液于360×g、4℃离心8min,收集沉淀物,用含有3%血清肝细胞培养基重悬细胞沉淀物,得到肝非实质细胞悬浮液;
18、在离心管中依次加入20ml 50%percoll分离液和20ml 25%percoll分离液,然后加入10ml肝非实质细胞悬浮液于percoll分离液的上层表面,于600×g、4℃进行percoll密度梯度离心8min,弃上清液和沉淀物,收集含有肝非实质细胞的位于离心管中间部分液体;
19、用含有3%血清肝细胞培养基重悬肝非实质细胞,于360×g、4℃离心8min,弃除上清液,重复两次,用含有10%血清的常规肝细胞培养基肝重悬肝非实质细胞。
20、优选地,所述食蟹猴肝非实质细胞的富集、纯化方法包括:
21、将含有食蟹猴肝非实质细胞悬液于100×g、4℃离心3min,离心两次,每次离心后,吸取上清,弃去沉淀物,然后将每次离心后收集的上清液于720×g、4℃离心8min,收集沉淀物,用含有3%血清肝细胞培养基重悬细胞沉淀物,得到肝非实质细胞悬浮液;
22、在离心管中依次加入20ml 50%percoll分离液和20ml 25%percoll分离液,然后加入10ml肝非实质细胞悬浮液于percoll分离液的上层表面,于1200×g、4℃进行percoll密度梯度离心8min,弃上清液和沉淀物,收集含有肝非实质细胞的位于离心管中间部分液体;
23、用含有3%血清肝细胞培养基重悬肝非实质细胞,于720×g、4℃离心8min,弃除上清液,重复两次,用含有10%血清的常规肝细胞培养基肝重悬肝非实质细胞。
24、可选地,所述96孔超低吸附孔板中每孔的接种量为500~3000个细胞/100±20μl混合细胞悬浮液/每孔。
25、可以理解,本领域通用的细胞培养的超低吸附孔板均适用于本发明。
26、可选地,所述超低吸附孔板为96孔u形底。
27、可选地,所述混合细胞悬浮液的配制方法包括:
28、按比例将肝实质细胞、肝窦内皮细胞、枯否细胞、肝星状细胞和培养基混合,得到混合细胞悬浮液。
29、优选地,所述培养基包括含有10%血清肝细胞完全培养基。
30、可以理解,本发明制备方法中还可包括分离原代肝细胞和肝实质细胞和肝非实质细胞的纯化和冻存的步骤。
31、可选地,所述培养的方法包括:将接种后混合细胞悬浮液置于37℃、5%co2的培养箱中培养3-4天后,然后用不含血清的肝微球维持培养基替换50%的超低吸附孔板中培养基。
32、第三方面,本发明提供第一方面所述的原代肝细胞共培养三维肝微球模型在药物研发中的应用。
33、可选地,所述应用包括临床药物诱导性肝毒性的评估、纳米药物的肝脏滞留/排除的预测、药物诱导的胆汁淤积风险评估、允许长时间重复给药毒性试验、慢性药物毒性效应的预测、低药物清除率的评估或药物诱导的炎症和肝纤维化的预测中任意一种。
34、与现有技术相比,本发明具有以下有益效果:
35、本发明构建一种新型的原代肝细胞共培养三维肝微球模型,缩短二维细胞培养物与整体动物模型之间的转化差距,可以更准确、高效的筛选和预测纳米药物在肝脏中的脱靶滞留风险/用来筛选和研究纳米药物的肝脏滞留/排除,由此指导纳米医学上设计和优化,加快脱靶药物的体内清除,有效的解决抗癌纳米药物在靶向-清除和疗效-毒性间的矛盾问题,开发精确靶向的多功能纳米药物以实现有效的肿瘤治疗,具有较好的肿瘤渗透积累和低的肝脏脱靶富集等优点,促进纳米药物等的发展和转化。
- 还没有人留言评论。精彩留言会获得点赞!