一种合成具有邻手性中心的手性醇的方法
本发明属于有机合成,具体涉及一种合成具有邻手性中心的手性醇的方法。
背景技术:
1、手性醇类化合物在各类手性化合物中有着十分重要的地位,它既是非常重要的有机合成砌块,也是天然产物和手性药物分子中的常见片段和骨架。在手性药物领域,具有手性中心的化合物的两个对映异构体虽然具有相似的物理性质,但是在药理学、毒理学、药物代谢动力学和新陈代谢等方面却表现出显著的不同,甚至是完全相反的性质。因此,生产单一对映体的手性化合物就成为了一大热点研究问题。
2、连续不对称氢化反应是一步合成某些药物分子、天然产物等重要结构单元,以及构筑多手性中心分子的一种强有力策略。其中,通过过渡金属催化α,β-不饱和酮的不对称氢化是合成具有光学活性手性醇的常用途径。那么理论上,基于多取代α,β-不饱和酮的连续不对称氢化反应能够为合成含有多手性中心的手性醇提供一种经济环保、绿色高效的方法。但目前为止,可以实现取代α,β-不饱和酮的高效不对称连续氢化反应的相关报道甚少,主要可能有以下几方面原因:1)酮的不对称加氢反应机理与烯烃的不对称加氢反应机理不同,酮或烯烃的不对称加氢反应往往需要不同的催化剂和不同的反应条件才能获得良好的效果。因此,在一步反应中使用单一催化剂,难以高反应收率和高立体选择性实现多取代烯酮的不对称连续氢化反应。2)第一个形成的手性中心通常会影响下一个生成的手性中心的立体控制,使其难以获得高的非对映选择性。3)在不对称氢化反应中,由于酮类和烯烃的反应活性不同,以及金属催化剂与底物之间的配位模型不同(内层与外层),导致在α,β-不饱和酮的连续不对称氢化反应中难以获得高的周转率(ton)。
3、例如,2017年ohkuma课题组报道了在叔丁醇钾的存在下,使用dm-segphos/dmapen钌双催化体系,首次通过线性β,β-二取代的α,β-不饱和酮的连续不对称氢化反应,制备了一系列具有高非对映选择性和对映选择性的γ-取代二级醇(chem.eur.j.2017,23,8806-8809)。2022年,andersson课题组报道了ir-n,p配合物催化开环脂肪族α,β-不饱和酮的不对称加氢反应:首先使用ir-n,p配合物选择性地不对称还原c=c双键生成手性酮,然后加入苯甲酰胺使催化体系实现进一步对c=o双键的还原,生成了一系列具有高非对映选择性和对映选择性的β-取代的脂肪族手性醇(j.am.chem.soc.2022,144,8734-8740)。
4、综上所述,在仅有的报道多取代α,β-不饱酮的不对称连续氢化反应体系中,仍然存在底物范围有限、反应条件较为苛刻等问题。因此,亟需开发出一种绿色、简便、经济、高效的方法来合成具有邻手性中心的手性醇。
技术实现思路
1、为克服上述现有技术存在的不足,本发明的目的在于提供一种合成具有邻手性中心的手性醇的方法。本发明以多取代α,β-不饱和酮类化合物为底物,通过连续不对称氢化反应一步法合成具有邻手性中心的手性醇,反应体系简单、反应条件温和、反应后处理简单、反应产物立体选择性高,符合绿色化学的发展要求,具有非常重要的应用前景。
2、为实现上述发明目的,本发明采用如下技术方案:
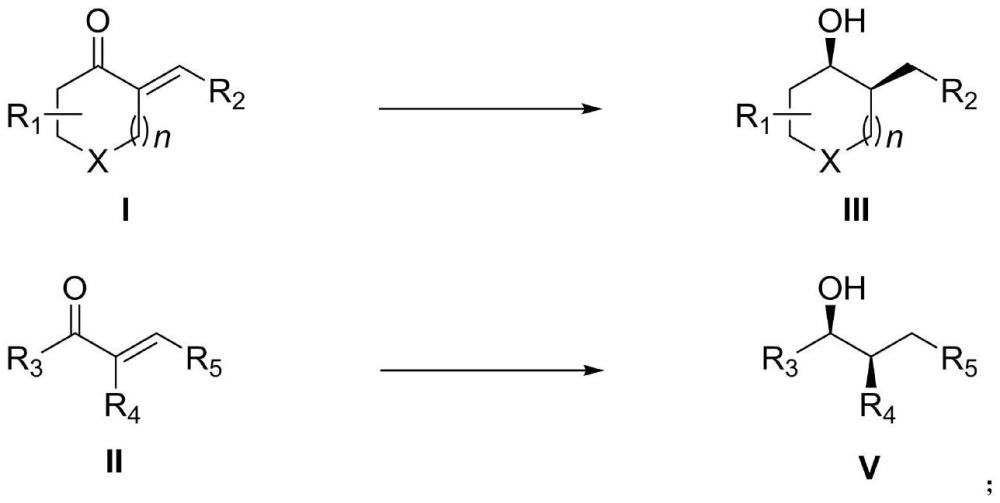
3、一种合成具有邻手性中心的手性醇的方法,将式i或式ii所示α,β-不饱和酮类化合物、手性钌络合物、碱加入有机溶剂中,在氢气氛围下反应,反应完成后分离纯化产物,得到式iii或式v所示具有邻手性中心的手性醇;
4、
5、其中,r1代表芳基、取代芳基中任意一种;r2代表芳基、取代芳基、杂环芳基、烷基中任意一种;r3代表芳基、取代芳基中任意一种;r4代表芳基、取代芳基中任意一种;r5代表芳基、取代芳基中任意一种;x代表c、s中任意一种元素,n等于1或2即六元环或七元环。
6、作为上述技术方案的优选,r1代表苯基,或者卤素、烷氧甲基中任意一种取代的苯基;r2代表苯基、噻吩基、呋喃基、萘基中任意一种,或者卤素、c1~c2烷基、c1~c2烷氧基、三氟甲基中任意一种或两种取代的苯基或环己烷基;r3代表苯基,或者卤素、烷氧基中任意一种取代的苯基;r4代表苯基,或者卤素、甲基中任意一种取代的苯基;r5代表苯基、萘基中任意一种,或者卤素、甲基、c1~c2烷氧基、三氟甲基中任意一种或两种取代的苯基。
7、上述技术方案中,首先是利用手性钌络合物选择性地不对称还原α,β-不饱和酮中的c=o双键生成中间体烯丙醇,然后烯丙醇在碱的促进下生成饱和酮,接着饱和酮继续在手性钌络合物催化下不对称还原生成具有邻手性中心的手性醇产物。由此可见,整个反应的立体选择性主要取决于手性钌络合物对饱和酮的不对称还原,通过动态动力学拆分过程获得高的非对映选择性和对映选择性。
8、作为上述技术方案的优选,所述手性钌络合物为中的任意一种。
9、现有技术中,通过不对称氢化反应合成手性醇,使用手性双膦双氮金属钌催化剂具有较好的催化活性,本发明通过大量研究发现,带有酒石酸结构的双膦配体的金属钌催化剂能够在本发明反应体系中表现出更好的立体选择性。
10、优选地,所述手性钌络合物为当使用该手性钌络合物作为催化剂时,合成的具有邻手性中心的手性醇收率更好、立体选择性更高(>99:1dr,97%ee)。
11、作为上述技术方案的优选,所述手性钌络合物的用量为α,β-不饱和酮类化合物摩尔量的0.25~1.5%。
12、作为上述技术方案的优选,所述的碱为叔丁醇钾、叔丁醇钠、甲醇钾中任意一种;所述碱的用量为胺类化合物摩尔量的0.25~1倍。
13、作为上述技术方案的优选,所述有机溶剂为甲苯、四氢呋喃、二甲苯中任意一种。
14、作为上述技术方案的优选,所述反应的反应温度为15~60℃,反应时间为2~96小时。优选地,所述反应温度为25℃。
15、作为上述技术方案的优选,所述氢气氛围中的氢气压力为5~40bar。
16、综上所述,本发明具有以下有益效果:
17、1、本发明以多取代α,β-不饱和酮类化合物为底物,在特定的手性钌络合物和碱性试剂的作用下,在氢气氛围中发生连续不对称氢化反应,通过动态动力学拆分过程实现一步合成具有邻手性中心的手性醇;
18、2、本发明反应底物范围广泛、简单易得,反应体系简单、反应条件温和、反应后处理简单,反应产物立体选择性高,大部分底物都能达到>99:1的非对映选择性;
19、3、本发明提供的合成具有邻手性中心的手性醇的方法简单、高效,符合绿色化学的发展要求且可以做到克级反应,适用于工业化生产,具有非常重要的应用前景。
技术特征:
1.一种合成具有邻手性中心的手性醇的方法,其特征在于,将式i或式ii所示α,β-不饱和酮类化合物、手性钌络合物、碱加入有机溶剂中,在氢气氛围下反应,反应完成后分离纯化产物,得到式iii或式v所示具有邻手性中心的手性醇;
2.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述手性钌络合物为中的任意一种。
3.根据权利要求2所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述手性钌络合物为
4.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述手性钌络合物的用量为α,β-不饱和酮类化合物摩尔量的0.25~1.5%。
5.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述碱的用量为胺类化合物摩尔量的0.25~1倍。
6.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述的碱为叔丁醇钾、叔丁醇钠、甲醇钾中任意一种。
7.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述有机溶剂为甲苯、四氢呋喃、二甲苯中任意一种。
8.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述反应的反应温度为15~60℃,反应时间为2~96小时。
9.根据权利要求1所述的合成具有邻手性中心的手性醇的方法,其特征在于,所述氢气氛围中的氢气压力为5~40bar。
10.权利要求1~9任一项所述的合成具有邻手性中心的手性醇的方法在工业化合成具有邻手性中心的手性醇中的应用。
技术总结
本发明属于有机合成技术领域,具体涉及一种合成具有邻手性中心的手性醇的方法。该方法以多取代α,β‑不饱和酮类化合物为底物,在特定的手性钌络合物和碱性试剂的作用下,在氢气氛围中发生连续不对称氢化反应,通过动态动力学拆分过程实现一步合成具有邻手性中心的手性醇。本发明反应底物范围广泛、简单易得,反应体系简单、反应条件温和、反应后处理简单、反应产物立体选择性高,符合绿色化学的发展要求,而且可以做到克级反应,适用于工业化生产,具有非常重要的应用前景。
技术研发人员:王昆,王超,徐慧,张冰,牛赛赛
受保护的技术使用者:湖州学院
技术研发日:
技术公布日:2024/3/31
- 还没有人留言评论。精彩留言会获得点赞!