具有微管蛋白羧肽酶活性的蛋白质的纯化方法及其基于肽的抑制剂与流程
本发明涉及一种用于在生物提取物中纯化具有微管蛋白羧肽酶活性的蛋白质的方法。本发明进一步涉及一种用于鉴定适合于抑制微管蛋白羧肽酶活性的基于肽的抑制剂的方法。本发明还涉及此类基于肽的抑制剂在用于治疗动物、优选哺乳动物中涉及微管去酪氨酸化缺陷的病症中的用途。
背景技术:
1、微管(mt)是构成真核细胞骨架的纤丝的主要类型。它们由两种球状蛋白质的二聚体——α-和β-微管蛋白异二聚体聚合而形成。它们参与许多不同的功能,包括细胞内运输(货物运输)、细胞运动、细胞分裂、细胞形态发生以及将机械信号传送到细胞内效应器(机械转导)。细胞骨架微管系统固有的动态不稳定性对于神经元的重塑、可塑性和适应性至关重要。每种具体的mt功能都需要募集特定的一组mt相关蛋白(map)和分子马达。许多map和马达与从mt表面伸出的微管蛋白c-末端尾部相互作用(ciferri等人,2008;mizuno等人,2004;roll-mecak&vale,2008;skiniotis等人,2004)。因此,使mt适应不同功能的一种方式是通过翻译后修饰来改变微管蛋白c-末端尾部的性质。
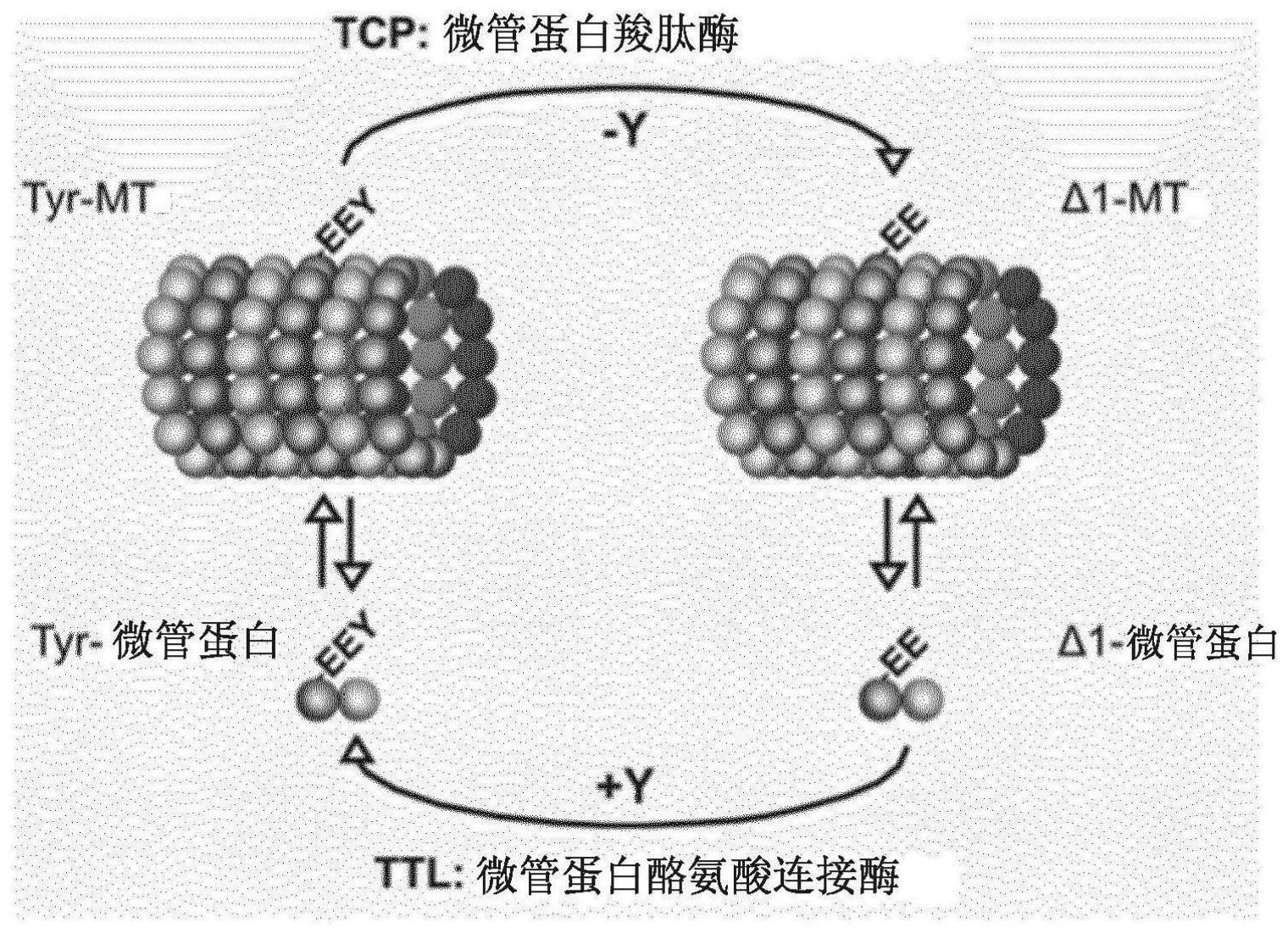
2、在所述微管蛋白c-末端尾部的翻译后修饰中,两种多聚修饰,即聚谷氨酰化和聚甘氨酰化,发生在α-和β-微管蛋白二者上(edde等人,1992;redeker等人,1994)。聚谷氨酰化和聚甘氨酰化由将由谷氨酸或甘氨酸残基构成的侧链添加到存在于这两种微管蛋白的c-末端处的一级序列谷氨酸上组成。最近已鉴定出催化这些修饰的酶(janke等人,2005;rogowski等人,2009;van dijk等人,2007)以及去除聚谷氨酰化的酶(rogowski等人,2010)。除多聚修饰外,在c-末端上还发生去酪氨酸化,但它是α-微管蛋白特异性的(arce等人,1975)。去酪氨酸化由从α-微管蛋白中去除最c-末端的酪氨酸组成,并且它导致生成所谓的δ1-微管蛋白(图1)。
3、到目前为止,拥有微管蛋白羧肽酶(tcp)活性的负责去酪氨酸化的酶尚属未知。值得注意的是,从不同组织和/或生物体获得的蛋白质提取物中所含的天然tcp活性可能在它们的负责去酪氨酸化的那组酶方面不同。
4、鉴定具有tcp活性的酶的特异性抑制剂对于治疗涉及微管去酪氨酸化的病症,例如神经变性疾病、神经元再生障碍、癌症、肌营养不良症、心脏病、血管病症、视网膜变性、不育症或纤毛病而言,特别令人感兴趣。
5、相应地,因此需要一种允许鉴定具有tcp活性的酶的方法以及一种允许设计和鉴定作用于天然tcp酶活性的分子的方法。
技术实现思路
1、有趣的是,本发明提出了鉴定具有tcp活性的酶和基于肽的抑制剂这二者的方法,而与原始组织和/或生物体无关。为此,本发明提出从生物提取物中纯化tcp活性以及使用表现出天然tcp活性的这种经纯化的生物提取物来测试和鉴定基于肽的抑制剂。更特别地,发明人意外发现,可以开发微管蛋白羧肽酶的天然底物,即α-微管蛋白的最c-末端氨基酸,作为用于修饰的部分或骨架,来抑制tcp活性。与α-微管蛋白的c-末端氨基酸序列共有序列同源性的肽可以模仿具有tcp活性的酶的天然底物,从而抑制其活性。更特别地,发明人创造性地使用了由从mt结构构成的中空管中伸出的α-微管蛋白最c-末端序列的可变长度(1至20个氨基酸)组成的肽来抑制生物提取物中所含的天然tcp活性。生成了特异性调控tcp活性的高度选择性、细胞可渗透且细胞毒性检测不到的可逆或不可逆(自杀配体)修饰的肽。本发明进一步提出了一组化学修饰的肽,其通过特异性调控tcp活性而在药理上作用于微管动力学。
2、由于具有微管蛋白羧肽酶(tcp)活性的负责去酪氨酸化的酶可能是有价值的药理靶标,因此本发明现在提出了一种用于鉴定具有微管蛋白羧肽酶(tcp)活性的负责去酪氨酸化的酶的方法。为此,发明人原创性地建立了一种生化方法来分离生物提取物中所含的tcp活性,然后特异性富集所有可以与微管结合的蛋白质。这样,在所述生化纯化步骤之前和之后,鉴定微管相关蛋白(map)组。因此,本发明的一个目的是提供一种从生物提取物中纯化具有微管蛋白羧肽酶活性的蛋白质的方法,所述方法包括:
3、(a)将所述生物提取物在0℃和10℃之间、优选在2℃和5℃之间、更优选在2℃的温度下离心;
4、(b)回收步骤(a)的上清液,并且通过添加gtp并将混合物在35℃和40℃之间、优选在37℃+/-2℃的温度下温育、然后离心来进行第一微管聚合循环;
5、(c)回收步骤(b)的沉淀物,重悬于冰冷的缓冲液中,在4℃+/-1℃下温育,并且通过添加gtp并将混合物在37℃+/-2℃下温育、然后离心来进行第二微管聚合循环;
6、(d)回收步骤(c)的沉淀物,重悬于冰冷的缓冲液中,在4℃+/-1℃下温育,并且通过添加gtp并将混合物在37℃+/-2℃下温育、然后离心来进行第三微管聚合循环;
7、(e)将步骤(d)的沉淀物重悬,将所述混合物进行离子交换色谱,并回收通过流;
8、(f)用60%饱和硫酸铵溶液沉淀所述通过流的蛋白质;
9、(g)将步骤(f)的沉淀级分进行疏水色谱,并通过将硫酸铵浓度逐渐降低至零进行洗脱,以回收具有微管蛋白羧肽酶活性的蛋白质级分。
10、本发明的另一个目的是提供一种用于在基于肽的抑制剂候选物之中选择能够抑制微管蛋白羧肽酶活性的基于肽的抑制剂的方法,所述基于肽的抑制剂候选物包含由1至20个氨基酸构成的肽部分,所述修饰肽在c-末端位置处具有选自y或f的氨基酸,其中所述方法包括(a)使所述基于肽的抑制剂候选物与含有具有微管蛋白羧肽酶活性的天然或重组蛋白质级分和微管的混合物接触,所述微管优选包括合成的微管和/或α-微管蛋白,并带有标记的c-末端y;以及(b)测量分离的y和/或去酪氨酸化的微管的水平。
11、有利地,所述具有微管蛋白羧肽酶活性的蛋白质级分用上文所述的蛋白质纯化方法获得。
12、在一个实施方式中,所述微管包括合成的微管和/或α-微管蛋白,并带有标记的c-末端y。
13、在一个实施方式中,将所述反应样品中分离的y的水平与对照样品中分离的y的水平进行比较,所述对照样品仅包含具有微管蛋白羧肽酶活性的蛋白质级分和微管。
14、在一个特定实施方式中,所述基于肽的抑制剂候选物的肽部分由α-微管蛋白的最c-末端氨基酸的1至20氨基酸构成。
15、在一个特定实施方式中,所述基于肽的抑制剂候选物的肽部分由氨基酸序列nter-x1-x2-x3-x4-x5-x6-x7-x8-x9-x10-x11-x12-x13-x14-x15-x16-cter的最c-末端氨基酸的1至16个构成,其中
16、-x1、x2、x5、x7、x9和x13是疏水性氨基酸,优选选自g、a或v,
17、-x3、x6、x8、x10、x11、x12、x14和x15是带负电荷的氨基酸,优选选自e或d,
18、-x4是极性不带电荷的侧链,优选选自s、t、n或q,以及
19、-x16是大的疏水性氨基酸,选自y或f。
20、例如,所述基于肽的抑制剂候选物的肽部分具有选自y、eay、edy和eey的氨基酸序列。
21、在一个特定实施方式中,所述基于肽的抑制剂候选物还包含反应性部分,所述反应性部分优选选自环氧琥珀酰基、酰氧基甲基、醛和酮。在一个实施方式中,所述反应性基团被纳入肽序列内。例如,所述反应性基团是环氧基(epoxyde),它替代了邻近于最c-末端芳族残基、优选f或y的谷氨酸残基。
22、本发明的另一个目的是提供一种用于治疗动物中涉及微管去酪氨酸化改变的病症的基于肽的抑制剂,其中所述基于肽的抑制剂包含由1至20个氨基酸构成的肽部分,所述肽部分在c-末端位置处具有选自y或f的氨基酸,并且其中所述基于肽的抑制剂至少部分抑制微管蛋白羧肽酶活性。
23、根据本发明,所述基于肽的抑制剂不可逆地或可逆地抑制微管蛋白羧肽酶活性。
24、所述病症优选选自:神经变性疾病,优选选自阿尔茨海默病,帕金森病,精神障碍和神经障碍,神经元再生障碍,癌症,优选选自结肠癌和神经母细胞瘤,肌营养不良症,心脏病,血管病症,不育症,视网膜变性,以及纤毛病。
25、本发明的另一个目的是提供一种药物组合物,其包含治疗有效量的这样的基于肽的抑制剂。
- 还没有人留言评论。精彩留言会获得点赞!