一种温度响应性分子印迹人工酶抑制剂的制备方法与应用
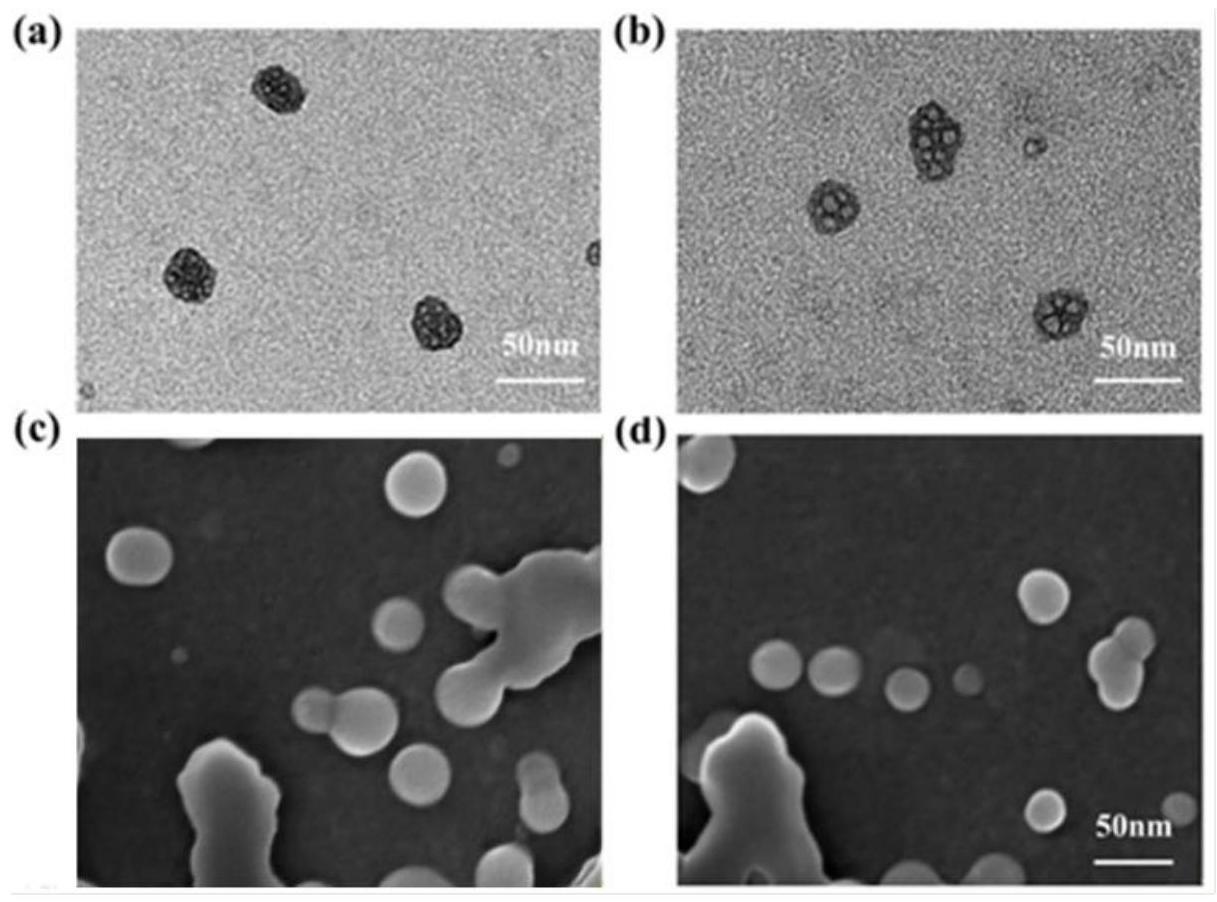
本发明属于生物医学高分子材料领域,涉及一种温度响应性分子印迹人工酶抑制剂的制备方法与应用。
背景技术:
1、酶几乎参与所有与生命活动有关的生化反应,是新陈代谢、信号传导及细胞调控等生物化学过程不可缺少的一类蛋白分子。在机体内,内源性酶抑制剂(eis)通过特异性结合和阻断酶的活性位点,自我调控酶的活性,不仅可以有效纠正由酶的过度活性或过度表达引起的代谢失衡,还可以起到抵御病原体入侵等作用。受天然eis的机制和功能的启发,人工酶抑制剂的开发由于其在生物医用领域中的多种优势得到了广泛的关注。分子印迹聚合物(mips)作为可定制的高亲和性和选择性的人工酶抑制剂,具有成本低廉、制备方法可调、存储环境要求低等优势,成为最有前途的酶抑制剂替代物之一。
2、尽管mips作为分子识别材料在分离与吸附等领域取得较大进展,但是开发能够模拟天然eis抑制机制的mips并用于生物医学领域的研究仍然处于初级阶段。目前,能够称为分子印迹人工酶抑制剂的mips更多用于特异性识别酶等大分子蛋白质,且面临制备方法复杂、模板洗脱困难、形态控制不佳、智能响应性差等问题,是mips替代天然eis的最主要的限制条件。因此,开发一种制备分子印迹人工酶抑制剂的通用方法具有重要的科学和社会意义。
3、此外,天然酶抑制剂作为参与生命活动不可或缺的生物大分子,能够根据体内环境的变化智能地展现出抑制行为,能否智能地响应外部环境是衡量mips能够模拟天然eis的重要指标。然而,采用常规方法制备的mips大多为刚性结构,只能简单机械地识别目标分子,缺乏灵活性和可变性,无法主动响应外界刺激并做出相应反应。为此,开发刺激响应性mips可以用来模拟机体内生物分子的功能,代替天然eis的功能在生物医学领域潜力巨大。
技术实现思路
1、本发明提供了一种温度响应性分子印迹人工酶抑制剂的制备方法与应用。所述的分子印迹人工酶抑制剂采用固相印迹法合成,对相应酶具有优异的特异选择性且其特异性具有温度响应性。基于该分子印迹人工酶抑制剂的特性,研究了不同温度下其对胰蛋白酶消化性能的抑制及对l929细胞粘附行为的调控。
2、为实现上述发明目的,本发明采用以下技术方案:
3、一种温度响应性分子印迹人工酶抑制剂,所述分子印迹人工酶抑制剂的粒径为50-100nm,为可溶胀的纳米凝胶颗粒;所述的纳米凝胶颗粒由温敏的n-异丙基丙烯酰胺和交联剂n,n-亚甲基双丙烯酰胺为骨架材料组成,含有功能基团苯甲脒和羧基;所述的交联剂n,n-亚甲基双丙烯酰胺含量为5%;所述的功能基团通过相应的功能单体参与聚合修饰在骨架上。
4、所述的纳米凝胶颗粒由固相印迹法制备得到,所述的固相印迹法将目标酶分子固定在固体支撑物玻璃珠上,纳米颗粒在玻璃珠与反应液界面反应制得,含有对相应酶具有特异性的印迹位点;所述玻璃珠粒径约为100μm;所述反应液由温敏单体、功能单体与交联剂组成;所述印迹位点对相应酶具有特异性的识别能力且受温度控制。
5、进一步地,所述分子印迹人工酶抑制剂能够有效抑制相应酶活性,且可以温控酶活性的呈现,智能抑制酶对细胞行为的影响。
6、本发明中提供了一种温度响应性分子印迹人工酶抑制剂的制备方法,具体包括步骤如下:
7、(1)玻璃珠gbs表面的活化
8、4m naoh溶液100℃加热至沸腾,待naoh溶液沸腾后加入直径为70~100μm的gbs,搅拌并持续加热15min。冷却后用纯水进行清洗并抽滤,直至清洗gbs的溶液ph值呈中性。随后将gbs取出放入玻璃培养皿中,放置烘箱内,40~50℃烘干后过筛待用。
9、(2)玻璃珠表面固定分子印迹模板
10、将步骤(1)表面活化过的gbs倒入环氧硅烷与无水甲苯的混合中,置于90~130℃油浴加热,冷凝回流15~18h;冷却后将gbs使用乙醇冲洗后,置于烘箱内干燥后过筛待用;
11、接着使用亚氨基二乙酸、氯化钠以及碳酸钠的混合溶液处理gbs,60~80℃油浴搅拌15~20h;纯水冲洗抽滤后,将gbs装入恒温色谱柱中,并连接至蠕动泵上,泵入纯水冲洗玻璃珠后,通入硫酸铜溶液接枝铜离子后再用纯水与pbs冲洗,最后将含模板分子的pbs溶液通入色谱柱,实现色谱柱内模板在gbs表面的固定。
12、(3)固相合成分子印迹人工酶抑制剂
13、称取温度响应性单体、功能单体、交联剂溶于pbs中,超声使其完全溶解,置于冰水浴中并通入氮气,形成预聚液,随后在无氧条件下将氧化还原引发剂过硫酸钾及四甲基乙二胺添加到预聚液中,继续通氮气后,将预聚液泵入步骤(2)所得色谱柱中;打开循环水浴开关,设置并保持色谱柱内温度为37℃,恒温反应4~15h后,继续在37℃下,pbs冲洗,冲洗未反应单体、低聚物和非印迹纳米颗粒nip-nps;
14、将循环水浴温度降至4℃,继续通pbs缓冲液将高亲和分子印迹纳米颗粒mip-nps冲出,过滤,透析,得到温度响应性分子印迹人工酶抑制剂,冻干后放入真空干燥箱中备用。
15、步骤(2)中,环氧硅烷与无水甲苯的混合液中,环氧硅烷与无水甲苯的体积比为1:1;所述的环氧硅烷与无水甲苯油浴温度为110℃,冷凝回流时间为17h。
16、步骤(2)中,所述亚氨基二乙酸、氯化钠以及碳酸钠的混合溶液中,亚氨基二乙酸、氯化钠以及碳酸钠的浓度分别为0.5~1.5m、0.2~0.5m、1~3m。
17、步骤(2)中,所述硫酸铜溶液浓度为30~60mm,流速为3ml/min,持续通入25-35min。
18、步骤(2)中,所述模板分子为胰蛋白酶,含模板分子的pbs溶液的浓度1mg/ml,gbs和含模板分子的pbs溶液的用量比为50g:30~50ml。
19、步骤(3)中,
20、所述温度响应性单体为n-异丙基丙烯酰胺nipaam;
21、功能单体为丙烯酰胺aam、丙烯酸aa和n-(4-甲脒基苯基)丙烯酰胺ab的混合物,或者丙烯酸aa和n-(4-甲脒基苯基)丙烯酰胺ab两者的混合物;
22、交联剂为n,n-亚甲基双丙烯酰胺bis,且均为纯化后使用。
23、步骤(3)中,所述预聚液的各个反应物nipaam、aam、ab、aa、bis的用量比例为110~230mg:14~70mg:20~25mg:0.8~1.5mg:15~18mg;
24、或者各个反应物nipaam、ab、aa、bis的用量比例为110~230mg:20~25mg:0.8~1.5mg:15~18mg。
25、步骤(3)中,所述引发剂过硫酸钾kps用量为15~20mg,使用时需经过pbs缓冲液溶解后添加,四甲基乙二胺temed的用量为1~2μl。
26、本发明还提供了上述制备方法所得分子印迹人工酶抑制剂在调控细胞粘附行为方面的应用,具体方案如下:
27、分别配制胰蛋白酶的pbs缓冲溶液、mip-nps的pbs缓冲溶液,37℃条件下混合3-5h后,加入到l929细胞贴壁的孔板内,调控25℃或37℃实现胞粘附行为的调控。
28、其中,所述胰蛋白酶的pbs缓冲溶液浓度为0.5mg/ml,mip-nps的pbs缓冲溶液浓度为1mg/ml,两者的体积比1:1。
29、所述l929细胞为成纤维细胞,用5w/ml浓度悬液,以100μl/孔加入到96孔板中,37℃下待细胞贴壁后使用。
30、与现有技术相比,本发明的有益效果:
31、本发明使用固相印迹合成温度响应性分子印迹人工酶抑制剂,选取了能与蛋白质中羧基形成稳定羧脒盐桥的苯甲脒功能单体,增强了对酶等蛋白质的亲和力;固相印迹法可以直接分离高低亲和性位点,即所得分子印迹聚合物中位点都为高亲和性位点;固相印迹法可以直接分离模板酶分子与聚合物,无须复杂的模板洗脱过程;固相印迹法所得分子印迹聚合物为纳米尺度的微凝胶颗粒,具有良好的水溶胀性能和温度响应性能;固相印迹所得分子印迹纳米颗粒无论在粒径尺寸、识别性能还是刺激响应性方面都更为接近天然酶抑制,是替代天然eis最佳选择。
32、目前制备用于生物医学领域的分子印迹聚合物常用的方法有沉淀聚合、反相微乳液聚合、载体表面印迹法等,但是这些方法面临有机溶剂环境生物不相容、化学修饰毒性高等问题,而且所制备的分子印迹聚合物尺寸较大、模板难洗脱、不能对外界刺激做出响应等,都不是制备人工酶抑制的有效手段,因此所得分子印迹聚合物只能简单的识别相应的酶,并不能真正代替酶抑制的功能。本发明为制备智能人工酶抑制剂提供了新思路新方法,并通过温度控释酶的活性从而用于细胞行为的调控,为本领域后续研究奠定基础。
- 还没有人留言评论。精彩留言会获得点赞!