MRSA脓毒症相关DIC的生物标记物及其作用机制的研究方法
本发明涉及mrsa脓毒症相关dic的生物标记物及其作用机制的研究方法,属于生物标记物。
背景技术:
1、弥散性血管内凝血(disseminated intravascular coagulation,dic)是脓毒症最常见的并发症,具有较高的发病率和死亡率。据统计,脓毒症患者诱发dic的发病率约20%-50%,而在发生dic 30天内患者死亡率高达45%,已成为导致脓毒症患者死亡和预后不良的关键因素。细菌感染是诱发脓毒症的首位病因,随抗生素在脓毒症治疗中的广泛使用,耐甲氧西林金黄色葡萄球菌(methicillin-resistant staphylococcus aureus,mrsa)已成为院内和社区感染的主要致病菌。mrsa的多重耐药甚至泛耐药,导致mrsa脓毒症相关dic病程延长,临床治疗愈加困难。
2、dic是多因素导致的微血管损伤,从而活化凝血系统形成广泛的微血栓,凝血因子消耗并继发纤溶亢进,引起的以出血和微循环衰竭为特征的一种临床综合征,最常见于脓毒症等感染性疾病。在脓毒症早期,机体通过凝血级联反应阻止病菌扩散、阻碍氧气和营养物质的输送,抵抗病原菌入侵。然而,随疾病发展,巨噬细胞失控的炎症反应可以提高tf活性并诱导其表达和释放,激活凝血系统,使机体持续处于高凝状态,对组织脏器造成不可逆的损伤。据统计,全球每年约有3000万人罹患脓毒症,我国每年新增脓毒症患者约250万;脓毒症患者凝血功能异常的发病率为50%-70%,轻者仅表现为凝血因子活性改变或血小板计数异常,而随疾病进展,约35%的危重患者出现dic,导致微血栓形成,出现全身出血和多器官功能障碍等症状,是脓毒症患者死亡的主要原因。
3、基于国内外脓毒症及相关dic的多个诊疗指南及研究报道,2017年我国急诊专家针对该疾病的诊疗共识起草了《脓毒症并发弥散性血管内凝血诊治急诊专家共识》,关于脓毒症相关dic提出了四方面治疗建议:病因(抗感染)治疗、抗凝治疗、替代治疗和中药治疗。抗菌药物是治疗首要措施,然而抗生素的开发和应用在有效降低患者死亡率的同时,多重耐药性细菌也随之产生。2021年全国细菌耐药检测网报道,我国mrsa平均检出率为29.4%,各地区mrsa检出率为15.2%-46.0%。值得注意的是,近年来革兰氏阳性菌脓毒症发病率逐年升高,占脓毒症40%以上,而mrsa已成为主要的革兰氏阳性耐药菌mrsa脓毒症相关dic不仅病情严重,病程延长,且患者预后不良,死亡率升高。尽管针对mrsa脓毒症相关dic的早期诊疗流程不断规范,抗感染、脏器支持等治疗方法不断进步,但其发病率和死亡率仍居高不下,且抗凝治疗显著增加了患者的出血风险,替代治疗需根据患者血液成分进行。因此,探寻新的、有效的mrsa脓毒症相关dic的生物标记物,及靶向治疗该疾病的新策略刻不容缓。
4、巨噬细胞是人体最主要的免疫细胞,在感染性疾病中承担着启动炎症反应,清除体内病原菌的作用。近年来,研究人员揭示了巨噬细胞焦亡可诱发脓毒症相关dic的新发病机制,然而基于该发病机制的靶向调控蛋白却知之甚少。
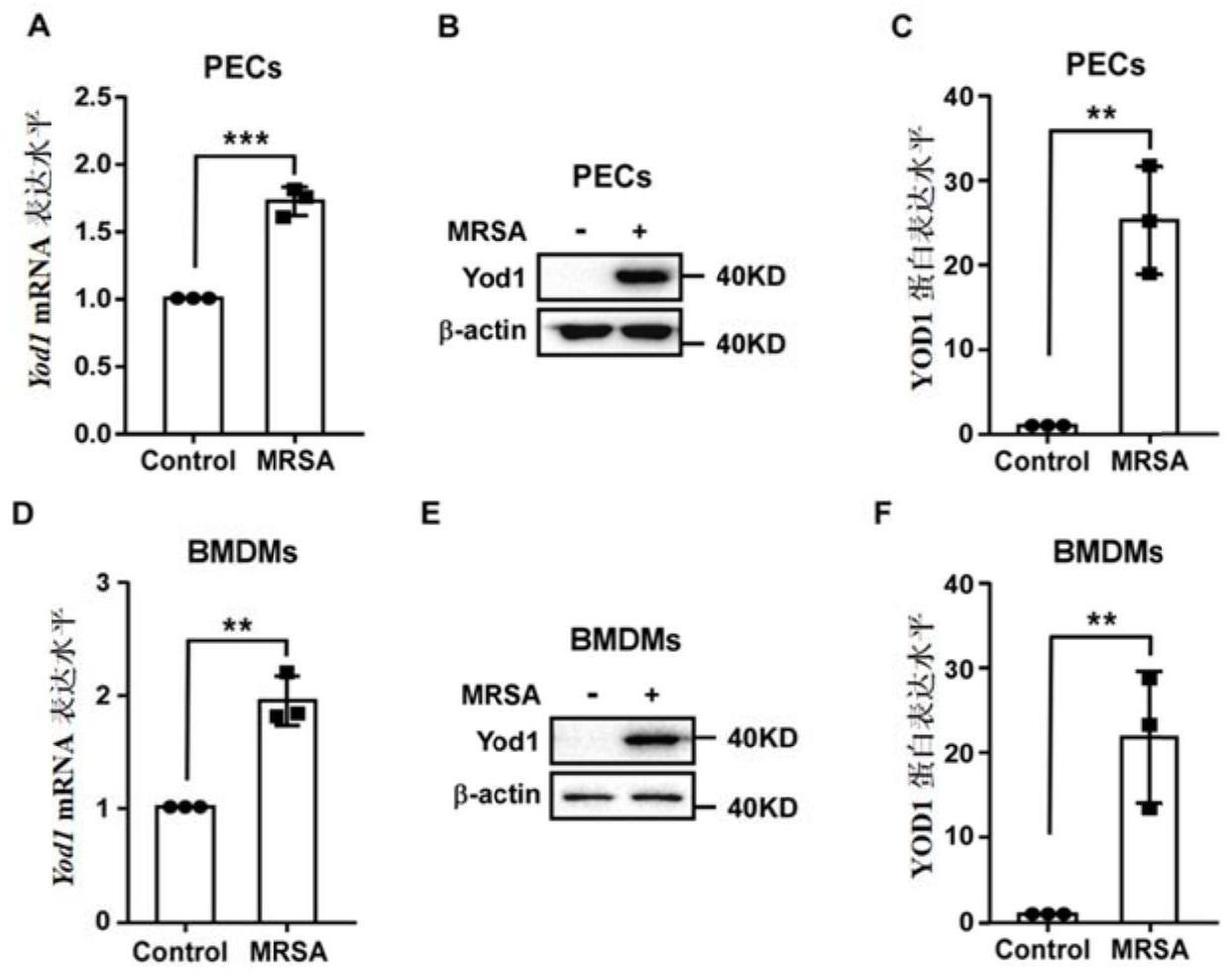
5、yod1是卵巢癌家族中高保守的去泛素化酶,由348个氨基酸组成,主要通过移除蛋白的泛素化修饰,调控蛋白活性和功能。目前的相关研究表明,yod1与多种疾病的发生、发展密切相关。在卵巢癌中发现,yod1在卵巢癌组织中表达升高,增强了卵巢癌细胞的迁移能力;在恶性骨肉瘤的研究中发现,抑制yod1的表达可以降低骨肉瘤细胞的活力、增殖和黏附能力;在肝癌中证实,yod1可以通过增强yap/taz的活性来促进肝细胞的增殖;在肾脏疾病中的研究发现,yod1能够特异性移除nedd4的k63位泛素化修饰,从而抑制细胞增殖;还有一些发现,yod1依赖其去泛素化酶活性,有效的降解大脑中的异常蛋白,延缓帕金森等神经退行性疾病的发展。
6、研究发现yod1可抑制mrsa脓毒症相关dic的进展,上述内容迄今为止未见任何报道。由此,以yod1为切入点,阐释其在mrsa脓毒症相关dic中的调控作用及分子机制,有望为该疾病的靶向治疗及生物标记物的研发提供新的思路。
技术实现思路
1、针对现有技术存在的不足,本发明的第一目的在于提供mrsa脓毒症相关dic的生物标记物。
2、本发明的第一目的在于提供上述生物标记物的作用机制的研究方法
3、为了实现第一目的,本发明是通过如下的技术方案来实现:mrsa脓毒症相关dic的生物标记物,所述生物标记物为去泛素化酶yod1。
4、为了实现第二目的,本发明是通过如下的技术方案来实现:mrsa脓毒症相关dic的生物标记物作用机制的研究方法,包括如下步骤:
5、s1:脓毒症小鼠模型的构建;
6、s2:血液及组织取材;
7、s3:血液、肝脏、脾脏、肺脏和肾脏组织中mrsa菌落数量计数;
8、s4:分析各组小鼠生存曲线;
9、s5:计算各组小鼠血小板数量;
10、s6:elisa检测各组小鼠血清中d-dimer,fib,tat,pai-1的水平;
11、s7:采用苏木素-伊红(h&e)进行组织染色
12、s8:小鼠腹腔及骨髓来源巨噬细胞的分离及培养;
13、s9:western blot检测小鼠巨噬细胞中yod1蛋白的表达;
14、s10:qpcr检测小鼠巨噬细胞中yod1 mrna的表达;
15、s11:统计学分析。
16、优选的,步骤s1具体为:选取6-8周龄wt小鼠和yod1-/-小鼠,随机分为4组:wt pbs组、wt mrsa感染组、yod1-/-pbs组、yod1-/-mrsa感染组,感染组小鼠经尾静脉注射菌悬液,pbs组注射等量的pbs;感染12h后,收集小鼠血液和组织。
17、优选的,步骤s2具体为:
18、s2.1:血液采集
19、用无菌注射器对其心脏穿刺抽取血液。
20、s2.2:组织取材
21、根据器官位置摘取完整组织,在无菌pbs中清洗,用无菌纱布吸去表面液体,保持组织原有状态装入ep管中。
22、优选的,步骤s3具体为:取等质量的组织放入无菌ep管中,加入pbs,研磨至匀浆;将血液和组织匀浆用pbs进行稀释,置于胰蛋白胨大豆琼脂培养基上,37℃恒温培养箱培养24h,根据培养基的菌落数量确定对应组织的细菌负荷量。
23、优选的,步骤s4具体为:将mrsa用无菌pbs稀释至浓度为1×109cfu/ml,感染组小鼠经尾静脉注射100μl菌悬液,pbs组注射等量的pbs,观察各组小鼠14天生存率。
24、优选的,步骤s5具体为:收集的各组小鼠心脏血液采用edta-k2抗凝,使用maccuradh-510自动血液分析仪检测血小板数量。
25、优选的,步骤s6具体为:在酶标包被板上分别设空白孔、待测样品孔、标准品孔;依次加入样品、生物素标记的抗抗体、酶标试剂,37℃孵育后冲洗,拍干;每孔加入显色剂,37℃室温避光显色15min,加入终止液以终止反应,以空白孔调零,在450nm波长处测量各孔吸光度,并根据标准品绘制的标准曲线计算样品浓度。
26、优选的,步骤s8具体为:选取6-8周龄的c57bl/6j小鼠,腹腔注射4%巯基乙酸盐溶液,三天半后,将小鼠处死,收集腹腔渗出细胞;离心弃去上清液,用含有10%fbs的rpmi1640培养基重悬细胞至适宜浓度,并将其接种到细胞培养板,培养2.5h后,弃去未贴壁细胞,贴壁细胞即为小鼠腹腔巨噬细胞;6-8周龄的c57bl/6j小鼠颈椎脱臼处死,取下完整的股骨和胫骨,pbs溶液中清洗,分离股骨和胫骨,暴露骨腔,用注射器吸取培养基(dmem高糖+10%fbs)反复冲洗骨腔内细胞,收集的细胞液轻柔吹打混匀,经70μm细胞筛过滤。裂解红细胞后,用培养基rpmi 1640+15% fbs+1%p/s+10ng/ml m-csf重悬,接种在培养皿中并放置于培养箱培养。3天后,补加等量的培养基(含m-csf浓度为20ng/ml)继续培养。培养的第7天,底部贴壁细胞即为诱导的小鼠骨髓来源巨噬细胞。
27、优选的,步骤s9具体为:
28、s9.1:将步骤s8得到的巨噬细胞进行接种,分为mrsa未感染组和mrsa感染组,加入细胞裂解液冰上裂解,离心取上清液,bca法测定蛋白浓度;
29、s9.2:经sds-page凝胶电泳分离后,将蛋白转移到pvdf膜上,过夜孵育,用tbst缓冲液冲洗,再用带有hrp标记的羊抗兔或羊抗鼠igg孵育,用tbst缓冲液冲洗;
30、s9.3:使用化学发光成像系统采集图像,image j软件进行分析统计,其中以β-actin为内参,以目的蛋白条带与β-actin条带灰度值的比值反映目的蛋白表达水平。
31、优选的,步骤s10具体为:使用trizol试剂提取细胞总rna,逆转录为cdna,利用sybr green染料法real-time pcr进行半定量基因表达量检测。
32、本发明的有益效果:
33、(1)本技术证实yod1抑制mrsa脓毒症相关dic的发生、发展,对于理解mrsa脓毒症相关dic具有重要意义;且yod1在mrsa感染后表达增高,进而可阻碍mrsa脓毒症相关dic的进展,有望成为脓毒症相关dic的生物标记物或临床治疗靶点。
34、(2)在小鼠巨噬细胞中加入mrsa感染,yod1表达显著增高;且与野生型小鼠相比,yod1-/-小鼠感染mrsa后,可在其主要组织脏器中检测到更多的mrsa,且血清中凝血相关指标增高,小鼠14天生存率下降,提示yod1可能是mrsa脓毒症相关dic的生物学标志物。
- 还没有人留言评论。精彩留言会获得点赞!