瑞卢戈利中间体化合物及瑞卢戈利的制备方法与流程
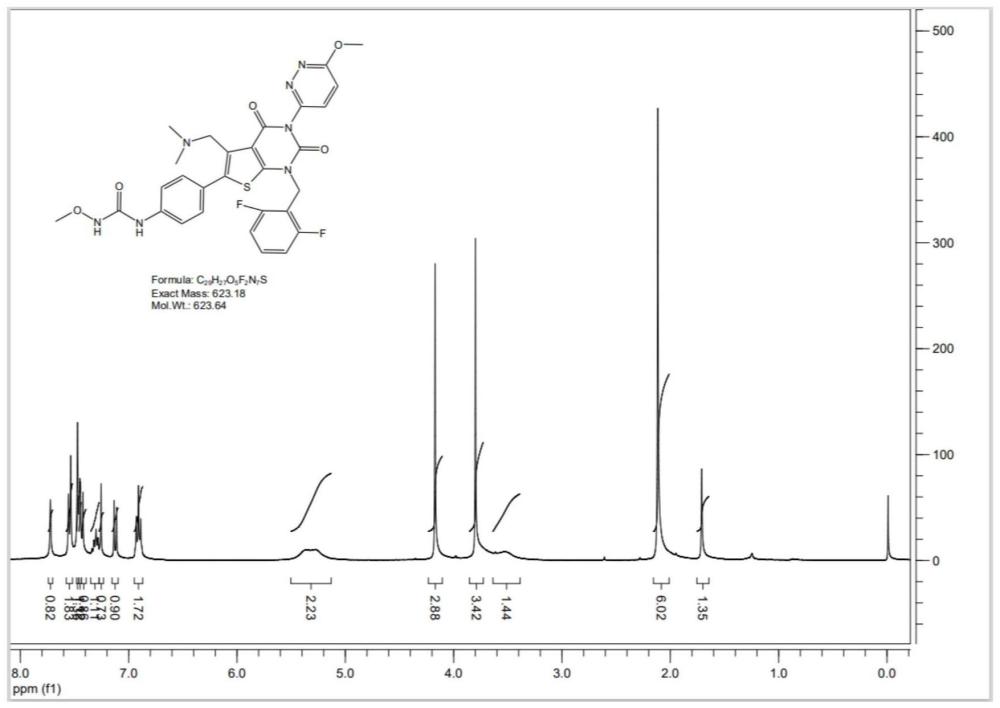
本发明涉及医药中间体,尤其是涉及瑞卢戈利中间体化合物及瑞卢戈利的制备方法。
背景技术:
1、瑞卢戈利是一种口服非肽类促性腺激素释放激素(gnrh)受体阻断剂,由日本武田制药和myovant sciences等公司共同开发,最早于2019年1月8日在日本pmda获批用于子宫肌瘤的治疗和症状缓解,商品名为2020年12月18日myovant sciences公司的瑞卢戈利片获美国fda批准用于治疗晚期前列腺癌成人患者,商品名为目前,武田制药已在国内完成瑞卢戈利片三期临床试验,临床试验的适应症为治疗晚期前列腺癌。
2、目前,国内外公开的瑞卢戈利的合成制备方法主要有以下几条路线。
3、①j.med.chem.2011,54,4998-5012,公开报道了如下制备工艺路线。
4、
5、②专利cn104703992b公开了如下制备工艺路线。
6、③专利cn110194776b公开了如下制备工艺路线。
7、④专利cn113563363b、cn113563304b、cn113429423b和cn113563303b公开了如下制备工艺路线。
8、
9、对比以上几条瑞卢戈利的制备工艺路线,其中路线①存在最后一步收率低,杂质多,生产成本高的问题;路线②和路线③的最后一步容易产生缩脲副产物,且比例高,难以去除,最终影响产品质量;路线④需要先后对脲上的n进行氨基保护和脱保护,影响产品收率并最终导致生产成本较高。
技术实现思路
1、本发明是为了克服现有技术中瑞卢戈利的制备方法收率不高、产品质量不佳、设备要求高、不适合工业化生产的问题,提供了瑞卢戈利中间体化合物及瑞卢戈利的制备方法,采用与现有技术不同的中间体及方法制得瑞卢戈利,操作简单安全、环境友好、产品质量佳、后处理简单、总收率高、生产成本低,且适合于工业化生产。
2、为了实现上述目的,本发明采用以下技术方案:
3、第一方面,本发明提供了一种瑞卢戈利中间体化合物a,结构式为:
4、
5、其中,r为甲基、乙基、苯基、苄基中的一种。
6、作为优选,由化合物sm-1与氯甲酸酯反应制得,化合物sm-1的结构式为:
7、
8、氯甲酸酯的结构式为:
9、
10、其中,r为甲基、乙基、苯基、苄基中的一种。
11、第二方面,本发明提供了一种瑞卢戈利中间体化合物b,结构式为:
12、
13、其中,r为甲基、乙基、苯基、苄基中的一种;x为氯、溴、碘中的一种。
14、作为优选,由上述的瑞卢戈利中间体化合物a与卤代试剂反应制得。
15、作为优选,所述的卤代试剂为n-氯代丁二酰亚胺、n-溴代丁二酰亚胺、n-碘代丁二酰亚胺中的一种。
16、第三方面,本发明提供了一种瑞卢戈利中间体化合物c,结构式为:
17、
18、其中,r为甲基、乙基、苯基、苄基中的一种。
19、作为优选,由上述的瑞卢戈利中间体化合物b与二甲胺或二甲胺盐酸盐反应制得。
20、第四方面,本发明提供了一种瑞卢戈利的制备方法,包括如下步骤:
21、(1)由化合物sm-1与氯甲酸酯反应制得上述的瑞卢戈利中间体化合物a;
22、(2)由所述的瑞卢戈利中间体化合物a与卤代试剂反应制得上述的瑞卢戈利中间体化合物b;
23、(3)由所述的瑞卢戈利中间体化合物b与二甲胺或二甲胺盐酸盐反应制得上述的瑞卢戈利中间体化合物c;
24、(4)由所述的瑞卢戈利中间体化合物c与甲氧基胺或甲氧基胺盐酸盐反应,得到瑞卢戈利。
25、本发明制备瑞卢戈利时,采用的工艺路线为:
26、(1)
27、(2)
28、(3)
29、(4)
30、本发明以化合物sm-1为起始原料,依次制得与现有技术不同的瑞卢戈利中间体化合物a、瑞卢戈利中间体化合物b、及瑞卢戈利中间体化合物c;然后在通过瑞卢戈利中间体化合物c制得瑞卢戈利,采用本发明中的方法制备瑞卢戈利,操作简单安全、环境友好、产品质量佳、后处理简单、总收率高、生产成本低,且适合于工业化生产。
31、作为优选,步骤(1)中反应时,化合物sm-1与氯甲酸酯的摩尔比为1:1~3,反应的温度为-20℃~30℃,反应时间为0.05h~10h;反应在缚酸剂存在下进行,缚酸剂为吡啶或三乙胺,化合物sm-1与缚酸剂的摩尔比为1:1~3;反应时的溶剂为有机溶剂,有机溶剂与所述的化合物sm-1的体积质量比为1ml/g~100ml/g;
32、和/或,步骤(2)中反应时,瑞卢戈利中间体化合物a与卤代试剂的摩尔比为1:1~5,反应的温度为-10℃~80℃,反应的时间为0.5h~10h,卤代试剂为n-氯代丁二酰亚胺、n-溴代丁二酰亚胺、n-碘代丁二酰亚胺中的一种;反应在引发剂作用下进行,引发剂为偶氮二异丁腈(aibn),瑞卢戈利中间体化合物a与引发剂的摩尔比为1:0.01~1,反应时的溶剂为有机溶剂,有机溶剂与瑞卢戈利中间体化合物a的体积质量比为1ml/g~100ml/g;
33、和/或,步骤(3)反应时,瑞卢戈利中间体化合物b与二甲胺或二甲胺盐酸盐的摩尔比为1:1~10,反应的温度为0℃~80℃,反应的时间为0.5h~10h,反应在缚酸剂存在下进行,缚酸剂为三乙胺或吡啶;瑞卢戈利中间体化合物b与缚酸剂的摩尔比为1:1~10,反应时的溶剂为有机溶剂,有机溶剂与瑞卢戈利中间体化合物b的体积质量比值范围为1ml/g~100ml/g;
34、和/或,步骤(4)反应时,瑞卢戈利中间体化合物c与甲氧基胺或甲氧基胺盐酸盐的摩尔比为1:1~10,反应的温度为0℃~80℃,反应的时间为0.5h~10h,反应时的溶剂为有机溶剂,有机溶剂与瑞卢戈利中间体化合物c的体积质量比值范围为1ml/g~100ml/g。
35、作为优选,步骤(1)中反应时,化合物sm-1与氯甲酸酯的摩尔比为1:1.5~2,反应的温度为-10℃~0℃,反应时间为1.5h~3h,化合物sm-1与缚酸剂的摩尔比为1:1.5~2,反应时的溶剂为氯甲烷、乙酸乙酯、dmf中的一种,溶剂与化合物sm-1的体积质量比为10~30ml/g;
36、和/或,步骤(2)中反应时,瑞卢戈利中间体化合物a与卤代试剂的摩尔比为1:1.05~1.2,反应的温度为0℃~30℃,反应的时间为2h~4h,瑞卢戈利中间体化合物a与引发剂的摩尔比为1:0.05~0.15,反应时的溶剂为腈类溶剂、乙酸乙酯、氯甲烷中的一种,溶剂与瑞卢戈利中间体化合物a的体积质量比为10~30ml/g;
37、和/或,步骤(3)反应时,瑞卢戈利中间体化合物b与二甲胺或二甲胺盐酸盐的摩尔比为1:1.2~3,反应的温度为20℃~40℃,反应的时间为2h~4h,瑞卢戈利中间体化合物b与缚酸剂的摩尔比为1:1.2~3,反应时的溶剂为乙酸乙酯、dmf、腈类溶剂中的一种,溶剂与瑞卢戈利中间体化合物b的体积质量比为10~30ml/g;
38、和/或,步骤(4)反应时,瑞卢戈利中间体化合物c与甲氧基胺或甲氧基胺盐酸盐的摩尔比为1:1.5~2,反应的温度为10℃~40℃,反应的时间为3h~5h,反应时的溶剂为dmf、乙酸乙酯、氯甲烷、腈类溶剂中的一种,溶剂与瑞卢戈利中间体化合物c的体积质量比为10~30ml/g。
39、因此,本发明具有如下有益效果:采用与现有技术不同的中间体及方法制得瑞卢戈利,操作简单安全、环境友好、产品质量佳、后处理简单、总收率高、生产成本低,且适合于工业化生产。
- 还没有人留言评论。精彩留言会获得点赞!