一种体细胞突变率的检测方法与流程
本公开涉及基因检测,尤其涉及一种体细胞突变率的检测方法。
背景技术:
1、体细胞突变是指生物个体的体细胞在繁殖过程中发生的基因突变并呈克隆生长,与胚系突变相比,体细胞突变不会遗传给后代,只影响个体自身。体细胞突变的发生通常与细胞活动中遭受的各类dna损伤和细胞分裂过程中dna的复制错误没有得到(正确的)修复相关。体细胞突变在个体生命过程中具有多种重要意义,与疾病相关的最广为熟知的是体细胞突变所导致的癌症,通常被称为癌症驱动体细胞突变。由于体细胞突变所产生的突变克隆癌细胞与正常细胞混合生长,通过检测样本(如病理组织、血浆、痰液、尿液等)中相关癌症驱动基因的体细胞突变有无(定性)或所占比率(定量),对肿瘤的筛查、靶向药物选择、疗效监测和预后评估等都具有重要的临床意义。
2、突变阻滞扩增系统pcr(arms-pcr),又称为等位基因特异性pcr(as-pcr)。arms-pcr具有检测灵敏度高、可检测低至0.5%~0.01%的突变,且具有体系设计与优化简易等特点。是目前国际上肿瘤个体化分子检测最重要、最广泛应用的技术之一,其在临床应用中的优势已被业内专家广泛认可,比如cfda批准的肿瘤靶向用药egfr基因突变检测试剂盒,90%以上都是arms-pcr检测方法。
3、arms-pcr的基本原理为引物3′端碱基与模板完全互补配对时,引物能正常进行延伸。如果引物的3′端碱基与模板碱基不互补,即存在错配,引物扩增能力显著下降,引物延伸被抑制甚至完全终止。因此,根据已知突变位点设计2条引物,其3′端碱基分别与突变(arms突变引物)和野生(arms野生引物)的模板碱基互补,arms突变引物对突变型等位基因特异,arms野生引物对野生型等位基因特异,标本分别在2个反应体系中(突变体系:arms突变引物+公用引物;野生体系:arms野生引物+公用引物)同时扩增,通过凝胶电泳或荧光定量pcr(qpcr)确定基因型。为提高引物特异性,通过在引物3′端-2~-4位引入人为错配碱基以降低错配引物的扩增能力,增加突变的区分能力。
4、最初,arms-pcr的突变检测结果鉴定采用终点法,即将扩增产物通过琼脂糖凝胶电泳,根据有无特异性电泳条带进行分型检测,由于引物(arms突变引物vs野生模板,arms野生引物vs突变模板)3′端错配也可以扩增出非特异性产物,该鉴定方法存在非特异性扩增产物电泳条带的干扰,且不适合高通量检测,操作繁琐,只能定性不能定量检测,扩增产物污染实验室等问题。
5、随着qpcr技术平台的发展和广泛应用,将arms特异性扩增和qpcr的数据分析(扩增曲线或循环阈值(ct值))相结合进行结果判读(arms-qpcr),已逐渐取代琼脂糖凝胶电泳方法成为目前主流的结果判读方法。arms-qpcr方法具有特异性强、灵敏度高、重复性好、速度快、全封闭反应、并基于qpcr数据分析方法进行突变定性或突变率定量检测等优势。
6、arms-qpcr定性检测突变,包括2个反应体系,其中突变体系(armsm-qpcr)由arms突变引物体系+水解探针或荧光染料组成,内参体系(内参-qpcr)由arms野生引物体系+水解探针或荧光染料,或由选定的内参基因的引物体系+探针或荧光染料组成。2个反应体系针对同一样本同时进行qpcr检测,根据ct值的差值δct(δct=内参-qpcr的ct值-armsm-qpcr的ct值)判定是否存在突变,常规的突变判定标准为δct>(7.0~14.0),取决于所建反应体系特异性的优化程度。定性检测只能报告有无突变,无法报告检测样本的突变率。目前,绝大部分arms-qpcr检测突变采用定性方法。
7、arms-qpcr突变率的定量检测,一般遵循qpcr的ct值与模板起始拷贝数的对数存在线性关系的绝对定量法,即用已知突变率的标准品绘制标准曲线来推算未知样品的突变率。具体检测是采用armsm-qpcr反应体系,将梯度突变标准品(如突变率为100%、10%、1%、0.1%、0.01%和0%)和待测样品分别同时检测,以标准品突变率的对数值为横坐标,以测得的ct值为纵坐标绘制突变率标准曲线,再根据待测样本的ct值,即可在突变率标准曲线中得到待测样本的突变率。由于待测样本的突变率未知,一般采用突变质粒或已知突变率的细胞系dna配制突变率标准品。
8、而qpcr反应的数据分析方法,按照定量分析的目的,可划分为绝对定量法和相对定量法;按照数据分析方法基于的理论基础和数学模型,可划分为指数模型数据分析法和动力学法。目前,qpcr分析仪数据分析软件普遍采用指数模型数据分析法,该方法的通用公式为:y=x(1+e)n(y=产量;x=初始模板量;e代表扩增效率;n=循环数);ct值与初始模板量的标准曲线为:ct值=-1/lg(1+e)*lg t0+lgk/lg(1+e),由于对一特定的pcr而言,e与k均为常数,故上式为ct值对原始模板拷贝数的对数(lgt0)一次方程,其标准形式y=kx+b,该直线的斜率为-1/lg(1+e),在横坐标上的截距为lgk/lg(1+e)(其中k值为基线荧光量值,代表恒定拷贝数);由于标准曲线的斜率为-1/lg(1+e),可知扩增效率e=10-1/斜率-1。理论上,e应为100%,表示在指数扩增阶段每次热循环后的模板量倍增。良好的扩增效率应在90%至110%之间,其对应的斜率为-3.58至-3.10之间。
9、由ct值与初始模板量的标准曲线方程可知,在arms-qpcr数据分析中,突变标准品与待测样本扩增效率e的一致性是决定突变检测结果准确的关键因素。
10、dna样本基质效应差异是影响扩增效率不一致的不可控因素,是导致检测结果偏差的主要因素。包括待测dna样本个体间的纯度、提取过程中残留的抑制pcr化合物(如盐、苯酚、氯仿和/或乙醇残留)不同、以及待测样本与突变率标准品间的总dna组成差异等,这些影响因素在现有arms-qpcr方法中所造成结果误差难以克服。
11、目前,无论是arms-qpcr定性还是定量检测方法,其计算结果都是以假设待测样品、内参和突变率标准品相互间的pcr扩增效率一致为前提。而在实际标本检测中,各反应间扩增效率的显著差异,特别是针对样本中突变率低至如0.5%~0.01%的突变,扩增效率不一致将显著影响检测结果的准确性。
12、除了扩增效率影响因素外,提取的dna样本浓度过低也是影响arms-qpcr检测的因素之一。通过标准曲线计算,当扩增效率为100%时,可计算出基因单个拷贝数(突变dna)定量的ct值在35左右,若大于35,理论上模板起始拷贝数小于1,重复性不佳。在dna高浓度按本如病理组织或血液标本中,armsm-pcr突变体系实测的ct值中,一般100%突变样本的ct值在22至30之间、100%野生样本的ct值>30或无扩增曲线;而对于血浆游离dna、尿液游离dna等低浓度样本,100%突变样本的ct值在30左右、100%野生样本无扩增曲线。因此,对于dna总量浓度低,同时突变dna又在1%至0.01%的样本,其往往测定的ct值>35,导致重复性差而难以准确定量检测突变率。
13、综上所述,针对arms-qpcr定量检测突变率方法,能否解决因基质效应差异引起的扩增效率不一致所导致的突变率定量检测误差,同时针对不同来源、不同浓度dna样本都可以准确定量检测突变率,是急需解决的技术问题。
技术实现思路
1、为了解决上述技术问题,本公开提供了一种体细胞突变率的检测方法。
2、第一方面,本公开提供了一种体细胞突变率的检测方法,所述检测方法包括如下步骤:
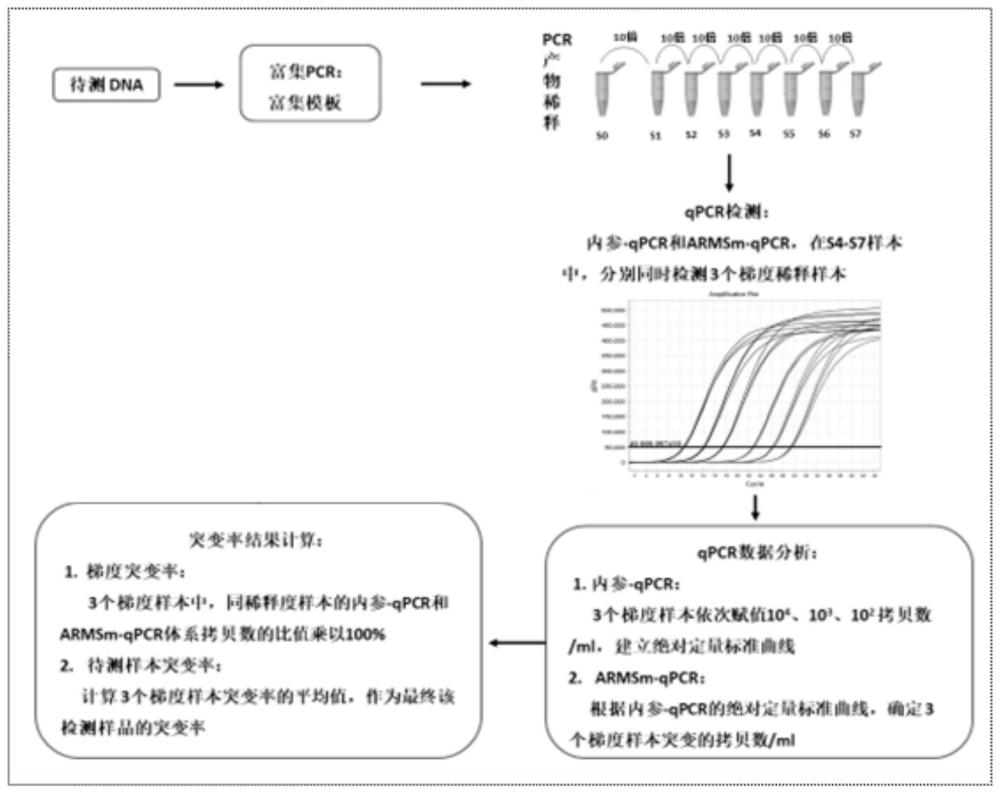
3、(1)对待测样本进行pcr扩增并稀释,以稀释产物作为模板,其中,所述稀释产物至少包括三个稀释梯度;
4、(2)对模板同时进行内参-qpcr检测和armsm-qpcr检测;
5、(3)以内参-qpcr检测的样本ct值和赋值拷贝数建立样本的绝对定量标准曲线;
6、(4)通过绝对定量标准曲线确定armsm-qpcr检测结果的赋值拷贝数,并确定待测样本的突变率。
7、作为本公开的一种优选技术方案,步骤(1)所述pcr扩增使用的引物序列如seq idno.1和seq id no.2所示。
8、作为本公开的一种优选技术方案,在步骤(1)中,所述稀释的方法包括:将pcr扩增产物进行10倍梯度稀释。
9、作为本公开的一种优选技术方案,作为模板的稀释产物的浓度范围为10-4~10-7m。
10、作为本公开的一种优选技术方案,所述模板包括至少三个连续梯度的稀释产物,且所述三个连续梯度的稀释产物的100%突变扩增和100%野生扩增的ct值均在10-35之间。
11、作为本公开的一种优选技术方案,在步骤(2)中,所述armsm-qpcr检测中-146(c/t)位点使用的引物序列如seq id no.3和seq id no.4所示。
12、作为本公开的一种优选技术方案,在步骤(2)中,所述armsm-qpcr检测中-24(c/t)位点使用的引物序列如seq id no.5和seq id no.6所示。
13、作为本公开的一种优选技术方案,在步骤(2)中,所述内参-qpcr检测使用的引物序列如seq id no.7和seq id no.8所示。
14、作为本公开的一种优选技术方案,在步骤(2)中,所述内参-qpcr检测和armsm-qpcr检测使用的指示探针相同,序列如seq id no.9所示。
15、作为本公开的一种优选技术方案,在步骤(2)中,同时进行内参-qpcr检测和armsm-qpcr检测的反应条件包括:
16、92-95℃,预变性1-5min;94-98℃,变性10-20s;55-65℃,退火30-60s;40-50个循环。
17、作为本公开的一种优选技术方案,步骤(2)还包括:完成检测后,比较armsm-pcr与内参-qpcr各自的回归曲线斜率,若两者斜率差值<0.1,则进行步骤(3),若两者斜率差值≥0.1,则重新进行检测。
18、作为本公开的一种优选技术方案,在步骤(4)中,所述待测样本的突变率的确定方法包括:
19、同稀释梯度模板的armsm-qpcr检测结果的赋值拷贝数与内参-qpcr检测结果的赋值拷贝数的比值乘以100%,得到对应稀释梯度模板的突变率;
20、计算所有稀释梯度模板的突变率的平均值,得到所述待测样本的突变率。
21、第二方面,本公开提供了第一方面所述的检测方法在靶向药物筛选中的应用。
22、本公开实施例提供的技术方案与现有技术相比具有如下优点:
23、(1)本公开提供的检测方法中,待测样本通过内参-qpcr和armsm-pcr同时检测,内参体系建立绝对定量标准曲线并赋值代表总目标dna拷贝数,突变体系通过ct值代入绝对定量标准曲线获得突变拷贝数,使得待测样本既是绝对定量标准品也是突变待测样本,解决了标准品制备、保存、配制的繁琐问题;
24、(2)本公开提供的检测方法采用至少三个梯度的稀释样本进行突变率检测,以平均突变率作为检测结果,能够显著降低检测的偶然误差,特别是对于突变率低至如0.5-0.01%的突变,能够显著增加检测结果的准确性;
25、(3)本公开提供的检测方法中,内参-qpcr和armsm-pcr的扩增效率一致,避免了由于dna样本基质效应引起的扩增效率不一致所导致的检测结果偏差的缺点,彻底解决了由于待测dna样本个体间的纯度、提取过程中残留的抑制pcr化合物(如盐、苯酚、氯仿和/或乙醇残留)不同、以及待测样本与突变率标准品间的总dna组成差异所带来的不可控的突变检测误差的问题;
26、(4)本公开提供的检测方法中,由于待测样本是先通过普通pcr扩增目标片段以增加模板拷贝数,然后再采用10倍梯度稀释产物作为模板进行检测,因此,低拷贝数和高拷贝数dna水平的待测样本皆适用于本公开提供的检测方法,解决了不同标本来源需要针对dna浓度、基质效应、反应条件、标准品匹配等建立不同检测系统并分别检测的问题;
27、(5)本公开提供的检测方法适用范围极广,能够应用于所有的arms可检测的突变类型(点突变、插入或确实突变等);
28、(6)本公开提供的检测方法为定量检测方法,能够用于疾病程度评估、疗效评估、复发监测等动态观察,在疾病诊断方面具有优异的应用效果,具有广泛的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!