孔隙生物支架、制造方法及制造孔隙生物支架的液体原料与流程
1.本发明涉及生物支架,具体涉及孔隙生物支架、制作方法及制造孔隙生物支架的液体原料。
背景技术:
2.孔隙生物支架为具有微米级或纳米级孔隙的框架结构体,用于微生物或医学样本培养,以及药物研发、测试等。传统的孔隙生物支架制造方法只能创建大规模有序平面基板上的纳米特征阵列。传统方法中的蚀刻方法及相分离方法需要使用有毒的化学药品,制成的生物支架也将有化学药品残留,因此可能为生物医学应用带来副作用。此外,此类方法制造的孔隙生物支架,其中的孔隙通常是无定形的、没有清晰的孔隙结构和可控的尺寸范围,这可能不符合对于某些细胞-纳米形貌相互作用进行研究的要求。
技术实现要素:
3.根据一个方面,本发明提供制造孔隙生物支架的方法,所述方法包括:向3d打印机提供液体原料,所述液体原料包括溶剂,例如冰醋酸、溶解于所述溶剂的基底材料,例如聚ε-己内酯,及溶解于所述溶剂的填充材料,例如麦醇溶蛋白。将所述液体原料从所述3d打印机向基板喷射,以固化形成密实支架。所述密实支架包括固化的基底材料及分布于所述固化的基底材料中且占据预设空间的固化填充材料。将所述密实支架浸于沥滤液,例如70%的乙醇溶液中,其中所述填充材料溶解于所述沥滤液,所述基底材料不溶解于所述沥滤液,使得所述固化填充材料通过溶解于沥滤液从所述密实支架中被移除,从而在所述密实支架中形成孔隙,获得孔隙支架。
4.根据另一方面,本发明提供用于制造孔隙生物支架的液体原料,所述液体原料溶剂、溶解于所述溶剂的填充材料,以及溶解于所述溶剂的基底材料。所述溶解于所述溶剂的所述填充材料及所述基底材料可通过3d打印形成密实框架,所述密实框架包括固化的基底材料及分布与所述固化的基底材料中的固化填充材料;且所述固化填充材料可溶解于沥滤液,所述固化的基底材料不溶解于所述沥滤液。
5.根据有一方面,本发明提供一种孔隙生物支架,所述生物孔隙支架包括:主框架,所述主框架由固化的基底材料制成;形成于所述主框架表面的多个孔隙。所述多个孔隙由所述固化的基底材料的连续纤维环绕。
6.附图简要说明
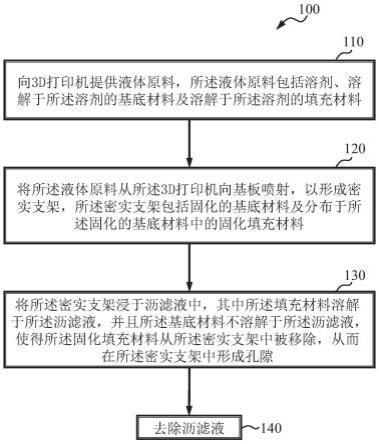
7.图1a示出根据本发明一个实施例的使用电流体动力喷墨打印机(ehdp)制作孔隙支架的步骤的流程图;
8.图1b至1e示出根据本发明一个实施例的使用电流体动力喷墨打印制作孔隙支架的步骤的示意图;
9.图2a、图2b示出pcl/麦醇溶蛋白-20支架的sem图像,图2c、图2d示出pcl-20-d孔隙支架的sem图像;
10.图3a至图3d分别示出pcl/麦醇溶蛋白-10密实支架、pcl-10-d孔隙支架、pcl/麦醇溶蛋白-20密实支架、pcl-20-d孔隙支架的纤维表面形貌的sem图像;
11.图4a和图4b分别示出pcl-10-d孔隙支架和pcl-20-d孔隙支架的纤维表面上生成的孔隙的尺寸分布的统计数据;
12.图5示出pcl支架、pcl/麦醇溶蛋白-10密实支架、pcl/麦醇溶蛋白-20密实支架在70%乙醇溶液中浸渍48小时内的重量损失-时间曲线;
13.图6a示出pcl支架、pcl/麦醇溶蛋白支架和pcl-d孔隙支架的应力-应变曲线,图6b示出图6a中的应力-应变曲线的初始线性范围的放大图;
14.图7示出通过mts方法评估培养第1天、第4天、第7天时支架上nih/3t3细胞的数目;
15.图8a至图8b示出接种了nih/3t3细胞第4天的pcl-20-d孔隙支架的clsm图像;图8c至图8d示出接种了nih/3t3细胞第7天的pcl-20-d孔隙支架的clsm图像;
16.图9a至图9c分别示出接种nih/3t3细胞第1天的pcl支架、pcl-10-d孔隙支架和pcl-20-d孔隙支架的sem图像;
17.图9d至图9f分别示出接种a549细胞第1天的pcl支架、pcl-10-d孔隙支架和pcl-20-d孔隙支架的sem图像;
18.图10示出接种a549细胞第1天、第4天、第8天时的pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架的clsm图像;
19.图11示出通过mts方法评估培养第1天、第4天、第8天时pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架上的a549细胞的数目;
20.图12a至12c示出在接种a549细胞培养第1天、第4天、第8天时的pcl-20-d孔隙支架的sem图像;
21.图13示出在接种a549细胞培养第1天时的pcl-10-d孔隙支架的光显微镜图像;
22.图14示出通过mts方法评估培养第1天、第4天、第8天时pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架上的mcf-7细胞的数目;
23.图15示出接种mcf-7细胞第1天、第4天、第8天时的pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架的clsm图像;
24.图16示出在接种mcf-7细胞培养第1天时的pcl支架的明场显微镜图像;
25.图17示出通过mts方法评估培养第1天、第4天、第8天时pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架上的hepg2细胞的数目;
26.图18示出接种hepg2细胞第4天、第8天时的pcl支架、pcl-10-d孔隙支架、pcl-20-d孔隙支架的clsm图像;
27.图19a至图19d分别示出通过定量实时聚合酶链式反应(polymerase chain reaction,pcr)分析检测的在支架上和2d板上生长的a549细胞的整联蛋白β1、局部黏着斑激酶(fak)、ki-67、基质金属蛋白酶9(mmp-9)的相对转录表达水平,其中n=8,β-肌动蛋白(β-actin)为管家基因(所有细胞中均要稳定表达的一类基因),2d板为对照组,*p《0.05,**p《0.01,***p《0.001;
28.图20a、图20b分别示出在培养第1天和第3天在2d板上生长的a549细胞形态和超结构的光学显微镜图像,
29.图20c、图20d分别示出在培养第1天和第8天在pcl-10-d孔隙支架上生长的a549细
胞形态和超结构的光学显微镜图像;
30.图21a示出通过定量实时pcr分析检测的在支架上和2d板上生长的a549细胞的上皮细胞钙粘蛋白基因的相对转录表达水平,其中n=8,β-肌动蛋白为管家基因(所有细胞中均要稳定表达的一类基因),2d板为对照组,*p《0.05,**p《0.01,***p《0.001;
31.图21b示出支架上a549细胞紧密连接的clsm图像,其中细胞膜用红色荧光染料染色;
32.图21c示出通过蛋白免疫印迹(western blot,wb)检测的支架上和2d板上的a549细胞的a:上皮细胞钙粘蛋白的蛋白表达和b:β-肌动蛋白的蛋白表达;
33.图21d示出图21c中的检测相应的半定量分析结果,其中n=6,*p《0.05,**p《0.01,***p《0.001;
34.图22a示出通过定量实时pcr分析检测的在支架上和2d板上生长的a549细胞的上皮生长因子(egf)的相对转录表达水平,
35.图22b示出通过定量实时pcr分析检测的在支架上和2d板上生长的a549细胞的上皮生长因子受体(epithelial growth factor receptor,egfr)的相对转录表达水平,其中n=8,β-肌动蛋白为管家基因(所有细胞中均要稳定表达的一类基因),2d板为对照组,*p《0.05,**p《0.01,***p《0.001;
36.图22c示出通过蛋白免疫印迹(western blot,wb)检测的支架上和2d板上的a549细胞的a:egfr的蛋白表达b:β-肌动蛋白的蛋白表达;
37.图22d示出图22c中的检测相应的半定量分析结果,其中n=6,*p《0.05,**p《0.01,***p《0.001。
具体实施方式
38.可以理解,除了所描述的示例实施例之外,如本文附图中一般描述和示出的实施例的部件可以以各种不同的设置来布置和设计。因此,结合附图所表示的示例实施例和以下更详细的描述仅为示例实施例的代表,并不限制实施例所要求保护的范围。
39.本说明书中对“一个实施例”、“另一个实施例”或“实施例”(或类似术语)的引用意为结合该实施例描述的特定特征、结构或特性包括在至少一个实施例中。因此,贯穿本说明书在各个地方出现的短语“在一个实施例中”或“在实施例中”等可以泛指相同的实施例,或表示并一同的实施例。
40.此外,所描述的特征、结构或特性可以在一个或多个实施例中以任何合适的方式组合。在以下描述中,提供了许多具体细节以提供对实施例的彻底理解。然而,相关领域的技术人员将意识到可以在没有一个或多个具体细节的情况下或者利用其他方法、组件、材料等来实践各种实施例。在其他情况下,一些或所有已知结构、材料、或者操作可能不被详细显示或描述,以避免混淆。
41.如图1a所示,根据一个实施例,本发明提供一种制作孔隙支架的方法100。方法100包括在步骤110向3d打印机提供液体原料110。该液体原料包括溶剂、溶解于所述溶剂的基底材料和溶解于所述溶剂的填充材料。方法100在步骤120将所述液体原料从所述3d打印机向基板喷射,以形成密实支架。所述密实支架包括固化的基底材料及分布于所述固化的基底材料中的固化填充材料,所述固化填充材料在所述固化的基底材料中占据预设空间。方
法100在步骤130将所述密实支架浸于沥滤液中,其中所述填充材料溶解于所述沥滤液,并且所述基底材料不溶解于所述沥滤液,使得所述固化填充材料从所述密实支架中被移除,从而在所述密实支架中形成孔隙。方法100在步骤140所述沥滤液,从而获得孔隙支架。
42.方法100还可以包括制备所述液体原料,其中制备所述液体原料包括所述填充材料溶解于所述溶剂一生成第一溶液,以及将所述基底材料溶解于所述第一溶液。
43.根据一个示例,所述基底材料为聚ε-己内酯(pcl),所述填充材料为麦醇溶蛋白,所述溶剂为冰醋酸。制备所述液体原料从而包括将麦醇溶蛋白的粉末溶解于所述冰醋酸中形成所述第一溶液,以及将所述pcl的粒料溶解于所述第一溶液,以生成所述溶解于冰醋酸中的pcl/麦醇溶蛋白液体原料。
44.所述pcl/麦醇溶蛋白液体原料中pcl和麦醇溶蛋白的浓度分别为60%w/v和10%w/v。可选地,pcl/麦醇溶蛋白液体原料中pcl和麦醇溶蛋白的浓度分别为50%w/v和20%w/v。
45.基底材料可以在45℃温度下超声波浴溶解于所述第一溶液。所述沥滤液可以是70%乙醇溶液。可以选择其它的材料作为溶剂、基底材料和填充材料。
46.如图1b至图1e所示,在根据一个实施例的制造方法中,以冰醋酸围殴溶剂、pcl/麦醇溶蛋白为溶质的液体原料502通过微型注射器泵12、注射器针头14及通过连接软管16被注入电流体动力喷墨打印机(ehdp)的打印头18。在喷头18和基板20之间电源22施加的高电场的作用下,液体原料502从ehdp的喷头18向基板20喷射,基板20同时相对于喷头18沿着轴线x、y和z中的至少一个移动,从而使得液体原料502沉积固化到基板20上,形成堆叠密实支架512。密实支架512包括固化的基底材料(即:固化pcl)502a及分布于所述固化的基底材料502a中的固化填充材料(即:固化麦醇溶蛋白)502b。固化填充材料502b在固化的基底材料502a中占据预设空间。基板20置于载物台24上的导电支承台26上,因此基板20跟随载物台24一起移动,从而在基板20上沉积烧结制成密实支架512。调整微型注射器泵12的供料速度、施加在喷头18和导电支承台26之间的电压、喷头18到基板20的距离和载物台24移动的速度,可以改变密实支架512的整体尺寸、纤维尺寸、密度等。
47.如图1d所示,密实支架512浸于沥滤液530中。沥滤液为可溶解填充材料但不可溶解基底材料的液体,例如70%乙醇溶液。经过预定的浸溶时间,例如48小时之后,密实支架512中的填充材料即通过溶解于沥滤液530而从密实支架512中移除,从而在所述密实支架512中形成孔隙。在去除沥滤液530之后,即可获得具有孔隙的支架。
48.可以通过调节pcl/麦醇溶蛋白液体原料502中填充材料(即:麦醇溶蛋白)502b和基底材料(即:pcl)502a的配比控制孔隙的尺寸、密度和分布。pcl/麦醇溶蛋白液体原料502可以为“pcl/麦醇溶蛋白-10”液体原料504或“pcl/麦醇溶蛋白-20”液体原料506。pcl/麦醇溶蛋白-10液体原料504中的pcl和麦醇溶蛋白的浓度分别为60%w/v和10%w/v。pcl/麦醇溶蛋白-20”液体原料506中pcl和麦醇溶蛋白的浓度分别为50%w/v和20%w/v。具有其它浓度配比的pcl和麦醇溶蛋白的pcl/麦醇溶蛋白混合液也可以作为液体原料。
49.使用“pcl/麦醇溶蛋白-10”液体原料504和“pcl/麦醇溶蛋-20”液体原料506,通过ehdp可以分别打印出“pcl/麦醇溶蛋白-10”密实支架524和“pcl/麦醇溶蛋白-20”密实支架526。作为比对分析,还可以使用仅包含pcl成分的液体原料,通过ehdp打印出pcl密实支架522。
50.浸于沥滤液530后,“pcl/麦醇溶蛋白-10”密实支架524和“pcl/麦醇溶蛋白-20”密实支架526中的麦醇溶蛋白成分通过溶解于沥滤液530,从密实支架524及密实支架526中分别被去除,使得“pcl/麦醇溶蛋白-10”密实支架524及“pcl/麦醇溶蛋白-20”密实支架526分别形成pcl-10-d孔隙支架544及pcl-20-d孔隙支架546。类似地,作为比对,pcl密实支架522经过通过溶解于沥滤液530,获得pcl成品支架542。
51.如图1e所示,使用pcl/麦醇溶蛋白-10液体原料504制得的pcl-10-d孔隙支架544的孔隙534的尺寸、分布与使用pcl/麦醇溶蛋白-20液体原料506制得的pcl-20-d孔隙支架546的孔隙536的尺寸、密度和分布不同。如前所述,pcl/麦醇溶蛋白-10液体原料504和pcl/麦醇溶蛋-20液体原料506具有不同比例的麦醇溶蛋白502b和pcl502a。因此,具有不同配比填充材料(即:麦醇溶蛋白)502b和基底材料(即:pcl)502a的pcl/麦醇溶蛋白液体原料502所制成的孔隙支架542的孔隙的尺寸、密度和分布不同。也即,可以通过调节填充材料和基底材料的配比,改变孔隙支架的孔隙尺寸、密度和分布。
52.图2a、图2b为根据本发明实施例制造的pcl/麦醇溶蛋白-20密实支架526的sem图像。图2c、图2d示出pcl-20-d孔隙支架546的sem图像。pcl/麦醇溶蛋白-20密实支架526是使用pcl/麦醇溶蛋-20液体原料506通过ehdp 10打印出的复合材料支架。密实支架526具有外径为从数百纳米至几微米之间的、由基底材料构成的沉积且连续纤维直径,类似于细胞外基质(extracellular matrix,ecm)微环境的尺寸。如图2a所示,pcl/麦醇溶蛋白-20密实支架526具有多个网格526g,每个网格526g包括多个网格侧壁526w,网格侧壁526w界定网格526g的网格隔间526p的边界,其中每个网格侧壁526w由复合材料纤维516逐层堆叠沉积而成(图2b)。网格隔间526p的平均边长约为200μm。复合材料纤维516是连续的材料纤维,其平均直径约为10μm。
53.将pcl/麦醇溶蛋白-20密实支架526浸于沥滤液(例如:70%乙醇溶液)530中,pcl/麦醇溶蛋白-20密实支架526中的填充材料(即:麦醇溶蛋白)502b溶解于沥滤液530,而pcl/麦醇溶蛋白-20支架526中的基底材料(即:pcl)502a不溶解于沥滤液530。填充材料502b通过溶解于沥滤液530从pcl/麦醇溶蛋白-20密实支架526中被移除,从而在pcl/麦醇溶蛋白-20密实支架526的表面形成多个孔隙536,制成孔隙支架(即:pcl-20-d支架)546。
54.如图2c所示,pcl-20-d孔隙支架546包括多个网格546g,每个网格546g包括多个网格侧壁546w,网格侧壁546w界定网格546g的网格隔间546p的边界,其中每个网格侧壁546w由复合材料纤维516逐层堆叠固化形成(图2d)。网格隔间546p的平均孔径约为200μm。复合材料纤维516是连续的,且平均直径约为10μm。由此可见,与pcl/麦醇溶蛋白-20密实支架526相比,经过沥滤液处理后得到的pcl-20-d孔隙支架546的网格结构未发生显著的变化。麦醇溶蛋白溶解于沥滤液后,pcl-20-d孔隙支架546保持与pcl/麦醇溶蛋白-20密实支架526相同的完整性。
55.图3a至图3d分别为示出pcl/麦醇溶蛋白-10密实支架524、pcl-10-d孔隙支架544、pcl/麦醇溶蛋白-20密实支架526、pcl-20-d孔隙支架546的纤维表面形貌的sem图像。图4a和图4b为分别示出pcl-10-d孔隙支架544和pcl-20-d孔隙支架546的纤维表面上生成的孔隙的尺寸分布的统计图。如前文所述,分别使用pcl/麦醇溶蛋白-10液体原料504和pcl/麦醇溶蛋白-20液体原料506通过ehdp 10打印出的对应pcl/麦醇溶蛋白-10密实支架524和pcl/麦醇溶蛋白-20密实支架526,置于沥滤液(例如:70%乙醇溶液)530中,制成对应的
pcl-10-d孔隙支架544和pcl-20-d孔隙支架546。由图3a和3b对比可知,与pcl/麦醇溶蛋白-10密实支架524相比,经过沥滤液处理后得到的pcl-10-d孔隙支架544的表面形成有多个孔隙534。由图3c和3d对比可知,与pcl/麦醇溶蛋白-20密实支架526相比,经过沥滤液处理后得到的pcl-20-d孔隙支架546的表面形成有多个孔隙536。也就是说,麦醇溶蛋白溶解于沥滤液后,pcl-10-d孔隙支架544及pcl-20-d孔隙支架546的表面形成有多个孔隙534、536。
56.由图3b及3d对比可知,pcl-10-d孔隙支架544的纤维表面的多个孔隙534及pcl-20-d孔隙支架546的纤维表面的多个孔隙536的尺寸、密度和分布不同。如图4a和4b所示,pcl-10-d孔隙支架544的纤维表面的多个孔隙534的尺寸介于50nm至300nm之间,平均尺寸为133.1
±
47.4nm;pcl-20-d孔隙支架546的纤维表面的多个孔隙536的的尺寸介于100nm至500nm之间,平均尺寸为为209.2
±
76.2nm。
57.pcl-10-d孔隙支架544及pcl-20-d孔隙支架546分别由具有不同配比的填充材料(即:麦醇溶蛋白)502b和基底材料(即:pcl)502a的pcl/麦醇溶蛋白液体原料液体原料502制成。由此可见,可以通过调节填充材料502b和基底材料502a的配比,改变孔隙支架542的复合材料纤维512的表面的多个孔隙的尺寸、密度和分布。
58.根据一个实施例,本发明提供一种用于制造孔隙支架的液体原料502。液体原料502包括溶剂、溶解于溶剂的基底材料502a,以及溶解于溶剂的填充材料502b。
59.以下通过具体示例详细说明根据本发明实施例的生物孔隙支架的制作方法、用于制造孔隙支架的液体原料以及根据该方法制造的孔隙支架。
60.示例1
61.生物孔隙支架的制作方法
62.1.1液体原料制备
63.将麦醇溶蛋白粉末溶解于冰醋酸(acoh)中,得到澄清的麦醇溶蛋白-冰醋酸溶液。
64.向麦醇溶蛋白-冰醋酸溶液中加入pcl粒料,并在45℃及超声波浴中逐渐溶解,重复地搅拌并除去气体后,得到均匀的pcl/麦醇溶蛋白液体原料液体原料502。
65.在该示例中,准备三种液体原料:(a)仅含pcl的液体原料500(pcl浓度为70%w/v即0.7g/ml),(b)pcl/麦醇溶蛋白-10液体原料504pcl浓度为60%w/v,麦醇溶蛋白浓度为10%w/v),以及(c)pcl/麦醇溶蛋-20液体原料506(pcl浓度为50%w/v,麦醇溶蛋白浓度为20%w/v)。
66.1.2通过电流体动力喷墨打印机(electrohydrodynamic jet printer,ehdp)制造支架
67.将pcl液体原料500、pcl/麦醇溶蛋白-10液体原料504、pcl/麦醇溶蛋白-20液体原料506分别提供于ehdp 10。以150mm/s的平均速度运行载物台24以移动基板20,打印出的3种材料样品的具有基本相同的外形及框架尺寸,例如,3种材料样品的网格隔间边长均为200μm、12层、整体外形尺寸为4cm
×
4cm的多层网格密实支架。
68.如图1d和图1e所示,通过用70%乙醇溶液530沥滤pcl/麦醇溶蛋白-10密实支架524以及pcl/麦醇溶蛋白-20密实支架526中的麦醇溶蛋白部分502b,分别得到pcl-10-d孔隙支架544和pcl-20-d孔隙支架546。
69.具体地,将pcl/麦醇溶蛋白密实支架524、526在40℃、真空中干燥。然后,将干燥的pcl/麦醇溶蛋白支架的每一侧置于紫外线(uv)下曝光15分钟进行灭菌。将无菌支架完全浸
入70%的乙醇溶液530中,置入恒温箱(37℃、5.0%co2)中,并以60rpm的速度振动恒温箱。48小时后,通过用去离子水(di水)清洗并在真空中干燥,制成具有孔隙的pcl/麦醇溶蛋白支架544、546。
70.1.4支架的表面形貌表征
71.如表1所示,仅含pcl成分的支架520、pcl/麦醇溶蛋白-10密实支架524和pcl/麦醇溶蛋白-20密实支架526的总厚度分别为79.3
±
9.4μm、72.8
±
4.1μm和78.8
±
2.9μm。与相应的pcl/麦醇溶蛋白-20密实支架526相比,pcl-20-d孔隙支架546的网格隔间的尺寸、纤维宽度和总厚度显示出较小的变化。纤维的平均直径约为10μm,
72.由于麦醇溶蛋白部分的释放,pcl-10-d孔隙支架544和pcl-20-d孔隙支架546的孔隙率分别略微上升至90.3
±
0.3%和91.3
±
0.9%。此外,pcl-20-d支架46的孔隙和裂缝的密度比pcl-10-d支架544高。通过改变麦醇溶蛋白502b在复合液体原料502中的配比,可以控制复合材料纤维512的纳米形貌特征,包括控制孔隙的尺寸、密度和分布。
73.表1.pcl、pcl/麦醇溶蛋白支架、pcl-d支架的表面形貌数据
[0074][0075]a体密度从复合材料支架中的pcl和麦醇溶蛋白的密度计算
[0076]
图2a、图2b分别示出pcl/麦醇溶蛋白-20密实支架526、pcl-20-d孔隙支架546的sem图像。总体上,pcl/麦醇溶蛋白-20密实支架526和pcl-20-d孔隙支架546具有大约200μm的平均孔径的网格结构。网格侧壁由12层复合材料纤维516堆叠形成。如图2a、图2b所示,在用沥滤液530溶解麦醇溶蛋白502b后,pcl-20-d孔隙支架546保持整体完整。
[0077]
图3a至图3d分别示出pcl/麦醇溶蛋白-10密实支架524、pcl-10-d孔隙支架544、pcl/麦醇溶蛋白-20密实支架526、pcl-20-d孔隙支架546的纤维表面形貌的sem图像。如图3b和图3d所示,在用沥滤液溶解麦醇溶蛋白后,孔隙支架的纤维表面上形成成有多个孔隙,裂缝、空腔等镂空结构。
[0078]
如图4a和图4b所示,在pcl-10-d孔隙支架544和pcl-20-d孔隙支架546的纤维表面上生成的孔隙的平均尺寸分别为133.1
±
47.4nm及209.2
±
76.2nm,并且一些孔彼此之间形成较大的纵向裂缝,长度从几百纳米到几微米之间。
[0079]
综上所述,麦醇溶蛋白502b以纳米颗粒的形式存在并分散于液体原料液体原料502中。麦醇溶蛋白纳米颗粒的聚集状态、尺寸、以及密度可以通过改变麦醇溶蛋白502b的配比调节。麦醇溶蛋白502b可以自组合为纳米球体、纳米棒状或纳米椭球形等形态,从而可以通过改变麦醇溶蛋白502b在液体原料液体原料502中的配比控制复合材料纤维512的纳米形貌特征(例如:孔隙、裂缝及空腔的尺寸、密度和分布)。
[0080]
1.5支架的重量和元素含量的表征
[0081]
图5为示出pcl支架520、pcl/麦醇溶蛋白-10密实支架524、pcl/麦醇溶蛋白-20密实支架526在70%乙醇溶液中浸渍48小时内的重量损失-时间曲线。如图5所示,在70%乙醇溶液530中浸渍48小时后,pcl支架520的重量损失处于可忽略不计范围,而pcl/麦醇溶蛋白-10密实支架524及pcl/麦醇溶蛋白-20密实支架526的重量损失是显著的,即,pcl/麦醇溶蛋白-10密实支架524及pcl/麦醇溶蛋白-20密实支架526的重量损失分别高达14.5%和24.2%。在在70%乙醇溶液530中浸渍开始的2小时内,pcl/麦醇溶蛋白-10密实支架524及pcl/麦醇溶蛋白-20密实支架的重量下降幅度较大,大约占总重量损失的90%。重量损失主要归因于蛋白质聚集体(麦醇溶蛋白部分)502b被沥滤液530的溶解,从而导致纤维表面生成纳米级的孔、裂缝和空腔等镂空结构的形成。麦醇溶蛋白部分502b配比较高的密实支架,经过沥滤液浸渍后,重量损失量相应较高。
[0082]
此外,元素分析结果(如表2所示)表明,pcl/麦醇溶蛋白-10密实支架524和pcl/麦醇溶蛋白-20密实支架526的总氮含量(n%)在经过沥滤处理后分别从2.58
±
0.08%和4.74
±
0.12%降至1.38
±
0.06%和0.82
±
0.09%,表明pcl-10-d支架544和pcl-20-d支架546中仍残留约8%和5%的麦醇溶蛋白502b。pcl-20-d孔隙支架546中较低的蛋白质残留归因于孔隙支架546更高的纳米大裂缝的密度,其进一步加大麦醇溶蛋白502b从密实纤维内部的释放。
[0083]
表2.沥滤处理前后的支架的元素分析结果
[0084][0085]
1.6支架的拉伸性能
[0086]
图6a示出pcl支架520、pcl/麦醇溶蛋白密实支架522和pcl-d孔隙支架542的应力-应变曲线,图6b示出图6a中的应力-应变曲线的初始线性范围的放大图,表明pcl支架520具有良好韧性。表3示出pcl支架520、pcl/麦醇溶蛋白密实支架52及pcl-d孔隙支架542的拉伸性能。
[0087]
表3.pcl支架、pcl/麦醇溶蛋白支架,和pcl-d支架的拉伸性能。
[0088][0089]
如表3所示,pcl/麦醇溶蛋白-10密实支架524和pcl/麦醇溶蛋白-20密实支架526的杨氏模量分别显著增加至265.3
±
27.8mpa和465.3
±
50.9mpa。当将麦醇溶蛋白/pcl的配比从1:6提高到2:5(即从pcl/麦醇溶蛋白-10支架524到pcl/麦醇溶蛋白-20支架526)时,屈服应力显示出梯度增强。pcl/麦醇溶蛋白-20密实支架526的最大应变也显著下降至120.8
±
26.0mpa,而pcl/麦醇溶蛋白-10密实支架524的最大应变仍仅含pcl成分的支架520接近。此外,pcl-10-d孔隙支架544的拉伸性能总体上与仅含pcl成分的支架520接近。pcl-20-d孔隙支架546的最大应力和最大应变大幅下降至8.4
±
0.3mpa和304.2
±
47.3%,比pcl支架520的最大应力和最大应变要小得多。与pcl支架520相比,pcl-20-d支架546的杨氏模量也降低了约30%。
[0090]
结果表明,pcl/麦醇溶蛋白复合材料支架522的杨氏模量和屈服应力都有明显的含量响应性改善。当与pcl 502a在溶液中混合时,麦醇溶蛋白502b组合为纳米颗粒,并与pcl聚合物链502a形成强烈的分子间相互作用,从而导致复合材料支架522硬度的明显增加。同时,如果麦醇溶蛋白502b的配比高,则pcl-20-d孔隙支架546和pcl/麦醇溶蛋白-20密实支架526的韧性下降,使得pcl-20-d孔隙支架546及pcl/麦醇溶蛋白-20密实支架526明显比pcl支架520脆。原因是麦醇溶蛋白纳米颗粒502b在较高浓度下开始团聚,并在某些区域变成较大的部分连续相,这会经常破裂并降低总体伸长率。经过沥滤过程溶解麦醇溶蛋白502b后,除了最大应变不同之外,pcl-20-d孔隙支架546的拉伸性能与pcl支架520相似。pcl-20-d孔隙支架546的最大应变约为其对应pcl/麦醇溶蛋白-20密实支架526的两倍,但仅为pcl支架520的三分之一。相比之下,pcl-10-d孔隙支架544与pcl/麦醇溶蛋白-10密实支架524相比于pcl支架520的拉伸性能的变化幅度较小。从表面形貌sem图像来看,pcl-10-d孔隙支架544的纤维表面主要由平均大小约为133nm的均匀的、分离的孔隙组成,这些孔隙在拉伸过程中可被压缩,对pcl相的整体性能影响不大。相反,pcl-20-d孔隙支架546的纤维表面上有较大裂缝,裂缝尺寸可达几微米,这会导致应力集中,使得pcl-20-d孔隙支架546在拉伸试验中易于破裂。因此,可以通过调节麦醇溶蛋白502b的配比改变支架的机械性能,并且pcl-10-d孔隙支架544被认为比原始pcl支架520具有改进的表面纳米形貌并且与原始pcl支架520具有接近的拉伸性能,因此,pcl-10-d孔隙支架544可成为原始pcl支架520的有
效替代品。
[0091]
1.7在支架上的细胞特性
[0092]
在本文中,使用不同的细胞系呈现pcl支架520和pcl-d孔隙支架542的细胞特性,包括nih/3t3(小鼠胚胎成纤维细胞)、a549(人非小肺癌)、mcf-7(人乳腺癌)和hepg2(人肝癌)细胞系。所有细胞系均在添加了10%胎牛血清和1%青霉素、链霉素的高葡萄糖dmem培养基中培养。细胞保持在一个潮湿、37℃、含有5%的二氧化碳的环境中。在细胞接种之前,pcl支架、pcl-10-d孔隙支架和pcl-20-d孔隙支架用70%乙醇溶液灭菌处理1小时,pbs洗涤三次,在培养基中浸泡一夜时间。无菌支架样品随后转移到96孔超低吸附培养板。指数级生长的细胞用0.05%胰酶-edta细胞分离并重新悬浮于培养基。将10μl细胞悬液(密度约为2
×
106细胞/ml)吸移入培养板的孔中的支架上,在37℃培养3小时以促进初始细胞附着。随后,培养板的每个孔填满90μl的完整培养基并保存在培养箱中。培养24小时后,用pbs清洗接种了细胞的支架,每两天补充新鲜的培养基以去除未附着的细胞、碎片和废物。
[0093]
细胞增殖用比色法评估,比色法包括[3-(4,5-二甲基-2-基)-5-(3-羧基甲氧)-2-(4-磺基苯基)-2h-四唑盐,内盐;mts]。通过代谢活性细胞将mts生物还原为有色的甲臜产物,该产物可溶于培养基并通过在490nm处的吸光度进行测量。甲臜产物的数量与活细胞的数量成正比。简言之,以设定的培养时间间隔(例如:培养第1天、第4天和第8天),除去培养基,并用pbs冲洗接种了细胞的支架。接着,将100μl的的celltiteraq
ueous
单溶液试剂吸移到所选的培养板的诸孔中,所选的培养板的诸孔含有500μl新鲜的完全培养基。然后将培养板在37℃、湿润的、5%co2气氛中培养1小时。最后,将200μl反应溶液转移到透明的96孔培养板中,使用读板器测量在490nm处的吸光度。如果原始读数高于线性范围的上限,则可用pbs稀释反应溶液以测量吸光度。
[0094]
通过共聚焦激光扫描显微镜观察接种了细胞的支架的形貌。将培养了细胞的支架在4℃的4%多聚甲醛溶液中固定20分钟,然后用pbs清洗。然后培养了细胞的支架进行通透性处理,具体地,用0.1%trion x-100持续5分钟,进行3次,然后用pbs中的2%牛血清白蛋白封闭30分钟。在通过clsm成像之前,细胞核用hoechst 33342(在培养基中10μg/ml)染色10分钟。细胞骨架用鬼笔环肽-fitc(肌动蛋白示踪剂绿色,在培养基中以1:100稀释)再染色10分钟。细胞膜用dii染料(在培养基中10μm)染色10分钟。用培养基清洗三次后,将支架转移至6孔μ-载玻片上并通过clsm成像。使用zen软件(蓝色版本,zeiss)获得3d重建的z-堆栈(z-stack)共聚焦图像。
[0095]
还通过sem显示接种了细胞的支架的形貌。首先将培养了细胞的支架用pbs冲洗,然后在4℃的4%多聚甲醛中固定30分钟。随后,通过使用梯度乙醇溶液(10%、30%、50%、70%、90%、95%和100%)对样品进行脱水,并在每种浓度下浸泡5分钟两次。最后,将样品在室温下真空干燥过夜,并在敷金层之后通过sem成像。用扫描电子显微镜对这些支架的形貌进行表征。在观察前,样品在30ma下进行30秒金层附着。通过sem图的正视图、后视图、侧视图测量纤维宽度、网格孔孔径大小和整体厚度。
[0096]
rna提取和定量实时pcr:收集在pcl支架和pcl-d支架上生长8天,在2d板上生长3天(融合度约80%)的a549细胞用于rna分析。使用trizol
tm
试剂提取总的细胞rna,并按照生产厂家的方案进行纯化。用分光光度计测定所得到的rna提取物的纯度和浓度。od260/280为1.8-2.2的样本是可以接受的。按照标准使用iscript
tm cdna合成试剂盒合成单链cdna,
每个样本的标准总rna浓度为1μg/ml。实时pcr按照steponeplus
tm
实时pcr系统的qpcr master mix kit的指示执行。
[0097]
表4列出目标基因的引物序列,pcr反应中每个引物的浓度为200nm。pcr反应按以下执行:95℃下2min,(95℃下3s,56℃下30s)
×
40个周期。3d支架上人类egf、egfr、mmp-9和上皮细胞钙粘蛋白基因的相对表达水平使用公式计算,人类β-肌动蛋白为管家基因,2d作为对照样本。
[0098]
表4.实时pcr检测引物列表
[0099][0100][0101]
蛋白免疫印迹检测分析:a549细胞在支架上培养8天,在2d板上培养3天后,a549细胞在冰冷的利托菌素诱导血小板凝集(ristocetin-induced platelet agglutination,ripa)缓冲液中用超声波发生器(科学技术公司scientz,,宁波,中国)裂解。以12,000g离心20分钟后从上清液中获取细胞裂解物。用pierce
tm bca蛋白检测试剂盒定量,每个样品中共80μg的蛋白用8%的十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sds-page)分离并转移到聚(偏二氟乙烯)膜(0.2μm,biorad)。用tbst缓冲液(20mm tris,ph 7.6,150mm氯化钠和0.1%tween-20)中的5%脱脂牛奶封盖1小时。印迹与抗上皮生长因子受体((2232s,1:1000,细胞信号技术,cell signaling technology,cst),抗上皮细胞钙粘蛋白(3195s,1:1000,细胞信号技术)和抗肌动蛋白(8457s,1:1000,细胞信号技术)作为4℃下的对照组,整晚摇晃(每分钟60转,60rpm)。这些印迹用辣根过氧化物酶(下丘脑调节性多肽,hypothalamic regulatory peptides,hrp)标记山羊抗兔免疫球蛋白g(immunoglobulin g,igg)二抗
(7074s,1:3000,细胞信号技术)进一步培养。最后,在用pierce
tm ecl wb基板(thermo scientific)显影后,用化学发光成像系统检测hrp活性。
[0102]
通过graphpad prism软件使用学生t检验对数据进行统计分析。p值《0.05被认为具有统计学意义。
[0103]
1.7.1nih/3t3细胞在支架上的细胞行为
[0104]
用移液管吸取小容量的nih/3t3细胞悬浮液(30μl,密度为20.0
×
106/ml)并转移至超低吸附培养板中的每个支架上,以使细胞与支架表面接触,用于初始接种细胞。培养3小时后,将剩余的培养介质(470μl)加入培养板的每个孔中并进行细胞的培养。在这个阶段,观察到一些细胞开始部分粘附在支架纤维上,而未附着的细胞聚集在一起形成簇,分散在培养基中。这些未附着的细胞将通过随后更换培养基而清除。通过mts方法评估培养第1天、第4天、第7天时支架上细胞的数目(图7,n=6,*p《0.05,**p《0.01)。培养第1天的细胞计数结果表明,附着在pcl-d支架542上的细胞数目比pcl支架520上的细胞数目高出约三倍。这表明具有孔隙(或纳米裂缝、纳米腔体)的多孔纤维表面有利于细胞附着。随后,细胞开始在支架上扩散、迁移和增殖,并且在培养第4天时,pcl-d支架542上的细胞数目比pcl支架520上的细胞数目高出约两倍。
[0105]
图8a至图8b示出接种了nih/3t3细胞第4天的pcl-20-d孔隙支架546的clsm图像。图8c至图8d示出接种了nih/3t3细胞第7天的pcl-20-d孔隙支架546的clsm图像。pcl-20-d孔隙支架546上细胞的较快增殖归因于多孔表面形貌可以促进nih/3t3细胞的迁移和向内生长。具体而言,图8a示出培养第4天细胞的肌动蛋白骨架聚集成环形结构并且交织在一起以支持pcl-20-d孔隙支架546的网格孔546p中的nih/3t3细胞的迁移和增殖。细胞膜呈现融合在一起而没有显示出单个细胞的清晰边缘,这可能是由于此阶段强烈的细胞-细胞相互作用所致。如图8b所示,在培养第4天,一些靠近网格546g的侧壁546w的角落的细胞能够像纺锤形一样伸长,并且能够容纳在网格孔546p中,这些细胞前缘处延伸的丝状伪足抓住相邻的诸纤维516。在支架546上的nih/3t3细胞拉长的双极形貌类似于体内。在体内,迁移的nih/3t3细胞具有前端-后端极性。结果,nih/3t3细胞从网格546g的侧壁546w向网格孔546p的中心活跃地增殖,形成独特的圆形结构。在培养的第1天和第4天,pcl-10-d孔隙支架544与pcl-20-d孔隙支架546上的细胞数量比较没有显著差异,这表明在pcl-10-d孔隙支架544上的工程纳米形貌可能足以增强细胞的粘附和生长。尽管由于不均匀的细胞接种密度,细胞在支架上最初的粘附和生长不均一,但在培养的第7天,细胞可以迁移到相邻的网格孔546p中,最终占据所有的网格孔546p。孔隙支架(pcl-20-d孔隙支架)546上的细胞数量趋于饱和,比初始接种时细胞数量高出大约二十倍。细胞进入静止生长状态,并完全形成组织状细胞片(如图8c、图8d所示)。大多数细胞能够在网格孔546p中定植并通过细胞间相互作用生成单层细胞片。pcl-d支架上的细胞数总是高于pcl支架上的。这表明pcl-20-d孔隙支架546可以有效地支持nih/3t3细胞的细胞粘附、迁移和增殖。
[0106]
为了阐明纤维纳米形貌对初始细胞粘附、扩散和增殖的影响,将接种了细胞的支架固定在4%多聚甲醛中,在梯度乙醇溶液中脱水并真空干燥后,通过sem进一步观察。如前文所述,工程改造的纤维表面有利于细胞粘附,因为pcl-d支架上的细胞数量在培养第1天就明显增加。如图9a、图9b、图9c中的虚线框所示,在培养第1天的pcl支架520,pcl-10-d孔隙支架544和pcl-20-d孔隙支架546上部分附着的nih/3t3细胞的比较来看,细胞紧密接触
pcl-d支架544/546的工程改造的纤维表面,且细胞大量的丝状伪足与孔隙和裂缝接触。相反,附着在pcl支架520表面的nih/3t3细胞的前缘似乎更加清晰和平滑,表明细胞-基底的相互作用松散。该生长状况与细胞可以通过高度动态的丝状伪足检测出周围环境的形貌特征相一致。随后,细胞将在纤维表面扩散、在纤维之间进行空间迁移。并且附着的细胞反过来可能会影响接触表面的纳米形貌,因为附着了细胞的纤维表面变得比原始纤维表面粗糙得多。
[0107]
1.7.2a549细胞在支架上的细胞特性
[0108]
为了进一步评估支架上的细胞特性,通过遵循相似的细胞接种方法,将a549人非小肺癌细胞培养在pcl支架520、pcl-10-d支架544和pcl-20-d支架546上。简言之,将30μl的a549细胞悬液(细胞密度为2.2
×
106/ml)吸移到超低吸附培养板的孔中的每个切割支架上。将培养板在培养箱(37℃,5%co2)中再保持3小时,以确保足够的细胞-支架接触以进行初始细胞粘附。随后,将接种了细胞的支架填充470μl介质并和往常一样培养。与nih/3t3成纤维细胞不同,a549细胞是上皮细胞,当粘附在表面上时通常不会表现出明显的形貌变化。用hoechst 33342(蓝色)和dii(红色)对a549细胞的细胞核和细胞膜进行染色,以进行clsm成像(图10)。
[0109]
通过mts测定法评估支架上的a549细胞的细胞增殖。从细胞计数结果(图11,n=6,*p《0.05,**p《0.01)来看,在pcl-d孔隙支架544/546上的细胞接种效率明显更高,这与nih/3t3细胞培养结果一致,即孔隙表面有利于细胞识别和粘附。此外,培养4天后,pcl-d孔隙支架544/546上的细胞数目大约比pcl支架520上的细胞数目高出约2倍,这表明a549细胞更喜欢在纳米多孔纤维表面上迁移和增殖。据观察,在培养第8天,pcl-d孔隙支架544/546上的细胞分布比pcl支架520上的细胞分布更均匀,正如高细胞迁移率和高细胞增殖率证明的那样。本发明为体外细胞生长提供一种新颖的3d微环境,在3d肿瘤建模、组织工程和药物筛选应用中具有重要的作用。
[0110]
图12a至12c分别示出在接种a549细胞培养第1天、第4天、第8天时的pcl-20-d孔隙支架546的sem图像。如图12a所示,从培养第1天的细胞形貌的图像来看,除了个别附着的细胞,a549细胞倾向于聚集在一起并形成细胞簇部分地粘附在纤维表面上。a549细胞的聚集归因于强烈的细胞间相互作用。椭圆形细胞紧密堆积在一起,形成类球形结构,其中很少一部分锚定在pcl-20-d孔隙支架546的网格侧壁546w上。a549细胞在接种期间的聚集可能是由于a549细胞的性质所致。相比于2d培养方式,在3d微环境中生长的a549细胞的生物学功能和药物敏感性与体内肿瘤更相似。而且,可以从在接种a549细胞培养第1天时的pcl-10-d支架544的光显微镜图像(图13)中看出,由于吸移接种方法,培养第1天的支架544上的细胞簇的分布相当不均匀。细胞簇的大小是随机的,但被限制为小于支架的网格孔544p的孔径。据推测,可以通过调节网格隔间544p的大小和支架的纤维的层数以及细胞接种密度和分布来控制细胞簇的大小。然后,如图12b所示,在培养的第4天,孔隙支架546上附着的细胞可以在纤维表面上扩散、迁移并沿着整个表面增殖。最后但并非最不重要的是,如图12c所示,在培养的第8天,在占据所有可用表面之后,细胞可从孔隙支架546的网格侧壁546w增殖到网格隔间546p中,形成圆形组织样结构。在培养几天后,在最初的接种过程中形成的细胞簇也可以融合成上皮组织样结构,上皮组织样结构的特征是在支架546的网格孔546p内紧密的细胞-细胞连接或细胞片。细胞形貌的重塑应该是由支架546上强烈的细胞间相互作用所驱
动的。
[0111]
纤维纳米形貌特征对细胞粘附的影响取决于细胞类型。对于成纤维细胞(nih/3t3细胞),有孔隙纤维表面的支架的细胞粘附明显改善,这可能是通过接触知道而增强细胞-基质交互所致。图9b和9c中用虚线框突出显示的,在培养的第一天,在pcl-d支架上的成纤维细胞表现出广泛的分化动态丝状伪足与纤维表面与孔隙接触,而粘附在pcl支架上的成纤维细胞边缘清晰(图9a)。同时,支架上上皮a549癌细胞的整体细胞粘附由细胞-基底相互作用、细胞间相互作用共同确定,因为a549细胞在接种时容易聚集并形成球状体。此外,粘附在支架上的a549细胞也倾向于沿纤维方向排列和伸长,显示纺锤形形态如图9d至9f所示。综上所述,纤维表面的纳米形貌可以提高被试的两种不同类型的细胞系的细胞增殖率,并且可以通过在支架上培养不同类型的细胞来开发多种细胞超结构,细胞超结构可以通过调节支架结构参数(孔隙形状和大小等)来控制。
[0112]
1.7.3mcf-7细胞在支架上的细胞特性
[0113]
用于初始细胞培养,将10μl的mcf-7细胞的细胞悬浮液(细胞密度为1.0
×
107/ml)缓慢地吸移到96孔超低吸附培养板中的每个支架中。将支架在37℃、5%co2的环境中培养2小时,以使细胞与支架纤维之间达到最佳接触。此后,将100μl的细胞培养基(dmem,10%fbs和1%青霉素/链霉素)加到培养板的每个孔中培养。在最初的细胞接种阶段,观察到细胞附着在支架纤维上时彼此结块。随后,细胞缓慢迁移并在整个支架上均匀分布。通过用1x pbs清洗支架3次,除去未附着的细胞。为了确定细胞的附着和生长,在培养第1天、第4天和第8天使用细胞计数试剂盒-8(cell counting kit-8,cck-8)进行增殖研究。简言之,在测试之前,用1x pbs将支架清洗3次。随后,将100μl新鲜细胞培养基和10μl cck-8试剂添加到培养板的每个孔中。然后将支架培养2小时,使得在试剂中的水溶性四唑盐能够由细胞中的脱氢酶还原以生成可色度量化的橙色甲瓒染料。用450nm的吸光度测量细胞数目。
[0114]
图14示出通过mts方法评估培养第1天、第4天、第8天时pcl支架520、pcl-10-d孔隙支架544、pcl-20-d孔隙支架546上的mcf-7细胞的数目(n=6,*p《0.05,**p《0.01)。pcl支架520、pcl-10-d孔隙支架544、pcl-20-d孔隙支架546的网格孔的孔径约为400μm。为了阐明细胞形貌,mcf-7细胞的细胞核和细胞膜分别用hoechst 33342(蓝色)和dii(红色)染色,用于clsm成像并且结果示于图15中。
[0115]
在培养第1天,尽管附着在pcl-10-d支架544和pcl-20-d支架546上的细胞比附着在pcl支架520上的细胞略少,如图14所示,初始细胞数目之间并没有显著差异。其中pcl-d孔隙支架544/546不能导致更好的初始细胞粘附。如图16所示的在接种mcf-7细胞培养第1天时的pcl支架520的明场显微镜图像中,细胞单独粘附在支架纤维上,或者形成细胞簇并部分粘附。这种情况是自然发生的,并且与a549细胞类似,因为mcf-7癌细胞是基于上皮的并且已知经常表现出簇状或队列迁移的表型。如图15的培养第1天的细胞的共聚焦成像所示,由于吸移的接种方法,支架纤维上的细胞分布非常不均匀。在培养的第4天至第8天,细胞迁移和增殖良好,占据支架纤维壁上的大部分空间,证明支架上的工程多孔表面形貌对细胞有利。附着在所有三种支架组合物上的细胞通常数量增加。如图14所示,在培养第4天,pcl-20-d孔隙支架546上的细胞增殖最快,相比于培养第1天细胞多出约4倍,此外,pcl-20-d孔隙支架546上的细胞比pcl支架520上的细胞多出约40%。到培养第8天,pcl-20-d孔隙支架546上的细胞继续显著增殖并且比pcl支架520和pcl-10-d孔隙支架544多出30%的细胞
数,这表明pcl-20-d孔隙支架546最适合于mcf-7细胞生长和迁移。
[0116]
1.7.4hepg2细胞在支架上的细胞行为
[0117]
用于初始细胞接种,将10μl的hepg2细胞的细胞悬浮液(细胞密度为1.0
×
107/ml)缓慢地吸移到96孔超低吸附培养板中的每个支架中。将支架在37℃、5%co2的环境中培养2小时,以使细胞与支架纤维之间达到最佳接触。此后,将100μl的细胞培养基(dmem,10%fbs和1%青霉素/链霉素)加到培养板的每个孔中培养。在最初的细胞接种阶段,观察到细胞附着在支架纤维上时彼此结块。随后,细胞缓慢迁移并在整个支架上均匀分布。通过用1x pbs清洗支架3次,除去未附着的细胞。为了确定细胞的附着和生长,在培养第1天、第4天和第8天使用细胞计数试剂盒-8(cell counting kit-8,cck-8)进行增殖研究。简而言之,在测试之前,用1x pbs将支架清洗3次。随后,将100μl新鲜细胞培养基和10μl cck-8试剂添加到培养板的每个孔中。然后将支架培养2小时,使得在试剂中的水溶性四唑盐能够由细胞中的脱氢酶还原以生成可色度量化的橙色甲瓒染料。用450nm的吸光度测量细胞数目。图17示出通过mts方法评估培养第1天、第4天、第8天时pcl支架520、pcl-10-d孔隙支架544、pcl-20-d孔隙支架546上的hepg2细胞的数目(n=6,*p《0.05,**p《0.01)。pcl支架520、pcl-10-d孔隙支架544、pcl-20-d孔隙支架546的网格孔的孔径约为400μm。为了阐明细胞形貌,hepg2细胞的细胞核和细胞膜分别用hoechst 33342(蓝色)和dii(红色)染色,用于clsm成像并且结果示于图18中。
[0118]
如图17所示,在培养第1天,各支架上的细胞数目具有显著差异,pcl支架520上的细胞比pcl-10-d支架544上的细胞多出50%,pcl支架520上的细胞比pcl-20-d孔隙支架546上的细胞多出70%。通过这些初始细胞接种数量可以推断出,与pcl支架520相比,pcl-d孔隙支架544/546上的多孔表面形貌并未导致改善的细胞附着。此外,如图18所示,在培养第1天的共聚焦图像可以看出,由于吸移接种方法,细胞以不均匀的分布附着在支架的网格侧壁上。但是,到培养第4天至第8天,所有三种支架中的细胞变得更均匀地分布,并均匀地占据网格侧壁上的大部分空间。到培养第4天,pcl-d孔隙支架544/546上的细胞数目与pcl支架520上的细胞数目相同。在培养第1天至第4天,pcl支架520上的细胞数目不变。这说明如前所述的形貌表面可以更好地促进细胞生长。由于hepg2细胞以簇的形式生长,到培养第8天,在图18的共聚焦图像中可以看到大的细胞簇。与pcl-d孔隙支架544/546相比,pcl支架520中的细胞总数最少,只有约60,000个细胞。pcl-10-d孔隙支架544上的细胞数显著增殖至比pcl-20-d支架546上的细胞多出20%,表明pcl-10-d孔隙支架544最适合hepg2细胞的生长和迁移。
[0119]
1.8支架和二维板(2d板)上a549细胞的选定生物标志物表达
[0120]
选择a549细胞在支架和平面培养板(2d板)上进行培养、比较,以进一步阐明纤维纳米形貌对支架上生长的细胞的生物标志物表达水平的影响。细胞生长进入稳定阶段,收集在支架上培养8天、在2d板上培养3天的达到80%的融合度的a549细胞,分别用于rna和蛋白质的量化。通过定量实时聚合酶链式反应(polymerase chain reaction,pcr)分析检测在支架上生长的a549细胞的所选生物标志物的转录表达水平,并与作为对照组的在2d板上单层培养的细胞的所选生物标志物的转录表达水平进行比较。一般来说,与在2d板上培养的细胞相比,在孔隙支架上培养的a549细胞具有广泛提高的基因表达,包括整联蛋白β1、局部黏着斑激酶(fak)、基质金属蛋白酶9(mmp-9)、上皮生长因子(egf)、上皮生长因子受体
(epithelial growth factor receptor,egfr)和上皮钙粘蛋白(e-cadherin)(除了增殖标记ki-67没有提高的基因表达以外)。以上结果与3d肺癌球体中宽基因表达的表型更准确地概括体内肿瘤的研究结果一致,这表明3d肿瘤模型具有巨大的抗癌药物筛选的潜力。
[0121]
细胞粘附和细胞增殖相关的生物标志物
[0122]
将细胞接种到支架上后,细胞对纳米级特征的反应由细胞反应和细胞粘附引起,而与细胞粘附有关的受体是由两个跨膜α-和β-亚基组成的整联蛋白。整联蛋白的胞外结构域特别地结合ecm蛋白,整联蛋白的胞质尾区与细胞骨架联结。联结允许周围基质的机械信号和化学信号通过激活相应的信号通路传递进细胞中,要确定的重要整联蛋白信号分子之一是fak,fak调节细胞反应,例如形态、迁移、运动、增殖、分化和存活。因此,纤维纳米形态对细胞粘附的影响是通过检测整联蛋白β1和fak的转录因子的表达来评估。如图19a所示,pcl支架上的a549细胞的整联蛋白β1基因表达水平大约是在2d板表面上的a549细胞的60%,但pcl-20-d支架上的a549细胞的整联蛋白β1基因表达水平增加到2d板表面上的a549细胞的1.6倍。与所有细胞附着并扩散在平面上的细胞单层相比,pcl支架上的一些细胞可能通过细胞-细胞粘附的支持而不是细胞-基底粘附的支持生长到网格孔的孔腔中,导致pcl三维支架上整联蛋白的表达水平降低。鉴于pcl-d支架提供比光滑pcl支架更大的纳米多孔纤维表面,使得整联蛋白表达增加。由于整联蛋白和fak参与细胞对附着基底的反应,如图19b所示,从pcl支架到pcl-20-d孔隙支架,局部黏着斑激酶(fak)基因表达呈现相似的增长趋势。这与基底纳米形态通过整联蛋白检测并由诸如fak的衔接蛋白转导的发现一致。纤维表面的纳米形貌特征可以由a549细胞通过黏着斑检测,整联蛋白和fak的表达水平与纳米特征的尺寸和密度密切相关。因为整联蛋白β1的表达和fak信号的激活在控制体内转移性肺癌细胞的增殖起关键作用,pcl-d孔隙支架可以为a549细胞提供更好的平台用来模拟细胞-基质粘附。
[0123]
增殖标志物ki-67的表达(图19c)在所有支架上接种的a549细胞上明显,这表明细胞在2d培养板上生长增殖比细胞在纤维支架上快得多。这个与在静电纺丝pcl支架上生长的肿瘤细胞显示较低的增殖率、更能模仿体内肿瘤的生长的研究一致。鉴于从pcl支架到pcl-20-d支架,ki-67基因的表达逐步增加,这与图11中的细胞计数结果一致,并表明增加纳米特征尺寸和密度可以通过激活整联蛋白-fak信号通路来促进细胞增殖。
[0124]
肺肿瘤相关生物标志物
[0125]
基质金属蛋白酶9(matrix metalloproteinases,mmp-9),也称为明胶酶b,是细胞质中的一种分泌酶,可降解细胞外基质(extracellular matrix,ecm)并促进肿瘤发展,包括侵袭、转移和血管生成。从图19d可以发现在所有支架上的细胞的mmp-9基因表达水平大约是在2d板的四倍,但在pcl支架和pcl-d支架之间未观察到显着差异。这表明支架上的癌细胞具有增强的代谢活性并促进恶性表型,但支架的表面形态对分泌蛋白质影响不大。
[0126]
此外,接种在支架上的a549细胞可以发展由强烈的细胞间相互作用支持的细胞球体和圆形细胞超结构。相反,生长在2d板上的细胞呈扁平状且铺展良好,细胞间接触有限(图20a至20d)。通过上皮细胞钙粘蛋白的基因/蛋白质表达水平评估细胞间相互作用,上皮细胞钙粘蛋白是一种单程跨膜糖蛋白,参与钙依赖性的细胞间粘附,并且被认为是维持上皮细胞组织结构和表型的关键成分。在打印支架上的上皮细胞钙粘蛋白的转录表达水平比2d板上的上皮细胞钙粘蛋白高10至15倍,其中在pcl-10-d支架上观察到最高水平(图21a)。
这些结果证明在打印支架上生长的细胞表达的蛋白质确实具有更高水平的细胞间粘附以支持组织形成。此外,在pcl-10-d支架的网格孔上生长的a549细胞的clsm图像中观察到具有紧密连接的密集的细胞聚集(图21b)。此外,上皮细胞钙粘蛋白的蛋白表达通过蛋白免疫印迹(western blot,wb)检测(图21c),并且半定量分析结果(图21d)表明支架上的相对上皮细胞钙粘蛋白的蛋白表达水平约为在2d板上的3至4倍,这与检测到的信使核糖核酸(mrna)表达水平一致。结果表明,pcl-d支架可以刺激附着的细胞之间的细胞间相互作用并促进组织形成,这将有利于在体外开发肿瘤模型。
[0127]
最后,因为表皮生长因子受体(egfr)及其家族受体是调节恶性细胞的增殖、分化、迁移和存活的复杂的信号级联,所以对egfr及其同源配体egf的基因和蛋白表达进行研究。此外,egfr也被认为是开发抗癌药物如单克隆抗体和酪氨酸的靶标激酶抑制剂的至关重要的治疗药物。在所有支架上的自分泌表皮生长因子(egf)的细胞基因表达水平大约是在2d板的两倍(图22a),但在pcl支架和pcl-d支架之间几乎没有区别。而在pcl-10-d支架上的a549细胞的egfr的mrna表达水平大约是在2d板上的4倍,是在pcl支架或pcl-20-d支架上的2倍(图22b)。通过蛋白免疫印迹(wb)检测egfr的蛋白表达(图22c),并且半定量分析结果(图22d)表明egfr的相对蛋白表达水平的趋势与其基因表达水平一致。这些结果与在纤维支架上培养的癌细胞表达更高水平的各种生长因子受体(生长因子受体与人类体内的肿瘤的蛋白质表达非常相似)的研究一致。然而,纳米特征对egfr基因表达的影响仍然不明确,由于在pcl-20-d支架上的egfr基因/蛋白质表达水平显著下降。据推测,细胞可以识别并响应pcl-d支架上的纳米形貌的不同的尺寸、分布,例如pcl-10-d支架上的孔隙和在pcl-20-d支架上的纳米槽/微米槽。此外,egfr还可以以其激活的磷酸化形式(pho-egfr)存在,并启动下游信号级联。图22d中所示的egfr蛋白表达仅能代表egfr的失活形式,这可能解释了蛋白免疫印迹(wb)检测的结果的偏差。
[0128]
目前,最常见、最简单的3d肺肿瘤细胞模型是浮动的球状体,诱导的肿瘤球状体的形态和生理功能与体内实体瘤相似,而且由于易于使用且成本低廉,3d肺肿瘤细胞模型已被广泛用作抗肿瘤肺筛查。但是,此模型中缺少天然组织微环境中的主要的细胞-ecm相互作用。或者,已经开发出基于水凝胶或多孔支架的肿瘤模型来培养a549细胞用于肿瘤建模和药物筛选,概括ecm体外微环境。虽然由于天然衍生的生物聚合物的内在的不稳定性,所以它们通常批次稳定性较低、可重复性差、生产成本高。
[0129]
本发明中的具有纤维纳米形貌的ehdj打印的支架将是开发用于癌症研究和药物筛选应用的3d肿瘤模型的有前景的平台。在纤维表面生成的纳米形貌特征有利于细胞粘附、增殖、迁移和组织结构形成,由相应的生物标志物的基因/蛋白质表达逐渐升高来证明。此外,ehdj打印的支架提供均质且可重复的微尺度多孔结构用于诱导肿瘤球状体并且细胞行为可以通过纤维表面的纳米级特征进行调整。最后,由于没有不确定的干扰成分,支架在视觉上对荧光成像透明,适用于分子生物学分析。
[0130]
麦醇溶蛋白可以用作pcl/麦醇溶蛋白复合液体原料中的模板,经沥滤处理后,ehdj打印的密实支架可在纤维表面产生可调的孔隙形貌特征。与pcl-10-d孔隙支架相比,pcl-20-d孔隙支架具有更高密度、更大尺寸的孔隙形貌特征。pcl-10-d孔隙支架的力学特性与仅含pcl成分的密实支架相似,而pcl-20-d孔隙支架由于其更大尺寸和更高密度的孔隙特征而具有较低的最大应力和最大应变。在nih/3t3和a549细胞系等上测试的结果表明,
孔隙形貌可以促进植入支架上的细胞的细胞粘附、迁移和增殖。细胞片或圆形细胞超结构均可通过支架孔腔中的成纤维细胞或上皮癌细胞发展,表明细胞-支架相互作用增强。与2d细胞单层相比,在3d打印支架上培养的a549细胞上检测的选择的生物标志物的表达已表明除了增殖标记ki-67以外,其它基因表达均得到改善。由从pcl密实支架到pcl-20-d孔隙支架上的整联蛋白β1,fak和ki-67的基因表达逐渐增强理解,纤维表面的孔隙形貌特征可以促进细胞粘附和细胞增殖。由上皮钙粘蛋白(e-cadherin)的基因表达/蛋白表达的增强可以证明,a549细胞形成的细胞超结构表现出更强的细胞间相互作用。此外,a549细胞的egfr基因表达/蛋白表达也可能是通过调整纤维的纳米形貌特征来调节,表明作为用于靶标抗癌药物筛选的肺肿瘤模型的潜力。
[0131]
如本文所使用,除非另有明确说明,否则单数“一”和“一个”可以解释为包括复数“一个或多个”。
[0132]
本发明出于说明和描述的目的,并非为详尽无遗或为限制性。许多修改和变化对于本领域普通技术人员来说是清楚易懂的。本文所选择和描述的示例实施例是为了解释原理和实际应用,使本领域普通技术人员能够理解本发明的各种实施例所适合的各种修改,以达到预期的特定技术效果。
[0133]
因此,尽管在此参考附图描述了说明性示例实施例,但是应当理解地,该描述不具限制性,本领域技术人员可以在不脱离本发明的范围或创意构思及实施方案的前提下,对其进行各种其他改变和修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1