一种亚甲基蓝和刚果红有机污染物的处理方法与流程
本发明属于光催化材料、吸附材料领域,特别涉及一种亚甲基蓝和刚果红有机污染物的处理方法。
背景技术:
有机染料亚甲基蓝和刚果红是染料厂、印染行业常用的染色剂,含此类染料的工业废水色度大、排放量大、毒性大、可生化性差,一直是废水处理中的一个难题。将含有亚甲基蓝和刚果红的工业废水直接排放到自然环境中会给人类赖以生存的环境带来严重的污染,从而危害人类的身体健康。所以,去除工业废水中的有机染料亚甲基蓝和刚果红是治理印染废水和净化环境的一个有效途径。
目前,TiO2及其金属掺杂物作为半导体光催化剂已经成为去除废水污染的有效技术之一,具有毒性低、耐腐蚀性的特点。在紫外光照射下,此类半导体类材料可以作为降解染料废水中有机染料分子的有效催化剂。但是此类材料的合成过程需要高温焙烧(400℃~600℃)和研磨等多道工序,而且催化过程中废水的pH会对TiO2材料的能级结构、表面特性和吸附平衡,当pH大于TiO2等电点时,染料分子很难吸附到TiO2材料表面,催化反应无法进行,这也对此类催化剂的催化效果有很大的限制性。
多金属氧酸盐作为无机建筑单元构筑的过渡金属配合物是一种无机-有机杂化的多功能材料,具有结构复杂多样、性能良好、应用范围广的特点。Anderson型多金属氧酸盐属于八面体杂原子类型,具有圆盘结构,其表面丰富的氧原子更易于与过渡金属离子配位形成新颖结构和多种性能的配合物材料。现有的Anderson型多金属氧酸盐基配合物通常是常规、回流或者溶剂条件下制备得到的,其稳定性相对较差。而且,在紫外光照射和暗室条件下现有Anderson型多金属氧酸盐基功能配合物材料可以同时去除多种染料分子的研究是非常有限的,尤其是对染料分子刚果红的催化降解、吸附去除的研究还未见报道。
技术实现要素:
本发明要解决的技术问题是提供一种原料成本低,对水溶性污染物亚甲基蓝和刚果红亲和能力强,可催化降解和吸附去除有机污染物亚甲基蓝和刚果红,去除效率高,不能造成环境二次污染的亚甲基蓝和刚果红有机污染物的处理方法。
本发明的技术解决方案是:
一种亚甲基蓝和刚果红有机污染物的处理方法,其具体步骤如下:
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
以氯化铜、八水铬钼酸钠和N,N'-双(4-吡啶甲酰基)乙烷烃为原料,加入去离子水中混合均匀,得到混合悬浮液,采用水热法进行合成,合成配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O;其中,4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷;
1.2、有机染料分子的催化降解或吸附去除
采用污水处理系统对含有有机染料分子的废水进行处理,所述有机染料分子的废水为含有亚甲基蓝、刚果红中至少一种有机污染物的水体,将步骤1.1合成的配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4作为降解催化剂加入污水处理罐中,或将步骤1.1合成的配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O作为吸附剂加入污水处理罐中搅拌,所述含有有机染料分子的废水中亚甲基蓝和刚果红的总质量与配合物的质量比为1:10~1:40,使有机染料分子的废水在紫外光照射45min~90min或暗室条件下放置5h~72h,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收重复使用。
进一步的,所述含有有机染料分子的废水中亚甲基蓝的浓度为10.0mg·L–1~20.0mg·L–1。
进一步的,所述含有有机染料分子的废水中刚果红的浓度为10.0mg·L–1~20.0mg·L–1。
进一步的,所述N,N'-双(4-吡啶甲酰基)-1,2-乙烷与八水合铬钼酸钠的摩尔比为1:1.5~1:4,N,N'-双(4-吡啶甲酰基)-1,2-乙烷与氯化铜的摩尔比为1:4~1:8。
进一步的,所述N,N'-双(4-吡啶甲酰基)-1,2-乙烷与去离子水的摩尔体积比为1:80mol/L~1:120mol/L。
进一步的,水热合成时,用盐酸调混合悬浮液pH至2.0~4.5,倒入高压反应釜中升温至100℃~130℃,水热条件下保温80h~100h。
进一步的,水热合成时,pH在3.0~4.5范围内,合成配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4为主要产物。
进一步的,水热合成时,pH在2.0~3.0范围内合成配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O为主要产物。
进一步的,步骤1.2使用吸附剂处理时,将固体分离装置回收的固体中有机染料分子从配合物中解析出来,解析时,使用的溶液为含氯化钠(NaCl)的N,N-二甲基甲酰胺(DMF)溶液进行浸泡。
进一步的,含氯化钠(NaCl)的N,N-二甲基甲酰胺(DMF)溶液的浓度为2.0g/L~10.0g/L,室温下浸泡0.5h~48h。
本发明的有益效果是:
(1)有机染料处理剂合成方法简单,产品成本低、毒性小,合成的配合物不溶于水溶液和常见的有机溶剂,选择八水铬钼酸钠(Na3[CrMo6H6O24]·8H2O)作为无机阴离子配体,采用N,N'-双(4-吡啶甲酰基)-1,2-乙烷作为中性含氮有机配体,与氯化铜在水热条件下反应自组装,可以同时在一个反应釜中制备得到蓝色块状和条状两种晶体:Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O,是结构和性能截然不同的两种配合物。水热合成配合物时通过调节体系的pH可以调控生成两种晶体的产率,其中,pH在3.0~4.5范围内合成配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4为主要产物,pH在2.0~3.0范围内合成配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O为主要产物;两种配合物在一个反应釜中同时生成,结晶过程相对缩短、能耗显著降低,合成产率较高,降低了合成成本;
(2)有机染料处理剂以N,N'-双(4-吡啶甲酰基)-1,2-乙烷作为有机配体,其结构中酰胺基团不仅是一种潜在的配位点,可以与金属离子配位,而且是一种极性基团,具有很好的亲水性,可以促进水溶液中配合物的生成,也使生成的配合物是亲水性的,这不仅有可能提高配合物催化降解水溶液中有机染料分子的活性,也可能增强配合物与水溶液中有机染料分子间的氢键等超分子作用从而产生吸附染料分子的性能;
(3)配合物作为催化剂或吸附剂,对水溶性的有机染料分子的亲和能力强、催化降解、吸附去除效果好;在紫外光照射或暗室条件下,配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4对亚甲基蓝(MB)和刚果红(CR)有机染料具有良好选择性光催化降解活性,而配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O对亚甲基蓝(MB)和刚果红(CR)有机染料具有良好的吸附性能;并且易于从反应体系中分离出来,不会造成对环境的二次污染,催化剂或吸附剂还可以循环使用,重复利用率高;在紫外光下,对染料分子亚甲基蓝(MB)和刚果红(CR)的光催化降解率分别为95.3%和77.4%、吸附去除率为95.9%和98.9%;在暗室条件下,亚甲基蓝(MB)和刚果红(CR)染料分子的光催化降解率分别为62.7%和66.8%、吸附去除率为92.9%和98.6%;两种配合物可分别作为紫外光照射下或暗室条件下去除多种有机染料的功能材料。
附图说明
图1是本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的PXRD衍射图;
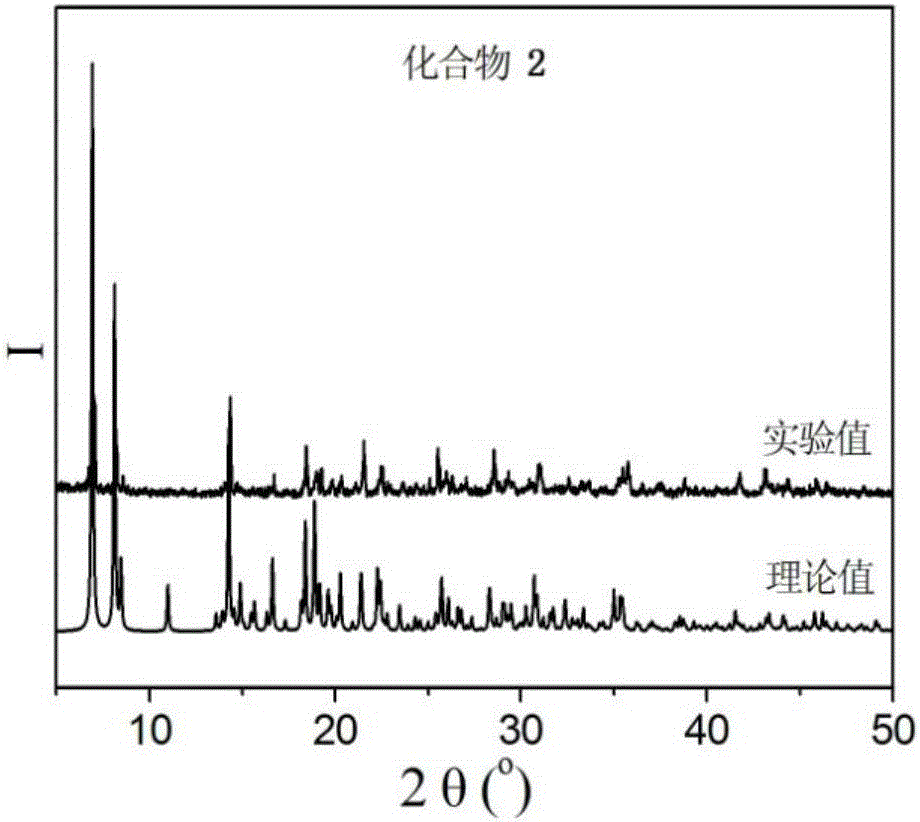
图2是本发明合成的{Cu2(L2)2[CrMoVI5MoV(OH)6O18](H2O)2}·2H2O的PXRD衍射图;
图3是本发明合成的配合物的热分析图;
图4是本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图;
图5是本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的二维无机双金属层结构图;
图6是本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的三维无机-有机骨架结构图;
图7是本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的三维骨架结构的拓扑图;
图8是本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图;
图9是本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的二维无机双金属层结构图;
图10是本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的二维无机-有机杂化层结构图;
图11是加入本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4在紫外光照射下、暗室条件下对亚甲基蓝(MB)、刚果红(CR)和罗丹明B(RhB)的光催化降解紫外吸收图;
图12是加入、不加入本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4在紫外光照射下、暗室条件下对亚甲基蓝(MB)和刚果红(CR)的光催化降解率曲线图;
图13是加入本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O在紫外光照射下、暗室条件下对亚甲基蓝(MB)、刚果红(CR)和罗丹明B(RhB)的吸附去除后溶液的紫外吸收图;
图14是加入本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O在紫外光照射下对亚甲基蓝(MB)和刚果红(CR)的吸附量曲线图;
图15是加入本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O在暗室条件下对亚甲基蓝(MB)和刚果红(CR)的吸附去除率曲线图;
图16是本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O吸附亚甲基蓝(MB)和刚果红(CR)后在暗室条件下进行脱附后的溶液的紫外吸收曲线图;
图17是本发明合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O作为吸附剂重复吸附CR五轮实验的吸附率柱状图;
图18是加入、不加入本发明合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O在紫外光照射下光催化或吸附亚甲基蓝(MB)、刚果红(CR)的去除率曲线图;
图中:1-Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4;
2-{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O。
具体实施方式
实施例1
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.4mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.15mmol Na3[CrMo6H6O24]·8H2O和8.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至2.3后,转移到25mL的高压反应釜中,以2.5℃/h的加热速率升温至110℃,水热条件下保温80h,以2.5℃/h的降温速率将温度降至室温,得到少量蓝色块状晶体和主要产物蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为5%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为35%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的吸附去除
采用污水处理系统对含有浓度为10.0mg·L–1亚甲基蓝和浓度为10.0mg·L–1刚果红的有机染料分子的废水进行处理,将步骤1.1合成的配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O作为吸附剂加入污水处理罐中搅拌,所述有机染料分子的废水中亚甲基蓝和刚果红的总质量与配合物的质量比为1:10,使有机染料分子的废水在紫外光照射45min,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收;固体回收步骤如下:将固体分离装置排出的固体在室温下干燥,并在暗室条件下浸泡在浓度为2.0g/L含有氯化钠(NaCl)N,N-二甲基甲酰胺(DMF)的溶液中,经过48h的浸泡亚甲基蓝(MB)分子全部从配合物中解析出来,而刚果红(CR)经过60min的浸泡全部从配合物中解析出来。
实施例2
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.6mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.3mmolNa3[CrMo6H6O24]·8H2O和10.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至2.8后,转移到25mL的高压反应釜中,以5℃/h的加热速率升温至130℃,水热条件下保温100h,以2.5℃/h的降温速率将温度降至室温,得到少量蓝色块状晶体和主要产物蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为9%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为38%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的吸附去除
采用污水处理系统对含有浓度为20.0mg·L–1亚甲基蓝的有机染料分子的废水进行处理,将步骤1.1合成的配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O作为吸附剂加入污水处理罐中搅拌,所述含有浓度为20.0mg·L–1亚甲基蓝的有机染料分子的废水中亚甲基蓝质量与配合物的质量比为1:20,使有机染料分子的废水在紫外光照射60min,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收;固体回收步骤如下:将固体分离装置排出的固体在室温下干燥,并在暗室条件下浸泡在浓度为5.0g/L含有氯化钠(NaCl)N,N-二甲基甲酰胺(DMF)的溶液中,经过48h的浸泡亚甲基蓝(MB)分子全部从配合物中解析出来。
实施例3
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.5mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.25mmol Na3[CrMo6H6O24]·8H2O和10.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至2.5后,转移到25mL的高压反应釜中,以5℃/h的加热速率升温至120℃,水热条件下保温96h,以2.5℃/h的降温速率将温度降至室温,得到少量蓝色块状晶体和主要产物蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为13%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为42%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的吸附去除
采用污水处理系统对含有浓度为20.0mg·L–1刚果红的有机染料分子的废水进行处理,将步骤1.1合成的配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O作为吸附剂加入污水处理罐中搅拌,所述有机染料分子的废水中刚果红的总质量与配合物的质量比为1:40,使有机染料分子的废水在紫外光照射90min,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收;固体回收步骤如下:将固体分离装置排出的固体在室温下干燥,并在暗室条件下浸泡在浓度为10.0g/L含有氯化钠(NaCl)N,N-二甲基甲酰胺(DMF)的溶液中,刚果红(CR)经过60min的浸泡全部从配合物中解析出来。
实施例4
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.7mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.4mmolNa3[CrMo6H6O24]·8H2O和12.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至3.3后,转移到25mL的高压反应釜中,以10℃/h的加热速率升温至110℃,水热条件下保温100h,以5℃/h的降温速率将温度降至室温,得到主要产物蓝色块状晶体和少量蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为27%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为17%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的催化降解
采用污水处理系统对含有浓度为10.0mg·L–1亚甲基蓝、浓度为10.0mg·L–1刚果红的有机染料分子的废水进行处理,将步骤1.1合成的配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4作为降解催化剂加入污水处理罐中搅拌,所述有机染料分子的废水中亚甲基蓝和刚果红的总质量与配合物的质量比为1:10,使有机染料分子的废水在暗室条件下放置5h,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收重复使用。
实施例5
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.45mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.3mmol Na3[CrMo6H6O24]·8H2O和10.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至3.9后,转移到25mL的高压反应釜中,以2.5℃/h的加热速率升温至120℃,水热条件下保温96h,以10℃/h的降温速率将温度降至室温,得到主要产物蓝色块状晶体和少量蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为38%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为10%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的催化降解
采用污水处理系统对含有浓度为10.0mg·L–1亚甲基蓝的有机染料分子的废水进行处理,将步骤1.1合成的配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4作为降解催化剂加入污水处理罐中搅拌,所述有机染料分子的废水中亚甲基蓝与配合物的质量比为1:20,使有机染料分子的废水在暗室条件下放置30h,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收重复使用。
实施例6
1.1、有机染料处理剂(光催化剂或吸附剂)的制备
将0.75mmol CuCl2·2H2O、0.10mmol N,N'-双(4-吡啶甲酰基)-1,2-乙烷、0.4mmol Na3[CrMo6H6O24]·8H2O和8.0mL H2O依次加入到25mL烧杯中,在室温下搅拌30min,得到悬浮混合物,用1.0mol/L的HCl溶液调解悬浮混合物的pH至4.2后,转移到25mL的高压反应釜中,以10℃/h的加热速率升温至130℃,水热条件下保温80h,以5℃/h的降温速率将温度降至室温,得到主要产物蓝色块状晶体和少量蓝色条状晶体,用去离子水和无水乙醇交替清洗3次,室温下自然晾干,得配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(产率为31%)和{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(产率为6%),其中4-dpye为N,N'-双(4-吡啶甲酰基)-1,2-乙烷,结构式为:其PXRD衍射图谱如图1和图2所示。配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4的配位环境图如图4所示,其金属-有机骨架是一种三维网络结构,展示了一种双节点的3,4-连接的{6.82}{64.8.10}拓扑结构,金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图5所示,二维无机层被双齿配位模式的4-dpye配体连接成的三维骨架结构如图6所示,三维拓扑结构如图7所示;配合物{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O的配位环境图如图8所示,其结构中金属铜连接金属Anderson型多金属氧酸盐形成的二维无机层如图9所示,单齿配位模式的4-dpye配体悬挂在二维无机层的两侧形成的金属-有机二维骨架结构如图10所示;
1.2、有机染料分子的催化降解
采用污水处理系统对含有浓度为20.0mg·L–1刚果红的有机染料分子的废水进行处理,将步骤1.1合成的配合物Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4作为降解催化剂加入污水处理罐中搅拌,所述有机染料分子的废水中刚果红与配合物的质量比为1:40,使有机染料分子的废水在暗室条件下放置5h,送入固液分离装置中进行固液分离,得到的液体由固体分离装置的液体出口排出,固体经回收重复使用。
基于Anderson型多金属氧酸盐和柔性双吡啶双酰胺有机配体的铜配合物的表征
(1)粉末衍射表征相纯度
在Rigaku Ultima IV粉末X射线衍射仪上收集完成粉末衍射数据,操作电流为40mA,电压为40kV。采用铜靶X射线。固定扫描,接收狭缝宽为0.1mm。密度数据收集使用2θ/θ扫描模式,扫描范围5°到50°,扫描速度为5°/s,跨度为0.02°/次。数据拟合使用Cerius2程序,单晶结构粉末衍射谱模拟转化使用Mercury 1.4.1。
如图1和图2所示,基于Anderson型多金属氧酸盐和柔性双吡啶双酰胺配体的铜配合物的粉末X射线衍射谱图与拟合的PXRD谱图基本吻合,表明配合物均为纯相。
(2)热重表征材料稳定性
热稳定性采用PE-Pyris Diamond S-II热分析仪完成,加热速率10℃/min,温度范围30℃~800℃。图3表明本发明合成的两个铜配合物的配位骨架分解温度范围为230℃~450℃。
(3)晶体结构测定
在显微镜下手动挑选大小适当的单晶样品,室温下采用Bruker SMART APEX II单晶X-射线衍射仪(石墨单色器,Mo-Ka,)收集衍射数据。扫描方式衍射数据使用SADABS程序进行吸收校正。数据还原和结构解析分别使用SAINT和SHELXTL程序完成。最小二乘法确定全部非氢原子坐标,并用理论加氢法得到氢原子位置。采用最小二乘法对晶体结构进行精修。图4~图10展示出实施例1~实施例6中合成的基于Anderson型多金属氧酸盐和柔性双吡啶双酰胺配体的铜配合物的基本配位情况和扩展结构,其中配合物1为Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4,配合物2为{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O。其晶体学衍射点数据收集与结构精修的部分参数如表1所示:
表1
配合物1作为催化剂对亚甲基蓝(MB)、刚果红(CR)和罗丹明B(RhB)的水溶液的光催化降解实验
对实施例1~实施例6合成的Cu5(μ2-OH)2(4-dpye)2[CrMo6(OH)5O19]2(H2O)4(配合物1)分别进行紫外光照射和暗室条件下催化亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液的降解实验,并分别以三种有机染料分子的水溶液对紫外光的特性吸收作为判断三种有机污染物分子的存在依据,用于确定在紫外光照射条件下或暗室条件下配合物1对三种水溶性污染物的催化降解能力。
配合物1紫外光照射下催化降解亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)实验的具体步骤如下:
将120mg的配合物1分别加入200mL浓度为15.0mg·L–1的亚甲基蓝(MB)水溶液1、浓度为15.0mg·L–1的刚果红(CR)、浓度为15.0mg·L–1的罗丹明B(RhB)水溶液中作为实验组,并取同体积的亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液作为对照组。搅拌实验组的亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液30min得到悬浮物,边搅拌边采用汞灯作为紫外光源进行照射。每隔15min取出5mL溶液进行离心分离,得到澄清上层溶液进行UV测试。如图11所示,实验组亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液在分别经过90min紫外光照射后,亚甲基蓝(MB)和刚果红(CR)的特征吸收显著降低,表明有机染料分子亚甲基蓝(MB)和刚果红(CR)的大部分已经被催化降解;而罗丹明B(RhB)的特征吸收降低不大,表明罗丹明B几乎没有发生催化降解。其中,配合物1对亚甲基蓝(MB)和刚果红(CR)的催化降解效率分别为95.3%和77.4%。
配合物1在暗室条件下催化降解亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)实验的具体步骤如下:
将120mg的配合物1分别加入200mL浓度为15.0mg·L–1的亚甲基蓝(MB)水溶液1、浓度为15.0mg·L–1的刚果红(CR)、浓度为15.0mg·L–1的罗丹明B(RhB)水溶液中作为实验组,并取同体积的亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液作为对照组。在暗室中,搅拌实验组的亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液30min得到悬浮物,每隔15min取出5mL溶液进行离心分离,得到澄清上层溶液进行UV测试。如图11所示,实验组亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液在暗室中分别经过90min的搅拌反应后,亚甲基蓝(MB)和刚果红(CR)的特征吸收明显降低,表明部分染料分子亚甲基蓝(MB)和刚果红(CR)的已经被催化降解;而罗丹明B(RhB)的特征吸收降低不明显,表明罗丹明B只有少量发生催化降解。其中,配合物1对亚甲基蓝(MB)和刚果红(CR)的催化降解效率分别为62.7%和66.8%。
如图12所示,不加入任何催化剂的对照组的亚甲基蓝(MB)、刚果红(CR)水溶液在暗室条件下搅拌反应90min后降解率仅为3.5%和2.5%。表明这两种染料分子亚甲基蓝(MB)和刚果红(CR)仅仅通过紫外光照射或者暗室条件下不加入任何催化剂时降解率非常低,但是配合物1作为催化剂能对亚甲基蓝(MB)和刚果红(CR)的降解起到好的催化作用,其中配合物1在紫外光下对亚甲基蓝(MB)催化降解效果最为显著,如图12。
配合物2作为吸附剂对亚甲基蓝(MB)、刚果红(CR)和罗丹明B(RhB)的水溶液的吸附去除实验
对实施例1~实施例6合成的{Cu(4-Hdpye)[CrMo6(OH)6O18](H2O)2}·2H2O(配合物2)分别进行紫外光照射下和暗室条件下对水溶液中的染料分子亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)吸附去除实验,并分别以水溶液中三种有机染料分子的吸附去除后溶液对紫外光的特性吸收作为判断三种有机污染物分子的存在依据,用于确定在紫外光照射条件下或暗室条件下配合物2对三种水溶性污染物的吸附去除能力。
配合物2紫外光照射下吸附去除亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)实验的具体步骤如下:
将120mg的配合物2分别加入200mL浓度为15.0mg·L–1的亚甲基蓝(MB)水溶液1、浓度为15.0mg·L–1的刚果红(CR)、浓度为15.0mg·L–1的罗丹明B(RhB)水溶液中作为实验组,并取同体积的亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液作为对照组。搅拌实验组的亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液30min得到悬浮物,边搅拌边采用汞灯作为紫外光源进行照射。每隔15min取出5mL溶液进行离心分离,得到澄清上层溶液进行UV测试。如图13所示,实验组亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液在分别经过90min紫外光照射后,亚甲基蓝(MB)和刚果红(CR)的特征吸收显著降低,表明有机染料分子亚甲基蓝(MB)和刚果红(CR)的绝大部分已经被配合物2吸附去除;而罗丹明B(RhB)的特征吸收降低不大,表明罗丹明B几乎没有发生吸附。其中,配合物2对亚甲基蓝(MB)和刚果红(CR)的吸附去除效率分别为96.5%和98.9%。如图14所示,配合物2作为吸附剂在紫外光照射下,随时间的增加对水溶液中有机污染物亚甲基蓝(MB)和刚果红(CR)分子的吸附量逐渐增多,90min时吸附量达到最大为192mg g-1和198mg g-1。
配合物2作为吸附剂在暗室条件下吸附去除亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)实验的具体步骤如下:
将120mg的配合物2分别加入200mL浓度为15.0mg·L–1的亚甲基蓝(MB)水溶液1、浓度为15.0mg·L–1的刚果红(CR)、浓度为15.0mg·L–1的罗丹明B(RhB)水溶液中作为实验组,并取同体积的亚甲基蓝(MB)水溶液、刚果红(CR)水溶液、罗丹明B(RhB)水溶液作为对照组。搅拌实验组的亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液30min得到悬浮物,分别根据吸附速度的快慢选择间隔15min、30min、1h、24h、36h等不同的时间取出5mL溶液进行离心分离,得到澄清上层溶液进行UV测试。如图13所示,实验组亚甲基蓝(MB)、刚果红(CR)、罗丹明B(RhB)水溶液在暗室中分别经过72h或5h的搅拌反应后,亚甲基蓝(MB)和刚果红(CR)的特征吸收明显降低,表明大部分染料分子亚甲基蓝(MB)和刚果红(CR)的已经被配合物吸附去除;而罗丹明B(RhB)的特征吸收降低不明显,表明罗丹明B只有少量发生吸附。其中,配合物2对亚甲基蓝(MB)和刚果红(CR)的吸附去除率分别为92.9%和98.6%如,如图15所示。
将吸附染料分子亚甲基蓝(MB)和刚果红(CR)的配合物2从水体中过滤、室温下干燥,并在暗室条件下浸泡在浓度为2.0g/L含有氯化钠(NaCl)的N,N-二甲基甲酰胺(DMF)溶液中,经过48h的浸泡后亚甲基蓝(MB)分子全部从配合物2中解析出来,而刚果红(CR)经过60min的浸泡就全部从配合物2中解析出来。如图16所示,随浸泡时间的增加,溶液中亚甲基蓝(MB)和刚果红(CR)的特征吸收逐渐增强,表明有机染料分子亚甲基蓝(MB)和刚果红(CR)已经逐渐的从配合物2中解析出来。经过上述解析染料分子处理后的配合物2又可再次作为吸附剂使用,重复使用五次,其吸附去除水溶液中的染料分子的吸附率没有发生明显降低(图17),因此配合物2可以作为高效吸附剂重复使用。
不加入任何吸附剂的对照组的亚甲基蓝(MB)、刚果红(CR)水溶液在紫外光照射或者暗室条件下搅拌反应72h后,亚甲基蓝(MB)和刚果红(CR)降解率非常低,表明这两种染料分子亚甲基蓝(MB)和刚果红(CR)仅仅通过紫外光照射或暗室条件下不加入任何吸附剂时实现降解去除是不能实现的,但是配合物2作为吸附剂能对水溶液中的亚甲基蓝(MB)和刚果红(CR)起到明显的吸附去除作用,只是配合物2在紫外光照射条件下对亚甲基蓝(MB)和刚果红(CR)的吸附去除需要的时间相对较短,90min就能达到96.5%和98.9%,如表2。
将实施例1~实施例6合成的配合物1和配合物2在紫外光照射条件或暗室条件下催化降解或吸附去除水溶液中染料分子亚甲基蓝(MB)和刚果红(CR)的实验数据进行对比分析(表2):
表2
由表2结果可知,在紫外光照射或者暗室条件下配合物1和配合物2分别对水溶性污染物亚甲基蓝(MB)和刚果红(CR)表现出好的催化降解效率或吸附去除能力,配合物1在紫外光下对亚甲基蓝(MB)催化降解效果最好,配合物2在紫外光照射或者暗室条件下均对两种染料分子表现出强的吸附去除能力。将两种配合物在紫外光照射下对染料分子亚甲基蓝(MB)和刚果红(CR)的去除率进行对比,如图18所示,配合物2的吸附去除率明显强于配合物1的催化降解率,这归因于两种配合物的不同网络结构。
以上仅为本发明的具体实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种活性炭基无机‑有机复合型材料的制备方法及用途与流程
- 一种腐蚀产物中氧化亚铁的测定方法与制造工艺
- 利用亚甲基蓝与G‑四链体的结合进行电化学检测端粒酶活性的方法与制造工艺
- 一种煤基复合染料的制造方法与工艺
- 一种聚吡咯功能化的钴配合物复合材料的合成方法及其应用与制造工艺
- 一种催化降解有机染料的钨氧簇化合物的制备方法及应用与制造工艺
- 一种Ag@CdSe/Al2TiO5复合光催化剂的制备方法及其用途与制造工艺
- 一种可调控亚甲基蓝单体释放速度的羟基磷灰石/单宁酸复合颗粒的制备方法与制造工艺
- 基于聚腺嘌呤‑亚甲基蓝电化学传感器检测铜离子的方法与制造工艺
- 一种利用紫外‑可见分光光度法同时测定溶液中亚甲基蓝和二价铜离子的三波长光谱方法与制造工艺