减少离子交换色谱中的pH漂移的制作方法与工艺
减少离子交换色谱中的pH漂移相关专利申请的交叉引用本申请要求2012年2月14日提交的美国临时专利申请号61/598,706的优先权,该文通过引用纳入本文。发明背景在离子交换色谱中可能出现流出物pH的瞬时变化。这些变化有时称为“pH漂移”或“pH转变”并且可能是意料之外且不受控制的。在一些条件下,即使进入色谱柱的溶液的pH与柱平衡溶液的pH相同,仍可能在离子交换体系中发生显著的pH漂移。这种现象描述于,例如Ghose等,Biotechnol.Prog.18:530-537(2002)。Pabst和Carta,J.ChromatographyA1142:19-31(2007)也描述了这种现象,注意到当固定相含有弱酸基团时,即使流动相经缓冲并且缓冲物质不与固定相互相作用,离子交换柱中在平衡和盐洗脱期间仍会发生不受控制的pH转变。部分由于pH漂移,此前在阳离子交换色谱中基本不可能产生共线的pH/电导梯度。在阳离子交换剂上,一旦加入氯化钠,pH就下降。根据缓冲物质的选择和浓度、交换剂的电荷特征、以及引入的氯化钠浓度,在pH正常化之前可能需要许多柱体积的缓冲液。pH的增加不与电导率平行,由于电导率从梯度开始时就线性上升。这造成了异常的洗脱曲线,其能够明显降低分离的质量。也在阴离子交换色谱中观察到相应的现象,其中在增加的盐梯度中pH初始以异常的非线性方式升高。本文所述的方法解决了这些和其他问题。
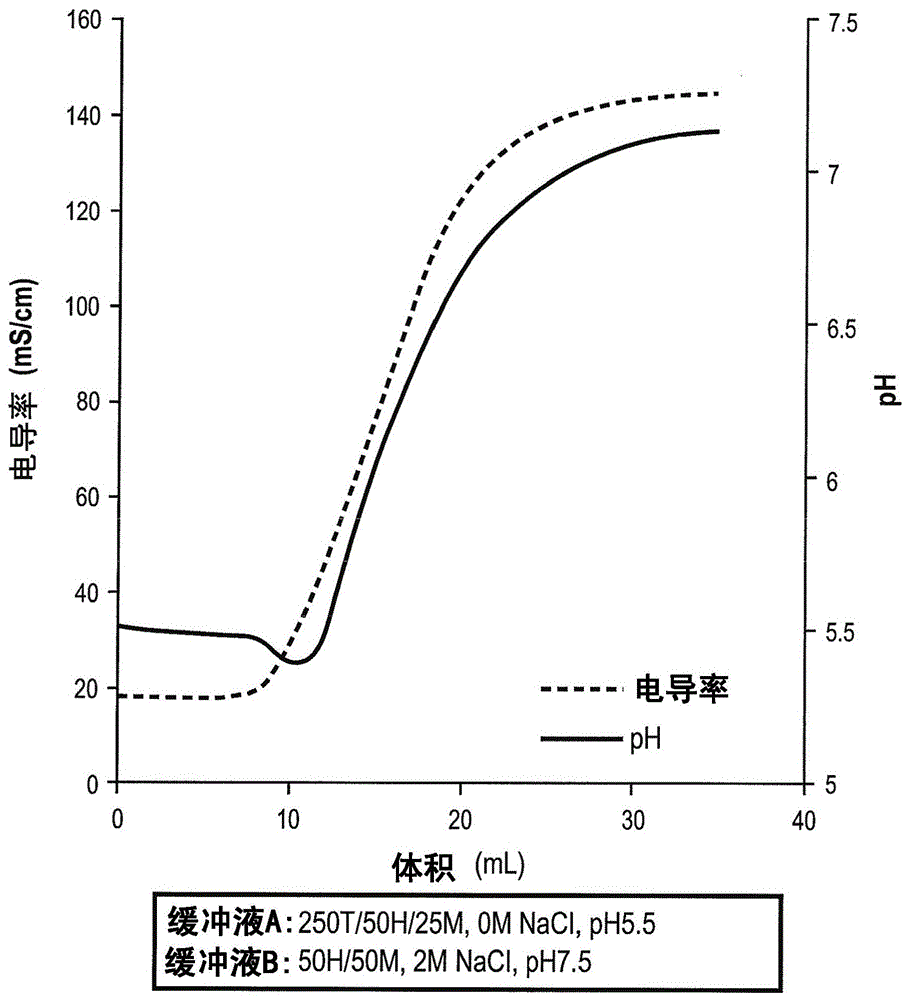
技术实现要素:
在一个方面,提供了在具有缔合的氢离子或氢氧根离子的带电荷固体支持物上抑制非受控pH漂移的形成的方法。在一些实施方式中,该方法包含:将固体支持物与包含所带电荷与固体支持物的净电荷相反的置换抗衡离子的溶液接触,从而取代与带负电固体支持物缔合的氢离子,或取代与带正电固体支持物缔合的氢氧根离子;并且随后从固体支持物上洗脱目标分子,其中所述洗脱包括提高与固体支持物接触的洗脱液的电导率。在一些实施方式中,该方法包含:将固体支持物与包含所带电荷与固体支持物的净电荷相反的置换抗衡离子的溶液接触,从而取代与带负电固体支持物缔合的大多数氢离子,或取代与带正电固体支持物缔合的大多数氢氧根离子;并且从固体支持物上洗脱目标分子,其中所述洗脱包括提高与固体支持物接触的洗脱液的电导率。在一些实施方式中,在接触之前,固体支持物与以下缓冲液缔合:平衡缓冲液;洗涤缓冲液;和/或上样缓冲液。在一些实施方式中,固体支持物是阳离子交换支持物并且所述平衡缓冲液具有4-7的pH。在一些实施方式中,固体支持物是阴离子交换支持物并且所述平衡缓冲液具有6.5-9的pH。在一些实施方式中,固体支持物包含负电荷并且氢离子与负电荷缔合。在一些实施方式中,固体支持物是阳离子交换固体支持物。在一些实施方式中,固体支持物是具有阳离子交换功能的混合式固体支持物。在一些实施方式中,具有阳离子交换功能的混合式固体支持物还包含疏水性功能。在一些实施方式中,置换抗衡离子是选自胺、胺衍生物、Tris和组氨酸的带正电分子。在一些实施方式中,置换抗衡离子的浓度为约100-约500mM。在一些实施方式中,固体支持物包含正电荷并且氢氧根离子与正电荷缔合。在一些实施方式中,固体支持物是阴离子交换固体支持物。在一些实施方式中,固体支持物是具有阴离子交换功能的混合式固体支持物。在一些实施方式中,具有阴离子交换功能的混合式固体支持物还包含疏水性功能。在一些实施方式中,置换剂是选自谷氨酸、天冬氨酸、磷酸盐和柠檬酸盐的带负电分子。在一些实施方式中,置换抗衡离子的浓度为约100-约500mM。在一些实施方式中,洗脱还包含特意改变洗脱溶液的pH。在一些实施方式中,洗脱不显著改变洗脱溶液的pH。在一些实施方式中,固体支持物包含与氢离子缔合的负电荷并且洗脱还包含提高洗脱溶液的pH。在一些实施方式中,固体支持物包含与氢氧根离子缔合的正电荷并且洗脱还包含降低洗脱溶液的pH。在一些实施方式中,包含置换抗衡离子的溶液还包含两性离子缓冲液。在一些实施方式中,所述缓冲液是两性离子缓冲液。在一些实施方式中,固体支持物包含负电荷并且缓冲液是带负电的缓冲液。在一些实施方式中,固体支持物包含正电荷并且缓冲液是带正电的缓冲液。在一些实施例中,目标分子是生物分子。在一些实施例中,生物分子是蛋白。在一些实施方式中,所述蛋白质是抗体。附图简要说明图1显示了从实施例1的方法中得到的pH和电导率的变化。图2显示了从实施例2的方法中得到的pH和电导率的变化。图3显示了从实施例3的方法中得到的pH和电导率的变化。定义“抗衡离子置换剂”是指所带电荷与加载其的色谱介质的净电荷相反的化学试剂,其中所述抗衡离子置换与带电荷离子交换固体支持物缔合的氢离子或氢氧根离子。抗衡离子置换剂可以是缓冲离子或通常不被认为是缓冲离子的离子。例如,在带净负电的色谱支持物的情况中,抗衡离子置换剂可以是诸如Tris、咪唑、组氨酸或组胺的阳离子缓冲液,但是也可以包括通常不用作缓冲剂的诸如赖氨酸或精氨酸的阳离子物质。抗衡离子置换剂可以具有单一正电荷(例如,诸如Tris或咪唑),或超过一个的正电荷(例如,诸如组胺、组氨酸、赖氨酸或精氨酸)。其也可以包括一个或多个负电荷,只要抗衡置换剂上的净电荷是正的(与带净负电的色谱支持物一起使用)。与带净负电的色谱支持物一起使用的抗衡离子置换剂也可以包括超过两个正电荷。在带净正电的色谱支持物的情况中,抗衡离子置换剂可以是诸如乙酸盐、磷酸盐、柠檬酸盐或硼酸盐的阴离子缓冲液,但也可以包括通常不用作缓冲剂的阴离子物质。抗衡离子置换剂可以具有单一负电荷(例如,诸如乙酸盐),或超过一个的负电荷(例如,诸如磷酸盐或柠檬酸盐)。抗衡离子置换剂也可以包括超过两个负电荷。抗衡离子置换剂也可以包括一个或多个正电荷,只要抗衡置换剂上的净电荷是负的(与带净正电的色谱支持物一起使用)。“抗体”是指免疫球蛋白、其复合或其片段形式。该术语可以包括但不限于衍生自人或其它哺乳动物细胞系的IgA、IgD、IgE、IgG和IgM类的多克隆或单克隆抗体,包括天然或遗传修饰的形式,如人源化、人、单链、嵌合、合成、重组、杂交、突变、接枝和体外产生的抗体。“抗体”也可以包括复合形式,其包括但不限于含有免疫球蛋白部分的融合蛋白。“抗体”也可包括抗体片段,如Fab、F(ab')2、Fv、scFv、Fd、dAb、Fc和其它组成,无论它们是否保留抗原结合功能。“混合式色谱支持物”是指采用多种化学机制来吸收蛋白或其它溶质的固相色谱支持物。固相可以是多孔颗粒、无孔颗粒、膜或整体件。示例包括但不限于利用阳离子交换(例如,其中支持物是带负电的)和疏水相互作用的组合的色谱支持物以及利用阴离子交换(例如,其中支持物是带正电的)和疏水相互作用的组合的色谱支持物。“目标生物分子”是指生物分子或生物来源的分子,用于按照本发明的方法的纯化。目标分子包括但不限于蛋白质或核酸(例如,RNA或DNA)。蛋白质的例子包括但不限于抗体、酶、生长调节物、凝血因子和磷蛋白。“生物分子制品”和“生物样品”是指含有需要纯化的生物来源的目标分子(“生物分子”)的任意组合物。在一些实施方式中,待纯化的目标分子是抗体或非抗体蛋白。发明详述I.引言在本文中已经发现并描述了用于避免离子交换色谱中pH漂移的方法。该方法包括在洗脱之前置换离子交换固体支持物上的氢离子或氢氧根离子(取决于固体支持物上的电荷)。通过在洗脱之前置换氢离子或氢氧根离子(其造成pH漂移),随后进行包括提高电导率(和离子强度)的洗脱可以没有明显的pH漂移。可以使用包含置换抗衡离子的溶液来置换氢离子或氢氧根离子,例如,所带电荷与待置换的氢离子或氢氧根离子相同(正或负)的抗衡离子。例如,在阳离子交换剂(例如,带负电离子交换固相支持物)和具有阳离子交换功能的混合式支持物的情况中,带正电的氢离子通常与固体支持物上的负电荷缔合。可以通过用带正电置换抗衡离子接触固体支持物来置换氢离子,从而在洗脱之前从固体支持物上洗下大多数的氢离子。在使用阴离子交换剂的情况中,固体支持物会与氢氧根离子缔合并且可以通过带负电的置换抗衡离子来置换这些氢氧根离子。在各情况中(阳离子或阴离子交换),改变pH的离子(分别是氢离子或氢氧根离子)原本会被释放产生非受控pH漂移,因为抗衡离子已经取代了这些改变pH的离子,随后的包括提高电导率的洗脱条件不会导致明显的pH漂移。相反,如果没有如上述使用初始置换抗衡离子,则观察到显著的pH漂移(潜在变化2个pH单位或更多)。通过如本文所述改善pH控制,可能形成相对没有异常pH漂移的电导率梯度。这适用于目标是实施恒定pH下的电导率梯度的情况,或者目标是实施与受控制pH变化同时发生电导率梯度的情况,包括pH与电导率变化同时上升或下降。II.方法本文提供的方法通常提供至少两个步骤:(1)氢离子或氢氧根离子置换步骤和(2)随后洗脱目标分子。在一些实施方式中,离子置换步骤包括在合适的缓冲液存在下用置换抗衡离子接触固体支持物,使得在洗脱之前中和通过置换抗衡离子释放的氢离子或氢氧根离子。会理解可以在这两个步骤之前,期间或之间实施额外的步骤。通过提供初始的置换溶液,包括提高电导率的随后的洗脱不会导致pH漂移。否则会发生的显著pH漂移可以包括,例如其中色谱输出溶液与输入溶液具有超过0.1、0.2、0.3、0.5、0.75、0.9、1、1.5或2个pH单位差异的那些情况。A.氢离子或氢氧根离子置换如上述,具有阳离子交换功能的色谱固体支持物通常具有大量与带负电支持物缔合的氢离子。相似地,具有阴离子交换功能的色谱固体支持物通常具有大量与带正电支持物缔合的氢氧根离子。本文所述的方法用抗衡离子基本置换了氢离子或氢氧根离子,该抗衡离子不显著影响与固体支持物接触的溶液的pH。在一些实施方式中,抗衡离子比氢离子或氢氧根离子对固体支持物具有更强的亲和力。虽然原理是相同的,为了解释的目的,下面分别描述了阳离子交换和阴离子交换功能。通过提供初始的氢离子置换缓冲液(或当使用阴离子交换时氢氧根离子置换缓冲液),可能在电导率梯度的过程中保持相对强的pH控制。在固体支持物具有阳离子交换功能的情况中,带正电的氢离子与支持物缔合。为了置换氢离子,置换抗衡离子也带正电以与氢离子竞争结合固体支持物。在一些实施方式中,置换抗衡离子可以是阳离子缓冲液。示例性的阳离子缓冲液包括,例如,Tris、咪唑、组氨酸或组胺。其他可能的阳离子置换抗衡离子可以包括一般不被认为是缓冲剂的试剂。示例包括但不限于赖氨酸或精氨酸。如从上述所列抗衡离子中看到,置换抗衡离子可以具有单一正电荷(例如,诸如Tris或咪唑),或超过一个的正电荷(例如,诸如组胺、组氨酸、赖氨酸或精氨酸)。在一些实施方式中,使用的具有阳离子交换功能的抗衡离子可以包括一个或多个负电荷,只要离子的净电荷是正的。抗衡离子置换剂也可以包括超过两个正电荷。例如,可以采用亚精胺,或聚阳离子(例如,聚乙烯亚胺)作为氢离子置换抗衡离子。氢离子置换抗衡离子的浓度可以变化。在一些实施方式中,置换抗衡离子的浓度是,例如5-1000mM,例如5-500mM、50-300mM、200-400mM、100-200mM等。可以基于使用的具体固体支持物和抗衡离子来确定其他的浓度。例如,在抗衡离子是聚离子(每个分子具有超过一个电荷)的实施方式中,抗衡离子的浓度通常可以更低。在一些实施方式中,聚离子抗衡离子的浓度为,例如0.1-10%,或0.5-5%,或1-3%。可以通过例如pH漂移的消除或明显减少确定大多数或更多缔合的氢离子或氢氧根离子的置换。例如,在氢离子或氢氧根离子置换之后,在提高电导率条件下,来自固体支持物的流出物的pH应该与输入溶液基本相等。因此,在一些实施方式中,在提高电导率条件下(例如,梯度或分阶洗脱),输入和流出物相差不超过例如0.1、0.2、0.3、0.5、0.75、0.9、1、1.5或2个pH单位。包含氢离子置换抗衡离子的溶液可以被调至任意pH。然而,在许多实施方式中,包含置换抗衡离子的溶液的pH会低于pH7,并且有时低于pH6或5或者甚至低于4。例如,在一些实施方式中,包含置换抗衡离子的溶液具有4-7的pH。在固体支持物具有阴离子交换功能的情况中,带负电的氢氧根离子与支持物缔合。为了置换氢氧根离子,置换抗衡离子也带负电以与氢氧根离子竞争结合固体支持物。在一些实施方式中,置换抗衡离子可以是阴离子缓冲液。示例性的阴离子缓冲液包括,例如,乙酸盐、磷酸盐、柠檬酸盐、甲酸盐、琥珀酸盐、苹果酸盐或乳酸盐。其他可能的阴离子置换抗衡离子可以包括一般不认为是缓冲剂的试剂,诸如谷氨酸或天冬氨酸。在一些实施方式中,使用的具有阴离子交换功能的抗衡离子可以包括一个或多个正电荷,只要离子上的净电荷是负的(例如,包括谷氨酸和天冬氨酸)。抗衡离子置换剂也可以包括超过两个负电荷。例如,海藻酸、角叉菜胶、羧甲基纤维素或羧甲基葡聚糖可以用作氢氧根离子置换抗衡离子。这最后一类的应用会降低实现相同置换所需的浓度。因为它们的大小,它们每摩尔包含多得多的置换能力。因此,例如,虽然300mM的乙酸盐可以置换一定量的氢氧根离子,只要10-50mM的海藻酸就可以产生相同的氢离子置换。氢氧根离子置换抗衡离子的浓度可以变化。在一些实施方式中,置换抗衡离子的浓度为,例如100-500mM,例如200-400mM等。可以基于使用的具体固体支持物和抗衡离子来确定其他的浓度。在阴离子交换功能固相上的应用通常会在高pH下开始。它们可以洗脱至较低的pH。在一些实施方式中,固相被平衡至6.5-8.5的pH。用阴离子抗衡离子置换剂的预洗脱处理去除了在柱平衡期间积累的大多数氢氧根离子并且防止不受控制的正pH漂移。在一些实施方式中,操作pH的范围为6-8,但是可以在4-9或更大的范围内。在一些实施方式中,包含置换抗衡离子的溶液也包含缓冲剂(或在置换抗衡离子本身也是缓冲剂的情况下包含第二缓冲剂)。在一些实施方式中,所述缓冲剂是两性离子缓冲剂。示例性的两性离子缓冲剂包括,但不限于MES或HEPES。缓冲剂可以作用为保持溶液的pH并且其浓度通常但并不总是比置换抗衡离子的浓度低。在一些实施方式中,两性离子缓冲剂的浓度为20-50mM。在一些实施方式中,缓冲剂的浓度为置换抗衡离子的摩尔浓度的1/20-1/5。例如,在一些实施方式中,置换抗衡离子的浓度为约300mM并且缓冲剂的浓度为约30mM。使用多种缓冲物质可有助于,例如产生具有跨度超过1个pH单位的线性pH梯度。例如,可以选择两种缓冲组分,使得一种的pKa在梯度的最低pH之上不超过0.5个pH单位,而另一种缓冲剂的pKa在梯度的最高pH之下不超过0.5个pH单位。另外,在一些实施方式中,缓冲剂pKa之间的最大实际间隔不超过1个pH单位。与该方法一致,如果pH间隔的跨度为3个pH单位,则可以使用三种或更多种缓冲物质。在缓冲剂具有多重pKa的情况中,单个缓冲剂可以作用为多个缓冲物质。在一些实施方式中,用于产生pH梯度的缓冲剂(例如,在用于置换氢离子或氢氧根离子的置换抗衡离子以外的)都是一种离子类型,例如,全部都是两性离子。如上述,置换抗衡离子步骤之前可以有其他步骤。在一些实施方式中,在置换抗衡离子步骤之前,平衡固体支持物周围的化学环境。在一些实施方式中,可以平衡混合式支持物以建立合适的pH、导电率和/或盐浓度。例如,通过将含有合适试剂的平衡缓冲液流过固体支持物(例如,流过柱)来建立支持物的平衡。平衡缓冲剂可包括但不限于MES、HEPES、BICINE、咪唑和Tris。例如,在一些实施方式中,缓冲剂与上述溶液中的(例如,两性离子)缓冲剂相同。在一些实施方式中,平衡溶液可以包含至少一些盐(例如,10、50、100mM等的氯化钠)。在一些实施方式中,平衡溶液的pH与抗衡离子置换溶液的pH基本相等。B.洗脱在置换固体支持物上的氢离子或氢氧根离子之后,可以洗脱目标分子。如上述,洗脱可以立即发生在置换之后或者间插步骤可以发生在洗脱之前。然而,为了获益于置换步骤,间插步骤应该不产生大量的氢离子或氢氧根离子在固体支持物上的缔合。洗脱会包含在与固体支持物接触的溶液中电导率(离子强度)的提高(例如,有或没有作为洗脱过程部分的pH变化)。洗脱可以包括,例如电导率梯度、电导率中的一个或多个阶梯升高等。另外,如果需要,可以改变洗脱溶液的pH(例如,相比平衡条件升高或降低)。在一些实施方式中,洗脱缓冲液含有电中性(非离子或两性离子)改性剂以调节氢键和/或疏水相互作用(脲、非离子型表面活性剂、两性离子表面活性剂、二元醇类、醇类)。在洗脱过程初始开发时,运行一个或多个电导率和/或pH梯度可有助于确定最优的洗脱条件。随后可以在最优洗脱条件下更方便和高效地运行分级梯度。C.任选的额外步骤本发明可与其它纯化方法联用以实现更高水平的纯化。示例包括,但不限于,其它常用于生物分子纯化的方法,如蛋白A(当纯化抗体时)和其它形式的亲和色谱、阴离子交换色谱、磷灰石色谱(例如,羟基磷灰石和氟磷灰石)、阳离子交换色谱、疏水相互作用色谱、固化金属亲和色谱和另外的混合式色谱方法。其它的选项包括但不限于沉淀、结晶和/或液体分配方法。D.示例性的离子交换和混合式固体支持物通常,任意具有离子交功能的离子交换或非磷灰石混合式固相预期在上述的方法中发挥作用。在一些实施方式中,固相包含阳离子交换功能。阳离子交换部分是带负电的并且对带正电的多肽生物分子有选择性。根据需要的电荷特征,本领域技术人员可以选择合适的阳离子交换部分。阳离子交换部分的非限制性示例包括羧基、磺基和磷酸基(phospo)部分。示例性的阳离子交换部分见述于,例如美国专利公开号US2009/0270596。示例性的市售可得的阳离子交换支持物包括但不限于UNOsphereSTM(伯乐实验室公司(Bio-RadLaboratories))、CaptoSTM(GE医疗集团(GEHealthcare))、FractogelSEHicapTM(M)(默克公司(MerckKGaA))、CMCeramicHyperDTM(颇尔公司(PALL))。一组示例性的混合式支持物包括阳离子交换功能,其可以通过额外的化学特征而强化,这些特征赋予参与一个或多个以下类型的相互作用的能力:阴离子交换、疏水相互作用、亲水相互作用、氢键、π-π键和金属亲和力。示例性的市售可得的具有阳离子交换功能的混合式支持物包括但不限于CaptoMMCTM(GE医疗集团)和NuviaTMcPrimeTM(伯乐实验室公司)。在一些实施方式中,固相包含阴离子交换功能。阴离子交换部分是带负电的并且对带负电的多肽生物分子有选择性。根据需要的电荷特征,本领域技术人员可以选择合适的阴离子交换部分。阴离子交换部分的非限制性示例包括二乙基氨基乙基、二乙基甲基氨基乙基、二乙基-[2-羟丙基]氨基乙基、烯丙胺季胺(allylaminequaternaryammonium)、聚烯丙胺、聚乙烯亚胺、吡啶和吡啶基衍生物部分。示例性的市售可得的具有阴离子交换功能的混合式支持物包括但不限于UNOsphereQTM、CaptoQTM、FractogelTMAE和QCeramicHyperDTM。另一组示例性的混合式支持物包括阴离子交换功能,其可以通过额外的化学特征强化,这些特征赋予参与一个或多个以下类型的相互作用的能力:阳离子交换、疏水相互作用、亲水相互作用、氢键、π-π键和金属亲和力。示例性的市售可得的阴离子交换支持物是CaptoAdhereTM(GE医疗集团)。IV.目标生物分子本发明提供了在结合-洗脱条件下从生物样品中纯化目标生物分子的方法。目标生物分子可以包括可使用离子交换色谱纯化的任意生物分子。目标生物分子的例子包括但不限于蛋白(例如,抗体、非抗体治疗性蛋白、酶、生长调节因子和凝血因子)。在一些实施方式中,目标分子是抗体或抗体片段。在一些实施方式中,抗体是IgG、IgM、IgA、IgD或IgE。在一些实施方式中,目标生物分子是Fc-融合蛋白。在本发明中使用的抗体制品能包含来自天然、合成或重组来源的未纯化的或部分纯化的抗体。未纯化的抗体制品能够来自多个来源,包括但不限于血浆、血清、腹水、乳品、植物提取物、细菌裂解液、酵母裂解液或经调理细胞培养基。部分纯化的制品可以来自已由至少一种层析、沉淀、其它分离步骤或前述的任意组合处理的未纯化制品。在本文所述的方法中可以使用任何抗体制品,其包括来自天然、合成或重组来源的未纯化或部分纯化的抗体。未纯化的抗体制品可来自多种来源,包括但不限于血浆、血清、腹水、乳品、植物提取物、细菌裂解液、酵母裂解液或经调理细胞培养基。部分纯化的制品可来自已由至少一种层析、沉淀、其它分级分离步骤或前述的任意组合处理的未纯化制品。在一些实施方式中,在纯化前,抗体还未经蛋白A亲和纯化。实施例实施例1用50mMMES,100mMNaCl,pH6.0平衡NuviaTMcPrimeTM(伯乐)柱,柱中包含由单体3-烯丙氧基-1,2-丙二醇、乙烯基吡咯烷酮聚合并用N,N’-亚甲基双丙烯酰胺交联的多孔大基质,基质连有配体对氨基马尿酸。以pH约6且电导率约生理水平(约12mS/cm)加载抗体样品。用两个柱体积(CV)平衡缓冲液洗涤柱。通过用由乙酸调至pH5.5的30mMMES,300mMTris再平衡色谱支持物,从而用Tris离子取代柱表面上的氢离子来取代氢离子。用10CV线性梯度至100mMHepes,2MNaCl开始洗脱。参见图1。因为氢离子已经被消除,当引入NaCl时pH并不降低,并且pH随着电导率线性升高。实施例2用由乙酸滴定至pH5.5的250mMTris,50mMHEPES,25mMMES(电导率约12mS/cm)平衡NuviaTMcPrimeTM(伯乐)柱,柱中包含由单体3-烯丙氧基-1,2-丙二醇、乙烯基吡咯烷酮聚合并用N,N’-亚甲基双丙烯酰胺交联的多孔大基质,基质连有配体对氨基马尿酸。通过按比例混合上述的梯度起始缓冲液和配制为50mMMES,50mMHEPES,2MNaCl,pH7.5的梯度结束缓冲液形成线性梯度。这产生了约0.07个pH单位的初始下降pH漂移并且在约2.5个柱体积内恢复初始pH,之后pH和电导率平行升高。参见图2。可以通过升高Tris的浓度来消除pH漂移的幅度和持续时间。参见实施例3。由于升高Tris浓度会提高电导率,应该考虑具体目标分子耐受电导率提高的能力。实施例3用滴定至pH5.5的1000mMTris,50mMMES,50mMHEPES平衡NuviaTMcPrimeTM(伯乐)柱,柱中包含由单体3-烯丙氧基-1,2-丙二醇、乙烯基吡咯烷酮聚合产生并用N,N’-亚甲基双丙烯酰胺交联的多孔大基质,基质连有配体对氨基马尿酸。通过按比例混合上述的梯度起始缓冲液和配制为50mMMES,50mMHEPES,2MNaCl,pH7.5的梯度结束缓冲液形成线性梯度。这基本没有产生下降的pH漂移并且pH和电导率基本平行上升。参见图3。应理解,本文所述的实施例和实施方式仅用于说明目的,本领域技术人员应了解据此作出的各种修饰或改变,且它们包括在本申请的主旨和权益以及所附权利要求书的范围内。本文引用的所有发表物、专利和专利申请通过引用全文纳入本文以用于所有目的。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1