向带电基质中、在带电基质中和/或从带电基质中主动转运带电分子的制作方法
本申请要求2014年4月4日提交的名称为“Active Transport of Charged Molecules,into,Within,and/or from Charged Matrices”的美国临时专利申请序列号61/975,575的权益,其通过引用整体并入本文。
技术领域
提供了用于向基质中、在基质中和/或从基质中主动转运(activetransport)分子的制品(article)和方法,所述基质包括生物基质。
背景技术:
分子的转运对于生命和许多工程化系统是必要的。转运过程可以是被动的或主动的。被动转运(passive transport)的一个实例是扩散。扩散是分子从高浓度区域向低浓度区域移动的过程。在扩散中,分子通过布朗运动(Brownian motion)移动并且经历随机游走(random walk),这导致分子向低浓度方向上的净位移。主动转运过程利用能量来移动分子。在一些主动转运过程中,向包含分子的系统施加力,使得分子在力的方向上移动。尽管分子可以通过被动或主动方式转运,但是分子的主动转运对于许多应用是有利的。因此,需要用于分子的主动转运的改进的制品和方法。
发明概述
提供了用于向基质中、在基质中和/或从基质中主动转运分子的制品和方法。在一些情况下,本发明的主题涉及相关产品、特定问题的替代解决方案和/或一种或更多种系统和/或制品的多种不同用途。
在一组实施方案中,提供了制品。在一个实施方案中,制品包含电场发生器(electric field generator);能够定位在由所述发生器提供的场中的室,其中所述室的至少一部分由半透材料(semipermeable material)限定;和所述室中的样品定位器(sample positioner)。
在另一组实施方案中,提供开了方法。在一个实施方案中,方法包括使用动电场(electrodynamic field)驱动分子通过基质的至少一部分。
在另一个实施方案中,方法包括使用电场驱动分子通过带电基质的至少一部分,从而使所述基质的所述分子的浓度改变至少约10%,同时所述基质变形(deforming)的量小于10%。
在一个实施方案中,方法包括在基质的存在下使分子暴露于电场,以及使所述分子与所述基质中的结合伴侣(binding partner)缔合(associating)。
在另一个实施方案中,方法包括使用电场使分子分布到整个基质中,其中整个所述基质中所述分子的浓度的变化小于25%。
在一个实施方案中,方法包括在抑制分子的至少一部分与结合伴侣之间结合的条件下,使分子分布在包含所述分子的结合伴侣的整个基质中。
在另一个实施方案中,方法包括使用强度大于或等于10V/m的电场驱动分子通过带电基质。
在结合附图考虑时,本发明的另一些优点和新特征将通过本发明多个非限制性实施方案的以下详细描述变得明显。在本说明书和通过引用并入的文献包含冲突和/或不一致公开内容的情况下,应以本说明书为准。
附图简述
将参照附图通过举例来描述本发明的一些非限制性实施方案,所述附图是示意性的而并未旨在按比例绘制。在图中,示出的每个相同的或接近相同的组件通常由单个附图标记表示。为了清楚起见,并没有标出每幅图中的每个组件,并且在对于本领域普通技术人员理解本发明不必要示出的情况下,并没有示出本发明的每个实施方案的每个组件。在附图中:
图1A-1B示出了根据某些实施方案,(1A)在基质存在下分子的布朗运动,和(1B)分子通过扩散向基质中被动转运;
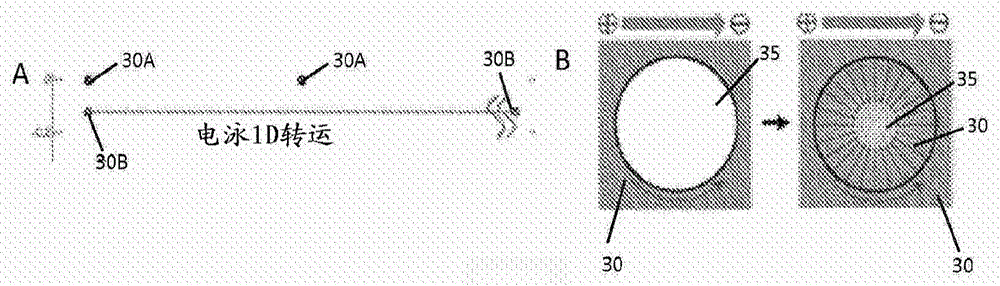
图2A-2B示出了根据一组实施方案,(2A)在基质存在下使用电场的主动转运,和(2B)分子通过电泳线性运动向基质中主动转运;
图3A-3B示出了根据某些实施方案,(3A)在基质存在下使用电场的主动转运,和(3B)分子通过电泳线性运动向基质中主动转运;
图4A-4B示出了根据一组实施方案,(4A)在基质存在下使用电场的主动转运;和(4B)分子通过电泳随机游走向基质中主动转运;
图5A-5C示出了根据某些实施方案,使用电场使(5A)分子向基质中注入(infusion),(5B)分子从基质中移出,和(5C)分子分布在基质中;
图6A-6B示出了根据一组实施的方案,(6A)分子与具有分子的结合伴侣的基质缔合,和(6B)在某些条件下,分子在具有分子的结合伴侣的基质中分布和缔合;
图7示出了根据一组实施方案,用于分子的电泳运动的制品;
图8A-8F示出了根据某些实施方案,用于电泳随机游走的方法和制品;
图9A-9F示出了根据某些实施方案,在抑制或促进分子与结合伴侣的缔合的条件下用于电泳随机游走的方法和制品;以及
图10A-10G示出了根据一组实施方案,(10A-10D)免疫染色分子向脑组织中主动转运,和(10E-10G)厚脑样品的免疫染色;
图11A-11C示出了根据某些实施方案,(11A)用于分子的电泳运动的制品,(11B)五小时后使用静态电转运清理(clear)的脑和通过随机电转运清理的脑,和(11C)使用静态电转运清理的脑、使用随机电转运清理的脑和使用被动扩散清理的脑;
图12A-12B示出了根据一组实施方案,(12A)经受SYTO 16、Dylight 594缀合的番茄凝集素和Alexa 647缀合的抗组蛋白H3抗体的电泳运动的脑,和(12B)经受SYTO 16、Dylight 594缀合的番茄凝集素和Alexa 647缀合的抗组蛋白H3抗体的被动运动的脑;
图13A-13B示出了根据某些实施方案,(13A)用于间接免疫组织化学的方案和(13B)全脑免疫染色后小鼠脑的腹侧被盖区(ventral tegmentalarea)的3D渲染(3D rendering)。
发明详述
一般性描述了用于向基质中、在基质中和/或从基质中主动转运分子的制品和方法。在一些实施方案中,电场可用于改变分子相对于基质的位置。电场可用于使分子移动到基质中的新位置、从基质中移出分子或使分子注入到基质中。例如,电场可用于使在基质中具有结合伴侣的分子移动到所述结合伴侣附近或离开所述结合伴侣附近。在一些实施方案中,可以通过使分子暴露于动电场改变分子的位置。在这样的一些实施方案中,相对于常规分子转运方法,并且在一些情况下,相对于暴露于静电场的分子,暴露于动态电场的分子可具有增强的迁移率和最小的不利基质相互作用。本文中所述的主动转运方法和制品可特别好地适用于多种应用,包括组织学、生物学和药学应用。
科学和技术中的多种应用需要向基质中、在基质中或从基质中转运分子。用于相对于基质定位分子的常规方法通常依赖于被动转运方法,例如扩散。但是,分子的被动转运可能相对缓慢,并且对于许多应用,使用被动转运方法不能在必要的时间框架(timeframe)中实现相对于基质的期望分子排布。图1A-1B中示出了被动转运的一个实例。图1A示出了分子20(例如,20A和20B)向基质中扩散。由于分子通过扩散的运动是基于碰撞的,分子进行小的随机运动,并且两个分子的净位移相对较小。因此,如图1B中所示,分子20随时间向基质25的渗透相对最小并且分子积累在基质的表面。
被动转运的替代方式是主动转运。常规主动转运方法通常依赖于向含有分子和基质的系统施加力(例如,水动力(hydrodynamic force))。力可导致分子在力的方向上迁移,使得分子在力的方向上的净位移与力的强度成正比。然而,许多常规主动转运系统受到能够产生的力的大小和/或力对分子和/或基质的影响的限制。例如,在一些实施方案中,高于某阈值的力和/或基质长时间暴露于力可不利地影响基质。
已经发现,在本发明某些实施方案的情况下,可使用电场实现分子向基质中、在基质中和/或从基质中迅速转运而不会不利地影响分子和/或基质。在一些实施方案中,可以以诱导非常规电泳运动的方式向分子施加电场,使得分子的净位移相对于某些常规技术增强。不受理论的限制,在某些实施方案中,认为本文中所述制品和方法可用于通过电泳随机游走诱导分子运动,其模拟布朗运动,但是导致相对大的分子净位移。
图2-4中示出了本文中所述的使用电场的分子主动转运的实例。在一些实施方案中,带电分子30(例如,30A和30B)可暴露于静电场,如图2A-2B中所示。带电分子30(例如,30A和30B)所经受的静电场可诱导分子在静电场方向上的电泳运动。如图2A中所示,在电场中,具有较高电荷密度的分子30B可比具有较小电荷密度的分子30A移动得更快。在这样的一些实施方案中,如图2A-2B中所示,电场可以是1维的,带电分子可以在静电场方向上线性移动。如图2B中所示,在某些实施方案中,分子30可在场方向(如箭头所示)上迅速分布在基质35中,而不会不利地影响分子和/或基质和分子。在这样的一些实施方案中,分子可以相对均匀地分布到整个基质中。例如,分子可以分布到整个基质中,使得整个基质的分子浓度变化小于或等于约25%(例如,小于或等于约20%、小于或等于约15%、小于或等于约10%、小于或等于约5%)。在另一个实施方案中,电场可用于驱动分子通过带电基质的至少一部分,使得基质中的分子浓度改变至少约10%(例如,至少约75%),但是基质的横截面尺寸的变化或任何其他变形小于10%。在一些实施方案中,使用静态电场使分子向基质中、在基质中和/或从基质中主动转运可很好地适用于不带电基质和具有相对低电荷密度的基质等基质。
在另一些实施方案中,如图3A中所示,基质45(例如,生物系统)可具有相对高的电荷密度,以使基质所经受的静电场诱导如图3A中所示分子40(例如,分子40A和40B)和如图3B中所示基质45的电泳运动。在某些实施方案中,带电基质的电泳运动可比带电分子的电泳运动显著更慢,使得分子的至少一部分被驱动进入高度带电的基质。在一些实施方案中,如图3B中所示,高电荷基质持续暴露于静电场可造成基质的横截面尺寸改变和/或基质的其他变形。在一些实施方案中,非传统电泳方法和制品可用于使分子向基质中、在基质中和/或从基质中移动,而不会不利地影响分子和/或基质和分子。
在一些实施方案中,如图4B中所示,可使用动电场驱动分子通过基质(例如,高度带电基质)的至少一部分,而不会不利地影响分子和/或基质。例如,具有高电荷密度的基质55可暴露于具有至少一种动态特性(例如,作为时间的函数变化的方向和/或强度)的电场。在这样的一些实施方案中,可避免由于电场和/或带电分子的流动使带电基质在单方向上经受持续和显著的力。基质上应力的降低显著降低了基质的变形。这可以是这样的情况,例如,带电基质由于施加场而移动,但是由于其相互连接性,基质不能像基质中相对未连接的分子移动的那么多。当电场相对于基质变化(例如,场的方向变化)时,相对于更加相互连接的基质,通常更广泛地驱动分子。随着时间的净效应是分子比基质显著更广泛地迁移(有时贯穿整个基质),而基质经历少得多的总净运动,有时基本上没有净运动。例如,动电场可用于驱动分子通过相对高度带电基质的至少一部分,使得基质中的分子浓度改变至少约10%(至少约75%),但是基质横截面尺寸的变化小于或等于约10%(例如,小于或等于约3%)。
在一些实施方案中,动电场可造成分子50经历电泳随机游走,如图4A中所示。电泳随机游走可至少部分地由以下事实造成:随着电场方向相对于基质改变,以不同方向推动(urge)基质中的带电分子。这与一些基质中可存在的固有随机路线(类似于包含孔隙(void)和更刚性区域的泡沫中的通道)相结合,导致分子采取半随机或随机、非线性、变化的、可能扭曲的运动路线。不受理论的约束,认为分子通过电泳随机游走移动的净位移与电迁移率和电场乘积大小的二次方成比例,而电泳线性运动与电迁移率和电场乘积大小线性地成比例。这种二次方依赖性选择性地加强了仅自由移动的具有高电迁移率的带电分子的迁移,而抑制具有低电迁移率的带电基质的运动。例如,在游离带电分子具有比基质束缚的分子高三个数量级的电迁移率的一个实施方案中,在诱导带电分子1mm位移的条件下,束缚的分子在动电场中仅移动1nm(通过电泳随机游走),在静电场中为1μm(例如,通过电泳线性运动)。因此,认为动电场可用于提高分子向基质中、在基质中或从基质中转运的速率。
本文中使用的术语“静电场”和“静态电场”具有其在本领域中的普通含义,可指不作为时间的函数改变的非零电场。相反地,术语“动电场”和“动态电场”具有其在本领域中的普通含义,可指具有至少一种作为时间的函数改变的特性的电场。通常来说,所述特性可以是电场强度、电场方向、电场频率或基质在静态电场中的运动,或者同时两种或更多种特性,但是也包括可以导致动电场的其他电场变量特征。在一些实施方案中,电场的形状可以改变以产生动电场。电场的可以以允许电场“聚焦”于目标区域的方式“成形(shaped)”。例如,可以操纵电场的形状,使得跨越某个小的目标区域的电势差比电场中的其他周围区域的大。一般来说,可使用动电场的一个或更多个特性的任何合适的变化,只要基质经历的电场是动态的即可。在一些情况下,动电场的一个或更多个特性的变化可以是规律的、无规律的和/或随机的。在超过一种特性作为时间的函数变化的一些实施方案中,两种或更多种特性的变化可以相同或不同。在一些设置中,对动电场的可变性的贡献可包括场强度在一段或更多段时间中降低到零或零附近。
还应理解的是,本文使用的术语“静电”场和“动电”场是指当施加场时基质在大部分或全部时间点所经历的场。例如,定位在两个静止并且带相反电荷的点电荷之间的规律振荡的异质基质可被称为在动电场中并且可使用动电场转运分子。又例如,可向基质施加动电场,所述基质的运动与电场的动态特性相耦合,使得在所有时间点基质对于电场的相对位置保持相同。所述基质将称为在静电场中并且可使用静电场转运分子。在另一个实例中,由电场发生器提供的静电场中的静止基质可以称为在静电场中并且可使用静电场转运分子。在一些实施方案中,本文中所述的制品可配置成产生动态或静态电场。
图5A-5C中示出了驱动分子通过基质的至少一部分的非限制性实例。在一些实施方案中,如图5A中所示,分子60可以是在基质65的存在下。在一些实施方案中,分子的至少一部分可以在基质外部。本文中所述的电场(例如,动态、静态)可以施加于包含分子和基质的区域。电场可以造成分子的至少一部分如箭头所示扩散到基质的至少一部分中。在一些实施方案中,分子可以相对均匀地分布到整个基质中,如图5A中所示。例如,整个基质的分子浓度变化可小于或等于约25%(例如,小于或等于约20%、小于或等于约15%、小于或等于约10%、小于或等于约5%、小于或等于约3%、小于或等于约2%、小于或等于约1%)。
在一些实施方案中,如图5B中所示,分子70可以在基质75内。本文中所述的电场(例如,动态、静态)可以施加于包含分子和基质的区域。电场可以造成至少一部分分子如箭头所示从基质的至少一部分中移除。在某些实施方案中,电场可造成大百分比的分子从基质中移除。例如,在一些实施方案中,电场可用于从基质(例如,带电基质)中移除至少约50%(例如,至少约60%、至少约70%、至少约75%、至少约80%、至少约85%、至少约90%、至少约95%)的期望的带电分子。在某些实施方案中,可从基质中移除基本上所有的所述分子,如图5B中所示。
在一些实施方案中,基质85可包含均匀分布在基质内的分子80,如图5C中所示。在一些情况下,分子可以集中于基质内的一个或更多个位置,使得整个基质内的分子浓度具有相对大的变化。在这样的一些实施方案中,整个基质内的分子浓度可以相对不均匀,使得基质内的不同区域之间存在显著的浓度梯度。例如,分子可以集中于基质内部的一个位置,使得所述位置的分子浓度相对高,而基质内其他位置(例如,表面附近)的分子浓度相对低或为零。在一些实施方案中,如图5C中所示,本文中所述电场(例如,动态、静态)可以施加于包含分子和基质的区域。电场可以造成分子分布到整个基质中,使得整个基质中的分子浓度变化降低和/或相对低。例如,整个基质中的分子浓度的变化可以小于或等于约25%(例如,小于或等于约20%、小于或等于约15%、小于或等于约10%、小于或等于约5%、小于或等于约3%、小于或等于约2%、小于或等于约1%)。
一般来说,本文中所述的方法和制品可用于改变基质中的分子浓度,如图5中所示。在一些实施方案中,本文中所述的方法和制品可用于使基质的分子浓度改变至少约10%(例如,至少约20%、至少约30%、至少约40%、至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%)。在一些实施方案中,本文中所述的方法和制品可用于使基质的分子浓度改变相对大的百分比(例如,至少约75%、至少约80%、至少约85%、至少约90%或至少约95%)。在一些实施方案中,当本文中所述的方法和制品用于分别向基质中注入和/或从基质中移除分子时,可发生大的浓度变化。
在某些实施方案中,本文中所述的方法和制品可用于使基质的分子浓度改变小的百分比,例如小于或等于约25%、小于或等于约20%、小于或等于约15%、小于或等于约10%或者小于或等于约5%。在一些实施方案中,当本文中所述方法和制品用于使已在基质中的分子重排或分布时,可能发生小的分子浓度变化。
如本文中所述,在一些实施方案中,可以向基质中、在基质中或从基质中转运分子,而不会不利地影响基质。例如,带电分子可以向基质中、在基质中或从基质中移动,而不显著地改变基质的一个或更多个横截面尺寸或者基质的其他形式的变形。例如,在某一实施方案中,所述方法可以以如下量改变基质的一个或更多个横截面尺寸或者基质的其他形式的变形:小于约15%、小于约12%、小于约10%、小于约8%、小于约5%、小于约3%、小于约2%或小于约1%。例如,方法可以使用电场驱动分子通过带电基质的至少一部分,从而使基质的分子浓度改变至少约10%(例如,至少约75%),而基质变形的量小于10%(例如,小于约3%)。
在一些实施方案中,基质可包含一种或更多种待转运分子的一种或更多种结合伴侣。例如,如图6A中所示,分子90可以是在包含分子的结合伴侣100的基质95的存在下。如本文中所述,包含分子和基质的区域可以暴露于电场(例如,动态、静态)。电场可以如箭头所示造成分子的至少一部分注入到基质的至少一部分中,并且与结合伴侣缔合。
在一些实施方案中,在驱动分子通过基质的至少一部分(进入基质的至少一部分、在基质的至少一部分中和/或离开基质的至少一部分)之前和/或同时,分子和/或基质可以暴露于抑制分子与结合伴侣之间缔合的条件。例如,如图6B中所示,分子和基质110可暴露于改变分子特性(例如,电荷、分子构象)的条件(例如,pH、离子浓度、化学物质浓度),其抑制分子与结合伴侣115之间的缔合。图6B示出了在暴露于所述条件之前具有特性A的分子105-A,其在暴露于所述条件后具有特性B,因此形成了分子105-B。然后可以驱动分子105-B通过基质的至少一部分。在一些实施方案中,在转运期间抑制分子与结合伴侣的缔合可以提高转运速率和/或有利于分子在基质中分布。例如,在分子总数小于结合伴侣总数的一些实施方案中,注入到基质中的分子可在基质表面或表面附近不均衡地与结合伴侣缔合。在这样的一些实施方案中,整个基质中的分子浓度具有相对大的变化。
如图6B中所示,在转运期间使分子和/或基质暴露于抑制分子与结合伴侣之间缔合的条件可允许分子分布到整个基质中,使得整个基质中的分子浓度变化相对低(例如,小于或等于约25%)。在分子105-B已分布在基质中后,分子和/或基质可暴露于促进或不抑制分子与结合伴侣之间缔合的条件。在这样的一些实施方案中,分子105-B可形成分子105-A并且与结合伴侣缔合。在某些实施方案中,促进或不抑制缔合的条件在一些情况下可以增强分子与结合伴侣缔合的能力。
图7中示出了本文中所述用于使用电场主动转运分子的制品120的实例。在一些实施方案中,所述制品可包含电场发生器140、室125、至少一个半透材料135和样品定位器130,如图7中所示。所述室可以能够定位在由所述电场发生器(例如,两个电极,阳极和阴极)提供的场中,并且所述室的至少一部分由半透材料(例如,多孔材料、纳米多孔材料)限定,所述半透材料具有特定的截留分子量(例如,约50,000至约500,000g/mol;约100,000g/mol至约500,000;约500g/mol至约10,000g/mol)。
一般来说,可使用任何能够产生电场的合适电场发生器。在一些情况下,电场发生器包含由来自电源(power supply)的电动势(electromotive force)来源驱动的两个或更多个电极(例如,阳极和阴极)。在一些实施方案中,电场发生器可以能够产生静电场或动电场。可以使用任何提供静态或动态电场的合适方法。在一些实施方案中,可以通过在至少两个电极之间提供静态电势差来产生静电场,所述至少两个电极在该过程中不相对于基质移动。动电场可以多种方式产生。在一种中,产生场的设备的方向可以相对于基质改变。例如,用于产生场的一组电极可以通过旋转或者相对于基质的其他运动等来相对于基质移动。基质可以移动,电极可以移动,或者二者均可以移动。或者,并非所有电极都需要相对于基质移动,但是任何电极相对于基质的运动通常将改变场相对于基质的方向。在另一组配置中,电极可以不相对于基质移动,但是施加于电极的电荷的极性和/或程度可以改变。例如,基质可被若干电极围绕,每个相对基质定向不同,并且不改变相对于基质的位置。施加于电极的电动势的强度可以随时间改变,以产生随时间变化的场,并且电极之间的极性可以改变,使得场相对于基质以多种方式中的任一种移动。在另一组配置中,可以通过动态地改变基质或基质周围的流体的电阻(resistance)来产生动电场。例如,可以在电极之间注入高度黏性液体或引入气泡以提高周围流体的电阻,其有效地增强通过基质的电流。通过该描述,本领域普通技术人员将能够容易地确定这些技术中的变化和/或利用其他技术产生适于特定应用的动电场。
一般来说,室可以是能够定位在电场发生器之间的任何合适的容器,其至少一部分由半透材料限定,包围样品定位器并且保留流体。在某些实施方案中,室可以能够定位在由电场发生器提供的场中。例如,如图7中所示,室125定位在电场发生器140之间。在电场发生器包含电极的一些实施方案中,室可以能够定位在两个电极(例如,阳极和阴极)之间。在某些实施方案中,室可移动,并且可以手动或通过自动控制移动到场中。在另一些情况下,室可以是静止的并且如此定位以使室在电场发生器提供电场的区域中。
在一些实施方案中,室的至少一部分由半透材料限定。半透材料可以是选择性渗透膜。在一些实施方案中,半透材料可允许某些分子保留在室中,而允许另一些分子离开室。在这样的一些实施方案中,期望分子在室中的保留可以使实现用于给定应用的期望结果所需分子的量最小化。例如,保留用于基质染色的分子可使基质染色所需染色分子的量最小化。在一些实施方案中,保留某些分子可以允许分子均匀分布在室中和/或阻止分子与电场发生器相互作用。在一些实施方案中,半透材料135可以具有某截留分子量和/或截留尺寸,使得半透材料对于处于或高于截留分子量和/或尺寸的分子是基本上不可渗透的。例如,如图7中的插图中所示,半透材料135对于分子150可能是基本上不可渗透的,但是对于具有较小分子量和/或尺寸的另一些分子(例如,155和160)是可渗透的。在一些实施方案中,半透材料可以是多孔的。例如,半透材料可以是纳米多孔材料。
本文中使用的术语“截留分子量”具有其在本领域中的普通含义,可指大于90%的分子被半透材料保留或者大于99%的分子被半透材料保留时的最低分子量。本领域普通技术人员将意识到,半透材料保留分子的能力还依赖于分子的形状,例如在一些情况下,具有所需分子量的分子可由于其形状而不被保留。例如,具有所需分子量的线性分子可能不被保留,而具有相同分子量的球蛋白分子被保留。术语“截留尺寸”具有其在本领域中的普通含义,可指大于90%的分子被半透材料保留或者大于99%的分子被半透材料保留时的最小分子尺寸。分子的尺寸可以通过分子的分子量或分子的横截面尺寸(例如,球状分子)限定。
一般来说,可以基于待保留分子的一种或更多种特性来选择截留分子量和/或尺寸。例如,具有相对高截留分子量和/或尺寸(例如,约50,000g/mol至约500,000g/mol;约100,000g/mol至约500,000g/mol)的半透材料可用于保留具有高分子量的分子,例如抗体。在另一些实例中,具有相对低截留分子量和/或尺寸(例如,约500g/mol至约10,000g/mol;约500g/mol至约5,000g/mol;约500g/mol至约3,000g/mol)的半透材料可用于保留具有低分子量的分子,例如肽、小分子、寡聚体、引物等。在一些实施方案中,半透材料的截留分子量可以为约500,000g/mol、约350,000g/mol、约200,000g/mol、约100,000g/mol、约75,000g/mol、约50,000g/mol、约25,000g/mol、约10,000g/mol、约5,000g/mol、约3,000g/mol、约2,000g/mol、约1,000g/mol或约500g/mol。在某些实施方案中,截留分子量可以为约500g/mol至约500,000g/mol、约1,000g/mol至约500,000g/mol、约10,000g/mol至约500,000g/mol、约50,000g/mol至约500,000g/mol、约100,000g/mol至约500,000g/mol、约500g/mol至约50,000g/mol、约500g/mol至约10,000g/mol、约500g/mol至约5,000g/mol、约1,000g/mol至约50,000g/mol或约1,000g/mol至约10,000g/mol。在一些实施方案中,半透材料的截留尺寸可以是约10微米、约5微米、约3微米、约2微米、约1微米、约0.8微米、约0.6微米、约0.5微米、约0.3微米、约0.2微米、约0.1微米、约0.05微米、约0.01微米、约0.005微米、约0.001微米或约0.0005微米。在一些实施方案中,截留尺寸可以是约0.001微米至约10微米、约0.001微米至约5微米、约0.001微米至约1微米、约0.001微米至约0.5微米、约0.001微米至约0.1微米、约0.1微米至约10微米、约0.1微米至约10微米或约1微米至约10微米。
在一些实施方案中,半透材料的平均孔径可小于或等于约5微米、小于或等于约3微米、小于或等于约2微米、小于或等于约1微米、小于或等于约0.8微米、小于或等于约0.6微米、小于或等于约0.5微米、小于或等于约0.3微米、小于或等于约0.2微米、小于或等于约0.1微米、小于或等于约0.05微米、小于或等于约0.02微米、小于或等于约0.01微米或者小于或等于约0.005微米并且大于零。
在一些实施方案中,用于使用电场主动转运分子的制品还可包含样品定位器。样品定位器可以配置为容纳基质(例如,生物系统)。在一些实施方案中,样品定位器还可配置为在室中移动。所述基质可充分固定于所述样品定位器,使得基质随样品定位器移动。在某些实施方案中,样品定位器可以能够沿着限定路径振荡和/或移动。在一些实施方案中,样品定位器的运动可用于形成动电场。例如,基质(例如,生物系统)可定位在样品定位器上,并且样品定位器可旋转,使得基质经历动电场。一般来说,样品电位器可配置为产生用于形成静态或动态电场的任何合适的运动。例如,在一些实施方案中,样品定位器可连续或周期性移动。在一些实施方案中,定位器可与控制样品定位器运动的控制系统连接。
在一些实施方案中,除了上述组件以外,制品可任选地包含外室、温度控制器、混合器、缓冲液循环器、流体入口或流体出口中的一种或更多种。在一些实施方案中,制品可以包含围绕室125的至少一部分的外室。外室可包含流体。在一些情况下,外室与流体再循环系统连接,所述流体再循环系统被配制为通过一个或更多个流体入口和出口转运流体进入室或离开室。在一些实施方案中,外室和室可以通过半透材料彼此流体连通。在一些实施方案中,制品包含与外室和/或室流体连通的一个或更多个缓冲液循环器。所述缓冲液循环器可用于替换、补充或移动室(例如,外室)的至少一部分中的缓冲液。在一些实施方案中,制品可包含温度控制器。温度控制器可用于控制制品的至少一部分中的流体的温度。例如,温度控制器可用于控制外室和/或室中流体的至少一部分的温度。在一些实施方案中,制品可包含混合器,其允许一种或更多种流体在进入室之前混合和/或在一个或更多个室中混合一种或更多种流体。
在一些实施方案中,本文中所述分子可以是或包含大分子(例如,聚合物)、生物大分子、配体、多核苷酸、寡核苷酸、蛋白质、抗体、小分子(例如,有机的、无机的)、核酸、多糖或生物学分子(biologic)。在某些实施方案中,超过一种分子可以移入基质、在基质中移动或移出基质。在这样的一些情况下,分子可以是相同类型或不同类型,并且可以选自上文中提到的组。在一些实施方案中,分子可以是光致发光分子或包含光致发光分子,例如染料、荧光分子或其他光致发光分子。在其中分子是或包含染料的一些实施方案中,染料可用于体外成像。在一些实施方案中,分子可以是或包含药物活性剂(即,药物)。药物活性剂可以是任何生物活性剂。在一些实施方案中,药物活性剂可选自美国食品和药品管理局(F.D.A.)出版的“Approved Drug Products with Therapeutic Equivalenceand Evaluations”(“橙皮书”(Orange Book))。在其中分子是或包含药物活性剂(即,药物)的一些实施方案中,可以驱动药物活性剂进入基质,并且包含所述药物活性剂的基质可用于治疗应用。
在一些实施方案中,本文中所述的基质可以是或包含生物系统(例如组织、细胞)、聚合物基质(例如,交联的、未交联的)、生物衍生基质、无机基质、有机基质或其组合。在一些实施方案中,基质可以是生物基质。本文中使用的生物基质可指包含至少一个生物细胞的基质。生物细胞可以是活细胞或非活细胞(例如,原核细胞、真核细胞)。生物基质的非限制性实例包括单细胞、单细胞生物体(细菌)、多细胞生物体、细胞聚集体、生物组织或整个器官或其组合。在一些实施方案中,生物基质可以包含一种或更多种生物组织(例如,神经组织)。合适组织的非限制性实例包括结缔组织、神经组织、肌肉组织(例如,骨骼肌组织、心肌组织、平滑肌组织)和上皮组织。在一些实施方案中,生物基质可以是整个器官(例如,脑)或器官的一部分。可以部分地或整体上作为生物基质使用的器官的非限制性实例包括脑、心脏、肺、肠、胃、脾、皮肤、肝、前列腺、膀胱、胰腺、甲状腺、肾、骨骼、脊髓和眼等。在一些实施方案中,基质可以是聚合物基质。可以使用任何合适的聚合物基质。在一些情况下,聚合物基质可以是带电聚合物基质。在某些实施方案中,基质可以是凝胶(例如,水凝胶)。
如本文中所述,基质可以是生物基质。在这样的一些实施方案中,细胞可以是细菌或其他单细胞生物体、植物细胞、真菌细胞或动物细胞。在一些实施方案中,细胞可以是单细胞生物体。单细胞生物体的非限制性实例包括原生生物、锥虫、变形虫、酵母细胞和藻类。在某些实施方案中,细胞可以是动物细胞。动物细胞的非限制性实例包括无脊椎动物细胞(例如,来自果蝇的细胞)、鱼细胞(例如,斑马鱼细胞)、两栖动物细胞(例如,蛙细胞)、爬行动物细胞、鸟细胞和哺乳动物细胞(例如,人细胞、灵长类动物细胞、牛细胞、马细胞、猪细胞、山羊细胞、狗细胞、猫细胞、来自啮齿类动物(例如大鼠或小鼠)的细胞)。在一些实施方案中,细胞可以是人细胞。在一些实施方案中,细胞可以来自多细胞生物体。例如,细胞可以是神经细胞、心肌细胞、成纤维细胞、角质形成细胞、肝细胞、软骨细胞、骨细胞、肌细胞、血细胞、内皮细胞、免疫细胞(例如,T细胞、B细胞、巨噬细胞、中性粒细胞、嗜碱性粒细胞、肥大细胞、嗜酸性粒细胞)或干细胞。
在一些实施方案中,分子和结合伴侣可以通过化学和/或生物学相互作用缔合。在一些实施方案中,分子和结合伴侣可以通过化学相互作用(例如化学键)缔合。化学键可以是共价键或非共价键。在一些情况下,化学键是非共价键,例如氢键、离子键、配位键(dative bond)和/或范德华相互作用。在一些实施方案中,分子和结合伴侣可以包含能够形成这样的键的官能团。例如,分子可以包含至少一个能够与结合伴侣的氢键受体上的电子对相互作用以形成氢键的氢原子。在一些实施方案中,分子和/或结合伴侣可包含富电子或缺电子部分,使得其可与其他结合伴侣和/或分子形成静电相互作用。应理解的是,组分之间的共价和非共价键可通过本领域普通技术人员已知的任何类型的反应,使用合适的官能团经过这样的反应形成。根据本文中的描述,本领域普通技术人员容易选择适于本文中所述的多个实施方案使用的化学相互作用。
在一些实施方案中,分子与结合伴侣之间的缔合可通过生物学结合事件(即,在互补的生物分子对之间)进行。例如,分子可包含实体(例如生物素),其可以与结合伴侣上的互补实体(例如亲和素或链霉亲和素)特异性结合。可以在生物大分子对之间形成生物键的生物分子的其他实例包括但不限于蛋白质、核酸、糖蛋白、碳水化合物、激素等。具体实例包括但不限于抗体/肽对、抗体/抗原对、抗体片段/抗原对、抗体/抗原片段对、抗体片段/抗原片段对、抗体/半抗原对、酶/底物对、酶/抑制剂对、酶/辅因子对、蛋白质/底物对、核酸/核酸对、蛋白质/核酸对、肽/肽对、蛋白质/蛋白质对、小分子/蛋白质对、谷胱甘肽/GST对、抗-GFP/GFP融合蛋白对、Myc/Max对、麦芽糖/麦芽糖结合蛋白对、碳水化合物/蛋白质对、碳水化合物衍生物/蛋白质对、金属结合标签/金属/螯合物、肽标签/金属离子-金属螯合物对、肽/NTA对、凝集素/碳水化合物对、受体/激素对、受体/效应物对、互补核酸/核酸对、配体/细胞表面受体对、病毒/配体对、A蛋白/抗体对、G蛋白/抗体对、L蛋白/抗体对、Fc受体/抗体对、生物素/亲和素对、生物素/链霉亲和素对、药物/靶标对、锌指/核酸对、小分子/肽对、小分子/蛋白质对、小分子/靶标对、碳水化合物/蛋白质对(例如麦芽糖/MBP(麦芽糖结合蛋白))、小分子/靶标对或金属离子/螯合剂对。根据本文中对其功能的描述、这样的生物学相互作用的实例以及本文中和本领域中对于鉴定合适化学相互作用的简单技术的知识,本领域普通技术人员可容易地选择适合用于本文中所述实施方案的分子和结合伴侣之间的生物学相互作用。
在一些实施方案中,抑制、促进或增强分子与结合伴侣之间的缔合的条件可以是pH、离子浓度、化学物质(例如,甲醛、表面活性剂)浓度或温度中的一种。本领域普通技术人员将知晓抑制、促进或增强分子与结合伴侣之间缔合的条件。
如本文中所述,分子和/或基质可以是带电的。一般来说,待被电场移动的分子是带电的或者是带电分子的前体。在一些实施方案中,本文中所述的方法和制品可特别好地适用于带电基质存在下带电分子的运动。本文中使用的术语“带电分子”和“带电基质”具有其在本领域中的普通含义,可指包含一个或更多个带电部分的分子或基质。本文中使用的“带电部分”是携带形式电荷(formal charge)的化学部分,例如一价(+1)、二价(+2)、三价(+3)等。带电部分可以是阴离子(即,带负电)或阳离子(即,带正电)。带负电基团或其前体的实例包括羧酸根基团、磺酸根基团、硫酸根基团、膦酸根基团、磷酸根基团、羟基等。带正电荷部分的实例包括胺基团(例如,伯胺、仲胺和/或叔胺)、铵基团、吡啶基团、咪唑基团。在一个特定实施方案中,带电部分包含磺酸根基团。在一些实施方案中,带电部分可包含-OH、-NH3+、-COO-、-SH、-CHO、酮、叠氮化物和/或卤化物。在一些实例中,带电部分的电荷可以随环境条件变化,例如pH的变化可改变所述部分的电荷,和/或造成所述部分变得带电和/或不带电。通常来说,在使用分子和/或基质的环境条件下确定部分的电荷。一般来说,可以根据需要选择分子和/或基质的电荷密度。
在一些情况下,分子和/或基质可包含一个或更多个可以转化成带电部分的前体部分。例如,分子和/或基质可以包含中性部分,所述中性部分可水解形成带电部分,例如上述那些。作为非限制性特定实例,基质可以包含丙烯酸叔丁酯和/或甲基丙烯酸叔丁酯,其可分别水解形成丙烯酸或甲基丙烯酸。本领域普通技术人员能够确定给定的化学部分是否携带形式电荷(例如,通过检查、pH滴定、离子电导性测量等)和/或给定的化学部分是否可以反应(例如,水解)以形成携带形式电荷的化学部分。
应理解术语“带电”或“带电部分”并不是指分子或基质上的“局部负电荷”或“部分正电荷”。术语“部分负电荷”和“部分正电荷”以其在本领域中的普通含义给出。“部分负电荷”在这样的情况下形成:官能团包含的键变得极化,使得电子密度拉向键的一个原子,在所述原子上产生部分负电荷。通常来说,本领域普通技术人员会识别可以以这种方式变得极化的键。
如本文中所述,电场可用于使分子移入基质、在基质中移动或移出基质的只是一部分。一般来说,可根据给定应用的需要选择电场的大小。例如,在一些实施方案中,电场的大小可大于或等于约1V/m、大于或等于约2V/m、大于或等于约3V/m、大于或等于约5V/m、大于或等于约10V/m、大于或等于约20V/m、大于或等于约40V/m、大于或等于约50V/m、大于或等于约75V/m、大于或等于约100V/m、大于或等于约200V/m、大于或等于约500V/m、大于或等于约1,000V/m、大于或等于约2,500V/m、大于或等于约5,000V/m、大于或等于约10,000V/m、大于或等于约25,000V/m、大于或等于约50,000V/m或者大于或等于约75,000V/m。在一些情况下,电场的大小可小于或等于约100,000V/m、小于或等于约75,000V/m、小于或等于约50,000V/m、小于或等于约25,000V/m、小于或等于约10,000V/m、小于或等于约5,000V/m、小于或等于约2,500V/m、小于或等于约1,000V/m、小于或等于约500V/m、小于或等于约200V/m、小于或等于约100V/m、小于或等于约50V/m或者小于或等于约10V/m。上述范围的组合也是可能的(例如,大于或等于约10V/m并且小于或等于约100,000V/m、大于或等于约20V/m并且小于或等于约100,000V/m)。其他值也是可能的。应理解,动电场的强度可指场的平均强度或动态场中使用的任何强度。在一些实施方案中,可达到更高的电场强度,而不会不利地影响使用电动态场的基质。
在一些实施方案中,动态电场可用于使分子相对于基质移动。在某些实施方案中,电场的至少一种或更多种特性可作为时间的函数变化。在一些情况下,电场的一种或更多种特性变化的频率可大于或等于约0.0001Hz、大于或等于约0.001Hz、大于或等于约0.01Hz、大于或等于约0.1Hz、大于或等于约1Hz、大于或等于约5Hz、大于或等于约10Hz、大于或等于约20Hz、大于或等于约50Hz、大于或等于约100Hz、大于或等于约250Hz、大于或等于约500Hz、大于或等于约750Hz、大于或等于约1,000Hz、大于或等于约5,000Hz、大于或等于约10,000Hz、大于或等于约50,000Hz、大于或等于约100,000Hz或者大于或等于约500,000Hz。在一些情况下,电场的一种或更多种特性变化的频率可小于或等于约1,000,000Hz、小于或等于约500,000Hz、小于或等于约100,000Hz、小于或等于约50,000Hz、小于或等于约10,000Hz、小于或等于约5,000Hz、小于或等于约1,000Hz、小于或等于约750Hz、小于或等于约500Hz、小于或等于约250Hz、小于或等于约100Hz、小于或等于约50Hz、小于或等于约20Hz、小于或等于约10Hz、小于或等于约5Hz或者小于或等于约1Hz。上述范围的组合也是可能的(例如,大于或等于约0.0001Hz并且小于或等于约10,000Hz、大于或等于约0.0001Hz并且小于或等于约100Hz)。其他值也是可能的。
在一些实施方案中,电场的两种或更多种特性可作为时间的函数变化。在这样的一些实施方案中,两种或更多种特性可以以相同或不同频率变化。在一些实施方案中,两种或更多种特性可以以相同频率变化。例如,电场的强度和方向可以以相同或不同频率变化。在一些实施方案中,一种或更多种特性可具有在第一时间框架中的第一频率和在第二时间框架中的第二频率。例如,电场的方向可具有0.01Hz的频率5分钟,以及10Hz的频率3分钟。在一些实施方案中,具有某频率的特性可以以规律间隔、无规律间隔和/或随机间隔变化。例如,电场可具有1Hz的频率,但是电场方向可变化,使得电场具有第一方向0.75秒和第二方向0.25秒。在另一些情况下,电场也可具有1Hz的频率,但是电场的方向可变化,使得电场具有第一方向0.5秒和第二方向0.5秒。
一般来说,可使用本领域普通技术人员已知的方法产生电场。在一些实施方案中,电场可以是一维、二维或三维电场。在一些实施方案中,多维动电场可以在一个多更多个维度是动态的。
一般来说,室(例如,室、外室)可具有合适的形状或尺寸。在一些实施方案中,可根据需要选择室的尺寸。应理解的是,室可具有任何合适的横截面尺寸。例如,在一些实施方案中,室的最大横截面尺寸可以大于或等于约0.01cm、大于或等于约0.05cm、大于或等于约0.1cm、大于或等于约1cm、大于或等于约2cm、大于或等于约5cm、大于或等于约10cm、大于或等于约20cm、大于或等于约30cm、大于或等于约40cm、大于或等于约50cm、大于或等于约60cm、大于或等于约70cm、大于或等于约80cm或者大于或等于约90cm。在一些情况下,室的最大横截面尺寸可小于或等于约100cm、小于或等于约90cm、小于或等于约80cm、小于或等于约70cm、小于或等于约60cm、小于或等于约50cm、小于或等于约40cm、小于或等于约30cm、小于或等于约20cm、小于或等于约10cm或者小于或等于约5cm。上述范围的组合也是可能的(例如,大于或等于约1cm并且小于或等于约100cm)。最大横截面尺寸的其他值也是可能的。
在一些情况下,室的至少一个或至少两个横截面尺寸(例如,高和宽)可大于或等于约0.01cm、大于或等于约0.05cm、大于或等于约0.1cm、大于或等于约1cm、大于或等于约2cm、大于或等于约5cm、大于或等于约10cm、大于或等于约20cm、大于或等于约30cm、大于或等于约40cm、大于或等于约50cm、大于或等于约60cm、大于或等于约70cm、大于或等于约80cm或者大于或等于约90cm。在一些情况下,室的至少一个或至少两个横截面尺寸可小于或等于约100cm、小于或等于约90cm、小于或等于约80cm、小于或等于约70cm、小于或等于约60cm、小于或等于约50cm、小于或等于约40cm、小于或等于约30cm、小于或等于约20cm、小于或等于约10cm或者小于或等于约5cm。上述范围的组合也是可能的(例如,大于或等于约1cm并且小于或等于约100cm)。其他值也是可能的。
室可具有一定的宽高比(width-to-height ratio)。在某些情况下,室的宽高比可大于或等于约1∶1、大于或等于约2∶1、大于或等于约5∶1、大于或等于约10∶1、大于或等于约15∶1或者大于或等于约20∶1。在一些情况下,室的宽高比可小于或等于约30∶1、小于或等于约20∶1、小于或等于约15∶1、小于或等于约10∶1、小于或等于约5∶1或者小于或等于约2∶1。上述范围的组合也是可能的(例如,大于或等于约1∶1并且小于或等于约20∶1)。其他值也是可能的。
如本文中所述,室的至少一部分可由半透材料限定。在一些实施方案中,半透材料可形成室的一个或更多个壁的一部分。在某些实施方案中,室的一个或更多个壁或整个室由半透材料限定的百分比可大于或等于约1%、大于或等于约5%、大于或等于约10%、大于或等于约20%、大于或等于约30%、大于或等于约40%、大于或等于约50%、大于或等于约60%、大于或等于约70%、大于或等于约80%、大于或等于约90%、大于或等于约95%或者大于或等于约97%。在一些实施方案中,室的一个或更多个壁或整个室由半透材料限定的百分比可小于或等于约100%、小于或等于约95%、小于或等于约90%、小于或等于约80%、小于或等于约70%、小于或等于约60%、小于或等于约50%、小于或等于约40%、小于或等于约30%、小于或等于约20%或者小于或等于约10%。上述范围的组合也是可能的(例如,大于或等于约5%并且小于或等于约90%、大于或等于约5%并且小于或等于约100%)。其他值也是可能的。
一般来说,样品定位器可具有任何合适的形状或尺寸。在一些实施方案中,样品定位器可占据室的很大一部分。例如,在一些实施方案中,室的横截面积与样品定位器的横截面积之比可小于或等于约30∶1、小于或等于约20∶1、小于或等于约15∶1、小于或等于约10∶1、小于或等于约5∶1或者小于或等于约2∶1。在一些情况下室的横截面积与样品定位器的横截面积之比可大于或等于约1∶1、大于或等于约1.5∶1、大于或等于约2∶1、大于或等于约5∶1、大于或等于约10∶1、大于或等于约15∶1或者大于或等于约20∶1。上述范围的组合也是可能的(例如,大于或等于约1∶1并且小于或等于约20∶1)。其他值也是可能的。
在一些实施方案中,可根据需要选择样品定位器的尺寸。应理解,样品定位器可具有任何合适的横截面尺寸。例如,在一些实施方案中,样品定位器的最大横截面尺寸可大于或等于约0.01cm、大于或等于约0.05cm、大于或等于约0.1cm、大于或等于约1cm、大于或等于约2cm、大于或等于约5cm、大于或等于约10cm、大于或等于约20cm、大于或等于约30cm、大于或等于约40cm、大于或等于约50cm、大于或等于约60cm、大于或等于约70cm、大于或等于约80cm或者大于或等于约90cm。在一些情况下,样品定位器的最大横截面尺寸可小于或等于约100cm、小于或等于约90cm、小于或等于约80cm、小于或等于约70cm、小于或等于约60cm、小于或等于约50cm、小于或等于约40cm、小于或等于约30cm、小于或等于约20cm、小于或等于约10cm或者小于或等于约5cm。上述范围的组合也是可能的(例如,大于或等于约1cm并且小于或等于约100cm)。最大横截面尺寸的其他值也是可能的。
在一些情况下,样品定位器的至少一个或至少两个横截面尺寸(例如,高和宽)可大于或等于约0.01cm、大于或等于约0.05cm、大于或等于约0.1cm、大于或等于约1cm、大于或等于约2cm、大于或等于约5cm、大于或等于约10cm、大于或等于约20cm、大于或等于约30cm、大于或等于约40cm、大于或等于约50cm、大于或等于约60cm、大于或等于约70cm、大于或等于约80cm或者大于或等于约90cm。在一些情况下,样品定位器的至少一个或至少两个横截面尺寸可小于或等于约100cm、小于或等于约90cm、小于或等于约80cm、小于或等于约70cm、小于或等于约60cm、小于或等于约50cm、小于或等于约40cm、小于或等于约30cm、小于或等于约20cm、小于或等于约10cm或者小于或等于约5cm。上述范围的组合也是可能的(例如,大于或等于约1cm并且小于或等于约100cm)。其他值也是可能的。
样品定位器可具有一定的宽高比(width-to-height ratio)。在某些情况下,室的宽高比可大于或等于约1∶1、大于或等于约2∶1、大于或等于约5∶1、大于或等于约10∶1、大于或等于约15∶1或者大于或等于约20∶1。在某些情况下,室的宽高比可小于或等于约30∶1、小于或等于约20∶1、小于或等于约15∶1、小于或等于约10∶1、小于或等于约5∶1或者小于或等于约2∶1。上述范围的组合也是可能的(例如,大于或等于约1∶1并且小于或等于约20∶1)。其他值也是可能的。
术语抗体是指天然的或者完全或部分合成产生的免疫球蛋白或其一部分。保留特定结合能力的其全部衍生物也包括在该术语中。该术语还包括具有与免疫球蛋白结合结构域同源或很大程度上同源的结合结构域的任何蛋白质。这些蛋白质可来自于天然来源,或者部分或完全合成产生。抗体可以是单克隆的或多克隆的。抗体可以是任何免疫球蛋白类别的成员,包括任何人类型:IgG、IgM、IgA、IgD和IgE。但是,IgG类的衍生物在本发明中是优选的。
生物大分子是多核苷酸(例如,RNA、DNA、RNA/DNA杂交体)蛋白质、肽、脂质、天然产物或多糖。生物大分子可以是天然的或非天然的。在一个优选实施方案中,生物大分子的分子量大于500g/mol。
配体是指对于靶标(例如,蛋白质、碳水化合物、脂质、肽、大分子、生物大分子、寡核苷酸、多核苷酸)具有结合亲和力的任何化学化合物、多核苷酸、肽、蛋白质、脂质、碳水化合物、小分子、天然产物、聚合物等。优选地,靶标是蛋白质。在一些实施方案中,配体对靶标是特异性的。在一些实施方案中,配体对靶标的结合亲和力为100mM至1pM、优选1mM至1pM、更优选1μM至1pM。配体可通过任何方式与其靶标结合,所述方式包括疏水相互作用、氢键合、静电相互作用、范德华相互作用、π堆叠、共价键合、磁性相互作用等。
多核苷酸或寡核苷酸是指核苷酸的聚合物。聚合物可包含天然核苷(即,腺苷、胸苷、鸟苷、胞苷、尿苷、脱氧腺苷、脱氧胸苷、脱氧鸟苷和脱氧胞苷)、核苷类似物(例如,2-氨基腺苷、2-硫代胸苷、肌苷、吡咯并嘧啶、3-甲基腺苷、C5-溴尿苷、C5-氟尿苷、C5-碘尿苷、C5-丙炔基-尿苷、C5-丙炔基-胞苷、C5-甲基胞苷、7-脱氮腺苷、7-脱氮鸟苷、8-氧代腺苷、8-氧代鸟苷、O(6)-甲基鸟嘌呤和2-硫代胞苷)、化学修饰的碱基、生物学修饰的碱基(例如,甲基化碱基)、插入的碱基(intercalated base)、修饰的糖(例如,2′-氟核糖、核糖、2′-脱氧核糖、阿拉伯糖和己糖)或修饰的磷酸基团(例如,硫代磷酸酯和5′-N-亚磷酰胺键联)。
蛋白质包含通过肽(酰胺)键连接在一起的氨基酸残基的聚合物。本文中使用的该术语是指任何尺寸、结构或功能的蛋白质、多肽和肽。通常来说,蛋白质为至少3个氨基酸长,优选至少10个氨基酸长,更优选至少25个氢基酸长,并且最优选至少50个氢基酸长。蛋白质的长度还可大于100个氨基酸。蛋白质可指单个蛋白质或蛋白质的集合。蛋白质可指全长蛋白质或蛋白质片段。本发明蛋白质优选仅包含天然氨基酸,但是可作为替代地使用本领域中已知的非天然氨基酸和/或氨基酸类似物。另外,本发明蛋白质中的一个或更多个氢基酸可被修饰,例如,通过添加化学实体,例如碳水化合物基团、羟基基团、磷酸基团、法呢基基团、异法呢基基团、豆蔻酰基基团、脂肪酸基团、用于缀合、功能化或其他修饰的接头等。蛋白质还可以是单分子或可以是包含蛋白质、脂质、RNA、DNA、碳水化合物等的多分子复合物。蛋白质可以是天然蛋白质或肽的天然或非天然片段。蛋白质可以是天然的、重组的或合成的,或者这些的任意组合。
本文中使用的术语小分子是指实验室中合成或天然发现的有机或无机化合物,其分子量小于约2000g/摩尔,或小于约1000g/摩尔,甚至小于约500g/摩尔。本文中使用的小分子可指“天然产物样”化合物,例如在结构上与天然产物类似,或者在立体中心的密度、功能团的密度、环体系、3D结构等方面类似的小分子;但是,术语“小分子”不限于“天然产物样”化合物,可包括并未基于或类似于已知天然产物的化合物。小分子可包括例如核酸、肽、多肽、肽核酸、肽模拟物、碳水化合物、脂质或其他有机(含碳)或无机部分。
以下实施例旨在举例说明本发明的某些实施方案,但没有例示本发明的完全范围。
实施例1
本实施例描述了使用电场将分子转运到基质中。
对生物系统的全面理解受到缺少能够在实际时间框架中对未切片的厚组织进行光学和分子探询的工具的阻碍。本实施例示出了一种基于电泳运动的新技术来解决该问题。所述技术应用于小鼠全脑组织,并且小鼠全脑组织可以在几天(a couple of days)内染色。
生物科学(尤其是神经科学)领域的一个重大挑战是从复杂的生物系统中提取详细的结构和分子信息。生物系统(例如经固定脑组织)的大部分研究强烈依赖于对目的结构或分子进行标记然后显微镜检查。标记技术(例如免疫组织化学和原位杂交)是生物医学的大部分实验室中的常规实践,并且光学显微术中的技术创新已经能够在亚细胞分辨率下观察组织结构的微小细节。但是,最常见的程序需要将厚组织切成μm或nm厚度的薄片以便光子和可视化分子探针二者能够渗透整个厚度,这个过程耗时、易出错并且费力或者昂贵(当自动化时)。已经开发了光学清理方法(optical clearing method),其提高了光学显微术的厚度,以在不切片的情况下对厚组织进行成像,但是这些方法并没有增强大分子渗透,因此并不与贯穿整个体积的分子表型分析兼容。作为克服这些问题的第一步,开发了赋予厚组织光学透明度和大分子可渗透性的技术。该技术能够通过光学显微术和分子表型分析技术(例如免疫组织化学和原位杂交)二者完全接近小鼠全脑和厚的死后人脑组织。但是,这些透明组织中的分子探询(例如,染色)依然不实用地慢,因为在成年小鼠全脑的情况下,探针分子(例如,抗体)被动扩散到整个组织厚度花费数周至数月。
为了解决这些限制,电场用于使带电分子移动通过致密组织比扩散快许多个数量级,并且速度与电场强度的二次方成比例。因此,电泳运动用于迅速和主动地转运具有期望功能的带电分子(例如,用于脂质移除的去垢剂分子或用于免疫标记的抗体分子)通过厚组织,允许快速的光学清理和分子表型分析。另外,通过策略性优化大流体回路(macrofluidic circuit)设置和调节溶液的组成、温度和黏度,可以将电流流动集中于组织并且加快所述过程。
在浓度梯度的存在下,降低浓度梯度的分子扩散活动(即,布朗运动)导致顺浓度梯度的净质量转运。这是当不含特定抗体的组织放在含有所述抗体的浴中时抗体扩散到组织中(虽然缓慢)的原因。这种被动扩散比电迁移慢数个数量级,在电迁移中带电分子顺电势梯度移动(图8)。但是这种强力的定向运动对组织造成应力,有时候使组织不可恢复地变形。但是,如果电场相对于组织旋转,净应力可以最小化,同时提高了通过电泳扩散进入组织的质量转运。理论预测电泳导致的有效扩散是相对于速度大小的约二次方,因此改善了带电分子的转运。在由50V和0.5rpm组成的该实验设置中,根据理论,抗体的扩散率提高了四个数量级。
为了使小鼠全脑组织透明,在4℃下将丙烯酰胺单体、甲醛和聚合引发剂注入到脑中以使组织交联并且使丙烯酰胺分子与组织连接。在37℃下的热引发聚合反应形成组织-丙烯酰胺聚合物杂交体结构(hybrid cunstruct)。然后,在离子型去垢剂溶液中对组织-聚合物杂交体进行电泳,以除去脂质和其他未交联的分子。为了加快清理过程(并且也为了随后迅速的分子标记),我们设计了一种新的电泳装置,其包括大量外通道循环和少量内循环(图8B-E)。这种装置的重要特征是中央的含组织反应室(内循环的一部分)与周围电解室(外循环的一部分)通过纳米多孔半透材料空间分离(图8)。这使得能够实现反应和电解室中溶液组成、温度、导电率和反应体积的独立且通用的控制。
首先,随着大体积的缓冲溶液在电解室和外通道循环,中央室的分离使得能够使用大幅降低量的试剂,例如昂贵的去垢剂和抗体分子,同时保持高浓度。其次,这种设置阻止了试剂直接接触电极,从而防止试剂分子被电化学反应消耗并且产生可损害组织的有害副产物。第三,具有高盐浓度的缓冲液可用于电解室,而低盐含量缓冲液可用于反应室,从而提高了反应室的电阻以及反应室末端之间的电压降落。最后,可选择性降低反应室中的溶液的温度(并因此降低黏度)以进一步提高溶液的电阻。通过优化盐浓度和温度,能够在优化后使反应室末端之间的电压降落提高约10倍(数据未示出)。冷却很重要,因为组织中已经表达的荧光团可在高于37℃时淬灭。没有溶液的循环,温度可容易超过37℃。冷却和循环使得能够应用高电压。
将组织-聚合物杂交体放在连接于用于旋转的步进电机(step motor)的固定器(holder)上。旋转使得带电分子均匀分布于整个试样中并防止清理程序期间的组织变形。另一个关键特征是大流体设置。进入溶液有效洗走电解产物,防止了酸或碱在每个电极处浓缩。通过改变pH控制蛋白质的电荷。在高pH下,大部分蛋白质具有净负电荷。
图8举例说明了电泳随机游走的原理和设备。图8A-8C示出了布朗随机游走(上)与电泳随机线性转运(中)和电泳随机游走(下)的比较。示出了计算机模拟结果(A)、示意图(B)和免疫染色结果(C)。圆1和2表示相同质量的带电颗粒,并且黑点表示具有较小质量的颗粒。颗粒2具有比颗粒1更高的电荷。在布朗随机游走中,颗粒进行小的随机运动,导致小的净位移。因此,颗粒的组织渗透慢并且分子积累在表面。在电场中,具有较高电荷的颗粒比具有较小电荷的颗粒移动得更快。带电分子可迅速穿过组织,但是其分布跟随电场梯度。这也对组织造成应力,并且有时可使组织不可恢复地变形。在电场中旋转组织模拟了布朗随机游走,但是具有大的颗粒净位移。通过电泳随机游走可以实现颗粒的均匀部分。图8C中所示结果通过Thy1-eGFP小鼠中eGFP的免疫染色获得。注意到来自Alexa 555缀合的eGFP抗体的信号均匀分布到整个脑中。图8D是装置的图像。电泳室由内室和两个外室组成。内室具有盖,所述盖具有步进电机及其控制器。图8E是装置的鸟瞰图。内室通过纳米多孔膜与外室分离,并且组织能够在内部旋转。外室在每一侧包含用于电泳的铂丝。图8F是装置的顶视图。组织样品与两个电极中的电化学反应分离。因为纳米多孔膜对大分子不可渗透,具有期望特性的此类大分子被限制在内室的小体积中并且均匀分布。
图9示出了具有动态亲和力变化(dynamic affinity shift)的电泳随机游走,其使得能够对大的完整组织进行迅速且均匀的免疫标记。图9A是免疫标记装置的示意图。对于该实验,将13ml含有抗体的硼酸锂缓冲液(50mM,pH 11)装载到内室中,并且大体积的冷却的硼酸锂缓冲液(50mM;pH 9;4℃)通过外室循环。向内室施加50V。小缓冲液分子可自由通过纳米多孔膜,但是抗体禁锢在内室中。这种独特的设计保护了重要的生物分子不被电氧化/还原降解。图9B举例说明了电泳期间内室中pH变化的时间过程。缓冲液离子通过纳米多孔膜的自由运动经过约4小时自然地将缓冲液的pH从11降低到9。n=4。图9C是不同pH的缓冲液中对eGFP染色的1mm厚Thy1-eGFP脑切片的代表性图像。在pH 9发生更高的抗体-抗原结合。图9D是整个组织中随时间的抗体穿透和分布的示意图。抗体分子在高pH下高度带电,因此,电泳随机游走方案下抗体的组织渗透和均匀分布在高pH下最高效。随着pH降低,分布的抗体开始与其抗原结合。图9E是对eGFP染色的全Thy1-eGFP小鼠脑的代表性图像,(左)仅进行电泳,(中)进行电泳和旋转,(右)电泳、旋转和动态亲和力变化。
图10举例说明了厚人脑样品的迅速清理和免疫染色。图10A是清理装置的示意图。带电SDS胶束通过纳米多孔膜限制在内室中,并且主动转运通过旋转组织,以模拟随机游走。SDS胶束不能穿过纳米多孔膜,而SDS单体可以。图10B是本技术(新清理)和现有技术(旧清理)pH随时间变化的图,其表明本发明技术并不造成pH降低。图10C是不同时间点经清理脑的代表性图像。本发明技术比旧CLARITY更迅速地清理脑。图10D表明利用本发明技术可以对厚人脑组织进行均匀和完全的免疫染色。图10E-G示出了脑组织的高放大率图像。图10H示出了使用本发明技术确定的给定大小的脑的树枝状桥(dendritic bridge)/神经元的图。
实施例2
本实施例描述了转运方法,其在本实施例中称为随机电转运(stochastic electrotransport),所述方法使得能够迅速且选择性地转运带电分子,而不破坏周围带电基质。最初,装置设计为执行去垢剂胶束的随机电转运,以能够迅速且均匀地清理完整组织。利用该装置,在短至3天中清理成年小鼠全脑组织。接着,设计了改进的装置以执行分子探针的随机电转运,以能够对完整组织进行迅速且均匀的染色。通过用合成核染色剂、碳水化合物结合蛋白和抗体对经清理的水凝胶进行成年小鼠全脑染色证明了这种方法的通用性。所述技术导致了在器官规模的哺乳动物组织中多种生物分子的显著均匀且迅速的标记。总之,随机电转运进一步促进了大规模完整生物系统的迅速且多维探询。
充分强的电场可加快离子的转运,其速度线性地依赖于其电迁移率,而不带电材料(例如,聚丙烯酰胺和琼脂糖凝胶)保持不动。但是,如果基质本身带电,固定电梯度可使周围基质不可逆地变形。带电离子基质是常见的并且包括全部生物组织,但是一个特别的实例是经清理的水凝胶-组织杂交体。在某些水凝胶-组织杂交体中,将水凝胶网格的小构建块注入到组织中并随后聚合以形成互相连接的纳米多孔网。在这个过程中,内源生物分子(例如,核酸、蛋白质和小分子)通过与合成聚合物链交联保持在其生理位置,而某些分子(例如,脂质)被从组织中移除以产生光学透明(“经清理”)水凝胶-组织杂交体。但是,保持生理结构所必需的高度交联显著降低了交联分子的电迁移率,这些交联分子在定向电场下缓慢迁移并且可损坏基质。
为了解决该问题,开发了如本实施例中所述的随机电转运,其选择性地加快自由移动的带电分子的转运,而不损坏周围带电基质。随机电转运依赖于这样的理念:随机电场可通过诱导电驱动的“随机游走”选择性地增强具有大电迁移率的颗粒的转运。我们使用动力学蒙特卡洛模型(Kinetic Monte Carlo model)的计算机模拟预测,在通过动态地改变电场引起的局部随机电场和孔的无序分布的存在下,颗粒的均方位移(mean squared displacement)(R2)与其电迁移率和场强的乘积的二次方成比例(通过有效旋转时标P和实验时间t归一化)。
这种独特的二次方依赖性使得能够选择性地仅将高电迁移颗粒(例如,抗体)的转运提高至比被动扩散高数个数量级,而抑制具有低电迁移率的束缚分子(例如,内源抗原)的运动。例如,在组织中分子探针的随机电转运中,诱导探针1mm位移的条件可仅使交联的内源生物分子移动1nm(对比在静态电泳中1μm)(假设前者的电迁移率比后者的电迁移率高3个数量级)。因此,带电基质可保持几乎不动,而未结合的功能性分子迅速扩散到整个基质中。
首先,将这种新转运策略应用于转运去垢剂十二烷基硫酸钠(SDS)胶束,以加快从水凝胶包埋的完整组织中提取脂质。利用某些静态电泳技术,完全清理成年小鼠全脑耗费数周。对组织施加更高电压可加快该过程,但是这可以静态电泳造成的组织变形为代价。另外,提高电压造成组织过热,促进了电极对去垢剂的不期望的消耗,并且加快了可能不利地影响组织样品(例如,循环溶液的pH迅速降低并且可使蛋白质变性)的电解副产物的积累。
为了解决这些问题并且有效地执行SDS胶束的随机电转运,构建了具有若干关键特征的新整合平台。所述装置在图11A中示出。首先,样品相对于静电场连续旋转以产生方向和强度二者随时间动态变化的电动力(electric force)。这种动电场与组织样品中无序分布的孔组合导致电泳驱动的带电分子的随机游走。其次,引入纳米多孔膜以分离循环清理缓冲液(200mM SDS、10mM硼酸锂,pH 9)和电泳缓冲液(10mM SDS,10mM硼酸锂,pH 9)的“内”通道和“外”通道。纳米多孔膜仅允许小的化学物质(包括载流离子(current-carrying ion)和SDS单体)自由移动通过两个通道,而将大的SDS胶束限制在内部。这种独特设计不仅保持了内通道内部的高SDS浓度,而且保护样品免于破坏性化学反应及其副产物(例如,多种酸和碱)。纳米多孔膜有效地阻挡电解副产物进入内循环,因此保护了样品。清理溶液选择200mM的SDS浓度,因为SDS胶束在200mM表现出最高的稳定性和去垢力,考虑到SDS的临界胶束浓度为~8.3mM,电泳缓冲液选择10mM以使得10mM的SDS单体可在两个通道之间平衡。最后,内(清理)和外(电泳)溶液循环的分离使得能够独立控制其温度和pH。
为了测试预期的随机电转运特性,将水凝胶包埋的成年小鼠脑组织放在装置中并且施加具有组织旋转的静态电转运(“随机电转运”)或没有组织旋转的静态电转运(“静态电转运”)5小时。如所预期的,在经受静态电泳的样品中观察到显著的变形,如图11B中所示。利用SDS胶束的随机电转运,在3天中完全清理了小鼠脑而没有显著的组织变形,如图11C中所示(注意到在折射率匹配溶液中孵育后组织的膨胀恢复)。相同持续时间的组织的静态电转运严重损坏了组织,而SDS胶束的被动扩散仅可部分地清理组织的表面。总之,这些结果证明,随机电转运使得能够迅速清理完整组织而不造成变形。
接着,修改装置以执行分子探针向经组织中的随机电转运。保持样品旋转,但是移除分离内通道和外通道的纳米多孔膜。相反,用纳米多孔膜围绕样品室以保持室中的高探针浓度并且保护样品和探针免于电解及其副产物。为了测试该整合系统,将大于小鼠脑的盘形丙烯酰胺凝胶(半径9mm;高8mm)放在装载有荧光素缀合的牛血清白蛋白(BSA-FITC)的室中并且施加随机电场。如所预期的,在3小时内观察到了BSA-FITC向凝胶中显著增强的扩散样转运以及BSA-FITC的均匀分布。接着,为了测试带电基质在随机电场下是否保持完整,使经清理小鼠全脑暴露于随机电场,并且使另一个经清理小鼠全脑暴露于静态电场。在一小时中,暴露于固定电场的脑显著损坏,而随机电场下的脑保持不变。
使用这种随机电转运装置,将数种不同类型的分子探针递送到经清理水凝胶成年小鼠全脑中。选择靶标存在于整个全脑中的探针来彻底评价随机电场可取得的均匀且完整染色的程度。选择了SYTO 16,一种广泛使用的有机核染料;荧光团缀合的番茄(Lycopersicon Esculentum,tomato)凝集素,一种广泛用作有效的血管标志物的碳水化合物结合蛋白;和抗组蛋白H3蛋白,存在于所有细胞核中的针对组蛋白H3蛋白的抗体。同时将这些探针向小鼠脑中随机电转运1天实现了在整个脑中其靶标的显著均匀且完全的染色,如图12A中所示。在探针溶液中摇动着被动孵育另一经清理脑相同持续时间仅在表面染色,而核心几乎没有标记,如图12B中所示。在三种分子探针中,抗体具有最高分子量(~150kDa),因此在被动染色实验中表现出最差的穿透(~300um),而在随机电转运的情况下穿透完全贯穿成像的整个深度。这些数据证明随机电转运可用于使传统组织化学技术扩展至完整组织。
然后,确定了随机电转运染色组织的高分辨率成像是否允许对组织结构进行定量分析。对另一个小鼠半球进行番茄凝集素的随机电转运10小时。光片显微术(light-sheet microscopy)用于迅速获得高分辨率体积图像。获得的图像显示出了不同深度的毛细血管和较大血管的均匀染色。在30秒内获得了步长2um的图像的分离z堆叠(z-stack)。由于其高反差,获得的图像可容易矢量化并且分析多种参数(例如,直径、总长度和分支点的数目)。脑范围血管的这种定量分析可揭示正常或患病组织中血管网络的重要结构或病理学特征。因此,随机电转运可用于器官规模生物系统的快速和定量的表型分析。
图11A示出了设计用于执行用于组织清理的随机电转运的装置的示意图。清理溶液(200mM SDS,10mM LB,pH 9)的内循环和电泳缓冲液(10mM SDS,10mM LB,pH 9)的外循环通过纳米多孔膜(插图)分离,其使SDS胶束保持在内循环中,而电解反应的副产物在外循环中。SDS单体和缓冲液离子可穿过纳米多孔膜自由移动。内室和其他室二者中SDS单体浓度平衡为~10mM。在穿过导电缓冲液离子的纳米多孔膜向内室施加电压,并且将组织室放在内室中。组织室用电阻尼龙网包围以允许SDS胶束和电流自由穿透,并且相对于电场旋转以产生动态变化的电场。使冷却的(10-20℃)缓冲溶液循环以提供用于电泳的离子以及移除电泳期间产生的热。在没有纳米多孔膜的情况下,内部清理溶液的pH在1天迅速降低至~4.5。随机电转运在3天中迅速且均匀地清理水凝胶包埋的成年小鼠全脑组织而不损坏组织。注意到在折射率匹配的溶液中孵育后组织的膨胀恢复。利用相同功率(90W),静态电场在短至5小时内使组织显著变形,如图11B中所示,并且在3天中使组织完全降解,如图11C中所示。图11B示出了冠状面(coronal section)。箭头指向组织的变形部分。在37℃下摇动相同持续时间的SDS被动扩散仅部分地清理了表面。所有网格为3mm×3mm。
图12A示出了经清理的水凝胶成年小鼠脑,其经历了SYTO 16(青蓝色核染色剂)、Dylight 594缀合的番茄凝集素(标记血管的碳水化合物结合蛋白)和Alexa 647缀合的抗组蛋白H3抗体(标记所有细胞核)的随机电转运。水平截面显示出了所使用的所有三种探针的全脑均匀且完全的染色。比例尺条为1mm。图12B示出了被动染色对照,其在37℃下通过轻轻摇动孵育相同的持续时间。比例尺条为1mm。
实施例3
在本实施例中,描述了一种在本实施例中称为eTANGO(纳米多孔凝胶器官杂交体中活性调节的分子的电随机转运)的新技术,其允许在小时时间尺度上对大规模完整生物系统进行几乎完全且均匀的原位分子标记。这通过整合两个新理念实现:随机电转运和动态活性变化。随机电转运选择性地且迅速(比被动扩散快数个数量级)地分散仅自由移动的带电分子(例如,抗体),而不破坏周围带电基质(例如,脑)。通过动态活性变化紧密控制探针-靶标反应动力学,以使整个系统中的反应时间同步。通过使用三种不同类型的分子探针实现整个小鼠中的细胞核、血管和多种神经细胞类型的3D可视化,证明了该整合方法的通用性。还通过对遗传表达的荧光蛋白进行染色确认了技术的特异性。所述技术允许在器官规模哺乳动物组织中显著均匀且迅速地标记多种生物分子。
为了实现随机电转运的潜力,开发了具有若干关键特征的新整合平台。首先,样品相对于静电场持续旋转以产生方向和强度二者随时间动态变化的电动力。其次,用纳米多孔膜包围样品室,仅允许小化学物质(例如,载流离子、活性调节分子)自由移动通过室,而将大探针分子限制在内部。这种设计不仅保持了室中的高探针浓度,而且保护样品和探针免于破坏性化学反应及其副产物(例如,多种酸和碱)。最后,温度控制的缓冲溶液绕着圆柱形室流动以精细控制组织内的反应环境(例如,温度和pH)。装置与脱装置组件(off-device component)整合以使随机电转运过程自动化。
尽管随机电转运大幅缩短了分子穿透所需时间,但是由于探针迁移时间尺度(小时)和反应时间尺度(亚秒至分钟)的差异,某些经清理水凝胶组织中内部的分子靶标依然经历不同的反应条件。如果单独应用被动扩散或随机电转运来标记大规模完整组织,在一些情况下,快的探针-靶标反应动力学可造成外部组织的饱和标记,留下内部结构未检查。为了克服该问题,利用以下事实动态地调节标记过程中探针的结合活性:分子之间的非共价结合反应由其弱的相互作用(例如,静电、疏水、氢键合)控制,并且这样的力的强度取决于周围化学环境。设计了一种可动态调节的环境,其在探针转运步骤中抑制结合,并且随后一旦探针均匀分散在整个组织中就全面“开启(swiched-on)”反应。这种方法允许整个组织中的内源分子靶标经历类似反应条件(时间和化学浓度)。
为了实现这些,开发了抑制或显著减缓从小有机分子、碳水化合物结合蛋白到抗体的大范围探针的结合反应的通用缓冲体系。表1中示出了所使用的探针。首先,研究了通过简单地将pH从中性变成碱性来抑制结合反应的能力。推断可使用pH变化,因为从中性变成碱性pH可改变许多分子的电荷。通过变成碱性pH改变分子的电荷可破坏或改变在中性pH下存在的分子的静电相互作用。单独使用pH,抑制了抗体亚组(包括α-GFP)中的反应,但是所测试的大部分探针在pH 11硼酸锂(lithiumborate,LB)缓冲液中表现出强反应性。接着,确定添加低浓度离子型去垢剂是否可进一步降低探针的反应性。众所周知,去垢剂化学物质可破坏分子的相互作用。发现10mM十二烷基硫酸钠(SDS)可有效抑制或显著减缓所测试的所有探针在宽范围的pH和缓冲体系中的结合反应。使用这样的小离子型分子(缓冲液离子或SDS)作为活性调节剂是有利的。可通过将化学物质电泳转运穿过纳米多孔膜迅速改变样品室中小离子型分子的浓度。另外,pH 11与中性pH相比赋予了常用分子探针(例如,抗体)更高的负电荷,从而提高了电迁移率。因此,这种缓冲体系可容易地用于本文中所述随机电转运系统,以在完整组织的分子标记过程中动态地调节探针的结合活性。这种“动态活性变化”与随机电转运的整合在本实施例中称为eTANGO。
表1.本实施例中使用的探针
为了测试整合eTANGO方法的预期特性,利用广泛使用的有机核染料PO-PRO-1对成年小鼠脑的整个半球进行核染色。PO-PRO-1在pH 7.5tris-硼酸盐(TB)缓冲液中表现出强烈标记,而其在具有SDS的pH 11 LB中几乎没有信号。另外,不论pH,PO-PRO-1具有两个正电荷,使得其适合于随机电转运和动态活性变化二者。为了测试是否可使用eTANGO在小鼠脑的完整半球中实现迅速且均匀的核染色,将组织与PO-PRO-1和非结合缓冲液(含SDS的pH 11 LB缓冲液)一起装载到样品室中,所述非结合缓冲液有利于探针转运但是不允许探针-靶标结合反应发生。没有探针的相同样品缓冲液通过装置循环,施加随机电场以驱动灭活探针进入组织。随机电转运5小时后,将样品移到促进探针-样品结合反应的“结合缓冲液”(pH 7.5 TB缓冲液)中并且被动孵育过夜。这种方法导致仅15小时内整个半球显著均匀且完全的核染色。为了评估通过eTANGO系统实现的标记的均匀性,对半球的中部横截面成像并且使用简单算法基于绝对强度阈值鉴定核,并且测量所有所鉴定核的染色强度。均匀标记允许精确进行这样的简单算法;如果标记不均匀,可需要复杂算法以将整个深度的不同信噪谱归一化。另外,染色核的平均强度在整个组织中是均匀的,这支持了组织中的探针靶标经历几乎相同的反应条件的声明。相同持续时间的利用被动扩散或仅利用随机电转运(无动态活性变化)的额外对照实验造成了在表面的饱和信号,而核心几乎没有标记,仅随机电转运的条件产生了比被动扩散相应实验稍微好的穿透。由于扩散固有的缓慢性质,仅利用动态活性变化的其他对照实验导致PO-PRO-1更好但是依然不足的穿透和弱的信号。这些结果证明,随机电转运和动态活性变化的组合eTANGO允许迅速、均匀和系统范围的核对比染色,其在用于解剖注释的组织学中很重要,并且特别可用于操作和分析3D体积数据集。
接着,证明了eTANGO是否可用于利用基于蛋白质之探针的分子表型分析。首先测试被广泛用作有效血管标志物的凝集素,一种碳水化合物-结合蛋白。荧光团缀合的番茄(西红柿)凝集素在中性pH下表现出强的与其靶标的结合,并且在所测试的缓冲液中具有高背景,而在10mMSDS存在下的中性和碱性pH二者下结合较弱但是更特异性。使用具有SD的pH 11 LB缓冲液作为慢结合缓冲液,因为等电点(pI)为9.0的凝集素在碱性pH下带更高电荷,允许更快电泳转运。为了使非特异性结合最小化,省略了强结合步骤。使用这种简单的一步法,在10小时内实现了整个小鼠半球的全部血管的均匀且完全的染色。然后使用定制的折射率匹配的浸渍介质对样品进行光学清理。光片显微术(light-sheetmicroscopy)用于迅速获得高分辨率体积图像。所获得的图像显示不同深度的毛细血管和更大血管的均匀染色。在30秒内获得步长2um的图像的分离z堆叠。由于其高反差,获得的图像可容易矢量化并且分析多种参数(例如,直径、总长度和分支点的数目)。脑范围血管的这种定量分析可揭示正常或患病组织中血管网的重要结构或病理学特征。这将eTANGO的功用进一步延伸到了器官规模生物系统的迅速且定量的表型分析。
最后,确定eTANGO是否与免疫组织化学方法相兼容。免疫组织化学是使用抗体-抗原结合反应的最常用的分子表型分析技术之一。但是,由于抗体的大尺寸(15nm)及其慢移动性,厚的完整组织的抗体标记依然是主要挑战。为了研究eTANGO是否允许大规模完整组织的迅速、完整且均匀的免疫标记,进行eTANGO以使用染料缀合的α-组蛋白H3(H3)抗体标记整个小鼠半球中的全部细胞核。首先,确定单独使用随机电转运是否可实现均匀染色。如所预期的且与我们先前利用PO-PRO-1进行的实验相一致,虽然通过随机电转运促进了抗体的转运,但是小鼠全脑仅~200μm厚的外层被标记并且具有高背景水平,而脑核心表现为几乎不存在信号。接着,应用eTANGO方法。为了使活性抑制的组蛋白抗体均匀分散在组织内部,将脑与含有染料缀合的α-组蛋白抗体的具有SDS的pH 11 LB缓冲液(非标记缓冲液)一起装载到室中,然后在相同非结合缓冲液循环的同时施加电场6小时。在该6小时长的非结合步骤之后,将循环缓冲液更换成结合缓冲液(pH 9 LB)以全面诱导抗体抗原结合反应。使用pH 9结合缓冲液而不是中性pH以确保抗体在结合步骤期间依然保持一些电迁移率。不同于单独随机电转运对照,这种整合的eTANGO方法导致完全且均匀的标记。总之,这些结果证明,随机电转运和动态活性变化的整合eTANGO允许迅速且均匀地在数小时时间框架中对小鼠全脑进行迅速且均匀的免疫染色。
为了进一步验证eTANGO使用免疫组织化学方法的能力,在完整经清理水凝胶Thy1-eGFP成年小鼠脑上进行α-GFP染色。经eTANGO处理的脑表现出在整个全脑中所有表达eGFP的神经元显著均匀且完全的α-GFP标记。为了比较,对另一个脑被动免疫染色相同持续时间并且观察到仅限于表面的标记。含有不同量eGFP(+)神经元的经eTANGO染色的海马、皮质和丘脑的详细检查表明,eTANGO能够对具有不均匀分布的抗原的样品均匀地免疫染色。在遗传性eGFP表达弱的丘脑中观察到了显著放大的信号强度,这可用于使弱表达的蛋白质可视化。还观察到在eTANGO后可以可靠地检测不同深度的不同脑结构。总之,结果证明随机电转运和动态活性变化的整合允许在数小时时间框架中对小鼠全脑进行迅速且均匀的免疫染色。
最广泛使用的免疫组织化学方法是通过首先使用靶标特异性的一抗染色然后添加与所述一抗结合的宿主物种特异性二抗的间接免疫染色,因为其允许信号放大和避免使荧光团与所有抗原特异性抗体缀合的需要。因此,eTANGO用于使用两个连续的非结合和结合循环对多种细胞标志物间接免疫染色,如图13A中所示。在使用无荧光团缀合的α-H3抗体的利用H3作为核复染剂缀合中,用酪氨酸羟化酶(TH)(对于儿茶酚的生物合成很重要的一种酶,其常用于中脑区域中多巴胺能神经元的可视化)对小鼠全脑进行eTANGO标记。如所预期的,α-H3抗体标记了所有核,而强的α-TH抗体信号限于公知的中脑多巴胺中心,例如腹侧被盖区(ventral tegmental area,VTA)和黑质(substantia nigra,SN),如图13B中所示。再一次,简单的强度阈值处理算法(intensity thresholdingalgorithm)精确鉴定了H3-免疫反应性细胞和TH-免疫反应性细胞,并且对中间VTA中的细胞总数和表达TH的神经元的计数,其可能归因于大体积中的均匀标记。
另外,对经清理水凝胶脑组织的小清蛋白(parvalbumin,PV)染色,这是一种广泛用作GABA能非锥体中间神经元亚群的标志物的钙结合蛋白。皮质层中PV(+)神经元的分布与先前的描述相匹配。出人意料地,发现Thy1-eGFP小鼠的腹后皮质区域中的许多PV(+)神经元也是eGFP(+),其在包括锥体神经元的神经元亚组中表达eGFP,表明一些锥体投射神经元也表达PV。还确认了这些神经元向下发出轴突纤维到外囊并且表现出典型锥体细胞的特性,例如锥体体细胞(pyramidal soma)、大尖端树突(large apical dendrite)、单轴突、多基部树突(multiple basal dendrite)和密集树突刺(dense dendritic spine)。尽管先前在小鼠或小鼠以外物种的压后(retrosplenial)皮质和躯体感觉皮质中描述了表达PV的投射神经元,但是这种PV(+)锥体神经元在其他皮质区域中的发现表明这种神经元亚型可代表可存在于不同皮质区域的不同类型的锥体神经元。这示出了eTANGO如何允许以无偏(non-biased)的方式整合多维信息(形态、连接和分子信息)的实例,其可允许鉴定被同时检查小的脑区域的常规方法低估的神经基底(neural substrate)。
图13A-B示出了:(13A)用于间接免疫组织化学的eTANGO实验方案和(13B)在利用eTANGO对TH和H3进行全脑免疫染色后3月龄Thy1-eGFP M系小鼠脑的腹侧被盖区(VTA)的3D渲染(SN是黑质,cp是大脑脚(大脑脚)),比例尺条等于300μm。
实施例4
本实施例描述了实施例2和3中所使用的方法。
实验对象:将实验开始时6-8周龄的雄性C57BL/6小鼠饲养在颠倒的12小时光/暗周期中。随意取用水和食物。
切片的经清理水凝胶组织够组织化学:为了对1mm厚脑组织切片进行染色,在水凝胶组织包埋步骤之后使用小鼠脑基质(RBM-2000C;ASIInstruments,Warren,MI)对组织进行切片。利用振动切片机(VT1200S;Leica,Buffalo Grove,IL)获得100μm厚切片。通过轻轻摇动着在37℃的50mL清理溶液中孵育对组织块进行被动清理。然后将经清理组织块放到24孔板中并且用染色缓冲溶液洗涤(在每幅图中指出)三次,每次两小时。然后在成像前将组织块孵育在相同的染色缓冲溶液中并且洗涤三次。对于间接免疫染色,在一抗之后对于二抗重复先前的步骤。所有洗涤和染色步骤在室温下轻轻摇动进行。然后将经染色切片光学清理并成像或直接成像。
eTANGO溶液制备:制备所选的非结合和结合缓冲液。使用以下缓冲液:(1)pH 11 LB缓冲液+SDS,其含有50mM氢氧化锂、10mM SDS、1%Triton-X 100和0.02%叠氮化钠并且用硼酸滴定至pH 11;(2)pH 11 LB缓冲液,其含有50mM氢氧化锂、1%Triton-X 100和0.02%叠氮化钠并且用硼酸滴定至pH 11;(3)pH 9 LB缓冲液,其含有50mM氢氧化锂、1%Triton-X 100和0.02%叠氮化钠并且用硼酸滴定至pH 9;(4)pH 7.5 TB缓冲液,其含有50mM Trizma碱(Sigma T6066)和0.02%叠氮化钠并且用硼酸滴定至pH 7.5。
eTANGO系统构建:定制eTANGO装置、样品室和相关附件(室盖、电机和电机控制器)并且装配。如下构建装置:(1)通过将2米的1/4″刚性、薄壁管(McMaster-Carr)浸渍在设置为1℃的冷却浴循环器(WiseCircu WCR-P8,1.6kW;Wisd Laboratory Instruments;Germany)中来制作热交换器;(2)使用电阻环氧树脂胶(Hysol ES1901;Henkel)将纳米多孔膜安装在样品室上。膜的孔径(截留分子量,即MWCO)小于期望探针的分子量。使用来自Spectrum Laboratories(Compton,CA)的以下膜:1kDa MWCO用于抗体;MWCO 6-8kDa用于抗体和凝集素;MWCO 100-500Da用于PO-PRO-1。(3)按如下顺序(流动方向)连接系统:泵(40PX,PanWorld,Japan)、热交换器、TANGO室和容器。热交换器直接设置在eTANGO室之前用于高效冷却。所有组件与合适尺寸的管(1/8”、3/8”)连接。(4)eTANGO装置放在在磁搅拌板(HI 190M,Hanna Instruments,RI)上并且添加小搅拌棒(30620-416;VWR)。在一些情况下,尼龙网(CMN-0074-D,Small Parts)用于构建围绕组织固定器的壁以将组织固定在适当位置。所测量的外溶液的温度为10-13℃。
eTANGO过程:使用以下步骤进行eTANGO过程。(1)室温下在非结合缓冲液中轻轻摇动着洗涤经清理凝胶组织2-3次一天,以利用非结合缓冲液平衡组织。或者,可以用eTANGO装置电泳洗涤组织以缩短洗涤时间。(2)向容器中填充非结合缓冲溶液、封闭装置并且开始循环。等到溶液冷却至10-13℃。(3)将组织放在室中并且向室装载具有3%牛血清白蛋白的非结合缓冲液。正好的缓冲溶液(3-5ml缓冲溶液)用于将组织浸渍在溶液中。(4)施加电场10分钟以使BSA分散在室中。(5)向组织室添加分子探针。(6)将组织室插入eTANGO装置并且向室施加50V 6小时。在该步骤中,探针分子开始均匀分布到整个经多孔CLARITY处理的组织中。运行时间可根据上述参数以及样品的尺寸、形状和密度以及探针分子的浓度、带电状态/电迁移率变化。(6)在非结合条件下的探针分布步骤之后,将缓冲溶液切换成结合缓冲液并且继续施加电压额外6小时或过夜。使室中的缓冲液组合物与室外的结合缓冲液平衡。在该步骤期间,分散的探针分子将与靶标结合。这种非结合/结合循环可重复数次以提高染色的均匀性。(7)对于洗涤,再次将缓冲液切换成非结合缓冲液,将室中的溶液替换成没有抗体的新鲜非结合缓冲液,并且施加电场。每小时更换溶液以增强未结合抗体的洗涤。(8)对于间接免疫染色(或相关多步骤染色程序),用二抗从步骤(3)开始重复。(9)在免疫染色之后,室温下将组织样品在~50ml的10mM LB,200mM SDS(pH 8-9)中于摇床上孵育过夜。
利用PROTOS光学清理:通过每100mL超纯水溶解75g泛影酸(D9268l Sigma-Aldrich)、70g d-山梨醇(S1876;Sigma-Aldrich)和23gn-甲基-d-葡糖胺(M2004;Sigma-Aldrich)来制备PROTOS(pH/折射率/渗量可调的光学清理溶液)。室温下轻轻摇动着将经处理样品在10mLPROTOS中孵育2-3天(每天更换溶液),用于折射率匹配和成像。选择所列比例以获得接近中性的pH,1.46左右的折射率和逆转清理期间观察到的组织膨胀的渗量。通过添加更大量n-甲基-d-葡糖胺可获得碱性更高的溶液,通过用额外的d-山梨醇代替泛影酸可降低渗量。使用AbbematWR/MW自动多波长折射计(Anton Paar,VA)测量折射率。
组织变形实验:为了评估随机电转运使组织样品变形的程度,将经清理脑组织在pH 11 LB缓冲液中放在eTANGO装置中并且旋转着经受50V。对于仅1D电泳,将另一个组织以这样的方式放置在eTANGO装置中:侧面(但不是背侧和腹侧)靠近电极并且不旋转。
Gel/BSA-FITC实验:为了在实验上测试通过水凝胶的随机电转运,由超纯水中4%丙烯酰胺、0.07%双丙烯酰胺、0.25%偶氮引发剂和1×PBS的溶液(全部为重量/体积)制备盘形聚丙烯酰胺凝胶(半径9mm;高8mm)。如上文对于CLARITY程序描述的那样将溶液在15ml圆锥管中脱气并且聚合,并且将所得圆柱形凝胶用剃刀刀片切成~8mm厚的圆盘。向eTANGO样品室装载BSA-FITC溶液(1mg/ml于pH 7.5 TB中),使盘形凝胶的圆形侧接触室的底部,平坦侧直立。pH 7.5 TB通过设备循环。然后施加200V 1小时或3小时以将向凝胶中转运BSA-FITC。然后使用大鼠脑基质从中部获得3mm厚的横截切片,并且利用荧光立体显微镜成像。
经CLARITY或eTANGO处理的小鼠脑组织的安放和成像:在PROTOS中孵育之后,将样品安放在载玻片与Willco皿(14032-120;Ted Pella)之间。将一块Blu-Tack黏合剂(Blu-tack via Amazon)卷成厚度稍微大于样品厚度的柱形并且以U形放在在载玻片上。然后将样品仔细放在Blu-Tack内侧并且将Willco皿紧紧压在黏合剂上(唇形侧朝上),直到其恰好与样品接触。然后将PROTOS注射到黏合剂之间的空隙空间中直到充满成像室而不引入气泡。然后使用环氧树脂胶(epoxy glue)(Hysol ES1901;Henkel)填充Blu-Tack中的间隙以构建壁并且密封在样品中。使用两个显微镜系统。尽管本文已经描述和举例说明了本发明的多个实施方案,但是本领域普通技术人员将容易想到用于执行本文中所述的功能和/或获得本文中所述结果和/或一个或更多个优点的多种其他装置和/或结构,并且每一种这样的变化和/或修改被认为是在本发明的范围内。更一般地,本领域技术人员将容易理解,本文中描述的所有参数、尺寸、材料和/或构造意在示例,并且真实参数、尺寸、材料和/或构造将取决于本发明教导所使用的特定应用。本领域技术人员将承认或者仅使用常规实验就能够确定本文中所述本发明的一些特定实施方案的等效方案。因此,应理解,前述一些实施方案仅以举例的方式给出,并且在所附权利要求及其等效方案的范围内,可以以具体描述和要求保护的那些以外的方式实施本发明。本发明涉及本文中所述的每一个单独特征、系统、制品、材料、试剂盒和/或方法。另外,两个或更多个这样的特征、系统、制品、材料、试剂盒和/或方法的组合(如果这样的特征、系统、制品、材料、试剂盒和/或方法不互相矛盾的话)也包括在本发明的范围内。
本文在说明书和权利要求书中未用数量词限定的名词应理解为意指“至少一个/种”,除非明确指出相反情况。
本文在说明书和权利要求书中使用的短语“和/或”应理解为所连接的要素中的“任一个或两个”,即,在一些情况下要素联合存在,而在另一些情况下分开存在。可能任选地存在通过“和/或”项明确指出的要素以外的其他要素,而不论其与明确指出的那些要素相关还是不相关,除非明确指出相反情况。因此,作为非限制性实例,当与开放式语言如“包含”联合使用时,提及“A和/或B”在一个实施方案中可指A而没有B(任选地包含除了B以外的要素);在另一个实施方案中可指B而没有A(任选地包含除了A以外的要素);在又一个实施方案中,可指A和B二者(任选地包含其他要素);等。
本文在说明书和权利要求书中使用的“或”应理解为具有与上文中定义的“和/或”相同的含义。例如,当分开列表中的项时,“或”或“和/或”应解释为包含,即包含若干要素或要素列表中的至少一个,但是也包含超过一个,并且任选地包含额外未列出的项。仅明确指出相反情况的术语,例如“仅一个”或“恰好一个”或当用于权利要求时“由......组成”将指包含若干要素或要素列表中的恰好一个要素。一般来说,当前面加上排外性术语如“任一个”或“中的一个”、“中的仅一个”或“中的恰好一个”时,本文中使用的术语“或”应仅解释为互斥选择(即,“一个或另一个但不是两个”)。当用于权利要求时,“基本上由......组成”应具有专利法领域中使用的普通含义。
本文在说明书和权利要求书中关于一个或更多个要素的列表使用的短语“至少一个”应理解为意指选自要素列表中的任一个或更多个要素的至少一个要素,但是未必包含要素列表中明确列出的每个和每一个要素中的至少一个,并且不排除要素列表中要素的任意组合。该术语还允许可任选地存在短语“至少一个”所指的要素列表中明确指出的要素以外的要素,而不论所述要素与指出的要素相关或不相关。因此,作为非限制性实例,“A和B中的至少一个”(或等效地,“A或B中的至少一个”,或等效地,“A和/或B中的至少一个”)在一些实施方案中可指至少一个A,任选地包含超过一个A,但是不存在B(任选地包含除了B以外的要素);在另一个实施方案中,指至少一个B,任选地包含超过一个B,但是不存在A(任选地包含除了A以外的要素);在又一个实施方案中,指至少一个A,任选地包含超过一个A,和至少一个B,任选地包含超过一个B(并且任选地包含其他要素);等。
在权利要求书和上述说明书中,所有过渡短语如“包含”、“包括”、“携带”、“具有”、“含有”、“涉及”、“持有”等应理解为开放式的,即意指包括但不限于。仅连接词(transitional phrase)“由......组成”和“基本上由......组成”应分别为封闭式或半封闭式连接词,如美国专利局专利审查程序手册2111.03部分中所示。
- 还没有人留言评论。精彩留言会获得点赞!