在微流体装置上冷冻和存档细胞的制作方法
本公开一般涉及用微流体装置处理和储存生物细胞。
背景技术:
随着微流体领域的不断发展,微流体装置已经成为处理和操纵诸如生物细胞的微物体的便利平台。即使如此,微流体装置的全部潜力,特别是应用于生物科学的全部潜力尚未实现。例如,尽管已经将微流体装置应用于生物细胞的分析,但仍然继续使用诸如试管和微量滴定板的容器来储存和存档这些细胞。这些类型的容器(试管和微量滴定板)不能很好地与微流体装置相互作用。此外,它们相对较大,因此当它们用于生物细胞的储存和存档时,占用大量昂贵的冷冻空间,并且需要大量昂贵的细胞保存试剂。
技术实现要素:
根据本文公开的实施例,用于在微流体装置中处理和储存生物细胞的示例性方法包括:(i)将可流动介质引入微流体装置中,可流动介质包括生物细胞,(ii)将来自可流动介质的一个或更多个生物细胞隔离在微流体装置的一个或更多个隔离区域中,以及(iii)冷冻包括被隔离在其中的所述一个或更多个生物细胞的微流体装置。微流体装置可以包括流动区域,所述一个或更多个隔离区域流体连接到流动区域。尽管最初可将少至单个的生物细胞隔离在微流体装置内,但更通常地,在微流体装置内的多个隔离区域中的每一个中隔离至少单个的细胞。在该方法的实施例中使用的通常的微流体装置可以具有从几十个到几百个或更多个中的任何数量的隔离区域,每个隔离区域的体积(没有限制)在约1.5×105立方微米到约1.5×106立方微米的范围中,因此能够隔离多达约10个细胞至约50个细胞或更多。在一个实施例中,在冷冻微流体装置之前,培养微流体装置的第一隔离区域中的一个或更多个被隔离(“起始”)的细胞,以在第一隔离区域中产生足够的(例如,至少8个或更多个,优选至少10、16、20、24、30或更多个细胞)多个“新”细胞使得在解冻微流体装置之后至少一个活细胞将存在于第一隔离区域中。
虽然并未实施公开的方法所必须的,但在优选实施例中,在冷冻微流体装置之前,创建并储存微流体装置的内容的文库以备将来检索和参考。例如,以示例的方式而不是限制,文库可以包括用于一个或更多个隔离的细胞中的每一个的标识(例如,隔离细胞的来源,诸如患者/受试者样品编号)和隔离区域位置。在一些实施例中,文库进一步包括识别以下各项中的一个或更多个的信息:(i)如何获得可流动介质中的生物细胞,(ii)如果有的话,在生物细胞被引入到微流体装置中之前或之后对生物细胞进行的处理,(iii)如果有的话,在一个或更多个隔离的生物细胞被隔离在隔离室中之后对该一个或更多个隔离的生物细胞进行的处理,(iv)在任何这样的隔离前或隔离后处理的期间获得的数据。微流体装置可以包括识别标记,诸如条形码、贴纸、rfid等,并且装置文库可以存储在数据库中,该数据库参考装置的识别标记。可选择地或附加地,装置文库可以被存储在与微流体装置耦接并且与其一起冷冻的存储器芯片(例如,eeprom等)中。
在各种实施例中,该方法还包括(在冷冻装置之前)将诸如二甲基亚砜(dmso)的细胞保存试剂引入到微流体装置中。在一个这样的实施例中,dmso以选择的相应浓度和持续时间被引入微流体装置中,使得在冷冻微流体装置时一个或更多个隔离的生物细胞基本上被含有约10%dmso的溶液包围。在一个这样的实施例中,dmso以约15%至约25%的体积浓度(例如,取决于微流体装置中的流动区域的体积与隔离区域的总体积的比例)被引入到微流体装置中,并被允许扩散到含有隔离的生物细胞的一个或更多个隔离区域中。在另一个这样的实施例中,灌注dmso穿过微流体装置足够的时间以在一个或更多个隔离区域中的每一个中实现约10%的dmso浓度。
在各种实施例中,冷冻微流体装置可以包括使微流体装置达到近冷冻(例如,约4℃)或冷冻(例如,约0℃)的温度的初始受控冷却540、随后的使微流体装置达到零下温度的额外冷却。作为示例而是非限制性的,微流体装置的初始受控冷却可以是在约每分钟1℃至约每分钟2℃的范围中的速率,也可以使用更慢(例如每分钟0.1℃)或更快(例如每分钟3.0℃或更快)的速率。在各种实施例中,零下温度为约-20℃或更低,并且更优选为约-80℃或更低,在一些实施例中包括约-150℃或更低。
该方法还可以包括解冻微流体装置,例如通过(i)微流体装置的受控加热和(ii)允许微流体装置自热至室温中的一种或两种方式,以便在解冻后测试、评估、测定、测序和/或使用隔离的细胞。例如,在一些实施例中,在解冻微流体装置之后,该方法包括在微流体装置中培养一个或更多个活细胞(例如通过连续或间歇灌注可流动的细胞生长基质穿过微流体装置),从而在微流体装置产生额外的细胞。在这样的实施例中,该方法还可以包括(在解冻之后)识别在解冻微流体装置之后一个或更多个隔离的细胞和/或由其产生的细胞中的哪一个是有活力的,和/或从微流体装置中取回至少一个隔离的细胞和/或由其产生的细胞。举例来说,在解冻之后,可以对微流体装置中的一个或更多个细胞进行测定以检测细胞分泌(例如包含抗体或细胞因子的免疫学分子)或细胞表面标记。
在某些实施例中,可以在具有一个或更多个被调理以减少结垢和/或细胞粘附的其内表面(例如,基板表面、盖子表面和/或通路材料的表面)的微流体装置执行该方法。例如,可以用阻止溶液处理流动区域和所述一个或更多个隔离区域以防止结垢和/或细胞粘附。因此,阻止溶液可包含结合到一个或更多个内表面的阻止剂,例如血清、血清白蛋白(例如bsa)、聚合物、去污剂、酶或其任意组合。
在某些实施例中,微流体装置可以包括包含涂覆材料的内部基板表面(和/或内部盖子表面和/或通路材料的内表面)。在一些实施例中,涂覆材料包括具有连接基和烷基基团的分子。连接基可以以共价键结合到内部基板表面,并且可以是例如甲硅烷氧基连接基。例如,烷基基团可以是未取代的烷基基团或取代的烷基基团,诸如氟烷基基团或全氟烷基基团。烷基基团可以包括含有至少10个碳原子(例如至少12、14、16、18、20、22或更多个碳原子)的直链碳。涂覆材料的分子可以形成与内部基板表面(和/或内部盖子表面和/或通路材料的内表面)以共价键结合的致密包封的单层结构。
在一些实施例中,涂覆材料包含具有连接基和阳离子基团和/或阴离子基团的分子,其中连接基以共价键结合到内部基板表面(和/或内部盖子表面和/或通路材料的内表面)。阳离子基团可以包括季铵基。阴离子基团可以包括膦酸、羧酸或磺酸。在一些相关的实施例中,涂覆材料可以包含具有连接基和两性离子基团的分子,其中连接基以共价键结合到内部基板表面(和/或内部盖子表面和/或通路材料的内表面)。两性离子基团选自羧酸甜菜碱、磺酸甜菜碱、氨基磺酸和氨基酸。在一些实施例中,阳离子基团、阴离子基团或两性离子基团能够与阻止剂以离子键结合。
在一些实施例中,涂覆材料包含含有亚烷基醚基团、糖基团或氨基酸基团的聚合物。例如,涂覆材料可以包含葡聚糖。可选择地或另外地,涂覆材料可以包含聚乙二醇。
所公开发明的实施例的其他和进一步的方面和特征将从参考附图的随后详细描述中变得显而易见。
附图说明
图1a是系统的示例性实施例的透视图,该系统包括用于培养生物细胞的微流体装置。
图1b是图1a的微流体装置的侧视剖视图。
图1c是图1a的微流体装置的俯视剖视图。
图1d是具有介电电泳(dep)配置的微流体装置的实施例的侧视剖视图。
图1e是图1d的微流体装置的一个实施例的俯视剖视图。
图2示出可用于图1a的微流体装置中的隔离室的示例,其中从流动通道到隔离区域的连接区域的长度大于在流动通道中流动的介质的穿透深度。
图3是可以在图1a的微流体装置中使用的隔离室的另一个示例,其包括从流动通道到隔离区域的连接区域,该连接区域比在流动通道中流动的介质的穿透深度长。
图4a-图4c示出微流体装置的另一个实施例,包括在该微流体装置使用的隔离室的另一个示例。
图5示出了微流体装置的实施例,该微流体装置具有以共价键结合到基板和器件盖的内表面的涂覆材料。
图6是处理、储存(通过冷冻)、解冻和进一步处理微流体装置中生物细胞的示例性方法的示意性流程图。
图7是创建和存储隔离在微流体装置中的生物细胞的文库的示例性方法的示意性流程图。
图8是冷冻微流体装置的示例性方法的示意性流程图,该微流体装置包含一个或更多个隔离在其中的生物细胞。
图9是解冻冷冻的微流体装置的示例性方法的示意流程图,该微流体装置包括一个或更多个隔离在其中的生物细胞。
具体实施方式
本说明书描述了本发明的示例性实施例和应用。然而,本发明不限于这些示例性实施例和应用,或者不限于在本文中示例性实施例和应用运行或被描述的方式。而且,附图可示出简化或局部视图,并且为了清楚起见,附图中的元件尺寸可以被夸大或者可以不按比例。此外,当在本文中使用术语“在…上”、“附接到”、或“耦接到”时,一个元件(例如,材料、层、基板等)可以“在另一个元件上”、“附接到另一个元件”、或“耦接到另一个元件”,而不管该一个元件直接在另一个元件上、附接、或耦接到该另一个元件,还是有一个或更多个介入元件在该一个元件和该另一个元件之间。此外,如果提供的话,方向(例如,在上面、在下面、顶部、底部、侧面、上、下、在…下方、在…上方、上部、下部、水平、垂直、“x”、“y”、“z”等)是相对的并且仅作为示例提供,以便于说明和讨论并且不作为限制。此外,在对一系列元件(例如元件a、b、c)进行描述的情况下,这些描述旨在包括所列出的元件自身的任何一个、少于全部所列出的元件的任意组合和/或全部所列出的元件的组合。
说明书中的块的划分仅便于查看,并不限制所讨论的任何元件组合。
如本文所使用的,“基本上”是指足以达到预期目的。术语“基本上”因此允许对绝对或完美状态、尺寸、测量、结果等进行诸如本领域普通技术人员可以预期的、但对总体性能没有显着影响的、小的、不重要的变型。当针对数值或者可以被表示为数值的参数或特征使用时,“基本上”是指在百分之十内。术语“多个”是指多于一个。
如本文所用,术语“微物体”可以包括以下中的一种或更多种:无生命微物体,诸如微粒、微珠(例如,聚苯乙烯珠、luminextm珠等)、磁珠、顺磁珠、微棒、微线、量子点等;生物微物体,诸如细胞(例如,胚胎、卵母细胞、精子、从组织分离的细胞、血细胞、免疫细胞(包括t细胞、b细胞、巨噬细胞、nk细胞、树突细胞(dc)等)、杂交瘤、培养细胞、从组织分离的细胞、来自细胞系的细胞(例如可以被转染和/或转化的cho细胞)、包括循环肿瘤细胞(ctc)的癌细胞、感染的细胞、报道细胞等)、脂质体(例如,合成的或由膜制备衍生的)、脂质纳米筏等;或无生命微物体和生物微物体的组合(例如,附着于细胞的微珠、脂质体包覆微珠、脂质体包覆磁珠等)。已经描述了脂质纳米筏,例如在ritchieetal.(2009)reconstitutionofmembraneproteinsinphospholipidbilayernanodiscs,mehotdenzymol.,464:211-231(里奇等人(2009年),磷脂双分子层奈米圆盘中的膜蛋白的重组,方法酶学,464:211-231)中描述的。珠粒还可以具有共价或非共价连接的其它部分/分子,诸如能够在测定中使用的荧光标记、蛋白质,小分子信号传导部分、抗原或化学/生物物种。
如本文所用,术语“细胞”是指生物细胞,其可以是植物细胞、动物细胞(例如哺乳动物细胞)、细菌细胞、真菌细胞等。哺乳动物细胞可以来自例如人类、小鼠、大家鼠、马、山羊、绵羊、牛、灵长类动物等。
如本文所使用的,术语“维持(一个或更多个)细胞”是指提供包括流体和气体成分的环境,以及可选地提供保持细胞存活和/或扩增所必须的条件的表面。
流体介质的“组分”是存在于介质中的任何化学或生物化学分子,包括溶剂分子、离子、小分子、抗生素、核苷酸和核苷、核酸、氨基酸、肽、蛋白质、糖、碳水化合物、脂质、脂肪酸、胆固醇、代谢产物等。
如本文关于流体介质所使用的,“使…扩散”和“扩散”是指流体介质的组分朝浓度梯度低的方向的热力学移动。
短语“介质的流动”是指流体介质的除扩散之外的由任何机制导致的整体移动。例如,介质的流动可以包括由于点之间的压力差从一个点到另一个点的流体介质的移动。这样的流动可以包括液体的连续的、脉冲的、周期的、随机的、间歇的或往复的流动,或者其任意组合。当一种流体介质流入到另一种流体介质中时,可导致介质的湍流和混合。
短语“基本上没有流动”是指流体介质在时间上的平均流速小于将材料(例如,目标分析物)的组分扩散到流体介质中或者在流体介质内扩散的速率。这种材料的组分的扩散速率可取决于例如温度、组分的大小以及组分与流体介质之间的相互作用的强度。
如本文关于微流体装置内的不同区域所使用的,短语“流体连接”是指当不同区域基本上填充有流体(诸如流体介质)时,每个区域中的流体被连接以形成流体的单个本体。这并不意味着不同区域中的流体(或流体介质)在组成上一定是相同的。而是,在微流体装置的不同的流体连接区域中的流体可具有不同的组成(例如,不同浓度的溶质,如蛋白质、碳水化合物、离子、或其它分子),其由于溶质向其各自的浓度梯度下降方向移动和/或由于流体通过该装置流动而不断变化。
在一些实施例中,微流体装置可以包括“波及”区域和“未波及”区域。未波及区域可以流体连接到波及区域,假设该流体连接被配置为使得介质在波及区域与未波及区域之间能够扩散而不是基本上没有流动。微流体装置可因此被配置为基本上使未波及区域与波及区域中的介质流分离,同时使得在波及区域与未波及区域之间仅能够进行扩散流体连通。
本文所用的“微流体通道”或“流动通道”是指长度明显长于水平尺寸和垂直尺寸的微流体装置的流动区域。例如,流动通道的长度可以是水平或垂直尺寸的至少5倍,例如,至少10倍、至少25倍、至少100倍、至少200倍、至少300倍、至少400倍、至少500倍或更长。在一些实施例中,流动通道的长度在约20,000微米至约100,000微米的范围内,包括其间的任何范围。在一些实施例中,水平尺寸在约100微米至约300微米的范围内(例如约200微米),垂直尺寸在约25微米至约100微米的范围内,例如约40微米至约50微米。应当注意,流动通道在微流体装置中可以具有各种不同的空间构造,因此不限于完美的线性元件。例如,流动通道可以是或包括具有以下构造的一个或更多个部分:曲线、弯曲,螺旋、倾斜、下降、分叉(例如多个不同的流动路径)以及它们的任意组合。此外,流动通道沿其路径可以具有不同的横截面积,扩大和收缩以在其中提供所需的流体流动。
在某些实施例中,微流体装置的流动通道是波及区域(以上定义)的示例,而微流体装置的分离区域(下文将进一步详细描述)是未波及区域的示例。
可以在这种微流体装置中测定生物微物体(例如,生物细胞)产生特定生物材料(例如,蛋白质,诸如抗体)的能力。例如,包括待测定的用于产生目标分析物的生物微物体(例如,细胞)的样本材料可以被装载到微流体装置的波及区域中。多个生物微物体(例如,哺乳动物细胞,诸如人体细胞)可以针对特定特征而被选择并且被设置在未波及区域中。然后,其余样本材料可以从波及区域流出,并且测定材料可以流入到波及区域中。由于所选择的生物微物体在未波及区域中,因此所选择的生物微物体基本上不受剩余样本材料的流出或测定材料的流入的影响。所选择的生物微物体可以允许产生目标分析物,其可以从未波及区域扩散到波及区域中,其中目标分析物可以与测定材料反应以产生局部可检测反应,每个局部可检测反应可以与特定的未波及区域相关联。与检测到的反应相关联的任何未波及区域可以被分析,以确定在未波及区域中的哪些生物微物体(如果有的话)是目标分析物的足够生产者。
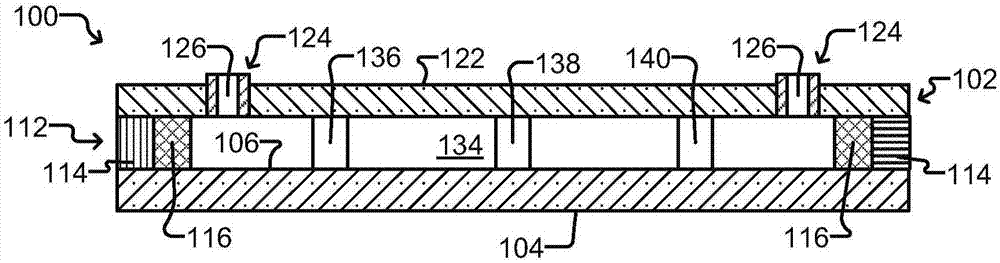
包括微流体装置的系统。图1a-图1c示出了具有微流体装置100的系统的示例,微流体装置100可用于本文所述的方法中。如图所示,微流体装置100包围微流体通路132,该微流体通路132包含多个互连的流体通路元件。在图1a-1c所示的示例中,微流体通路132包括流动通道134,流动通道134流体连接到隔离室136、隔离室138、隔离室140。尽管在所示实施例中示出了一个流动通道134和三个隔离室136、138、140,但是应当理解,在替代实施例中,可以分别有多于一个的流动通道134以及多于或少于三个的隔离室136、138、140。微流体通路132还可以包括另外的或不同的流体通路元件,例如流体室、贮液器等。
微流体装置100包括包围微流体通路132的壳体102,微流体通路132可包含一种或更多种流体介质。虽然装置100可以以不同的方式物理构造,但在图1a-1c所示的实施例中,壳体102包括支撑结构104(例如基底)、微流体通路结构112和盖子122。支撑结构104、微流体通路结构112和盖子122可以彼此附接。例如,微流体通路结构112可以设置在支撑结构104上,盖子122可以设置在微流体通路结构112上。利用支撑结构104和盖子122,微流体通路结构112可以限定微流体通路132。微流体通路132的内表面在附图中标识为106。
如图1a和图1b所示,支撑结构104可以位于装置100的底部,盖子122位于装置100的顶部。可选择地,支撑结构104和盖子122可以处于其他方位。例如,支撑结构104可以位于装置100的顶部,盖子122位于装置100的底部。不管配置如何,设置一个或更多个流体通过(即进入和出去)口124,每个流体通过口124包括与微流体通路132连通的通道126,允许流体材料流入或流出壳体102。流动通道126可包括阀、闸门、通孔等。尽管在所示实施例中示出了两个流体通过口124,但是应当理解的是,装置100的替代实施例可以仅具有一个流体通过口124或具有多于两个的流体通过口124,其提供流体材料进入和流出微流体通路132。
微流体通路结构112可以限定或容纳微流体通路132的通路元件或位于壳体102内的其它类型的通路。在图1a-图1c所示的实施例中,微流体通路结构112包括框架114和微流体通路材料116。
支撑结构104可以包括基板或多个互连的基板。例如,支撑结构104可以包括一个或更多个互连的半导体基板、印刷电路板(pcb)等及其组合(例如,安装在pcb上的半导体基板)。框架114可以部分地或完全地围绕微流体通路材料116。框架114可以是例如基本上围绕微流体通路材料116的相对刚性的结构。例如,框架114可以包括金属材料。
微流体通路材料116可以用空腔等图案化以限定微流体通路132的互连和微流体通路元件。微流体通路材料116可以包括柔性材料(例如,橡胶、塑料、弹性体、硅树脂、聚二甲基硅氧烷(“pdms”)等),其可以是透气的。可构成微流体通路材料116的材料的其他例子包括模制玻璃、诸如硅(例如,可光图案化的硅)的可蚀刻材料、光致抗蚀剂(例如su8)等。在一些实施例中,这样的材料(并且因此微流体通路材料116)可以是刚性的和/或基本上不透气的。不管所使用的材料如何,微流体通路材料116都在框架114内设置在支撑结构104上。
盖子122可以是框架114和/或微流体通路材料116的组成部分。或者,盖子122可以是结构上不同的元件(如图1a和1b所示)。盖子122可以包括与框架114和/或微流体通路材料116相同或不同的材料。类似地,支撑结构104可以是与框架114或微流体通路材料116分开的结构(如图所示),或者是框架114或微流体通路材料116的组成部分。同样,框架114和微流体通路材料116可以是如图1a-1c所示的分开结构或相同结构的组成部分。在一些实施例中,盖子或顶盖122由刚性材料制成。刚性材料可以是玻璃或类似物。在一些实施例中,刚性材料可以是导电的(例如,ito涂覆的玻璃)和/或被改性的,以支持细胞粘附、存活和/或生长。改性可以包括合成或天然聚合物的涂覆。在一些实施例中,定位在图1a-图1c的各隔离室136、138、140上方的盖子或顶盖122的一部分或者在图2、图3和图4中所示的下述实施例中的等同物,由包括但不限于pdms的可变形材料制成。因此,盖子或顶盖122可以是具有刚性部分和可变形部分的复合结构。在一些实施例中,盖子122和/或支撑结构104对光线是透明的。
盖子122还可以包括至少一种透气的材料,包括但不限于pdms。
其他系统组件。图1a还示出了可以与微流体装置100一起使用的控制/监控系统170的简化框图描绘,控制/监控系统170与微流体装置100一起提供用于生物细胞培养的系统。如图所示(示意性地),控制/监控系统170包括控制模块172和控制/监控设备180。控制模块172可以被配置为直接和/或通过控制/监控设备180来控制和监视装置100。
控制模块172包括控制器174和存储器176。控制器174可以是例如数字处理器、计算机等,存储器176可以是例如非暂时性数字储存器,用于将数据和机器可执行指令(例如,软件、硬件、微代码等)存储为非暂时性数据或信号。控制器174可以被配置为根据存储在存储器176中的这样的机器可执行指令进行操作。可选地或另外地,控制器174可以包括硬连线(hardwired)的数字电路和/或模拟电路。控制模块172因此可以被配置为执行(自动地或者基于用户直接输入)本文描述的方法中有用的任何处理、本文讨论的这样的处理的步骤、功能、动作等。
控制/监控设备180可以包括多种不同类型的装置中的任何一种,用于控制或监控微流体装置100和利用微流体装置100执行的处理。例如,控制/监控设备180可以包括:电源(未示出),用于向微流体装置100供电;流体介质源(未示出),用于向微流体装置100提供流体介质或从微流体装置100移除介质;动力模块,以非限制性示例的方式,例如选择器控制模块(下面描述),用于控制微流体通路132中的微物体(未示出)的选择和移动;图像捕捉机构,以非限制性示例的方式,例如用于捕捉微流体通路132内部的图像(例如,微物体的图像)的检测器(下面描述);刺激机构,以非限制性示例的方式,例如如图1d所示的实施例的下述光源320,用于将能量引导到微流体通路132中以刺激反应;等等。
更特别地,图像捕捉检测器可以包括用于检测流动区域中的事件的一个或更多个图像捕捉装置和/或机构,流动区域包括但不限于图1a-图1c、图2和图3所示的实施例的流动通道134,图4a-图4c所示实施例的流动通道434,图1d-图1e所示实施例的流动区域240,和/或各个示出的微流体装置100、微流体装置300和微流体装置400的隔离室,事件包括包含在占据各流动区域和/或各隔离室的流体介质中的微物体。例如,检测器可以包括能够检测流体介质中的微物体(未示出)的一个或更多个辐射特性(例如,由于荧光或发光)的光电检测器。例如,这样的检测器可以配置为检测介质中的一个或更多个微物体(未示出)正在辐射电磁辐射和/或辐射的近似波长、亮度、强度等。检测器可以在光的可见、红外或紫外波长下捕捉图像。合适的光电检测器的示例包括但不限于光电倍增管检测器和雪崩光电检测器。
合适的成像装置的例子包括检测器,该检测器可以包括数字照相机或光电传感器,诸如电荷耦合器件和互补金属氧化物半导体(cmos)成像器。可以用这样的装置捕获图像并且分析(例如,由控制模块172和/或操作员)。
流动控制器可以被配置为控制流体介质在各所示微流体装置100、微流体装置300和微流体装置400的流动区域/流动通道/波及区域中的流动。例如,流动控制器可以控制流体的方向和/或流速。流动控制器的这种流动控制元件的非限制性示例包括泵和流体致动器。在一些实施例中,流体控制器可以包括附加元件,诸如一个或更多个传感器,用于感测例如在流动区域/流动通道/波及区域中介质的流动速度和/或ph。
控制模块172可以配置为从选择器控制模块、检测器和/或流动控制器接收信号并且对其进行控制。
特别参考图1d中所示的实施例,光源320可以将对照射和/或荧光激发有用的光引导到微流体通路132中。可选择地或另外地,光源可以将能量引导到微流体通路132中以刺激反应,包括向dep配置的微流体装置提供选择和移动微物体所需的激活能量。光源可以是能够将光能投射到微流体通路132中的任何合适的光源,例如高压汞灯、氙弧灯、二极管、激光器等。二极管可以是led。在一个非限制性示例中,led可以是广谱“白光”led(例如prizmatix的uhp-t-led-white)。光源可以包括用于产生结构化光(structuredlight)的投影仪或其他装置,诸如数字微镜装置(dmd)、msa(微阵列系统)或激光器。
用于选择和移动包括生物细胞的微物体的动力模块。如上所述,控制/监控设备180可以包括用于选择和移动微流体通路132中的微物体(未示出)的动力模块。可以使用各种动力机构。例如,介电泳(dep)机构可用于选择和移动微流体通路中的微物体(未示出)。图1a-图1c的微流体装置100的支撑结构104和/或盖子122可以包括dep配置,用于在微流体通路132中的流体介质(未示出)中的微物体(未示出)上选择性地诱发dep力,从而选择、捕获和/或移动单个微物体。控制/监控设备180可以包括用于这种dep配置的一个或更多个控制模块。可以替代地使用重力、磁力、流体流动等,在微流体通路内移动或者从微流体通路输出包括细胞的微物体。
具有dep配置的微流体装置(包括支撑结构104和盖子122)的一个示例是图1d和图1e中所示的微流体装置300。尽管为了简单起见,图1d和1e示出了微流体装置300的流动区域240的一部分的侧剖视图和俯视剖视图,但是应当理解,微流体装置300还可以包括一个或更多个隔离室以及一个或更多个另外的流动区域/流动通道,例如本文关于微流体装置100和400描述的那些,dep配置可以合并在微流体装置300的任何这样的区域中。应当进一步理解的是,任何上述或下面要描述的微流体系统部件可以合并到微流体装置300中和/或与微流体装置300结合使用。例如,包括上面结合图1a-图1c的微流体装置100描述的控制/监控设备180的控制模块172也可以与微流体装置300一起使用,包括一个或更多个图像捕捉检测器、流动控制器和选择器控制模块。
如图1d所示,微流体装置300包括第一电极304、与第一电极304间隔开的第二电极310以及覆盖电极310的电极激活基板308。各第一电极304和电极激活基板308限定流动区域240的相对表面,其中包含在流动区域240中的介质202提供电极304和电极激活基板308之间的电阻流动路径。还示出了电源312,电源312配置为连接到第一电极304和第二电极310并在电极之间产生偏压,用于在流动区域240中产生dep力。电源312可以是例如交流(ac)电源。
在某些实施例中,图1d和图1e中所示的微流体装置300可以具有光学致动的dep配置,例如光电镊子(oet)配置。在这样的实施例中,可以通过选择器控制模块控制来自光源320的光322的图案改变,这可以用来选择性地激活在流动区域240的内表面242上的目标位置314上的“dep电极”的图案的改变。在下文中,流动区域240的内表面242上的目标区域314被称为“dep电极区域”。
在图1e所示的示例中,引导到内表面242上的光图案322'以所示的方形图案照射交叉影线的dep电极区域314a。其他dep电极区域314未被照射并在下文中称为“暗”dep电极区域314。通过dep电极激活基板308(即,从内表面242上的每个暗电极区域314到第二电极310)的电阻抗大于通过介质202(即,从第一电极304穿过流动区域240中的介质202到内表面242上的暗dep电极区域314)的电阻抗。然而,照射dep电极区域314a降低了通过电极激活基板308(即,从内表面242上的照射的dep电极区域314a到第二电极310)的阻抗,以小于通过介质202(即,从第一电极304穿过流动区域240中的介质202到达内表面242上的照射的dep电极区域314a)的阻抗。
利用激活的电源312,前述配置在各个照射的dep电极区域314a和相邻的暗dep电极区域314之间的介质202中产生电场梯度,这又产生局部dep力,以吸引或排斥流动介质202中的附近微物体(未示出)。以这种方式,吸引或排斥介质202中的微物体的dep电极可以被选择性地激活和停用,以便通过改变从光源320投射到微流体装置300中的光图案322来操纵(即移动)在流动区域240之内的微物体。例如,光源320可以是激光器或其他类型的结构化光源,例如投影仪。dep力吸引或排斥附近的微物体可以取决于参数,例如但不限于,电源312的频率和介质202和/或微物体(未示出)的介电性质。
图1e中所示的照射的dep电极区域314a的正方形图案322'仅是示例。dep电极区域314的任何数量的图案或配置可以通过从源320投射到装置300中的对应图案的光322被选择性地照射,并且可以通过改变光图案322来重复地改变照射的dep电极区域322'的图案,以便操纵流体介质202中的微物体。
在一些实施例中,电极激活基板308可以是光电导材料,并且内表面242的其余部分可以是无特色的。例如,光电导材料可以由非晶硅制成,并且可以形成具有约500纳米至约2微米厚度(例如,基本上1微米厚)的层。在这样的实施例中,根据光图案322(例如,图1e所示的光图案322'),可以在流动区域240的内表面242上的任何位置并以任何图案形成dep电极区域314。照射的dep电极区域314a的数量和图案因此不是固定的,而是对应于各投射的光图案322。在美国专利no.7,612,355中示出了示例,其中未掺杂的非晶硅材料被用作可构成电极激活基板308的光电导材料的示例。
在其他实施例中,电极激活基板308可以包括基板,该基板包含多个掺杂层、电绝缘层和形成如半导体领域中已知的半导体集成电路的导电层。例如,电极激活基板308可以包括光电晶体管阵列。在这样的实施例中,电路元件可以形成在流动区域240的内表面242处的dep电极区域314与第二电极310之间的电连接,其可以被各光图案322选择性地激活。当未被激活时,通过每个电连接(即,从内表面242上的相应dep电极区域314通过电连接到第二电极310)的电阻抗可大于通过介质202(即,从第一电极304通过介质202到达内表面242上的对应的dep电极区域314)的阻抗。然而,当被光图案322的光激活时,通过照射的电连接(即,从每个照射的dep电极区域314通过电连接到第二电极310)的电阻抗可以减小到小于通过介质202(即,从第一电极304通过介质202到对应的照射的dep电极区域314a)的电阻抗的量,从而如上所述地激活相应的dep电极区域314处的dep电极。吸引或排斥介质202中的微物体(未示出)的dep电极因此可以通过光图案322在流动区域240的内表面242处的许多不同的dep电极区域314处被选择性地激活和停用。电极激活基板308的这种配置的非限制性示例包括美国专利no.7,956,339的图21和图22中示出的基于光电晶体管的装置300。
在其他实施例中,电极激活基板308可以包括包含多个电极的基板,其也可以是光致动的。电极激活基板308的这种配置的非限制性示例包括在公开号为2014/0124370的美国专利申请中示出和描述的光致激活装置200、光致激活装置400、光致激活装置500和光致激活装置600。在其他实施例中,支撑结构104和/或盖子122的dep配置不依赖于微流体装置的内表面处的dep电极的光激活,而是选择性地使用可寻址且可激励的电极,该电极定位成与包括至少一个电极的表面相对,例如在美国专利no.6,942,776中所描述的。
在dep配置的装置的一些实施例中,通常如图1d所示,第一电极304可以是壳体102的第一壁302(或盖子)的一部分,电极激活基板308和第二电极310可以是壳体102的第二壁(或基底)的一部分。如图所示,流动区域240可以位于第一壁302与第二壁306之间。然而,前述仅仅是示例。在替代实施例中,第一电极304可以是第二壁306的一部分,电极激活基板308和/或第二电极310中的一个或两个可以是第一壁302的一部分。此外,光源320可以可选地位于壳体102下方。在某些实施例中,第一电极304可以是铟锡氧化物(ito)电极,但是也可以使用其他材料。
当使用图1d至图1e的微流体装置300的光学致动dep配置时,选择器控制模块因此可以通过将一个或更多个连续的光图案322投射到装置300中以按照围绕和“捕获”微物体的连续图案来激活流体区域240的内表面242的dep电极区域314处的对应的一个或更多个dep电极,从而选择流动区域240中的介质202中的微物体(未示出)。然后,选择器控制模块可以通过相对于装置300移动光图案322(或者装置300(以及因此其中捕获的微物体)可以相对于光源320和/或光图案322移动),在流动区域240内移动捕获的微物体。对于以微流体装置300的电致动dep配置为特征的实施例,选择器控制模块可以通过电激活流动区域240的内表面242的dep电极区域314处的dep电极子组来选择在流动区域240中的介质202中的微物体(未示出),dep电极子组形成围绕并“捕捉”微物体的图案。然后,选择器控制模块可以通过改变正被电激活的dep电极子组来在流动区域240内移动所捕获的微物体。
隔离室配置。图1a至图1c中示出了装置100的隔离室136、隔离室138和隔离室140的非限制性示例。具体参照图1c,每个隔离室136、隔离室138、隔离室140包括限定隔离区域144的隔离结构146和将隔离区域144流体连接到流动通道134的连接区域142。每个连接区域142具有进入到流动通道134中的近端开口152、以及进入到各隔离区域144中的远端开口154。连接区域142优选地被配置成使得在流体通道134中以最大速度(vmax)流动的流体介质(未示出)的流动的最大穿透深度不会意外地延伸到隔离区域144中。设置在各个隔离室136、隔离室138、隔离室140的隔离区域144中的微物体(未示出)或其他材料(未示出)可以从而与流动通道134中的介质(未示出)的流动隔离并且基本不受其影响。流动通道134因此可以是波及区域的示例,并且隔离室136、隔离室138、隔离室140的隔离区域可以是未波及区域的示例。如上所述,各个流动通道134和隔离室136、隔离室138、隔离室140被配置为容纳一种或更多种流体介质(未示出)。在图1a-图1c所示的实施例中,流体通过口124流体连接到流动通道134,并允许流体介质(未示出)被引入到微流体通路132或从微流体通路132移除。一旦微流体通路132包含流体介质,可以在流动通道134中选择性地产生在其中的特定流体介质的流动。例如,介质的流动可以被创建成从用作入口的一个流体通过口124到用作出口的另一个流体通过口124。
图2示出了图1a-图1c的装置100的隔离室136的示例的详细视图。隔离室138、隔离室140可以类似地配置。还示出了位于隔离室136中的微物体222的示例。
如已知的,微流体流动通道134中的流体介质202(由方向箭头212指示)经过隔离室136的近端开口152,可以引起介质202进入到隔离室136或者从隔离室136流出的二次流动(由方向箭头214指示)。为了将隔离室136的隔离区域144中的微物体222与二次流动214隔离,从近端开口152到远端开口154的连接区域142的长度lcon优选大于在流动通道134中的流动212的速度处于最大值(vmax)时进入到连接区域142中的二次流动214的最大穿透深度dp。只要流动通道134中的流动212不超过最大速度vmax,则流动212和产生的二次流动214就被限制到各流动通道134和连接区域142,并且保持在隔离室136的隔离区域144之外。流动通道134中的流动212因此将不会将微物体222从隔离室136的隔离区域144中抽出。
此外,流动212不会将可能位于流动通道134中的各种颗粒(例如,微粒和/或纳米颗粒)移动到隔离室136的隔离区域144中。具有大于最大穿透深度dp的长度lcon的连接区域142因此可以防止隔离室136受到来自流动通道134或另一个隔离室138、隔离室140的各种颗粒的污染。
因为流动通道134和隔离室136、隔离室138、隔离室140的连接区域142可能受到流动通道134中的介质202的流动212的影响,所以流动通道134和连接区域142可以被视为波及(或流动)区域。另一方面,隔离室136、隔离室138、隔离室140的隔离区域144可以被认为是未波及(或非流动)区域。例如,流动通道134中的第一介质202中的成分(未示出)可以基本上仅通过第一介质202的成分从流动通道134经由连接区域142进入到隔离区域144中的第二介质204中的扩散,而与隔离区域144中的第二介质204混合。类似地,隔离区域144中的第二介质204中的成分(未示出)可以基本上仅通过第二介质204的成分从隔离区域144经由连接区域142进入到流动通道134中的第一介质202中的扩散,而与流动通道134中的第一介质202混合。应当理解,第一介质202可以是与第二介质204相同或不同的介质。此外,例如通过隔离区域144中的一个或更多个细胞对第二介质的调节,或者通过改变流过流动通道134的介质,第一介质202和第二介质204可以开始相同,然后变得不同。
由流动通道134中的流动212引起的二次流动214的最大穿透深度dp可以取决于多个参数。这样的参数的例子包括(但不限于):流动通道134的形状(例如,通道可以将介质引导到连接区域142中,将介质转移离开连接区域142,或者简单地流过连接区域142);在近端开口152处流动通道134的宽度wch(或横截面积);在近端开口152处连接区域142的宽度wcon(或横截面积);流动通道134中的流动212的最大速度vmax;第一介质202和/或第二介质204的粘度等。
在一些实施例中,流动通道134和/或隔离室136、隔离室138、隔离室140的尺寸以如下的方式相对于流动通道134中的流动212定向:流动通道宽度wch(或流动通道134的横截面积)可以基本垂直于流动212;在近端开口152处连接区域142的宽度wcon(或横截面积)可以基本平行于流动212;连接区域的长度lcon可以基本上垂直于流动212。前述仅仅是示例,流动通道134和隔离室136、138、140的尺寸可以是相对于彼此处于附加和/或进一步的方位。
如图2所示,连接区域142的宽度wcon可以从近端开口152到远端开口154是均匀的。因此,远端开口154处的连接区域142的宽度wcon可以在与近端开口152处的连接区域142的宽度wcon对应的下面确定的范围中的任意一个。可选择地,远端开口154处的连接区域142的宽度wcon可以比在近端开口152处的连接区域142的宽度wcon更大(例如,如图3的实施例中所示)或更小(例如,如图4a-图4c的实施例中所示)。
还如图2所示,远端开口154处的隔离区域144的宽度可以与近端开口152处的连接区域142的宽度wcon基本相同。因此,远端开口154处的隔离区域144的宽度可以在与近端开口152处的连接区域142的宽度wcon对应的下面确定的范围中的任意一个内。可选择地,远端开口154处的隔离区域144的宽度可以比近端开口152处的连接区域142的宽度wcon更大(例如,如图3所示)或更小(未示出)。
在一些实施例中,流动通道134中的流动212的最大速度vmax基本上与流动通道134可保持的、而不会在流动通道所处的各微流体装置(例如,装置100)中引起结构失效的最大速度相同。通常,流动通道可以保持的最大速度取决于各种因素,包括微流体装置的结构完整性和流动通道的横截面积。对于本文公开和描述的示例性微流体装置,具有约3,500至10,000平方微米的横截面积的流动通道中的最大流速vmax为约1.5微升/秒至15微升/秒。可选地,流动通道中的流动的最大速度vmax可被设置为确保隔离区域与流动通道中的流动隔离。特别地,基于隔离室的连接区域的近端开口的宽度wcon,可以设定vmax以确保进入到连接区域的二次流动的穿透深度dp小于lcon。例如,对于连接区域具有宽度wcon为约40微米至50微米、lcon为约50微米至100微米的近端开口的隔离室,vmax可以设定为或约为0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5微升/秒。
在一些实施例中,连接区域142的长度lcon与隔离室136、138、140的隔离区域144的对应长度的总和可以足够短,用于包含在隔离区域144中的第二介质204的成分到第一介质202(在流动通道134中流动或者包含在流动通道134中)的相对快速的扩散。例如,在一些实施例中,连接区域142的长度lcon(1)与在位于隔离室136、138、140的隔离区域144中的生物微物体和连接区域的远端开口154之间的距离(2)的总和可以是以下范围之一:大约40微米至500微米、50微米至450微米、60微米至400微米、70微米至350微米、80微米至300微米、90微米至250微米、100微米至200微米或包括前述端点之一的任何范围。分子(例如,诸如抗体等的目标分析物)的扩散速率取决于许多因素,包括(但不限于)温度、介质的粘度和分子的扩散系数d0。例如,20℃左右的水溶液中的igg抗体的d0约为4.4×10-7厘米2/秒,细胞培养基的运动粘度约为9×10-4米2/秒。因此,在约20℃的细胞培养基中的抗体可具有约0.5微米/秒的扩散速率。因此,在一些实施例中,位于隔离区域144中的生物微物体扩散到流动通道134中的时间周期可以是大约10分钟或更少(例如大约9分钟、8分钟、7分钟、6分钟、5分钟或更少)。扩散的时间周期可以通过改变影响扩散速率的参数来操纵。例如,介质的温度可以升高(例如,升高至诸如约37℃的生理温度)或降低(例如降低至约15℃、10℃或4℃),从而分别增大或减小扩散率。可选择地或另外,可以增大或减小介质中溶质的浓度。
图2中所示的隔离室136的物理配置仅仅是示例,隔离室的许多其他配置和变型也是可能的。例如,示出的隔离区域144的大小为包含多个微物体222,但是隔离区域144的尺寸可以为仅包含大约一个、两个、三个、四个、五个或类似的相对较小数量的微物体222。因此,隔离区域144的体积可以是例如至少约3×103、6×103、9×103、1×104、2×104、4×104、8×104、1×105、2×105、4×105、8×105、1×106、2×106、4×106、6×106立方微米或更大。
作为另一个例子,在图2中示出隔离室136为大致垂直地从流动通道134延伸,并因此与流动通道134大致形成约90°角。可选择地,隔离室136可以以其他角度,诸如例如从大约30°到大约150°的任何角度,从流动通道延伸134。
作为又一示例,在图2中示出连接区域142和隔离区域144为具有基本矩形的配置,但是连接区域142和隔离区域144中的一个或两个可以具有不同的配置,包括(但不限于)椭圆形、三角形、圆形、沙漏形等。
作为又一个示例,在图2示出连接区域142和隔离区域144具有基本均匀的宽度。也就是说,示出连接区域142的宽度wcon沿着从近端开口152到远端开口154的整个长度lcon是均匀的。隔离区域144的相应宽度类似地是均匀的,并且示出连接区域142的宽度wcon和隔离区域144的对应宽度是相等的。然而,在替代实施例中,前述中的任何一个可以是不同的。例如,连接区域142的宽度wcon可以沿着从近端开口152到远端开口154的长度lcon例如以梯形或沙漏形式变化,隔离区域144的宽度也可以沿着长度lcon例如以三角形或烧瓶的方式变化,连接区域142的宽度wcon可以不同于隔离区域144的宽度。
图3示出了隔离室336的替代实施例,示出了前述变型的一些示例。虽然替代隔离室336被描述为微流体装置100中的室136的替代物,但是应该理解的是,隔离室336可以代替本文公开或描述的任何微流体装置实施例中的任何隔离室。此外,在给定的微流体装置中可以设置一个隔离室336或多个隔离室336。
隔离室336包括连接区域342和包括隔离区域344的隔离结构346。连接区域342具有通向流动通道134的近端开口352和通向隔离区域344的远端开口354。在图3中示出的实施例中,连接区域342扩展,使得其宽度wcon沿着连接区域lcon的长度从近端开口352到远端开口354增加。然而,除了具有不同的形状,连接区域342、隔离结构346和隔离区域344的功能通常与图2所示的隔离室136的上述连接区域142、隔离结构146和隔离区域144相同。
例如,流动通道134和隔离室336可被配置成使得二次流动214的最大穿透深度dp延伸到连接区域342中,但不延伸到隔离区域344中。连接区域342的长度lcon因此可以大于最大穿透深度dp,基本上如以上关于图2所示的连接区域142所讨论的。而且,如上所述,隔离区域344中的微物体222将保持在隔离区域344中,只要流动通道134中的流动212的速度不超过最大流速vmax即可。流动通道134和连接区域342因此是波及(或流动)区域的示例,并且隔离区域344是未波及(或非流动)区域的示例。
图4a-图4c描绘了包括微流体通路432和流体通道434的微流体装置400的另一个示例性实施例,是图1a-图1c的各个微流体装置100、通路132和流体通道134的变型。微流体装置400还具有多个隔离室436,这些隔离室436是上述隔离室136、138、140和336的附加变型。特别地,应该理解,图4a-图4c中所示的装置400的隔离室436可代替装置100和装置300中的上述隔离室136、138、140和336中的任意一个。同样,微流体装置400是微流体装置100的另一变型,并且也可具有与上述微流体装置300相同或不同的dep配置,以及本文描述的任何其他微流体系统组件。
图4a-图4c的微流体装置400包括支撑结构(在图4a-图4c中不可见,但可与图1a-图1c中描述的装置100的支撑结构104相同或大致相似)、微流体通路结构412和盖子(在图4a-图4c中不可见,但可以与图1a-图1c中描述的装置100的盖子122相同或大致相似)。微流体通路结构412包括框架414和微流体通路材料416,框架414和微流体通路材料416可以与图1a-1c所示的装置100的框架114和微流体通路材料116相同或基本相似。如图4a所示,由微流体通路材料416限定的微流体通路432可以包括多个流动通道434(示出了两个,但可以有更多个),多个流动通道434流体连接到多个隔离室436。
每个隔离室436可以包括隔离结构446、隔离结构446内的隔离区域444、以及连接区域442。从流动通道434处的近端开口472到隔离结构436处的远端开口474,连接区域442将流动通道434流体连接到隔离区域444。通常根据图2的上述讨论,流动通道434中的第一流体介质402的流动482可以产生从流动通道434进入隔离室436的各连接区域442和/或离开隔离室436的各连接区域442的第一介质402的二次流动484。
如图4b所示,每个隔离室436的连接区域442通常包括在通往流动通道434的近端开口472与通往隔离结构446的远端开口474之间延伸的区域。连接区域442的长度lcon可以大于第二流动484的最大穿透深度dp,在这种情况下,二次流动484将延伸到连接区域442中而不被重新引导向隔离区域444(如图4a所示)。可选择地,如图4c所示,连接区域442可以具有小于最大穿透深度dp的长度lcon,在这种情况下,二次流动484将延伸穿过连接区域442并且被重新引导向隔离区域444。在后一种情况下,连接区域442的长度lc1和lc2的总和大于最大穿透深度dp,使得二次流动484将不会延伸到隔离区域444中。无论是连接区域442的长度lcon大于穿透深度dp,还是连接区域442的长度lc1和lc2之和大于穿透深度dp,不超过最大速度vmax的流动通道434中第一介质402的流动482将产生具有穿透深度dp的二次流动,隔离室436的隔离区域444中的微物体(未示出,但可以与图2所示的微物体222相同或大致相似)将不会通过流动通道434中的第一介质402的流动482而被从隔离区域444中抽出。流动通道434中的流动482也不会将各种材料(未示出)从流动通道434抽到隔离室436的隔离区域444中。这样,扩散是流动通道434中的第一介质402中的组分可以从流动通道434移动到隔离室436的隔离区域444中的第二介质404中的唯一机制。同样地,扩散是隔离室436的隔离区域444中的第二介质404中的组分可以从隔离区域444移动到流动通道434中的第一介质402的唯一机制。第一介质402可以是与第二介质404相同的介质,或者第一介质402可以与第二介质404不同的介质。可选择地,例如通过隔离区域444中的一个或更多个细胞对第二介质的调节,或者通过改变流过流动通道434的介质,第一介质402和第二介质404可以开始相同,然后变得不同。
如图4b所示,流动通道434中的流动通道434的宽度wch(即,沿横穿图4a中的箭头482指示的流过流动通道的流体介质的方向获得的)可以基本上垂直于近端开口472的宽度wcon1并因此基本上平行于远端开口474的宽度wcon2。然而,近端开口472的宽度wcon1和远端开口474的宽度wcon2不必基本上彼此垂直。例如,标定近端开口472的宽度wcon1方向的轴线(未示出)与标定远端开口474的宽度wcon2方向的另一个轴线之间的角度可以不是垂直的,因此不是90°。可选角度的示例包括以下任何范围的角度:约30°至约90°、约45°至约90°、约60°至约90°等。
在隔离室136、138、140、336或436的各种实施例中,隔离室的隔离区域可以具有被配置为支持培养中的不超过约1×103、5×102、4×103、3×102、2×102、1×102、50、25、15或10个细胞的体积。在其他实施例中,隔离室的隔离区具有支持至多且包括约1×103、1×104或1×105个细胞的体积。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或14)处的流动通道134的宽度wch、在近端开口352(隔离室336)处的流动通道134的宽度wch、或在近端开口472(隔离室436)处的流动通道434的宽度wch可以是以下范围中的任一个:约50-1000微米、50-500微米、50-400微米、50-300微米、50-250微米、50-200微米、50-150微米、50-100微米、70-500微米、70-400微米、70-300微米、70-250微米、70-200微米、70-150微米、90-400微米、90-300微米、90-250微米、90-200微米、90-150微米、100-300微米、100-250微米、100-200微米、100-150微米和100-120微米。以上仅仅是示例,流动通道134或434的宽度wch可以处于其它范围(例如,由上面列出的任何端点限定的范围)中。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或140)处的流动通道134的高度hch、在近端开口352(隔离室336)处的流动通道134的高度hch、或在近端开口472(隔离室436)处的流动通道434的高度hch可以是以下范围中的任一个:大约20-100微米、20-90微米、20-80微米、20-70微米、20-60微米、20-50微米、30-100微米、30-90微米、30-80微米、30-70微米、30-60微米、30-50微米、40-100微米、40-90微米、40-80微米、40-70微米、40-60微米或40-50微米。前述仅仅是示例,流动通道134或流动通道434的高度hch可以处于其他范围(例如,由上面列出的任何端点限定的范围)内。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或140)处的流动通道134的横截面积、在近端开口352(隔离室336)处的流动通道134的横截面积、或在近端开口472(隔离室436)处的流动通道434的横截面积可以是以下范围中的任一个:约500-50,000平方微米、500-40,000平方微米、500-30,000平方微米、500-25,000平方微米、500-20,000平方微米、500-15,000平方微米、500-10,000平方微米、500-7,500平方微米、500-5,000平方微米、1,000-25,000平方微米、1,000-20,000平方微米、1,000-15,000平方微米、1,000-10,000平方微米、1,000-7,500平方微米、1,000-5,000平方微米、2,000-20,000平方微米、2,000-15,000平方微米、2,000-10,000平方微米、2,000-7,500平方微米、2,000-6,000平方微米、3,000-20,000平方微米、3,000-15,000平方微米、3,000-10,000平方微米、3,000-7,500平方微米或3,000-6,000平方微米。前述仅仅是示例,在近端开口152处的流动通道134、在近端开口352处的流动通道134或者在近端开口472处的流动通道434的横截面积可以处于其它范围(例如,由上面列出的任何端点限定的范围)。
在隔离室136、138、140、336或436的各种实施例中,连接区域lcon的长度可以是以下范围中的任一个:约1-200微米、5-150微米、10-100微米、15-80微米、20-60微米、20-500微米、40-400微米、60-300微米、80-200微米和100-150微米。前述仅仅是示例,连接区域142(隔离室136、138或140)、连接区域342(隔离室336)或连接区域442(隔离室436)的长度lcon可以处于与前述示例不同的范围(例如,由上面列出的任何端点限定的范围)中。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或140)处的连接区域142的宽度wcon、在近端开口352(隔离室336)处的连接区域342的宽度wcon、或在近端开口472(隔离室436)处的连接区域442的宽度wcon可以是以下范围中的任一个:约20-500微米、20-400微米、20-300微米、20-200微米、20-150微米、20-100微米、20-80微米、20-60微米、30-400微米、30-300微米、30-200微米、30-150微米、30-100微米、30-80微米、30-60微米、40-300微米、40-200微米、40-150微米、40-100微米、40-80微米、40-60微米、50-250微米、50-200微米、50-150微米微米、50-100微米、50-80微米、60-200微米、60-150微米、60-100微米、60-80微米、70-150微米、70-100微米和80-100微米。前述仅是示例,在近端开口152处的连接区域142的宽度wcon、在近端开口352处的连接区域342的宽度wcon、或近端开口472处的连接区域442的宽度wcon可以与前述示例不同(例如,由上面列出的任何端点限定的范围)。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或140)处的连接区域142的宽度wcon、在近端开口352(隔离室336)处的连接区域342的宽度wcon、或在近端开口472(隔离室436)处的连接区域442的宽度wcon可以是以下范围中的任一个:约2-35微米、2-25微米、2-20微米、2-15微米、2-10微米、2-7微米、2-5微米、2-3微米、3-25微米、3-20微米、3-15微米、3-10微米、3-7微米、3-5微米、3-4微米、4-20微米、4-15微米、4-10微米、4-7微米、4-5微米、5-15微米、5-10微米、5-7微米、6-15微米、6-10微米、6-7微米、7-15微米、7-10微米、8-15微米和8-10微米。前述仅是示例,在近端开口152处的连接区域142的宽度wcon、在近端开口352处的连接区域342的宽度wcon、或近端开口472处的连接区域442的宽度wcon可以与前述示例不同(例如,由上面列出的任何端点限定的范围)。
在隔离室136、138、140、336或436的各种实施例中,在近端开口152(隔离室136、138或140)处的连接区域142的长度lcon与连接区域142的宽度wcon之比、在近端开口352(隔离室336)处的连接区域342的长度lcon与连接区域342的宽度wcon之比、或在近端开口472(隔离室436)处的连接区域442的长度lcon与连接区域442的宽度wcon之比可以大于或等于以下比率中的任一个:大约0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0、4.5、5.0、6.0、7.0、8.0、9.0、10.0或更大。以上仅为示例,在近端开口152处的连接区域142的长度lcon与连接区域142的宽度wcon之比、在近端开口372处的连接区域342的长度lcon与连接区域342的宽度wcon之比、在近端开口472处的连接区域442的长度lcon与连接区域442的宽度wcon之比可以与前述示例不同。
在具有隔离室136、138、140、336或436的微流体装置的各种实施例中,vmax可设定为大约0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4或2.5微升/秒。
在具有隔离室136、138、140、336或436的微流体装置的各种实施例中,隔离区域144(隔离室136、138或140)、隔离区域344(隔离室336)或隔离区域444(隔离室436)的体积可以是例如至少约3×103、6×103、9×103、1×104、2×104、4×104、8×104、1×105、2×105、4×105、8×105、1×106、2×106、4×106、6×106立方微米或更大。
在一些实施例中,微流体装置具有隔离室136、138、140、336或436,其中可保持不超过约1×102个生物细胞,隔离室的体积可以不超过约2×106立方微米。
在一些实施例中,微流体装置具有隔离室136、138、140、336或436,其中可保持不超过约1×102个生物细胞,隔离室的体积可以不超过约4×105立方微米。
在其他实施例中,微流体装置具有隔离室136、138、140、336或436,其中可保持不超过约50个生物细胞,隔离室的体积可以不超过约4×105立方微米。
在各种实施例中,微流体装置具有以本文讨论的任一实施例配置的隔离室,微流体装置具有:大约100到大约500个隔离室、约200至约1000个隔离室、约500至约1500个隔离室、约1000至约2000个隔离室或约1000至约3500个隔离室。
在一些其他实施例中,微流体装置具有以本文讨论的任一实施例配置的隔离室,微流体装置具有:约1500至约3000个隔离室、约2000至约3500个隔离室、约2000至约4000个隔离室、约2500至约4000个隔离室或者约3000至约4500个隔离室。
在一些实施例中,微流体装置具有以本文讨论的任一实施例配置的隔离室,微流体装置具有:约3000至约4500个隔离室、约3500至约5000个隔离室、约4000至约5500个室、约4500至约6000个隔离室或约5000至约6500个室。
在进一步的实施例中,微流体装置具有以本文讨论的任一实施例配置的隔离室,微流体装置具有:约6000至约7500个隔离室、约7000至约8500个隔离室、约8000至约9500个隔离室、约9000至约10,500个隔离室、约10,000至约11,500个隔离室、约11,000至约12,500个隔离室、约12,000至约13,500个隔离室、约13,000至约14,500个隔离室、约14,000至约15,500个隔离室、约15,000至约16,500个隔离室、约16,000至约17,500个隔离室、约17,000至约18,500个隔离室。
在各种实施例中,微流体装置具有以本文讨论的任一实施例配置的隔离室,微流体装置具有:约18,000至约19,500个隔离室、约18,500至约20,000个隔离室、约19,000至约20,500个隔离室、约19,500至约21,000个隔离室或约20,000至约21,500个隔离室。
隔离室的其他特性。尽管以上将限定装置100的各个隔离室136、138、140(图1a-图1c)以及形成装置400的隔离室436的隔离结构446(图4a-图4c)的微流体通路材料116(图1a-图1c)和416(图4a-4c)的屏障作为物理屏障示出和讨论,应该理解,屏障可以替代地被创建为“虚拟”屏障,该“虚拟”屏障包括由光图案322的光激活的dep力。
在一些其他实施例中,各隔离室136、138、140、336和436可以被屏蔽不受照射(例如,通过检测器和/或选择器控制模块引导光源320),或者可以仅被选择性照射短暂的时间。包含在隔离室中的细胞和其他生物微物体因此可以在被移入隔离室136、138、140、336和436之后被保护免于进一步的(即,可能危险的)照射。
流体介质。关于具有流动通道和一个或更多个隔离室的微流体装置的上述讨论,流体介质(例如,第一介质和/或第二介质)可以是能够维持生物微物体处于基本可测定状态的任何流体。可测定状态将取决于生物微物体和正在进行的测定。例如,如果生物微物体是正在被测定目标蛋白质的分泌的细胞,假设该细胞是活的并且能够表达和分泌蛋白质,则该细胞将基本上可测定的。
处理和储存生物细胞。图5a示出了用于保持和储存(例如,当冷冻时)生物细胞的多个微量测试孔板的堆叠(现有技术)。如上所述,微量测试孔板与微流体装置不能很好地相互作用。此外,它们相对较大,因此当它们用于生物细胞的储存和存档时,占用大量昂贵的冷冻空间,并且需要大量昂贵的细胞保存试剂。作为比较,图5b是根据本文公开的实施例构建的示例性微流体装置的图片。
更具体地,本文详细示出和描述的微流体装置的基础结构,使其本身成为用于生物细胞的更有效的储存容器,尤其是因为相同的微流体装置可用于细胞的下游实验和分析,例如测序、培养、扩增/克隆/亚克隆、测定等(以下统称为“测试”)。特别地,在样品已经在微流体装置中被初始处理之后,包括将生物细胞隔离到隔离室(例如,上述图1a-图1c中示出的装置100的隔离室136、138和140)的各个隔离区域中,可以创建被隔离的细胞的文库(或库)并将其存储在与微流体装置相关联的存储介质中,并且随后可以在一个零下的储存冷冻机中冷却并储存装置(无论是数天、数周、数月还是数年),直到需要测试被隔离的细胞。
为此并且参照图6,用于在微流体装置中处理和储存生物细胞的示例性方法包括:在步骤500,将可流动介质引入微流体装置,该可流动介质包括生物细胞。在步骤510,将来自可流动介质的一个或更多个生物细胞隔离在微流体装置的一个或更多个隔离区域中。在步骤550,将微流体装置冷冻以便储存,包括隔离在其中的一个或更多个生物细胞。
冷冻之前的细胞扩增。尽管最初可将仅仅单个生物细胞隔离在微流体装置内,但更通常地在微流体装置内的多个隔离区中的每一个中隔离至少单个细胞。在该方法的实施例中使用的通常的微流体装置可以具有从几十个到几百个或更多个中的任何数量的隔离区域,每个隔离区域的体积(没有限制)在约1.5×105立方微米到约1.5×106立方微米的范围中,因此能够隔离多达约10个细胞至约50个细胞或更多。在一个实施例中,在冷冻微流体装置之前,培养微流体装置的第一隔离区域中的一个或更多个被隔离(“起始”)的细胞,以在第一隔离区域中产生足够的多个“新”细胞使得在解冻微流体装置之后至少一个活细胞将存在于第一隔离区域中。
为此目的,可能需要在冷冻装置之前允许充分培养以在每个目标隔离室中积聚至少八个生物细胞,并且更优选在冷冻装置之前在每个目标隔离室中积聚至少十个、十六个、二十个、二十四个、三十个或四十个生物细胞。在一些情况下,可能优选的是,在冷冻装置之前在每个目标隔离区域中积聚更大数量的细胞,包括在微流体装置中具有足够尺寸的隔离室的一些实施例中,在冷冻之前在每个目标隔离区域中积聚五十、六十、七十、八十、九十、或甚至一百或更多个中的任何数量的细胞。在目前公开的微流体装置内扩增生物细胞的方法已在2016年4月22日提交的美国专利申请no.15/135,707中描述,其全部内容通过引用并入本文。
阻止溶液(blockingsolution)和阻止剂(blockingagent)。不受理论的限制,在细胞冷冻然后解冻之后,细胞裂解的发生率很高,结果是,微流体装置的内表面可能结垢(例如,由于裂解细胞的细胞内容物,包括蛋白质、核酸和其他生物分子,粘附到微流体装置的内表面,特别是基板表面),并且可以导致未裂解的细胞粘附或“贴附”到微流体装置的结垢的内表面。在一些实施例中,微流体装置的一个或更多个内表面(例如,dep配置的微流体装置的电极激活基板的内表面、微流体装置的盖子和/或通路材料的表面)用阻止溶液和/或阻止剂处理,以防止或减少细胞粘附或贴附。在一些实施例中,要在微流体装置中被冷冻的细胞被输入到包含一种或更多种阻止剂的阻止溶液中。
在其他实施例中,在将细胞引入到微流体装置之前,用包含阻止剂的阻止溶液处理或“准备”微流体装置(例如,dep配置的微流体装置)的内表面。可以使用任何方便的阻止剂/阻止溶液,包括但不限于:血清或血清因子、牛血清白蛋白(bsa)、聚合物、去污剂、酶及其任意组合。在一些具体的实施例中,将使用阻止剂来处理微流体装置的内表面。在一个示例中,包含亚烷基醚基团的聚合物可作为阻止剂包含在阻止溶液中。多种含亚烷基醚的聚合物可能是合适的。含亚烷基醚的聚合物的一个非限制的示例性类别是两亲性非离子嵌段共聚物,其包括聚合物链内比例和位置不同的聚环氧乙烷(peo)和聚环氧丙烷(ppo)亚单元的嵌段。
在一些实施例中,阻止溶液可以包含各种蛋白质和/或肽作为阻止剂。在具体的实施例中,用于本公开的阻止溶液包括如白蛋白(例如bsa)的蛋白质和/或包含白蛋白和/或一种或更多种其他相似的蛋白质的血清(或多种不同血清的组合)来作为阻止剂。血清可以来自任何方便的来源,包括但不限于胎牛血清、绵羊血清、山羊血清、马血清等。在某些实施例中,阻止溶液中的bsa以约1mg/ml至约100mg/ml的范围存在,包括5mg/ml、10mg/ml、20mg/ml、30mg/ml、40mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml或更多或其间的任何值。在某些实施例中,阻止溶液中的血清以约20%(v/v)至约50%v/v的范围存在,包括25%、30%、35%、40%、45%或更多或其间的任何值。在一些实施例中,bsa作为阻止剂以5mg/ml存在于阻止溶液中,而在其他实施例中,bsa作为阻止剂以70mg/ml存在于阻止溶液中。在某些实施例中,血清作为阻止剂以30%存在于阻止溶液中。
涂覆材料。取决于实施例,任何前述的阻止剂/阻止溶液可以被用于涂覆微流体装置(例如,dep配置的和/或ew配置的微流体装置)的一个或更多个内表面的各种涂覆材料取代,或者与各种涂覆材料结合在一起使用。在一些实施例中,微流体装置的至少一个表面包括减少表面结垢和/或防止或减少细胞粘附到表面的涂覆材料。在一些实施例中,微流体装置的基本上所有的内表面都包括涂覆材料。涂覆的内表面可以包括流动区域(例如通道)、室或隔离围栏或其组合的表面。在一些实施例中,多个隔离围栏中的每一个具有涂覆有涂覆材料的至少一个内表面。在其它实施例中,多个流动区域或通道中的每一个具有涂覆有涂覆材料的至少一个内表面。在一些实施例中,多个隔离围栏中的每一个和多个通道中的每一个的至少一个内表面涂覆有涂覆材料。
聚合物类涂覆材料。该至少一个内表面可以包括包含聚合物的涂覆材料。聚合物可以共价或非共价结合(或连接)到该至少一个表面。聚合物可以具有各种结构基元,诸如在嵌段聚合物(和共聚物)、星形聚合物(星形共聚物)和接枝或梳形聚合物(接枝共聚物)等中发现的,所有这些都可以适用于本文公开的方法。
聚合物可以包括包含亚烷基醚基团的聚合物。多种含亚烷基醚的聚合物可适用于本文所述的微流体装置。含亚烷基醚的聚合物的一个非限制的示例性类别是两亲性非离子嵌段共聚物,其包括聚合物链内比例和位置不同的聚环氧乙烷(peo)和聚环氧丙烷(ppo)亚单元的嵌段。
在其他实施例中,涂覆材料可以包括含有羧酸基团的聚合物。羧酸亚基可以是烷基、烯基或含有亚基的芳族基团。一个非限制性的示例是聚乳酸(pla)。
在其他实施例中,涂覆材料可以包括含有磺酸基团的聚合物。磺酸亚基可以是烷基、烯基或含有亚基的芳族基团。一个非限制性的示例是聚苯乙烯磺酸(pssa)或聚茴脑磺酸。后者的示例性聚合物是聚电解质,并且可以改变表面的特性以阻止细胞粘附。
在一些实施例中,涂覆材料可以包括含有氨基甲酸乙酯基团的聚合物,例如但不限于聚氨酯。
在其他实施例中,涂覆材料可以包括含有磷酸酯基团的聚合物,磷酸酯基团在聚合物主链的末端或聚合物主链的侧面。
在其他实施例中,涂覆材料可以包括含糖基的聚合物。在非限制性示例中,诸如源自藻类多糖或真菌多糖(诸如黄原胶或葡聚糖)的多糖,可适合于形成可减少或防止微流体装置中的细胞粘附的材料。例如,可以使用大小约3kda的葡聚糖聚合物来为微流体装置内的表面提供涂覆材料。
在其他实施例中,涂覆材料可以包含含有核苷酸基团的聚合物(即核酸),其可以具有核糖核苷酸基团或脱氧核糖核苷酸基团。核酸可以仅含有天然核苷酸基团,或者可以含有非天然核苷酸基团,非天然核苷酸基团包含但不限于核碱基、核糖或磷酸基团类似物,诸如7-脱氮腺嘌呤、戊糖、甲基膦酸酯或硫代磷酸酯基团。含核酸的聚合物可以包括可减少或防止细胞粘附的聚电解质。
在其他实施例中,涂覆材料可以包括含有氨基酸基团的聚合物。含有氨基酸基团的聚合物可以包括含有天然氨基酸的聚合物或含有非天然氨基酸的聚合物,其中任一种可以包括肽、多肽或蛋白质。在一个非限制性的示例中,蛋白质可以是牛血清白蛋白(bsa)。在一些实施例中,可以在涂覆材料内提供细胞外基质(ecm)蛋白以优化细胞粘附来促进细胞生长。可包含在涂覆材料中的细胞基质蛋白可包括但不限于胶原蛋白、弹性蛋白、含有rgd的肽(例如纤连蛋白)或层粘连蛋白。在其他实施例中,可以在微流体装置的涂覆材料内提供生长因子、细胞因子、激素或其他细胞信号物质。
在进一步的实施例中,涂覆材料可以包括含有胺基团的聚合物。聚氨基聚合物可以包括天然聚胺聚合物或合成聚胺聚合物。天然聚胺的示例包括精胺、亚精胺和腐胺。
在一些实施例中,涂覆材料可以包括含有多于一种的环氧烷基团、羧酸基团、磺酸基团、磷酸酯基团、糖基团、核苷酸基团或氨基酸基团的聚合物。在其他实施例中,聚合物调理的表面可以包括多于一种聚合物的混合物,每种聚合物具有环氧烷基团、羧酸基团、磺酸基团、磷酸酯基团、糖基团、核苷酸基团和/或氨基酸基团,其可以独立地或同时被包括到涂料中。
以共价键连接的涂覆材料。在一些实施例中,所述至少一个内表面包含以共价键连接的分子,其减少表面结垢和/或防止或减少细胞贴附到微流体装置的表面。以共价键连接的分子包括连接基团,其中连接基团以共价键连接到微流体装置的表面。连接基团还以共价键连接于被配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团。连接基团所连接的表面可以包括微流体装置的基板的表面,对于其中微流体装置包括dep配置的实施例,微流体装置的基板可以包括硅和/或二氧化硅。在一些实施例中,以共价键连接的涂覆材料基本涂覆微流体装置的所有内表面。
在一些实施例中,配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的以共价键连接的基团可以包括烷基或氟烷基(其包括全氟烷基)基团;单糖或多糖(其可以包括但不限于葡聚糖);醇(包括但不限于炔丙醇);多元醇,包括但不限于聚乙烯醇;亚烷基醚,包括但不限于聚乙二醇;聚电解质(包括但不限于聚丙烯酸或聚乙烯膦酸);氨基(包括其衍生物,诸如但不限于烷基化胺、羟基烷基化氨基、胍盐和含有未被芳构化的氮环原子的杂环基,未被芳构化的氮环原子诸如但不限于吗啉基或哌嗪基);羧酸,包括但不限于丙炔酸(其可以提供羧酸盐阴离子表面);膦酸,包括但不限于乙炔基膦酸(其可以提供膦酸盐阴离子表面);磺酸根阴离子;羧酸甜菜碱;磺酸甜菜碱;氨基磺酸;或氨基酸。
配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的以共价键连接的基团可以是如本文所述的任何聚合物,并且可以包括一种或更多种含有环氧烷基团、羧酸基团、糖基团、磺酸基团、磷酸基团、氨基酸基团、核酸基团或氨基基团的聚合物。
在其它实施例中,配置成减少表面结垢和/或防止或减少细胞粘附到微流体装置表面的以共价键连接的基团可包括非聚合物基团,诸如烷基基团、取代的烷基基团、氨基酸基团、醇基团、氨基基团、羧酸基团、膦酸基团、磺酸基团、氨基磺酸基团或糖基团的,取代的烷基基团诸如氟烷基基团(包括但不限于全氟烷基基团)。
在一些实施例中,以共价键连接的基团可以是包含碳原子的烷基,所述碳原子形成直链(例如,至少10个碳或至少14、16、18、20、22个碳或更多个碳的直链)。因此,烷基可以是无支链的烷基。在一些实施例中,烷基可以包括取代的烷基(例如,烷基中的一些碳可以被氟化或全氟化)。烷基可以包含连接到非取代碳的直链上的取代(例如,氟化或全氟化)碳的直链。例如,烷基可以包括连接到第二链段的第一链段,第一链段可以包括全氟烷基,第二链段可以包括未取代的烷基。第一链段和第二链段可以直接或间接连接(例如通过醚键连接)。烷基的第一链段可以位于连接基团的远侧,烷基的第二部分可以位于连接基团的近侧。在其他实施例中,烷基可以包括支链烷基,并且可以进一步具有一个或更多个中断烷基的烷基主链的亚芳基。在一些实施例中,烷基或氟化烷基的支链部分或亚芳基中断部分位于远离连接基团的点以及表面的共价键连接处。
在其他实施例中,以共价键连接的基团可以包括至少一个氨基酸,其可以包括多于一种类型的氨基酸。因此,以共价键连接的基团可以包括肽或蛋白质。在一些实施例中,以共价键连接的基团分可包括氨基酸,氨基酸可提供两性离子表面,以支持细胞的生长、存活、可移植或其任意组合。
以共价键连接的基团可以包括一种或更多种糖。以共价键连接的糖可以是单糖、二糖或多糖。可以改性以共价键连接的糖以引入反应性配对基团,所述反应性配对基团允许用于附着到表面的偶联或设计。示例性的反应性配对基团可以包括醛、炔或卤代基团。可以以任意方式修饰多糖,其中可以改性每种糖单体或者改性多糖中仅一部分糖单体,以提供可以直接或间接偶联至表面的反应性配对基团。一个示例可以包括葡聚糖多糖,其可以通过非支链接头间接偶联到表面。
以共价键连接的基团可以包括一个或更多个氨基。氨基可以是取代的胺基团、胍基团、含氮杂环基团或杂芳基基团。含有氨基的基团可以具有允许微流体装置(可选地隔离围栏和/或流动区域(例如通道))内的环境的ph修正的结构。
涂覆材料可以仅包含一种以共价键连接的基团,或者可以包含多于一种不同类型的以共价键连接的基团。例如,氟烷基调理的表面(包括全氟烷基)可以具有多个以共价键连接的基团,所述基团全部相同,例如具有相同的到表面的连接基团和共价结合、相同的总长度和相同数量的氟亚甲基单元(包含氟烷基团)。或者,涂覆材料可以具有多于一种的附着到表面的以共价键连接的基团。例如,涂覆材料可以包括分子,该分子具有以共价键连接的烷基或氟烷基基团,其具有特定数目的亚甲基或氟亚甲基单元;涂覆材料可以进一步包括另一组分子,该组分子具有附着于烷基或氟烷基链的共价带电基团,该烷基或氟烷基链具有更大数目的亚甲基或氟亚甲基单元。在一些实施例中,具有多于一种以共价键连接的基团的涂覆材料可以被设计为使得第一组分子具有更多数量的主链原子且因此从共价结合到表面的长度更长,从而可以提供容量以在涂覆的表面处呈现更庞大的基团,同时使得第二组分子具有不同的、更少的空间需求目的和更少的主链原子,从而可以帮助将整个基板表面功能化并且由此避免不期望的粘附或者与构成基板本身的硅或氧化铝接触。在另一个示例中,以共价键连接的基团可以提供在表面上以任意方式呈现交替电荷的两性离子表面。
调理表面特性。在一些实施例中,当以共价键连接至微流体装置的表面(例如,dep配置的基板表面)时,以共价键连接的基团可以形成单层。在一些实施例中,由以共价键连接的基团形成的调理表面可以具有小于10nm(例如,小于5nm或约1.5nm至3.0nm)的厚度。在其他实施例中,由以共价键连接的基团形成的调理表面可具有约10nm至约50nm的厚度。在一些实施例中,调理表面不需要完美形成的单层以具有适当的功能用于dep配置的微流体装置内的操作。
在各种实施例中,微流体装置的涂覆材料可以提供期望的电特性。不受理论限制,影响涂覆有特定涂覆材料的表面的鲁棒性的一个因素是内在电荷捕获。不同的涂覆材料可能会捕获电子,从而可能导致涂覆材料损坏。涂覆材料中的缺陷可能增加电荷俘获并导致涂覆材料的进一步损坏。类似地,不同的涂覆材料具有不同的介电强度(即导致介电击穿的最小施加电场),这会影响电荷捕获。在某些实施例中,涂覆材料可具有降低或限制电荷捕获量的总体结构(例如,密集堆叠的单层结构)。
除了涂覆材料的组成之外,诸如涂覆材料的物理(和电气)厚度之类的其他因素可以影响微流体装置中基板的dep力和/或电润湿力的产生。各种因素可以改变涂覆材料的物理和电气厚度,包括涂覆材料沉积在基板上的方式(例如气相沉积、液相沉积、旋涂或静电涂覆)。涂覆材料的物理厚度和均匀性可以使用椭圆计测量。
除了它们的电气特性之外,涂覆材料可以具有与生物分子一起使用而有益的特性。例如,含有氟化(或全氟化)烷基的涂覆材料相对于未取代的烷基可以提供减少表面结垢量的益处。本文使用的表面结垢是指不加选择地沉积在微流体装置表面上的物质的量,其可以包括生物材料(如蛋白质和降解产物、核酸、以及各降解产物)的永久或半永久沉积。这种结垢可以增加生物微物体对表面的粘附量。
下表中包括了可用于微流体装置的不同涂覆材料的各种电和功能特性。
除了调理表面的组成之外,诸如疏水性材料的物理厚度之类的其他因素可能影响dep力。各种因素可以改变调理表面的物理厚度,例如在基板上形成调理表面的方式(例如气相沉积、液相沉积、旋涂、泛涂和静电涂覆)。调理表面的物理厚度和均匀性可以使用椭圆计测量。
除了其电气特性之外,调理表面可以具有与生物分子一起使用而有益的特性。例如,含有氟化(或全氟化)碳链的调理表面相对于烷基封端链可以提供减少表面结垢量的益处。本文使用的表面结垢是指不加选择地沉积在微流体装置表面上的物质的量,其可以包括生物材料(如蛋白质及其降解产物、核酸及相应降解产物等)的永久或半永久沉积。
下表中包括了可用于dep配置的调节表面的各种特性。可以看出,对于条目1至7(其全部为本文所描述的以共价键连接的调理表面)而言,通过椭圆光度法测量的厚度始终比条目8(通过非共价旋转涂布形成的cytop表面(n/a表示整个表格中不可用的数据))小。发现结垢更依赖于表面的化学性质而不是形成模式,因为氟化表面通常比烷基(碳氢化合物)调理表面的结垢更少。
表1.与cytop(非共价形成的表面)相比,通过共价改性表面而制备的各种调理表面的特性。
1.cytop结构:
2.旋涂、非共价键
到表面的连接基。形成涂覆材料的以共价键连接的基团通过连接基连接到表面上。连接基可以是通过含硅氧烷的试剂与基板表面的氧化物反应形成的硅氧基连接基,基板表面的氧化物可以包括氧化硅(例如,对于dep配置的基板)或氧化铝或氧化铪(例如,对于ew配置的基板)。在一些其他实施例中,连接基可以是通过含膦酸的试剂与基板表面的氧化物反应形成的膦酸酯。
多部分调理表面。以共价键连接的涂覆材料可以通过分子的反应形成,该分子已经包含配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团(例如,烷基硅氧烷试剂或氟代烷基硅氧烷试剂,其可以包括全氟烷基硅氧烷试剂),如下面所描述的。可选地,以共价键连接的涂覆材料可以通过将配置成减少表面结垢和/或防止或减少细胞贴附的基团偶联到其自身以共价键连接到表面的表面改性配体来形成。
制备以共价键连接的涂覆材料的方法。在一些实施例中,以共价键连接至微流体装置表面(例如,包括隔离栅栏和/或流动区域的至少一个表面)的涂覆材料具有分子式1的结构。
涂覆材料可以共价键连接到dep-配置的基板的表面的氧化物。dep配置的基板可以包括硅或氧化铝或氧化铪,并且氧化物可以作为基板的天然化学结构的一部分存在,或者可以如下所述引入。
涂覆材料可以通过连接基(“lg”)附接到氧化物,连接基可以是由硅氧烷或膦酸基与氧化物反应形成的硅氧基或膦酸酯基。配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团可以是本文所述的任何基团。连接基lg可以直接或间接连接至配置成减少表面结垢和/或防止或减少细胞粘附至微流体装置表面的基团。当连接基lg直接连接到该基团时,可选的,接头(“l”)不存在,并且n为0。当连接基lg间接连接到该基团时,存在接头l并且n是1。接头l可以具有线性部分,其中线性部分的主链可以包括1至200个选自硅、碳、氮、氧、硫和磷原子的任意组合的非氢原子,如本领域已知的,受限于化学键合限制。在一些非限制性示例中,其可以被选自醚、氨基、羰基、酰氨基或膦酸酯基组成的群中的一个或更多个基团的任意组合中断。另外,接头l可具有一个或更多个中断接头主链的亚芳基、杂亚芳基或杂环基。在一些实施例中,接头l的主链可以包含10至20个原子。在其他实施例中,接头l的主链可以包含约5个原子至约200个原子、约10个原子至约80个原子、约10个原子至约50个原子、或约10个原子至约40个原子。在一些实施例中,主链原子全部是碳原子。在其它实施例中,主链原子不全是碳,并且可以包括硅、碳、氮、氧、硫或磷原子的任何可能的组合,如本领域已知的,受限于化学键合限制。
当配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团以一步工序附加到基板的表面时,可以使用分子式2的分子来引入涂覆材料。
基团–(l)n–lg.
分子式2
在一些实施例中,配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团可以以多步骤工序被附加到基板的表面。当配置成减少表面结垢和/或防止或减少细胞贴附的基团以分步方式偶联至表面时,接头l可进一步包含偶联基团cg,如分子式3所示。
在一些实施例中,偶联基cg表示从反应性基团rx和反应性配对基团rpx(即,被配置为与反应性基团rx反应的基团)的反应所得的基团。例如,一个典型的偶联基cg可以包括羰酰胺基,其是氨基与如活化酯、酰氯等羧酸衍生物反应的结果。其它cg可以包括亚三唑基(trizolylenegroup)、甲酰胺、硫代酰胺、肟、烷基硫(mercaptyl)、二硫化物、醚、或烯基,或者可以根据反应性基团和其相应反应性配对基团反应形成的任何其他合适的基团。偶联基cg可位于接头l的第二端(即,配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团的近端)。在一些其他实施例中,偶联基cg可以中断接头l的主链。在一些实施例中,偶联基cg是三唑基,其是炔基和叠氮基之间的反应的结果,其中任一个可以是反应性基团rx或反应性配对基团rpx,如本领域已知的用于点击偶合反应(clickcouplingreaction)。三唑基也可以被进一步取代。例如,从结合到二苯并环辛炔基反应性配体基团rpx的基团与表面改性分子的叠氮基反应性基团rx的反应得到二苯并环辛烯基稠合的亚三唑基团,更详细地在下面的段落中描述。各种二苯并环辛炔改性的分子在本领域中是已知的,或者可以被合成以包括配置为支持细胞生长、存活、可移植或其任意组合的基团。
当以多步方法形成涂覆材料时,可以通过使含基团的试剂(分子式5)与具有连接到其上的表面改性配体(分子式6)的基板反应,来引入配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团。
分子式4的改性表面具有附接到其上的表面改性配体,其具有分子式-lg-(l”)j-rx,其连接到基板的氧化物并且与上述分子式1的调理表面类似地形成。基板的表面可以是如上所述的dep配置的基板表面,并且可以包括原生于基板的或引入到基板中的氧化物。连接基lg如上所述。接头l”可以存在(j=1)或不存在(j=0)。接头l”可以具有线性部分,其中线性部分的主链可以包括从硅、碳、氮、氧、硫和磷原子的任意组合中选择的1至100个非氢原子,如在本领域中已知的,受限于化学键合限制。在一些非限制性的示例中,其可以被醚、氨基、羰基、酰氨基或膦酸酯基的任意组合中断。另外,接头l”可具有一个或更多个中断接头主链的亚芳基、杂亚芳基或杂环基。在一些实施例中,接头l”的主链可以包含10至20个碳原子。在其他实施例中,接头l”的主链可以包括约5个原子到约100个原子、约10个原子到约80个原子、约10个原子到约50个原子或约10个原子到约40个原子。在一些实施例中,主链原子全部是碳原子。在其它实施例中,主链原子不全是碳,并且可以包括硅、碳、氮、氧、硫或磷原子的任何可能的组合,如在本领域中已知的,受限于化学键合限制。
反应性基团rx存在于表面改性配体的远离表面改性配体与表面的共价键的末端。反应性基团rx是用于偶联反应以引入被配置成减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团的任何合适的反应性基团。在一些实施例中,反应性基团rx可以是叠氮基、氨基、溴、硫醇、活化酯、琥珀酰亚胺基或炔基基团。
含基团试剂。含基团试剂(分子式5)配置为供应配置为减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团。
基团-(l’)m-rpx
分子式5
含基团试剂的被配置为减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团通过反应性配对基团rpx与反应性基团rx的反应连接到表面改性配体。反应性配对基团rpx是被配置为与相应的反应性基团rx反应的任何合适的反应性基团。在一个非限制性的示例中,一个合适的反应性配对基团rpx可以是炔,并且反应性基团rx可以是叠氮化物。可选地,反应性配对基团rpx可以是叠氮基团,并且相应的反应性基团rx可以是炔。在其他实施例中,反应性配对基团rpx可以是活性酯官能团,反应性基团rx可以是氨基。在其他实施例中,反应性配对基团rpx可以是醛,并且反应性基因rx可以是氨基。其它的反应性基团-反应性配对基团组合是可能的,这些示例决不是限制性的。
分子式5的被配置为减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团可包括本文所述的任何基团,包括:烷基或氟烷基(其包括全氟烷基)基团;单糖或多糖(其可以包括但不限于葡聚糖);醇(包括但不限于炔丙醇);多元醇,包括但不限于聚乙烯醇;亚烷基醚,包括但不限于聚乙二醇;聚电解质(包括但不限于聚丙烯酸或聚乙烯膦酸);氨基(包括其衍生物,例如但不限于烷基化的胺、羟基烷基化的氨基、胍盐和含有未被芳构化的氮环原子的杂环基,例如但不限于吗啉基或哌嗪基);羧酸,包括但不限于丙炔酸(其可以提供羧酸盐阴离子表面);膦酸,包括但不限于乙炔基膦酸(其可以提供膦酸盐阴离子表面);磺酸根阴离子;羧酸甜菜碱;磺酸甜菜碱;氨基磺酸;或氨基酸。
分子式5的含基团试剂的被配置为减少表面结垢和/或防止或减少细胞贴附到微流体装置表面的基团可以直接连接(即m=0时的l’)或间接地连接到被连接到反应性配对基团rpx。当反应性配对基团rpx与被配置为减少表面结垢和/或阻止或减少细胞贴附的基团间接连接时,反应性配对基团rpx可以连接至接头l’(m=1)。反应性配对基团rpx可以连接到接头l’的第一末端,并且配置成减少表面结垢和/或防止或减少细胞贴附的基团可以连接到接头l’的第二末端。接头l’可以具有线性部分,其中线性部分的主链包括1至100个选自硅、碳、氮、氧、硫和磷原子的任意组合的非氢原子,如在本领域中已知的,受限于化学键合限制。在一些非限制性的示例中,其可以被醚、氨基、羰基、酰氨基或膦酸酯基团的任意组合中断。另外,接头l’可具有一个或更多个中断接头主链的亚芳基、杂亚芳基或杂环基。在一些实施例中,接头l’的主链可以包含10至20个原子。在其他实施例中,接头l’的主链可以包括约5个原子到约100个原子、约10个原子到约80个原子、约10个原子到约50个原子或约10个原子到约40个原子。在一些实施例中,主链原子全部是碳原子。在其它实施例中,主链原子不全是碳,并且可以包括硅、碳、氮、氧、硫或磷原子的任何可能的组合,如在本领域中已知的,受限于化学键合限制。
当含基团试剂(分子式5)与具有表面改性配体(分子式3)的表面反应时,形成具有分子式2的调理表面的基板。接头l’和接头l”则在形式上是接头l的一部分,并且反应性配对基团rpx与反应性基团rx的反应产生分子式2的偶联基cg。
表面改性剂。表面改性剂是具有结构lg-(l”)j-rx(分子式4)的化合物。连接基lg与基板表面的氧化物以共价键连接。基板可以是dep配置的基板,并且可以包括硅或氧化铝或氧化铪,氧化物可以作为基板的天然化学结构的一部分存在,或者可以如本文所述地引入。连接基lg可以是本文所述的任何连接基,例如甲硅烷氧基或膦酸酯基,由硅氧烷或膦酸基与基板表面上的氧化物反应形成。上面描述了反应性基团rx。反应性基团rx可以直接连接(l”,j=0)或通过接头l”(j=1)间接连接至连接基lg。连接基lg可以附接到接头l”的第一末端,并且反应性基团rx可以连接到接头l”的第二端,一旦表面改性剂如分子式6那样附接到表面,反应性基团rx将处于基板的表面的远端。
接头l”可以具有线性部分,其中线性部分的主链包括1至100个选自硅、碳、氮、氧、硫和磷原子的任意组合的非氢原子。在一些非限制性的示例中,其可以被醚、氨基、羰基、酰氨基或膦酸酯基团的任意组合中断。另外,接头l”可具有一个或更多个中断接头l”主链的亚芳基、杂亚芳基或杂环基。在一些实施例中,接头l”的主链可以包含10至20个原子。在其他实施例中,接头l”的主链可以包括约5个原子到约100个原子、约10个原子到约80个原子、约10个原子到约50个原子或约10个原子到约40个原子。在一些实施例中,主链原子全部是碳原子。在其它实施例中,主链原子不全是碳,并且可以包括硅、碳、氮、氧、硫或磷原子的任何可能的组合,如在本领域中已知的,受限于化学键合限制。
在一些实施例中,使用化学气相沉积将涂覆材料(或表面改性配体)沉积在微流体装置的内表面上。通过化学气相沉积,涂覆材料可以实现致密包封的单层,其中包含涂覆材料的分子以共价键与微流体装置的内表面的分子结合。为了获得理想的包封密度,可以在至少110℃(例如至少120℃、130℃、140℃、150℃、160℃等)的温度下将包含例如烷基封端的硅氧烷的分子,进行至少15小时(例如,至少20、25、30、35、40、45或更多小时)的气相沉积。这样的气相沉积通常在真空下并且在诸如水合硫酸盐(例如,mgso4·7h2o)的水源的存在下进行。典型地,增加气相沉积的温度和持续时间产生疏水涂覆材料的改进特性。
例如,可选地,通过预先清洁盖子110、微流体通路材料116和/或基板(例如,dep配置基板的电极激活基板206的内表面208,或者ew配置基板的支撑结构104的电介质层)可以改善气相沉积工艺。例如,这种预清洁可以包括溶剂浴,诸如丙酮浴、乙醇浴或其组合。溶剂浴可以包括超声处理。可选择地或另外地,这种预清洁可以包括在可以去除各种杂质的氧等离子体清洁器中处理盖子110、微流体通路材料116和/或基板,同时引入被氧化的表面(例如表面上的氧化物,其可以如本文所述的以共价键改性)。氧等离子体清洁器可以例如在真空条件下以100w工作60秒。可选择地,可以使用液相处理代替氧等离子体清洁器,液相处理包括如过氧化氢的氧化剂来氧化表面。例如,盐酸和过氧化氢的混合物或者硫酸和过氧化氢的混合物(例如食人鱼溶液,其具有的硫酸与过氧化氢的比率可以在约3:1至约7:1的范围中)可以用来代替氧等离子体清洁器。
在一些实施例中,在已经组装微流体装置200以形成限定微流体通路120的壳体102之后,使用气相沉积来涂覆微流体装置200的内表面。在完全组装的微流体通路120上沉积包含致密包封的单层的涂覆材料会有利于提供各种功能特性。不受理论的限制,在完全组装的微流体通路120上沉积这种涂覆材料可有利于防止由微流体通路材料116与电极激活基板206/电介质层和/或盖子110之间的弱化结合引起的脱层。
图4a-图4d描绘了包含示例性类别的涂覆材料的微流体装置500的剖视图。如图所示,涂覆材料529(示意性示出)可以包括与基板504的内表面508和微流体装置500的盖子510的内表面509都以共价键结合的单层致密包封的分子。涂覆材料529可以布置在接近并向内朝向微流体装置500的壳体502的所有内表面508、509,在一些实施例中以及如上所讨论的那样,包括用于限定微流体装置500内的通路元件和/或结构的微流体通路材料的表面(未示出)。在替代实施例中,涂覆材料529可以仅设置在微流体装置500的一个或一些内表面上。
在图5所示的实施例中,涂覆材料529包含单层的烷基封端的硅氧烷分子,每个分子通过甲硅烷氧基以共价键结合到微流体装置500的内表面508、509。然而,可以使用任何上述涂覆材料529(例如烷基封端的膦酸酯分子)。更具体地,烷基可以包含至少10个碳原子(例如10、12、14、16、18、20、22或更多个碳原子)的直链,并且任选地可以是取代的烷基。如上所述,包含单层致密包封分子的涂覆材料529可以具有在dep配置的微流体装置500中使用的有益的功能特性,诸如最小电荷捕获、减小的物理/电气厚度以及基本均匀的表面。
在一些实施例中,用于涂覆微流体装置500的内表面508、509的涂覆材料529提供减少细胞粘附的功能益处。在具体的实施例中,涂覆材料529可以包含在其面向壳体的末端(即单层涂覆材料529的未结合到内表面508、509并靠近壳体502的部分)处的氟烷基(例如氟化烷基或全氟化烷基)。如上面所讨论的,涂覆材料529可以包括单层氟烷基封端的硅氧烷或氟烷基封端的膦酸酯,其中氟烷基存在于涂覆材料529的面向壳体的末端。这样的涂覆材料529提供有利于减少结垢的功能,并且更通常地,减少生物分子如存在于细胞外膜上的生物分子的粘附。
在一些实施例中,用于涂覆微流体装置500的内表面508、509的涂覆材料529提供有益的功能,在于呈现一个或更多个可结合阻止溶液中的阻止剂的基团。取决于实施例,涂覆材料529可以包含或被化学改性(例如通过反应)为在其面向壳体的末端处提供包含阳离子(“阳离子基团”)(例如季铵基)的基团。在一些实施例中,涂覆材料529可包含或被化学修饰为在其面向壳体的末端处提供包含阴离子的基团(“阴离子基团”),例如,膦酸、羧酸或磺酸基团。在一些实施例中,涂覆材料529可以包含或被化学改性为在其面向壳体的末端处呈现阳离子和阴离子的混合物。
创建文库。再次参照图6,虽然并非实施公开的方法所必须的,但在冷冻微流体装置之前,在(可选)步骤520处,创建并存储微流体装置的内容的文库以备将来检索和参考。例如,另外参考图7,文库521可以包括用于一个或更多个隔离细胞中的每一个的基本标识522和隔离区域位置。被隔离的细胞的标识可以包括细胞的来源,特别是从中获得细胞的样品的来源。例如,这可以是与样品编号(例如,患者/受试者样品编号)和/或标示从样品中隔离的每个细胞的任意标签一样少的信息。另外地或可选择地,细胞的“标识”可以包括从受试者收集细胞的具体解剖学位置的标识,以及关于细胞从其起源的样品在细胞被进入到微流体装置之前可能如何被处理的信息。这样的样品处理可以包括从组织样品例如组织活检或细针穿刺物(fna)分离细胞,或者从体液样品例如血液、尿液、唾液、精液、口腔拭子、滑液、房水、玻璃状液、组织培养物(例如,培养物中受精的胚胎)等收集/浓缩细胞等。值得注意的是,从其获得细胞样品的受试者不需要是人。例如,细胞鉴定可以表明受试者是非人类哺乳动物或其他动物(例如,实验室动物、家养宠物、驯养农场动物、动物园动物、野生动物等)。
可以包括在隔离的生物细胞的文库(或“库”)521中的附加信息包括在微流体装置内生物细胞隔离之前(523)或之后(524)对一个或更多个隔离的生物细胞执行的处理523和524(如果有的话),以及在任何这种隔离前或隔离后处理期间获得的数据525。然后,将隔离的细胞的文库或库521存储(在步骤526)在与微流体装置相关联的存储器中。例如,微流体装置可以包括识别标记,诸如条形码、贴纸、rfid等,并且装置文库可以存储在数据库中,该数据库参考装置的识别标记。可选择地或附加地,装置文库可以被存储在与微流体装置耦合即与其一起冷冻的存储器芯片(例如,eeprom等)中。
在各种实施例中,在图6中的可选步骤530表示的,方法还包括(在冷冻装置之前)将诸如二甲基亚砜(dmso)的细胞保存试剂引入到微流体装置中。在一个这样的实施例中,dmso以选择的相应浓度和持续时间被引入微流体装置中,使得在冷冻微流体装置时一种或更多种隔离的生物细胞基本上被含有约10%dmso的溶液包围。在一个这样的实施例中,dmso以约15%至约25%的体积浓度(取决于例如流动区域的体积与隔离区域的总体积的比例)被引入到微流体装置中,并允许扩散到含有隔离的生物细胞的一个或更多个隔离区域中。在一个这样的实施例中,灌注dmso穿过微流体装置足够长的时间以在一个或更多个隔离区域中的每一个中实现约10%的dmso浓度。
参考图8,冷冻微流体装置(图6中的步骤550)可以包括初始受控冷却540,使微流体装置达到近冷冻(例如,约4℃)或冷冻(例如,约0℃)的温度,随后额外冷却544,使微流体装置达到零下温度。或者,初始冷却可以是不受控冷却542。作为示例而是非限制性的,微流体装置的初始受控冷却540可以是在约每分钟1℃至约每分钟2℃的范围中的速度,也可以使用更慢(例如每分钟0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8或0.9℃)或更快(例如每分钟2.1、2.2、2.3、2.4、2.5、2.6、0.7、2.8、2.9、3.0℃或更快)的速度。受控冷却的速度可以根据情况,例如在从慢至每分钟0.1℃或每分钟0.2℃到快至大约每分钟3.0℃或每分钟4.0℃的范围内而变化。在各种实施例中,零下温度为约-20℃或更低,并且更优选为约-80℃或更低,在一些实施例中包括约-150℃或更低。
还参照图9,该方法还可以包括解冻微流体装置(步骤570),包括(在步骤560)从低温储存取回微流体装置,然后进行微流体装置的受控加热562和/或允许微流体装置自热至室温(步骤564),以便在解冻后测试、评估、测定、测序和/或以其他方式使用隔离的细胞。例如,如图6中通常由步骤590标示的,在解冻微流体装置之后,可能期望在微流体装置中培养一个或更多个活细胞,例如通过连续或间歇灌注可流动的细胞生长介质穿过微流体装置,从而在微流体装置产生额外的细胞。在这样的实施例中,细胞的处理可以进一步包括(在解冻之后)识别在解冻微流体装置之后一个或更多个隔离的细胞和/或由其产生的细胞中的哪一个是有活力的,和/或从微流体装置中取回至少一个隔离的细胞和/或由其产生的细胞。举例来说,在解冻之后,可以对微流体装置中的一个或更多个细胞进行测定以检测细胞分泌(例如包含抗体或细胞因子的免疫学分子)或细胞表面标记。
示例
示例1-在微流体装置上冷冻1f5杂交瘤细胞(atcchb-9645)。
本申请的发明人将在标准培养板中生长的生物细胞引入到36℃的微流体装置中。然后操纵细胞并将其隔离在微流体装置(仍然在36℃)中的各个隔离区域中。将15%dmso溶液(在介质中)流入微流体装置,然后将装置在36℃下孵育30分钟,不进行灌注。然后将微流体装置以1.8℃/分钟的受控速度冷却至0℃。据观察,在冷冻过程中,隔离的细胞继续移动,但随着温度下降而减慢。将该装置置于聚苯乙烯泡沫塑料盒中,然后将其置于-80℃冰箱中过夜。第二天,将微流体装置从冰箱(并且从聚苯乙烯泡沫塑料盒)中取出,并允许最高加热到室温(假设由于相对较小的装置尺寸,装置温度在一分钟内上升到室温)。然后将该装置放置在测试仪器上,将珀尔帖设定在约24℃,开始灌注培养基。之后,将装置的温度以大约3℃/分钟升高到36℃。观察到一些细胞在装置解冻期间开始移动,并且一些存活的(活的)整天继续移动,在一天结束时有一小部分存活,符合生物细胞的标准冷冻-解冻程序。在微流体装置被冷冻然后被解冻之后,oet过程继续对微流体装置(以及其中隔离的细胞)工作。
示例2-在微流体装置上冷冻前列腺癌细胞。
将组织活检分解成多个单个的细胞并引入微流体装置。将12毫升的细胞悬浮液以1×106个细胞/毫升的浓度输入到装置中,该装置具有大约1.0毫升的总通道体积,具有在任何时刻接近1000个细胞的标称量。使用自动围栏算法(automatedpenningalgorithm)将细胞分别置于隔离室中。在细胞加载和隔离过程中,装置温度设置在12℃。然后将微流体装置放入冷冻机中冷冻足够的时间。然后通过从冷冻机中取出来解冻该装置,并放置在设备上(t=12℃)。使用oet观察到隔离室中的活细胞可以移动,并且可以被输出用于进一步分析,例如测序。
尽管已经示出和描述了实施例,但是可以进行各种修改而不脱离本文公开的发明构思的范围。因此,除了在下面的权利要求书中所限定的之外,本发明不应受到限制。
- 还没有人留言评论。精彩留言会获得点赞!