由诱发的空化所驱动的高速按需液滴生成及单细胞包封的制作方法
本申请要求于2012年2月9日提交的USSN13/370,196的权益和优先权,其整体通过引用并入本文以用于所有目的。
政府支持声明
本发明是在政府支持下进行的,美国航空和航天局颁发的许可号NCC2-1364,美国卫生研究院颁发的许可号Y018228;以及美国国家科学基金会颁发的许可号0747950、0852701和0901154。政府对该发明具有某些权利。
技术领域
本发明涉及微流体领域。在某些实施方案中,提供了用于高速形成液滴和/或包封液滴、颗粒和/或细胞的方法和设备。
背景技术:
微流体设备吸引了很多关注,因为它们提供平台用于对极小体积的流体执行分析,当利用光蚀刻技术产生该设备时,能够以低成本制造。这些设备具有作为“实验室晶片”的潜力,集成多个功能性,包括例如,样本制备、支撑聚合酶链式反应的热循环以及吸收或者荧光监控。它们的紧凑尺寸使其尤其适用于便携式设备,这潜在地允许在临床医生办公室或现场进行复杂分析的性能。然而,在分析多个样本时使用微流体设备的挑战之一是样本区室化。尽管常规实验室分析器可以利用一系列试管或者类似容器以防止样本之间的污染,但是该方法难以应用于小体积流体,其中与设备表面的相互作用会取代总体流动属性。
典型微流体设备利用连续通过设备的单个流体相。将离散体积的流体测试样本或者试剂引入这种设备会导致形成移过装置通道的流体段。不幸地是,这种流体段将趋于变得散布,这是由于流道内的力(诸如扩散和湍流)。此外,流体段的组分会与微流体设备的通道壁相互作用,仅在稍晚的时间被释放。这种现象会导致流体段之间的污染,并且致使需要使用降低流体通道内湍流的特征来设计这种微流体芯片,并需要设计测试协议(包括样本之间的内部体积的耗时的洗涤或者冲刷)。另外,流体段的分散使得对于特征反应难以提供流体段内含物的可再现体积和浓度。
解决该问题的一个方法是引入数字微流体设备,在该设备中,用于分析或者其他处理的样本流体以离散的低体积液滴形式被引入设备的通道中。例如,以在包含不混溶油介质的通道内行进的水性液滴形式引入具有生物化学或者生物学内含物的水性样本降低了与通道壁的相互作用并且防止了散布,从而最小化液滴之间的污染。能够类似地处理用于表征这种样本的试剂。然而,为了有效,数字微流体设备需要以下机制,即,用于以精确的体积控制进行高速液滴生成以充分实现精确的高通量分析。
被动机制可以用于快速连续的液滴生成,作为通过这种设备的流动的函数。以该方式可以以每秒几千液滴的速率生成高度均匀的液滴(Yobas等人,(2006)Lab on a chip,6:1073-1079)。US7,759,111描述了这种设备,其中由不混溶的油流从水性介质流中剪切出液滴。被动设备的另一实例公开于WO2010/110843A1,其中侵入流体通道的屏障与流体以及通道的流动特性结合作用以形成涡旋,该涡旋提供了驱动液滴形成的压力的周期变化。然而,这种设备不提供包含专门指定体积的样本流体的液滴的按需生成(例如,体积包含特定的关注细胞),也不能自身生成具有不同体积的个体液滴。这限制了它们用于表征不同样本体积的实用性以及在各种测试协议的性能方面的实用性。
用于液滴生成的主动方法能够解决这些问题,该方法依赖于使用施加的力来驱动液滴形成。这种设备可以包括调整通过设备的流动的物理部件。其的一个实例是使用压缩空气驱动的微阀,微阀集成入微流体设备(Zeng等人,(2009)Lab on a chip 9:134-1343),这允许以每秒高达100个液滴的速率形成可控的液滴。该方法的另一实例是使用柔性材料(PDMS)的活动壁,该活动壁集成入微流体芯片中并且由空气压力驱动以周期地中断流体相的流动以提供散布(Hsiung等人,(2006)J.Micromechanics and Microengineering,16:2403-2410),这展示了高达每秒20个液滴的液滴形成速率。又一实例US2010/0059120公开了使用通过开口连接的两个通道,其中,一个通道中的流动中断器能够被触发以阻挡流体流动并且迫使其内含物的一部分进入第二通道。这种设备的另一实例描述于US2010/0163412,其公开了包括柔性流体储罐的设备,该柔性流体储罐主要被内置压电设备压缩以生成用于液滴形成的压力。这种特征显著增加了设计这些微流体设备的复杂性,进一步使得制造工艺变得复杂。这种方法的机械性质限制了能够产生液滴的频率,而且随着时间会发生改变。另外,相比使用被动设备产生的液滴,这些方法趋于产生液滴尺寸会大幅变化的液滴群。
主动液滴生成的其他方法取决于使用向设备施加的无质量(massless)更少或者基本无质量的能量,从而避免机械部件的缺点。这些方法中的一些利用了向设备施加电场以改变流体流动或者更改两个流体之间的界面的属性以利于液滴形成。这会需要所涉及的流体之间大的传导差,会限制这种设备的实用性。例如,US2006/0231398公开了使用势差通过电润湿在不混溶的低阻流体与高阻流体之间移动液滴,利用势差暂时降低流体之间界面处的表面张力,直到存在的流型(flow pattern)足以生成液滴。类似方法描述于WO2010/151776,其中,势差驱动了作用之组合以生成液滴,所述作用包括两个不混溶流体之间界面中的电动流动和干涉。使用势差驱动液滴形成的又一实例见于WO2011/023405A1,其公开了喷嘴结构和建立势差的组合以将传导流体的液滴电喷射入介电流体中。US2005/0031657公开了液滴形成中涉及的不需要流体之间大传导差的方法,其描述了使用电阻加热器加热设备内的容器的一部分,直到存储于其中的一部分流体蒸发。蒸发流体的压力将一部分剩余流体通过喷嘴推入不混溶的流体。然而,该方法的液滴生成是相对慢的,每个喷嘴每秒仅产生约15-25个液滴。尽管这些方法避免了使用机械部件,但是它们需要向设备并入电极、电阻加热器或者类似部件。这增加了设计设备的复杂性,并进一步需要使用支撑特征来可靠地供给电流。
发明简述
在多个实施方案中,此处描述了用于在第二流体中快速且可重现地生成第一流体的液滴的新颖的方法和设备。所述流体可以是不混溶的,其中不混溶的流体能够包括彼此不显著可溶的流体,由于物理属性(诸如密度或者粘度)而一时间段内不混合的流体,以及由于层流而多时间段内不混合的流体。通过第一流体内的暂态泡(诸如空化泡)的膨胀和后续收缩来驱动液滴形成。或者,第一流体内的泡的形成可以引起其作用在第二流体上,从而驱动在第三流体中生成第二流体的液滴。空化泡能够使用单向能量源来生成,从而不需要向本发明的设备并入电极、加热器或者类似部件。合适的单向能量源包括但不限于脉冲激光器,使用其可允许以每秒小于1个至高达100,000个液滴的速度按需形成高度可再现的液滴。液滴体积能够得到控制,在某些实施方案中,液滴体积的范围为约1至约150皮升。在某些实施方案中,活细胞在高细胞活性的情况下能够被捕获到这种液滴内,在某些实施方案中,细胞活性高达92.07%。因为不需要机械阀或泵,所以这些方法和设备尤其适用于微流体设备。
在一个实施方案中,第一流体和第二流体可以是不混溶的,它们可操作地联接。在某些实施方案中,可操作联接的形式可以为流体连通。在其他实施方案中,柔性膜可以介入第一流体和第二流体之间。在第一流体内生成空化泡可向第一流体生成足够的速率和/或脉冲和/或位移,以移动可控体积的第二流体。在某些实施方案中,这种空化泡在1毫秒内膨胀并收缩,能够移动的可控体积为约1微升或更少。这种空化泡可以通过辐射(例如通过脉冲激光器)产生。在一些实施方案中,可控体积的第二流体的体积能够通过能量和/或脉冲频率和/或脉冲激光的波长来控制,能量和/或脉冲频率和/或脉冲激光的波长可以由控制器来调制。
在另一实施方案中,第一流体路径和第二流体路径经由开口联接。在一些实施方案中,第一和第二流体路径中的流体是不混溶的。在第一流体内生成空化泡向一部分第一流体施加足够的速率以引起第一流体的液滴移过开口并进入第二流体路径。在某些实施方案中,所述开口可以构造为端口、通道或者喷嘴。这种空化泡可以通过辐射(例如通过脉冲激光器)产生。在一些实施方案中,所述激光器辐射的强度、持续时间和/或位置能够调制液滴体积。
在本发明的另一实施方案中,第一流体路径和第二流体路径流体连通,并且第二流体路径经由开口联接至第三流体路径。在一些实施方案中,第二和第三流体路径中的流体是不混溶的。在第一流体内生成空化泡向一部分第二流体施加足够的速率以引起第二流体的液滴移过开口并进入第三流体路径。在某些实施方案中,所述开口可以构造为端口、通道或者喷嘴。在一些实施方案中,所述第二流体可以包括颗粒和/或细胞。所述第二流体路径可以被监控,这种监控产生的数据传递至控制器。在一些实施方案中,空化泡通过辐射产生,辐射可以由控制器启动。辐射能够呈激光脉冲形式,而在一些实施方案中,液滴的体积可以使用激光脉冲的强度、持续时间以及位置来调制。
在另一实施方案中,柔性膜介入第一流体路径和第二流体路径之间,并且第二流体路径经由开口联接至第三流体路径。在一些实施方案中,第二和第三流体路径中的流体是不混溶的。在第一流体内生成空化泡引起一部分柔性膜弹性变形而进入第二流体路径。该弹性变形向一部分第二流体施加足够的速率以引起第二流体的液滴移过开口并进入第三流体路径。所述开口可以构造为控制器。在一些实施方案中,所述第二流体可以包括颗粒和/或细胞。所述第二流体路径可以被监控,这种监控产生的数据传递至控制器。在一些实施方案中,空化泡通过辐射产生,辐射可以由控制器启动。辐射能够呈激光脉冲形式,而在一些实施方案中,液滴的体积可以使用激光脉冲的强度、持续时间以及位置来调制。
在本发明的另一实施方案中,第一流体路径和第二流体路径通过开口连接,其中所述开口经定位以使得在第一流体路径中的泡的形成能够诱发力,该力引起第一流体的液滴移过开口并进入第二流体路径。在某些实施方案中,所述开口可以构造为端口、通道或者喷嘴。在一些实施方案中,所述开口构造为喷嘴。控制器联接至能量源(例如脉冲激光器),该能量源能够引导能量进入第一流体路径以引起一个或多个泡的形成。在一些实施方案中,所述泡能够是空化泡。在其他实施方案中,能量源是脉冲激光器;控制器可以构造为通过调制由脉冲激光器产生的激光脉冲的强度、持续时间和/或位置来调节液滴的体积。
在另一实施方案中,第一流体路径和第二流体路径经定位以使得柔性膜介入它们之间。柔性膜转而经定位以使得在第一流体路径内的泡的形成引起一部分柔性膜的弹性变形,该弹性变形转而诱发对第二流体路径中包含的流体的力。第二流体路径和第三流体路径通过开口连接,开口经布置以使得当这种力施加在第二流体路径的流体上时,流体的液滴通过开口被挤入第三流体路径。控制器构造为引导能量,该能量引起在第一流体路径中的泡的暂时形成。该暂态泡能够是空化泡。在某些实施方案中,所述开口可以构造为端口、通道或者喷嘴。在一些实施方案中,所述开口构造为喷嘴。在各种实施方案中,监控器可以构造为监控第二流体路径或者第三流体路径,其中监控器将收集的数据传递至控制器。在某些实施方案中,控制器可以构造为控制第二流体路径中指定体积的流体向第三流体路径的转移,其中所述指定体积使用来自监控器的数据确定。
在一些实施方案中,流体路径可以包括颗粒或者细胞,颗粒或者细胞被挤入另一流体路径的周围液体的液滴包封。监控器可以包括在一些实施方案中,以表征这种颗粒或者细胞,当与控制器联接时可以允许特定液滴内的特定颗粒或者细胞的可控的包封。
在多个实施方案中,提供了用于生成液滴的设备。在某些实施方案中,所述设备包括邻近第二流体流(例如,微流体流)的第一流体流(例如,微流体流),第一流体流包括第一流体,第二流体流包括第二流体,其中第二流体在第一流体中是不混溶的。在某些实施方案中,所述设备包括:第一微流体通道,其包括、包含和/或引导第一流体流;以及第二微流体通道,其包括、包含和/或引导第二流体流,其中第一微流体通道邻近或者靠近第一微流体通道,并且流体连通第二通道(例如,经由端口或者通道)。在某些实施方案中,第二流体包括水性流体。在某些实施方案中,第一流体包括油或者有机溶剂。在某些实施方案中,第一流体包括选自以下的溶剂:四氯化碳、氯仿、环己烷、1,2-二氯乙烷、二氯甲烷、乙醚、二甲基甲酰胺、乙酸乙酯、庚烷、己烷、甲基叔丁基醚、戊烷、甲苯、和2,2,4-三甲基戊烷。在某些实施方案中,第一流体包括油。在某些实施方案中,设备包括布置在第一微流体流和第二微流体流之间的第三流体流。在某些实施方案中,设备包括布置在第二流体和端口或通道之间的第三流体流。在某些实施方案中,设备还包括布置在第二微流体通道中的第三流体流,其位于端口和第二流体之间。在某些实施方案中,第三流体流包含待包封的液滴、细胞或者颗粒。在某些实施方案中,端口或者通道包括喷嘴。在某些实施方案中,第一和/或第二微流体通道由选自以下的材料形成:玻璃、金属、陶瓷、矿物、塑料和聚合物。在某些实施方案中,第一和/或第二微流体通道由弹性材料形成(例如,聚二甲基硅氧烷(PDMS)、聚烯烃塑性体(POP),全氟聚乙烯(a-PFPE)、聚氨酯、聚酰亚胺以及交联(酚醛聚合物)树脂等)。
在某些实施方案中,设备产生大致连续体积调节(tuning)的液滴,范围为约0.1fL或者约1fL,或者约10fL或者约50fL,或者约100fL,或者约500fL至高达约1μL,或者约500nL,或者约1nL,或者约500pL,或者约400pL或者约300pL或者约200pL或者约150pL。在某些实施方案中,设备产生大致连续体积调节的液滴,范围为约0.1fL至约1μL,或者约0.1fL至高达约500nL,或者约1fL至高达约1nL,或者约1fL至高达约500pL,或者约500fL至高达约500pL或者约1pL至高达约150pL。在某些实施方案中,设备能够提供按需液滴生成,速度为大于约1,000个液滴/秒,更优选大于约2,000个液滴/秒,更优选大于约4,000个液滴/秒,更优选大于约6,000个液滴/秒,或更优选大于约8,000个液滴/秒。在某些实施方案中,设备能够提供按需液滴生成,速度范围为从0液滴/秒、1个液滴/秒、2个液滴/秒、约5个液滴/秒、约10个液滴/秒、约20个液滴/秒、约50个液滴/秒、约100个液滴/秒、约500个液滴/秒、或者约1000个液滴/秒至高达约1,500个液滴/秒、约2,000个液滴/秒、约4,000个液滴/秒、约6,000个液滴/秒、约8,000个液滴/秒、约10,000个液滴/秒、约20,000个液滴/秒、约50,000个液滴/秒、或者约100,000个液滴/秒。在某些实施方案中,设备能够提供按需液滴生成,速度为大于约1,000个液滴/秒,更优选大于约10,000个液滴/秒,更优选大于约20,000个液滴/秒,更优选大于约40,000个液滴/秒,更优选大于约50,000个液滴/秒,更优选大于约80,000个液滴/秒,或更优选大于约100,000个液滴/秒。在某些实施方案中,设备存在于以下系统中(或者作为该系统的部件),即,该系统包括能够在流体流或者微通道中形成泡的能量源。在某些实施方案中,能量源包括光学能量源或者微波发射器。在某些实施方案中,能量源包括激光器(例如,脉冲激光器)。在某些实施方案中,设备和/或系统构造为在第二微流体流中激发蒸气泡。在某些实施方案中,设备和/或系统构造为在靠近端口或者通道的第二微流体通道中激发蒸气泡。在某些实施方案中,设备和/或系统构造为在与第一或者第二微流体流不流体连通的第三微流体通道或室中激发蒸气泡。在某些实施方案中,在液体或者凝胶介质中激发蒸气泡。在某些实施方案中,在油或者非水性介质中激发蒸气泡。在某些实施方案中,在包括吸光纳米颗粒/微颗粒(例如染料分子、金属纳米颗粒等)的介质中激发蒸气泡。在某些实施方案中,设备布置在基板上,基板包括选自以下的材料:聚合物、塑料、玻璃、石英、介电材料、半导体、硅、锗、陶瓷以及金属或者金属合金。在某些实施方案中,设备与其他微流体部件(例如,微流体部件如PDMS通道、井、阀等)集成在一起。在某些实施方案中,设备是实验室芯片的部件。
在多个实施方案中,提供了用于生成液滴和/或包封颗粒或者细胞的系统。在某些实施方案中,系统包括如上描述的(或者下述的)设备,以及用于在流体中形成气体泡的激发源。在某些实施方案中,激发源是激光器、微波源或者超声波能量源。在某些实施方案中,系统还包括用于检测系统中的颗粒或者细胞的部件(例如,光学检测系统、电检测系统、磁检测系统、声波检测系统、电化学检测系统等)。在某些实施方案中,所述部件包括用于检测散射、荧光或者拉曼光谱信号的光学检测系统。
在多个实施方案中,提供了用于生成液滴的方法。在某些实施方案中,该方法涉及提供如上描述的(以及下述的)设备;以及利用能量源在第二微流体流或第二微流体通道中或者在第三微流体通道或室中形成泡以将液滴喷射入第一微流体流或通道。在某些实施方案中,利用能量源包括利用脉冲激光器以在第二微流体流或通道中或者在第三微流体通道或室中激发空化泡。
在多个实施方案中,提供了移动可控量的流体的方法。在某些实施方案中,这种方法包括:在第一流体中生成空化泡,其中空化泡向一部分第一流体施加足够的速率,从而移动可控体积的第二流体,所述第二流体可操作地联接至第一流体。在某些实施方案中,第二流体的可控体积为约10μL或更少,或者约5μL或更少,或者约1μL或更少,或者约500nL或更少,或者约100nL或更少,或者约1nL或更少,或者约500pL或更少,或者约200pL或更少。在某些实施方案中,空化泡具有的持续时间为约100ms或更少,或者约50ms或更少,或者约1ms或更少,或者约0.5ms或更少,或者约1ms或更少、或者约0.5ms或更少,或者约0.1ms或更少,或者约0.05ms或更少。在某些实施方案中,第二流体的可控体积是1μL或更少,并且空化泡的持续时间为约1ms或更少。在某些实施方案中,第一流体和第二流体处于流体连通。在某些实施方案中,柔性膜介入第一流体和第二流体之间。在某些实施方案中,第一和第二流体是不混溶的。在某些实施方案中,空化泡是通过用脉冲激光器辐射一定体积的第一流体而生成的。在某些实施方案中,所述方法还包括使用调节脉冲激光的能量和/或脉冲频率和/或波长中至少之一的控制器来控制第二流体的可控体积。在某些实施方案中,所述方法包括以至少约1000Hz、或者至少约5,000Hz、或者至少约10,000Hz的频率生成多个分开的额外空化泡。在某些实施方案中,第二流体的可控体积为约500纳升或更少。在某些实施方案中,第二流体的可控体积是约200pL或更少。在某些实施方案中,以约1kHz或更高的频率、或者以约5kHz或更高的频率、或者以约10kHz或更高的频率来重复所述方法。
在多个实施方案中,提供了用于在设备中生成液滴的方法。在某些实施方案中,所述方法包括:提供包括第一流体的第一流体路径,包括第二流体的第二流体路径,以及使第一流体路径流体联接至第二流体路径的开口;以及在第一流体路径中生成空化泡,其中空化泡向一部分第一流体施加足够的速率和/或脉冲和/或位移以挤压第一流体的液滴经过开口并进入第二流体路径。在某些实施方案中,第一流体和第二流体是不混溶的流体。在某些实施方案中,第一流体是水性流体,而第二流体是有机溶剂或者油。在某些实施方案中,第二流体是水性流体,而第一流体是有机溶剂或者油。在某些实施方案中,开口构造为喷嘴。在某些实施方案中,空化泡是通过用脉冲激光器辐射一定体积的第一流体而生成的。在某些实施方案中,所述方法涉及选择激光脉冲的强度、持续时间、波长和位置中至少之一,从而产生期望体积的液滴。
在某些实施方案中,提供了用于在设备中生成液滴的方法,包括:提供包括第一流体的第一流体路径,包括第二流体的第二流体路径,第二流体路径与第一流体路径流体连通,包括第三流体的第三流体路径,以及使第二流体路径流体联接至第三流体路径的开口;以及在第一流体路径中生成空化泡,其中空化泡向一部分第二流体施加足够的速率以挤压第二流体的液滴经过开口并进入第三流体路径。在某些实施方案中,第二流体和第三流体是不混溶的流体。在某些实施方案中,第二流体是水性流体,而第三流体是有机溶剂或者油。在某些实施方案中,第二流体是水性流体,而第三流体是有机溶剂或者油。在某些实施方案中,所述方法还包括监控第二流体路径,并且将通过这种监控生成的数据传递至控制器。在某些实施方案中,第二流体还包括颗粒。在某些实施方案中,第二流体还包括细胞。在某些实施方案中,开口构造为喷嘴。在某些实施方案中,空化泡是通过辐射一定体积的第一流体而生成的。在某些实施方案中,辐射由控制器激发。在某些实施方案中,辐射是激光脉冲。在某些实施方案中,所述方法还包括选择激光脉冲的强度、持续时间、波长和位置中的至少之一,从而产生期望体积的液滴。
在某些实施方案中,提供了用于在设备中生成液滴的方法,其包括:提供包括第一流体的第一流体路径,包括第二流体的第二流体路径,包括第三流体的第三流体路径,介入第一流体路径和第二流体路径之间的柔性膜,以及第二流体路径和第三流体路径之间的开口;以及在第一流体路径中生成空化泡,其使一部分柔性膜弹性变形(例如,膜由弹性材料制成(例如聚二甲基硅氧烷(PDMS)、聚烯烃塑性体(POP)、全氟聚乙烯(a-PFPE)、聚氨酯、聚酰亚胺以及交联(酚醛聚合物)树脂等))进入第二流体路径,其中柔性膜的该部分的弹性变形向一部分第二流体施加足够的速率和/或脉冲和/或位移以挤压第二流体的液滴经过开口并进入第三流体路径。在某些实施方案中,第二流体和第三流体是不混溶的流体。在某些实施方案中,第二流体是水性流体,而第三流体是有机溶剂或者油。在某些实施方案中,第二流体是水性流体,而第三流体是有机溶剂或者油。在某些实施方案中,所述方法还包括监控第二流体路径中的流体,并且将通过这种监控生成的数据传递至控制器。
在多个实施方案中提供了用于生成液滴的设备。在某些实施方案中,所述设备包括:第一流体路径;第二流体路径;在第一流体路径和第二流体路径之间的开口,开口经布置以使得第一流体路径中的流体中的泡的形成诱发有效量的力,从而将流体的液滴从第一流体路径通过开口挤入第二流体路径;以及联接至能量源的控制器,其可操作地构造为引起能量源引导能量,该能量诱发在第一流体路径中的一个或多个泡的暂时形成。在某些实施方案中,泡是空化泡。在某些实施方案中,开口构造为喷嘴。在某些实施方案中,能量源是脉冲激光器。在某些实施方案中,控制器构造为调节液滴的体积作为以下至少之一的函数:激光脉冲的强度、激光脉冲的持续时间、激光脉冲的波长、以及激光脉冲在第一流体通道内的位置。
在多个实施方案中,提供了用于生成液滴的设备。在某些实施方案中,所述设备包括:第一流体路径;第二流体路径;第三流体路径;介入第一流体路径和第二流体路径之间的柔性膜,柔性膜经布置以使得第一流体路径中的流体中的泡的形成诱发力,该力使一部分柔性膜弹性变形;在第二流体路径和第三流体路径之间的开口,开口经布置以使得一部分柔性膜的弹性变形诱发对第二流体的力,从而将第二流体的液滴从第二流体路径通过开口挤入第三流体路径;以及可操作地构造为引导能量的控制器,该能量诱发在第一流体路径中的流体中的泡的暂时形成。在某些实施方案中,泡是空化泡。在某些实施方案中,所述设备还包括监控器,其构造为监控第二或者第三流体路径,并且还构造为将数据从监控器传递至控制器。在某些实施方案中,控制器还构造为控制指定体积的第二流体进入第三流体路径,指定体积至少部分地由来自监控器的数据确定。
在任何前述方法和设备的某些实施方案中,生成液滴,液滴的体积变化为约10%或更少,优选约5%或更少,更优选约3%或更少,或者约2%或更少,或者约1%或更少,重复率范围为约1kHz至高达约10kHz。
附图简述
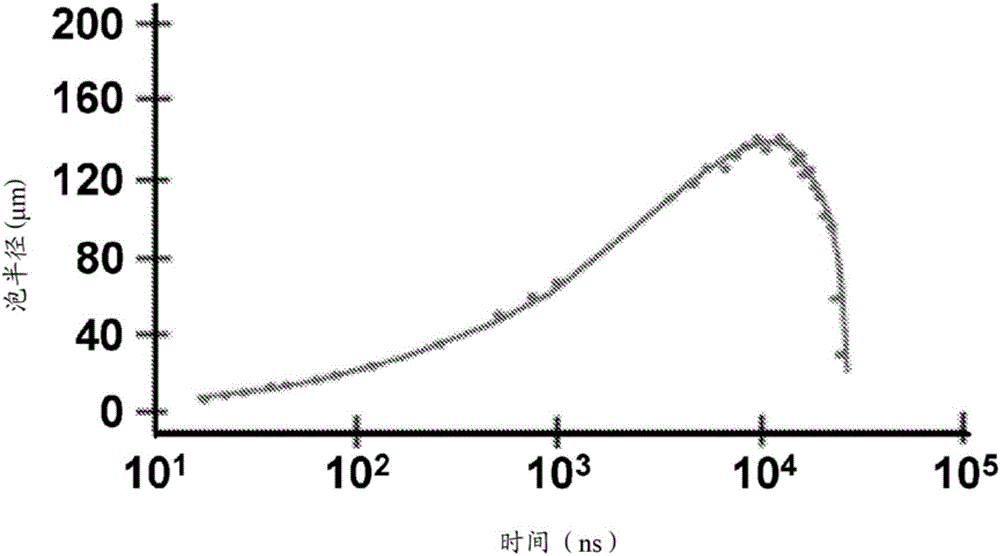
图1A和1B示出使用脉冲激光器创建空化泡的过程。图1A示出用聚焦激光脉冲辐射产生的一定体积的流体内的等离子生成,之后生成冲击波并且空化泡膨胀和后续坍塌。图1B示出用于空化泡的膨胀和后续坍塌的典型时间过程的图。
图2图示出使用脉冲激光器生成的空化泡的形成和后续坍塌的时间过程。
图3示意地图示出本发明一个实施方案的在流体通道内生成液滴。
图4示意地图示出本发明另一实施方案的在流体通道内生成液滴,该液滴包含颗粒或者细胞。
图5示意地图示出本发明另一实施方案的在流体通道内生成液滴。
图6示意地图示出本发明另一实施方案的在流体通道内生成液滴。
图7示意地图示出本发明另一实施方案的在流体通道内生成液滴,该液滴包含颗粒或者细胞。
图8的面板(a)-(i)示出按需液滴生成的时间分辨图像系列。
图9示出通过改变激光脉冲的能量以及通过改变激光脉冲的位置来调制所生成液滴的体积。
图10的面板(a)-(d)图示出使用以不同间隔重复的一系列激光脉冲在流体通道内连续生成液滴。比例尺具有100微米的长度。面板(a)图示出2毫秒间隔,面板(b)图示出1毫秒间隔,面板(c)图示出500微秒间隔,以及面板(d)图示出100微秒间隔。
图11的面板(a)和(b)图示出以不同的激光脉冲频率生成的收集液滴。比例尺具有100微米的长度。面板(a)图示出通过1kHz激光脉冲频率生成的液滴。面板(b)图示出通过10kHz激光脉冲频率生成的液滴。
图12的面板(a)-(d)图示出使用以不同间隔重复的一系列激光脉冲在流体通道内连续生成液滴。面板(a)图示出2毫秒间隔,面板(b)图示出1毫秒间隔,面板(c)图示出500微秒间隔,以及面板(d)图示出100微秒间隔。
图13的面板a-c示出在通过空化泡生成的液滴内包封颗粒或者细胞。面板(a)示出流体通道内的颗粒。面板(b)示出在诱发空化泡且后续生成液滴之前以及之后的不同时间间隔的细胞位置,如白箭头所指示。面板(c)图示出连续生成一系列液滴,每个液滴包封细胞。
图14图示出使用1Hz频率的激光脉冲在流体通道内顺序生成液滴。
发明详述
在多个实施方案中,提供了用于可控体积的液滴的按需高速液滴生成的设备和方法,其在微流体领域中具有特定应用。在多个实施方案中,所述方法和设备还能够用来包封细胞和/或颗粒和/或其他流体液滴。
在多个实施方案中,此处描述的设备和方法利用新颖的可控致动机制,利用单向能量来诱发短暂的活空化泡。在一些实施方案中,该能量呈脉冲激光器的形式,其提供了突发(bursts)的光学能量,能够控制该能量的强度、持续时间、波长和/或位置。
图1A图示出激光脉冲诱发的水性介质中的空化泡形成的基础机制。激光脉冲聚焦在特定体积的水性介质上。该光学能量的吸收导致水分子在聚焦区域内分解,从而生成靠近焦点的等离子泡。等离子的成分在数纳秒内重新组合,从而生成释放能量的冲击波以及爆炸的蒸气泡(也称为空化泡),蒸气泡以每秒100米迅速膨胀,之后迅速坍塌。图1B示出用于泡形成以及坍塌的典型时间过程。能够看到在启动之后高达约1微秒,泡半径迅速增加,之后迅速坍塌。
图2示出使用该致动机制的泡形成的一系列显微照片。能够看到在启动之后22纳秒,冲击波从等离子生成点向外膨胀。快速膨胀的空化泡在72纳秒是易于观察的,直到55微秒泡膨胀出框架。此后是泡的急速坍塌,这在启动之后152微秒内基本完成。在泡膨胀时,这种泡内部的压强能够高达数十兆帕斯卡或更多。许多独特属性提供了用于超快的微流体致动和纳流体致动的独特机制,所述独特属性诸如:驱动力的迅速致动(取决于激光脉冲持续时间,从数飞秒至数纳秒)、单向能量迅速转换成机械功率、大量的合力、空化泡产生的相对大的位移、以及所涉及的力的极限瞬时性质。利用该致动机制,能够实现微流体的和纳流体的部件(诸如开关、阀和泵)以前所未有的速度和精度引导、驱动和调节微流体尺度和纳流体尺度的流体流,从而能够实现新颖的功能性。
本发明的一个例示实施方案示意地示于图3。该图示出其能够作为微流体设备的设备,其包括:包含第一流体(322)的第一流体通道(320)(例如,微通道)以及包含第二流体(312)的第二流体通道(310)(例如,微通道),其中第二流体在第一流体中是不混溶的,并且其中流体通道经由开口(330)彼此流体连通。在一些实施方案中,该开口呈喷嘴形式。单向能量源(340)(例如脉冲激光器)指向第一流体通道(320)。在某些实施方案中,激光器能够例如使用镜子(350)来指向,并使用透镜(355)来聚焦于一定体积的第一流体通道(320)中。在一些实施方案中,镜子和/或透镜构造为允许单向能量源聚焦于第一流体通道(320)内的不同位置。单向能量源(340)启动在第一流体通道(320)内的暂态泡(360)(例如,空化泡)的形成,从而驱动第一流体的液滴(370)进入第二流体通道(310)。泡的坍塌引起挤出的第一流体的回流,从而引起形成窄“颈”并且迅速导致液滴(380)释放进入第二流体通道(310)。
图8示出一系列照片,所述照片示出在这种设备中液滴的形成和释放。图8的面板(a)示出通过开口连接的一组平行的流体通道。图8的面板(b)可见空化泡的诱发,这将一个通道的一部分内含物挤入到其他通道,如图8的面板(c)至(e)所见。随着泡坍塌,形成了连接流体的窄“颈”,如图8的面板(f)和(g)所见。最终,该颈收缩并且液滴被释放,如图8的面板(h)和(i)所示。
本发明另一实施方案示于图4。该图示出能够作为微流体设备的设备,其包括:包含第一流体的第一流体通道(420)(例如,微通道),包含第二流体(417)的第二流体通道(415)(例如,微通道),以及包含第三流体(412)的第三流体通道(410)(例如,微通道),其中第二流体在第三流体中是不混溶的,并且其中第二流体通道和第三流体通道经由开口(430)彼此流体连通。在一些实施方案中,该开口呈喷嘴形式。在某些实施方案中,第二流体可以包括颗粒或者细胞(416),并且在第一流体中通过层流和/或化学不混溶性而可以是不混溶的。单向能量源(440)(例如脉冲激光器)任选地使用镜子(450)而指向第一流体通道(420),并且使用例如透镜(455)而指向且任选地聚焦于一定体积的第一流体通道(420)。在一些实施方案中,镜子和/或透镜构造为允许单向能量源聚焦于第一流体通道(420)内的不同位置。单向能量源(440)启动在第一流体通道(420)内的暂态泡(460)(例如,空化泡)的形成,驱动第二流体的液滴(470)进入第三流体通道(410)。泡的坍塌引起挤出的第二流体的回流,从而引起形成窄“颈”并且迅速导致液滴(480)释放进入第三流体通道(410)。
另一示意实施方案示于图5。该图示出能够作为微流体设备的设备,其包括:包含第一流体(522)的第一流体通道(520)(例如,微通道),包含第二流体(517)的第二流体通道(515)(例如,微通道),以及包含第三流体(512)的第三流体通道(510)(例如,微通道),其中第二流体在第三流体中是不混溶的,并且其中第二流体通道和第三流体通道经由开口(530)彼此流体连通。在一些实施方案中,该开口呈喷嘴形式。第二流体可以包括颗粒或者细胞(516),其可以随后被包封在生成的流体液滴中,并且第二流体能够经由孔口(535)或者类似结构与第一流体通道(520)流体连通。单向能量源(540)(例如脉冲激光器)任选地使用镜子(550)而指向第一流体通道(520),并且使用例如透镜(555)指向(且任选地聚焦)于一定体积的第一流体通道(520)。在一些实施方案中,镜子和/或透镜构造为允许单向能量源聚焦于第一流体通道(520)内的不同位置。单向能量源(540)启动在第一流体通道(520)内的暂态泡(560)(例如,空化泡)的形成,驱动第二流体的液滴(570)进入第三流体通道(510)。泡的坍塌引起挤出的第二流体的回流,从而引起形成窄“颈”并且迅速导致液滴(580)释放进入第三流体通道(510)。
本发明另一实施方案示于图6。该图示出能够作为微流体设备的设备,其包括:包含第一流体(622)的第一流体通道(620)(例如,微通道),包含第二流体(617)的第二流体通道(615)(例如,微通道),以及包含第三流体(612)的第三流体通道(610)(例如,微通道),其中第二流体在第三流体中是不混溶的,并且其中第二流体通道和第三流体通道经由开口(630)彼此流体连通。在一些实施方案中,该开口呈喷嘴形式。柔性膜(635)介入第一流体通道(620)和第二流体通道(615)之间。单向能量源(640)(例如脉冲激光器)任选地使用镜子(650)而指向第一流体通道(520),并且任选地使用透镜(655)聚焦于一定体积的第一流体通道(620)。在一些实施方案中,镜子和/或透镜构造为允许单向能量源聚焦于第一流体通道(620)内的不同位置。单向能量源(640)启动在第一流体通道(620)内的暂态泡(660)(例如,空化泡)的形成,这导致柔性膜(635)弹性变形。该弹性变形驱动第二流体的液滴(670)进入第三流体通道(610)。泡(660)坍塌之后的反向弹性变形导致挤出的第二流体的回流,从而引起形成窄“颈”并且迅速导致液滴(680)释放进入第三流体通道(610)。除了以上讨论的其他参数之外,还可通过弹性膜的硬度来控制该构造的响应时间。
本发明再一实施方案示于图7。该图示出能够作为微流体设备的设备,其包括:包含第一流体(722)的第一流体通道(720)(例如,微通道),包含第二流体(717)的第二流体通道(715)(例如,微通道),以及包含第三流体(712)的第三流体通道(710)(例如,微通道),其中第一、第二和第三流体是不混溶的(例如,通过层流和/或化学不混溶性)。第二流体可以包括颗粒或者细胞(716),其可以随后被包封在生成的流体液滴中。单向能量源(740)(例如脉冲激光器)任选地使用镜子(750)而指向第一流体通道(720),并且任选地使用透镜(755)而聚焦于一定体积的第一流体通道(720)。在一些实施方案中,镜子和/或透镜构造为允许单向能量源聚焦于第一流体通道(720)内的不同位置。单向能量源(740)启动在第一流体通道(720)内的暂态泡(760)(例如,空化泡)的形成,驱动第二流体的液滴(770)进入第三流体通道(710)。泡的坍塌引起挤出的第二流体的回流,从而引起形成窄“颈”并且迅速导致液滴(780)释放进入第三流体通道(710)。
尽管以上已经指出了使用脉冲激光器作为单向能量源,应该注意的是,其他能量源页适用于本发明。供替代的单向能量源包括非激光器、高输出光学源(例如聚弧灯)、微波辐射、感应加热以及声学能量(例如超声波)。
在某些实施方案中,脉冲激光器是优选能量源。激光的优势在于,它们不需要任何电或者机械布线或者相互连接来输送能量。激光束能够穿过透明基板聚焦于任意3D位置。这消除了界面问题,并且利于集成在标准铸造的微流体芯片上。
示意激光器包括但不限于波长例如532nm的纳秒脉冲激光器。微秒、皮秒或者飞秒脉冲激光器等也能够应用。在某些实施方案中,激光器的波长还能够是UV、可见光或者近红外的。
在某些实施方案中,设备或者包括该设备的系统能够包括监控设备,监控设备表征一个或多个流体通道的内含物。来自该监控设备的数据能够传递至控制器,控制器转而可以构造为基于从监控器接收的数据来触发单向能量源。例如,荧光监控器可以匹配包含荧光标记的细胞或者颗粒的流体通道。当来自监控器的数据指示包含期望的荧光标记的细胞匹配液滴生成机制时,控制器能够启动激光脉冲,这引起形成了包封期望的细胞的液滴。类似地,吸光度可以用于区别所监控的流体流的内含物。该布置有利地允许在流体通道内选择可具有独特或者期望的内含物的特定体积,从而传递至第二流体通道以用于收集或者分配至设备的另一功能区域。监控器不限于荧光或者吸光度监控器。例如,有利地可以类似使用磁监器、电容监控器、电感监控器和电化学监控器。
应该理解的是,尽管在某些实施方案中,一个或多个流体流(例如,流体路径)可以约束在物理通道(例如,微通道)内,但是流体流不需要用物理屏障/通道壁限制或隔开。在某些实施方案中,通过使用电润湿技术(参见例如,Cheng及Hsiung,(2004)Biomedical Microdevices,65:341-347)、通过电动器件、通过使用单向层流(例如,通过调节流率和/或流截面和/或流粘度)等,经由改变流体流所处的表面的极性/疏水性/表面自由能量可以使流体流沿着预定路径被约束和/或隔开和/或引导(参见,例如,Zhao等人,(2002)Anal.Chem.,74(16):4259-4268)。
在某些实施方案中,流体流是微流体流。“微流体流”是指以下流,即,其中所述流体流的至少约40%、或者至少约50%、或者至少约60%、或者至少约70%、或者至少约80%、或者至少约90%、或者至少约95%、或者至少约98%、或者至少约99%的流通量或者质量穿过具有至少一个特征尺寸(例如,宽度或者直径)的截面区域,所述特征尺寸为小于1,000μm、更优选小于约900μm、或者小于约800μm、或者小于约700μm、或者小于约600μm、或者小于约500μm、或者小于约400μm、或者小于约300μm、或者小于约250μm、或者小于约200μm、或者小于约150μm、或者小于约100μm、或者小于约75μm、或者小于约50μm、或者小于约40μm、或者小于约30μm、或者小于约20μm、或者小于约10μm、或者小于约1μm。在某些实施方案中,“微流体流”是指包含在微流体通道内的流体流。
在某些实施方案中,一个或多个流体流布置在通道或者微通道中。术语“微流体通道”或者“微通道”可替换使用,并且是指具有至少一个特征尺寸(例如,宽度或者直径)的通道,所述特征尺寸为小于1,000μm、更优选小于约900μm、或者小于约800μm、或者小于约700μm、或者小于约600μm、或者小于约500μm、或者小于约400μm、或者小于约300μm、或者小于约250μm、或者小于约200μm、或者小于约150μm、或者小于约100μm、或者小于约75μm、或者小于约50μm、或者小于约40μm、或者小于约30μm、或者小于约20μm。
在某些实施方案中,此处描述的方法和设备可以利用不混溶的流体。在该情形中,当对两个流体使用术语“不混溶的”时,该术语指示流体当以一些比例混合时不形成溶液。传统的不混溶的材料是水以及油。如此处使用的,不混溶的流体还包括以下流体,即,当以一些比例结合时所述流体基本不形成溶液。通常,当材料如果等比例结合而不形成溶液时,所述材料是基本不混溶的。在某些实施方案中,不混溶的流体包括彼此不显著可溶的流体、由于物理属性(诸如密度或者粘度)一时间段内不混合的流体、以及由于层流多时间段内不混合的流体。
另外,这种流体不限于液体,而是可以包括液体以及气体。因而,例如,在形成包括水性溶剂(诸如水)的液滴时,可以预期诸多有机化合物,诸如四氯化碳、氯仿、环己烷、1,2-二氯乙烷、二氯甲烷、乙醚、二甲基甲酰胺、乙酸乙酯、庚烷、己烷、甲基叔丁基醚、戊烷、甲苯、2,2,4-三甲基戊烷等。各种相互不可溶的溶剂系统对于本领域技术人员是公知的(参见例如表1)。在另一实例中,包含生理正常量的溶质的水性缓冲剂液滴可以产生于包含高浓度的蔗糖的稠密水性缓冲剂中。在又一实例中,包含生理正常量的溶质的水性缓冲剂液滴可以产生于包含生理正常量的溶质的第二水性缓冲剂中,其中两个缓冲剂通过层流分开。在又一实例中,流体液滴可以产生于气体中,诸如氮气或者空气。
表1示出彼此混溶的或者不混溶的各种溶剂。左栏的溶剂与右栏的溶剂不混合,除非另有说明。
在某些实施方案中,第一流体和第二流体不需要彼此是不混溶的。在这种实施方案中,简单地通过调节微通道中的流率以及泡形成的速率来形成隔开的泡,可以使喷射的液滴保持彼此隔开。
在多个实施方案中,通过此处描述的设备和方法所生成的液滴能够包含或者包封各种各样的材料。在一些实施方案中,液滴可以包含测试样本、细胞、细胞器、蛋白质、核酸、酶、PCR或者其他测试试剂、生物化学剂、染料或者微粒(例如聚合微球体、金属微颗粒或者颜料)。在其他实施方案中,液滴可以包封一个或多个先前生成的液滴。另外,本发明不需要限制于水性液滴系统。例如,这种液滴生成方法和设备可以使用于纳米粒涂层中,在纳米粒涂层中,有机溶剂中的材料可用于将层沉积在纳米粒上或者包封纳米粒。
正如上文所注意到的,在一些实施方案中,流体通道中的开口能够构造为喷嘴。能够优化这种喷嘴的深度、内径和外径以控制液滴尺寸、液滴均匀性、在流体界面处的混合或者它们的组合。
此处描述的液滴生成设备可以设置在基板上,该基板与包括流体通道的材料不同。例如,流体通道可以使用布置在刚性表面上的弹性材料制成。合适的流体通道材料包括但不限于柔性聚合物,诸如PDMS、塑料以及类似材料。流体通道还可以由非柔性材料构成,诸如硬质塑料、玻璃、硅、石英、金属以及类似材料。合适的基板包括但不限于透明基板,诸如聚合物、塑料、玻璃、石英或者其他介电材料。其他合适的基板材料包括但不限于非透明材料,诸如不透明的或者半透明的塑料、硅、金属、陶瓷以及类似材料。
上文以及实施例中的参数(例如流率、激光强度、激光频率/波长、通道尺寸、端口/喷嘴尺寸、通道壁硬度、空化泡形成的位置等)能够经变化以优化液滴形成和/或液滴/颗粒/细胞包封以用于特定的期望应用。
多种形式、材料以及尺寸比例可以用于此处描述的液滴生成设备的构造中以及用于包括液滴生成设备的微流体设备中。在一些实施方案中,液滴生成设备和连接流体通道由PDMS(或者其他聚合物)构成,并且使用软光刻方法制成。PDMS是有吸引力的材料,这是基于各种原因,包括但不限于低成本、光学透明度、易于模制以及弹性特性。PDMS还具有期望的化学特性,包括与常规硅氧烷化学制剂的相容性以及与细胞培养要求(例如低毒性、透气性)的相容性。在示意的软光刻方法中,准备原模以形成流体通道系统。该原模可以通过微机加工处理、光刻处理、或者诸多本领域技术人员公知方法来产生。这种方法包括但不限于湿式刻蚀、电子束真空沉积、光蚀刻、等离子增强化学气相沉积、分子束外延、反应离子刻蚀和/或化学辅助离子束加工(Choudhury(1997)The Handbook Microlithography,Micromachining,and Micrabrication,Soc.Photo-Optical Instru.Engineer.;Bard&Faulkner,Fundamentals of Micrabrication)。
原模一旦准备好就暴露于预聚合物,其随后固化以在PDMS中形成图案复本。该复本移出原模并且被裁切,并且在需要时添加流体入口。聚合物复本可以任选地用等离子(例如O2等离子)处理,并且结合至合适的基板(诸如玻璃)。用O2等离子处理PDMS会生成表面,该表面当与合适的基板共形接触时会紧密且不可逆地密封,并具有以下优势,即,生成的流体通道壁当与水性溶液一起使用时是带负电荷的。这些固定电荷支撑电动泵,可以使用电动泵来移动流体通过设备。尽管上述使用PDMS制造液滴生成设备,应该认识到,许多其他材料能够替换该聚合物或者与该聚合物一起使用。实例包括但不限于聚烯烃塑性体、全氟聚乙烯、聚氨酯、聚酰亚胺以及交联苯酚/甲醛聚合物树脂。
在一些实施方案中,可以预期单层设备。在其他实施方案中,可以预期多层设备。例如,可以使用商用CAD程序设计多层网络的流体通道。该设计可以转换为一系列透明正片(transparencies),其随后被用作光刻用掩膜以创建原模。针对该原模的PDMS铸件可产生包含多层网络的流体通道的聚合物复本。该PDMS铸件能够用等离子处理并且粘附于上述基板。
如上文注意到的,此处描述的方法和设备尤其适使于微流体设备。因此,在一些实施方案中,流体通道是微通道。这种微通道具有的特征尺寸范围为约100纳米至1微米、至高达约500微米。在各种实施方案中,特征尺寸范围为约1、5、10、15、20、25、35、50或者100微米至高达约150、200、250、300或者400微米。在一些实施方案中,特征尺寸范围为约20、40或者约50微米至高达约100、125、150、175或者200微米。在多个实施方案中,邻近的流体通道之间的壁厚度范围为约0.1微米至约50微米,或者约1微米至约50微米,更典型地约5微米至约40微米。在某些实施方案中,邻近的流体通道之间的壁厚度范围为约5微米至约10、15、20或者25微米。
在多个实施方案中,流体通道的深度范围为从5、10、15、20微米至约1mm、800微米、600微米、500微米、400微米、300微米、200微米、150微米、100微米、80微米、70微米、60微米、50微米、40微米或者约30微米。在某些实施方案中,流体通道的深度范围为约10微米至约60微米,更优选为约20微米至约40或50微米。在一些实施方案中,流体通道可为开放的;在其他实施方案中,流体通道可以被覆盖。
如上文注意到的,本发明的一些实施方案包括喷嘴。当存在喷嘴时,喷嘴直径能够为从约0.1微米或者约1微米至高达约300微米、200微米、或者约100微米。在某些实施方案中,喷嘴直径能够为从约5、10、15或者20微米至高达约25、30、35、40、45、50、55、60、65、70、75或者约80微米。在一些实施方案中,喷嘴直径为从约1、5、10、15或者20微米至约25、35或者40微米。
在一些实施方案中,此处描述的方法和设备能够生成液滴,速度范围从0液滴/秒、约2个液滴/秒、约5个液滴/秒、约10个液滴/秒、约20个液滴/秒、约50个液滴/秒、约100个液滴/秒、约500个液滴/秒、或者约1000个液滴/秒至高达约1,500个液滴/秒、约2,000个液滴/秒、约4,000个液滴/秒、约6,000个液滴/秒、约8,000个液滴/秒、约10,000个液滴/秒、约20,000个液滴/秒、约50,000个液滴/秒及约100,000个液滴/秒。
在多个实施方案中,此处描述的设备和方法能够生成具有大致连续体积的液滴。能够控制液滴体积以提供从约0.1fL、约1fL、约10fL及约100fL至约1微升、约500nL、约100nL、约1nL、约500pL或约200pL的体积。在某些实施方案中,液滴的体积控制范围从约1pL至约150pL、约200pL、约250pL或者约300pL。
如上所示,此处描述的微通道液滴形成/喷射设备能够提供集成有在微流体“芯片”上的或在流通制造系统中的其他处理模块的系统,以用于微颗粒涂层、微颗粒药物载体制剂等。然而,这些用途仅是示意性的而不是限制性的。
在多个实施方案中,包括执行此处描述的方法的部件/模块/设备的微流体能够操作小至1纳升至若干纳升的体积。因为微流体反应体积接近于单个哺乳动物细胞的尺寸,所以用这些设备进行单细胞mRNA分析时材料损失是最小的。在微流体设备内处理活细胞的能力对于单细胞转录物组的研究提供了很大的优势,因为随着细胞死亡,mRNA会快速降解。已经报道了一个示意性高集成微流体设备(Zhong等人,(2008)Lab on a Chip,8:68-74;Zhong等人,(2008)Curr.Med.Chem.,15:2897-2900),其具有26个并联的10nL反应器以用于研究单个人体胚胎干细胞(hESC)中的基因表达,并且能够易于修改以集成(intetrate)此处描述的设备。某些示意性微流体设备包括用于获得单细胞cDNA的系统,包括在该设备内执行细胞捕获、mRNA捕获/纯化、cDNA合成/纯化。本文的设备和方法提供了在这种设备中包封和/或隔离个体细胞的有效器件,以例如用于进一步处理。
能够使用多种方法来沿着此处描述的设备的流动路径和/或通道传输流体或者液滴、颗粒、细胞等的混合物。这种方法包括但不限于重力流动、注射泵、蠕动泵、电动泵、泡沫驱动泵和气压驱动泵。
实施例
以下实施例用于例示所要求保护的发明,但是并不对其进行限制。
实施例1
由脉冲激光器诱发的空化所驱动的液滴生成
使用标准软光刻技术构造图3所示的脉冲激光器驱动式液滴生成(PLDG)设备。PLDG设备具有两个流体通道,一个流体通道填充有水,而另一个流体通道填充有油。两个流体通道都是100微米宽和100微米高。流体通道通过构造为喷嘴的开口连接,开口的颈部为30微米宽。调节通道中的流率以产生稳定的油/水界面。
基于激光脉冲诱发的空化泡来致动该PLDG设备,当强激光脉冲聚焦于包含是的流体通道时生成空化泡。激光脉冲的焦点处的等离子形成可生成迅速膨胀的空化泡,如上所述。这扰乱了油/水界面并且将水液滴推入相邻的填充有油的流体通道以形成稳定的水液滴。在这些研究中,该空化泡的存在期的范围为从数十微秒至数百微秒。
为了诱发空化泡,Q-开关Nd:YVO4脉冲激光束通过100×物镜聚焦入PLDG设备,该脉冲激光束波长532nm,脉冲宽度15纳秒,最大重复频率100KHz。其他波长也可以是合适的,诸如UV、可见以及红外的。使用时间分辨成像系统来捕获液滴生成。图8示出在液滴生成期间获得的一系列的这种图像。将玉米油用于连续油相并且将磷酸缓冲盐水(PBS)用于水相,调节玉米油和PBS的流率以在喷嘴开口处形成稳定的界面(图8的面板(a))。空化泡形成是在启动激光脉冲1微秒内启动的(图8面板(b))并且在3微秒内达到最大尺寸,推动PBS进入玉米油通道(图8的面板(c))。泡在5微秒之后开始坍塌(图8的面板(d))。随着空化泡坍塌,窄颈形成在PBS流体通道和挤出的液滴之间(图8的面板(d)至(f))。由于流体力学不稳定性,该连接切断(图8的面板(g))。结果,使用100微焦激光脉冲在约500微秒内生成137pL液滴,然后液滴通过流过玉米油通道而被传输离开(图8的面板(h)和(i))。
实施例2
PLDG生成的液滴的体积控制
通过调节脉冲激光输送的能量能够控制PLDG的体积,脉冲激光输送的能量是激光强度和脉冲持续时间、激光激发的位置或者它们之组合的函数。或者,可以使用偏束器调节脉冲激光的能量。
图9图示出通过调节这些参数来控制PLDG产生的液滴的体积。液滴由图9示出,面板(a)至(d)示出在距喷嘴47微米的固定距离处改变激光能量的效果(图9中,面板(a)=100微焦,面板(b)=90微焦,面板(c)=80微焦,面板(d)=70微焦)。这产生了可控液滴尺寸,范围从约55至约5微米,随激光能量降低而减小。
控制液滴尺寸示于图9的面板(e)至(g),其中激光能量保持恒定在100微焦,焦点至喷嘴的距离在约40微米至约80微米之间调节。随着焦点移开玉米油/PBS界面,液滴尺寸从约60微米减小至约25微米。使用组合激光能量以及焦点与流体界面之间距离的组合,液滴体积能够控制在1pL至150pL之间。
实施例3
PLDG产生的液滴的尺寸的一致性(Consistency)
因为PLDG是按需方法,所以PLDG通过控制激光脉冲之间的间隔能够以不同频率产生液滴。图10示出以2毫秒(图10的面板(a))至100微秒(图10的面板(d))的不同激发间隔连续液滴生成的结果。调节接收液滴的流体通道的流率以保持液滴以高液滴生成速率分散。
图11示出以液滴生成频率1kHz(面板(a))和10kHz(面板(b))收集的示意性液体。液滴尺寸是一致的,尽管形成液滴的速度之差有10倍。图12示出类似研究的结果,激光激发之间的间隔设定为2毫秒(面板(a))、500微秒(面板(c))和100微秒(面板(d))。从以500微秒间隔(2kHz)生成的液滴收集的数据示出体积变化为0.689%。
不同激光激发间隔的连续生成液滴示于图14,激发间隔为2毫秒(面板(a))、500微秒(面板(b))和100微秒(面板(c))。使用脉冲间隔100微秒以及激光器功率90微焦,能够实现一致的为10kHz的液滴生产率。
实施例4
用PLDG在液滴中进行包封
因为PLDG是还允许液滴体积控制的按需方法,所以PLDG允许流体通道的特定内含物以液滴形式包封在第二流体通道中。这种应用的实例是包封来自穿过PLDG设备的颗粒流或细胞流中的指定的单个颗粒或者细胞,控制器基于从监控器接收的数据来引导颗粒流或细胞流。这种颗粒或者细胞能够在培养基的液滴内隔开,并且由第二流体通道运载以用于进一步表征。
这示于图13。在图13的面板(a),颗粒(白箭头指示)示于PLDG设备的流体通道中。包封液滴的生成示于图13的面板(b)。能够看到从诱发空化泡起250微秒之后能看到液滴挤出通过喷嘴以封闭颗粒。图13的面板(c)示出了类似研究的结果,并且连续捕获细胞。以这种方式包封活的HeLa细胞呈现高活性率(92.07%)。通过一个小时以10kHz的速率连续施加激光脉冲已经测试了PLDG设备的可靠性,这相当于生成3.6百万空化泡生成,对设备没有可观察到的损坏。
已经公开了液滴生成方法和设备,其尤其适用于微流体设备。这些提供了速率高达100kHz的迅速按需液滴生成。液滴体积能够调节并已经示出为高度可再现的,体积差小于1%。所公开的设备不利用机械部件,并且使用位于外部的单向能量源(例如脉冲激光器)极大地简化该设备和支撑装备的设计。还应注意,PLDG方法的效率以及固有的简化性在微流体领域之外具有实用性。高速的液滴产生和产生的液滴的窄尺寸分布表明这种方法和设备可以用于制备乳液,其中液滴尺寸的一致性是很重要的。实例包括但不限于药品,包括疫苗组合物。高速的液滴产生和当挤出时控制液滴体积的能力表明这种方法和设备可以用于将生成的液滴沉积到流体/气体界面以及固体表面上,从而沉积以及定位非挥发性液滴内含物。这种用途的实例包括但不限于高分辨率打印以及生成微阵列。然而,对本领域技术人员来说明显的是,除了这些已经描述的内容之外,许多修改是可行的,这并不超出此处的发明构思。
应理解,此处描述的实例以及实施方案仅用于示意目的,根据其的各种修改或者改变可以建议给本领域的技术人员,并且包括在本申请的精神和概要内以及附随权利要求的范围内。此处引用的所有公开、专利以及专利申请整体通过参考并入此处用于所有目的。然而,当并入此处的参考文件中定义或者使用的术语与此处提供的该术语的定义不一致或者矛盾时,不应用参考文件中的该术语的定义。术语“包括”以及“包括有”应该理解为以非排他方式引用元件、部件或者步骤,这表示所引用的元件、部件或者步骤与其他没明确提到的元件、部件或者步骤可以一起存在或使用或组合。
- 还没有人留言评论。精彩留言会获得点赞!