改性菱沸石吸附剂组合物、其制造和使用方法与流程
本公开涉及吸附剂组合物、其制造和使用方法。更具体地,本公开涉及特别可用于从含氧流动力学分离氧的吸附剂组合物,例如用于纯化来自空气的粗氩或氮。吸附剂为对于氧的动力学选择性沸石吸附剂,在环境温度或低于环境温度下有效。更特别地,吸附剂为改性菱沸石型沸石。
背景
在气体生产工业中,需要在环境温度或低于环境温度下从含氧流有效分离氧。
在低温空气分离中,基于其沸点和相对挥发度分离氮(n2)、氧(o2)和氩(ar)。第一低温塔负责粗分离空气中三种主要组分:氮(78%)、氧(21%)和氩(1%)。将侧流去除并发送到称为侧臂塔或粗氩塔的第二塔。该流称为“粗”是因为其以仅约95%氩退出该侧臂塔。进一步纯化该粗氩的常规方法限于:“deoxo”纯化、吸气床(getterbed)工艺和附加蒸馏。deoxo方法使控制量的氢与氩流中的氧反应以去除氧。因为氢和氧反应产生显著热量,若不适当控制,该方法可能危险。吸气床仅在较低氧浓度下通过用铜催化剂使氧反应形成氧化铜起作用。当期望高纯度氩时,可用第三蒸馏塔将其浓缩。遗憾的是,由于氧和氩的沸点相似,这些蒸馏塔需要200级以上,且比期望的更不经济。
为了通过吸附机理实现o2与n2或ar的动力学分离,必须开发具有非常特定的孔尺寸的吸附剂结构。虽然ar的lennard-jones6-12动力学直径(3.40å)小于o2(3.46å),但o2不是球形分子,且具有可以利用的最小分子尺寸。吸附机理表明,最小分子尺寸是动力学排阻的限制因素。在合适取向下,o2会扩散进入具有2.8å有效直径的孔内。ar为球形分子,具有3.4å的恒定直径。这种0.6å的直径差是o2选择性吸附剂必须表现出的灵敏度。用这样的吸附剂,可以设计以更安全和更经济的方式纯化来自低温空气分离过程的粗氩和快速有效得多地从o2纯化n2的方法。
已开发基于o2分子较小的动力学直径,相对于n2选择性吸附o2的碳分子筛,参见例如yang,r.t.(gasseparationbyadsorptionprocesses,butterworths,boston,1987)。更新近,在s.u.rege和r.t.yang(adsorption,2000,vol.6,15-22)以及graham等人的美国专利7,501,009中,提议碳分子筛用于通过动力学分离从ar去除o2。
然而,碳分子筛用于纯化粗n2或ar带来若干问题,包括但不限于:如果返回至低温蒸馏塔有燃烧的可能性,可变的孔尺寸分布,和其它缺点。沸石为多孔铝硅酸盐,其为不可燃物,并包含基于其高度结晶结构的良好控制的孔尺寸。因此,它们可克服许多这些缺点。
菱沸石型沸石具有三维孔结构,其含有具有3.8埃8-元氧环开口的通道。该环直径接近对于o2与ar和n2的动力学分离讨论的目标孔尺寸,参见上文。已知天然存在的菱沸石型沸石,其具有多种组成和用于平衡铝硅酸盐的alo2单位电荷的阳离子。典型的天然菱沸石组合物为mx(si25.5al10.5o72),其中m为阳离子混合物,并选择x以平衡alo2基团的电荷。已经通过几种方法制备合成菱沸石,包括在水热条件下从作为原料的y型沸石结晶。
通常根据沸石组合物骨架中si与al原子的比率描述菱沸石沸石。此后,关于硅与铝原子的比率指沸石骨架中的原子。通常以简写提及菱沸石沸石。例如,菱沸石通常缩写为cha。此后,通过在括号中规定si/al比限定具有特定si/al比的菱沸石组合物。例如,通过cha(1.6)规定具有1.6的si/al的菱沸石。
天然菱沸石通常具有2.2至3.5的si/al比。在大自然中已观察到与菱沸石(cha)同构的具有低至1.4的si/al比并在其沸石骨架中含有铁的组合物(e.passaglia,naturalzeolites:occurrence,properties,use,pergamompress,1978,pp.45-52)。不容易得到大量纯的天然菱沸石。
barrer已在两个出版物中描述具有1至1.5的si/al的显示为单相合成cha组合物的物质。在第一个出版物中,r.m.barrer和j.w.baynham(j.ofthechemicalsociety,1956,2892-2903)报导通过直接合成制备的具有1.15至1.36和>1.96的si/al的组合物。未包括具体合成路线,且对于这些组合物仅报导有限的分析数据。对于si/al<1.96的组合物,报导了具有仅单一的阳离子类型的分离的cha组合物。对基于si/al=2.5的天然菱沸石的组合物,报导了具有混合的na和ca阳离子取代的菱沸石组合物。
在该出版物中报导和在约-182℃收集的低温吸附数据显示,不论阳离子取代,基于缓慢的吸收速率,通过具有1.36或更小的si/al的cha结构有效排阻o2和ar两者。这表明这些组合物不适合用于从ar分离o2。
在第二个出版物中,r.m.barrer和d.e.mainwaring(j.ofthechemicalsociety,daltontransactions,1972,1254-1259)报导具有1.07至1.5的si/al的cha组合物和si/al=2.25的cha。从koh、偏高岭土和无定形二氧化硅凝胶制备组合物。虽然从具有2至10的sio2与al2o3比率的变化凝胶组成制备报导的菱沸石,但未观察到具有1.5至2.25的si/al的菱沸石。这表示在barrer描述的条件下这些不是稳定的组合物。通过x射线衍射表征si/al=1和2.25的材料,但未对si/al>1和<1.5的组合物报导分析数据。同样,未报导这些cha组合物的混合阳离子形式。报导了来自对cha(si/al=2.25)的li、na、k、ca和h形式的吸附研究的数据。在除钾以外的全部阳离子形式中,在-195℃观察到o2吸收。在该温度下kcha(2.25)完全排阻o2,表示在该si/al比或以下,使用钾阳离子,孔变得太小。
在美国专利5,026,532中,coe和gaffney描述制备具有1.8至2.3的si/al比的菱沸石的方法。描述用氢氧化四甲铵作为模板剂,由氢氧化铝、二氧化硅溶胶、氢氧化钠和氢氧化钾合成cha(2.1)。未报导这些菱沸石组合物的混合阳离子形式。
在美国专利4,943,304中,coe和gaffney教导使用ca交换的具有1.8至2.7的si/al的菱沸石,用于从杂质气体纯化本体气体,其中本体气体大部分被沸石排阻。本体气体包括比起氮较不强烈地结合到菱沸石的气体,以及由于其比氮更大的尺寸而被排阻的那些气体。这些尤其包括氩、氢、氦、氪、氖和四氟甲烷。在该申请中,对于较低的si/al钙菱沸石组合物,包括具有1、1.3、1.6和1.72的si/al的那些组合物,显示n2容量数据。未报导该si/al范围内的混合阳离子菱沸石。此外,基于与具有较高si/al比的菱沸石相比组合物相对低的氮容量,摒弃si/al低于1.8的菱沸石组合物的使用。p.webley和合作者(j.phys.chem.c,2013,117,12841-12847)公开在阳离子含量和si/al比方面变化,且包括混合阳离子型菱沸石的一系列cha组合物。在该研究中,骨架si/al组成从1.04到远远超过2.0;然而为了制备si/al=1.5和以下的cha组合物,webley使用kuznicki(j.chem.soc.,faradaytransactions,1991,87(1),1031-1035)描述的方法。制备富al的cha的这种方法使用cha(2.5)接触naoh和氧化铝。根据kuznicki,由他的方法形成的具有1-2.5的名义si/al比的组合物实际上为cha(1)和cha(2.5)的混合物。预料这些材料产生组合物中两种材料吸附性能的混合。通过该方法不会得到单一的单相组合物,因此webley报导的混合阳离子菱沸石组合物不同于本发明的低si组合物。本发明的组合物基本为单相,因此预期具有单一的孔结构和尺寸,以及独特的吸附性质。“单相”是指组合物至少90%为具有特定si/al比的一种类型的cha,例如cha(1.6),与具有两种不同si/al比的菱沸石共混物相反。
因此,由于潜在的益处,需要在环境温度和低于环境温度两者,对于o2相对ar和o2相对n2的吸附,具有高的动力学选择性的均质单相沸石吸附剂。本文公开沸石组合物,特别是符合这些和其它目标的菱沸石组合物。
对于使用沸石吸附剂从含氧流吸附分离o2,webley小组(adsorption,11,173-177(2005))描述使用具有2.4的si/al比的钾菱沸石,以表明在0℃至50℃的温度范围o2相对ar的选择性吸附,然而,已经观察到这种基于平衡的材料呈现非常缓慢的o2吸收。
很多其它研究人员提到o2与ar基于平衡的分离,但很少有报导快速动力学分离。大部分这些动力学分离使用碳分子筛(cms),其借助于尺寸选择性,能在环境温度下以约为ar的30倍快的速率吸收o2(美国专利6,500,235,以及s.u.rege和r.t.yang,adsorption,2000,vol.6,15-22)。美国专利6,500,235还提到使用含有有机金属骨架(mof)的过渡金属。两种材料都显示相对缓慢的吸收,且因为它们包含有机组分,所以若这些流要再循环回到低温流,则必须过滤。
仅一些沸石材料已报导用于环境温度下o2与n2或ar的动力学分离。s.kuznicki,b.dunn,eeyring和d.hunter(separationscienceandtechnology2009,44:7,pp1604-1620)报导使用ba交换的钛硅酸盐barpz-3进行o2与ar的动力学分离。对于该材料和o2/ar<10的动力学选择性,速率显得缓慢。s.farooq(gasseparationsandpurification,vol.9,no.3,pp205-212)描述可能使用改性4a材料,来自uop的rs-10,其显示在与cms材料相似的o2吸收速率下,对于o2相对n2和ar的吸附,与碳分子筛相当的动力学选择性。
在低于环境温度下,d.w.breck(zeolitemolecularsieves,roberte.kriegerpublishingco.,1984)描述在o2/n2和o2/ar的动力学分离中使用沸石4a。
kovak等人在美国专利5,159,816中提到使用沸石吸附剂的列举,包括5a、4a、发光沸石、13x和菱沸石,用于低温tsa过程中的氧和氮吸附。
gary等人在美国专利6,083,301中教导使用包括si/al比<1.15的沸石的吸附剂,用于从惰性流体流去除杂质;然而,该说明书教导使用沸石x作为沸石吸附剂。
因此,期望开发可用于分离o2、n2和ar的沸石吸附剂。这些吸附剂自身可具有任何以下性质:较大的选择性、较快的吸附及脱附、增加的o2容量、增加的生产率和较容易再生(例如无加热或无真空)和其它品质。
概述
本文讨论满足一种或多种这些期望的性质的吸附剂。
公开一种制备吸附剂的方法,其中该方法包括以下步骤:(a)将nay沸石、水性al(oh)3和水性koh混合;和(b)加热步骤(a)所得的混合物经规定量的时间,以获得包含至少90%具有1.0至2.2si/al比的单相菱沸石的组合物。
单相菱沸石可包含钾阳离子,其中k:al摩尔比为至少0.90。
此外,步骤(b)加热到约70℃至120℃,还包含保持在70℃至120℃的温度1-8天。步骤(b)加热可至约90℃-100℃,还包含保持在90℃至100℃的温度1-8天。
该方法还可包含实施单相菱沸石的离子交换,以产生具有1.0至2.2的si/al比的单相nacha组合物,其中na/al摩尔比大于0.95。实施离子交换可包含将含有至少90%的具有1.0至2.2si/al比的单相菱沸石的组合物与具有10倍过量(以nacl相对于单相组合物中钾阳离子摩尔数的摩尔%计)的1mnacl水溶液混合,直到k被na完全交换,以产生单相nacha组合物。
单相nacha组合物可进一步经离子交换,以产生包括至少两种类型阳离子的单相混合阳离子cha,其中在一个实施方案中,至少两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
该方法还可包括用一种或多种li、ag、k、ca、mg、zn、cu、ba和sr阳离子的水溶液实施nacha组合物的后续离子交换。
该方法可包含用li阳离子、k阳离子或其组合实施nacha组合物的后续离子交换。该方法可包含用li阳离子的水溶液实施nacha组合物的后续离子交换,以产生li,nacha组合物,其中在一个实施方案中,li,nacha组合物的两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
该方法可包含用k阳离子的水溶液实施nacha组合物的后续离子交换,以产生k,nacha组合物,其中在一个实施方案中,k,nacha组合物的两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
上述方法可涉及用a当量的k阳离子水溶液离子交换1当量nacha组合物,以产生具有a:(b-a)的k:na比的ak,nacha,其中a为期望的钾阳离子数,且b为每单位cha的阳离子总数,其中b的范围为11.25至18。
在一个实施方案中,b为12至18,且a为1至7。
在另一个实施方案中,b为约12.8至15.3,且a为1至7。
在又一个实施方案中,混合阳离子交换菱沸石为1k,nacha、2k,nacha、3k,nacha、4k,nacha或6k,nacha。
在另一个实施方案中,菱沸石具有1.35至1.6的si/al比。
在又一个实施方案中,菱沸石具有1.0至2.0的si/al比。
以下阐述本发明一些另外的实施方案:
实施方案1.一种用于制备吸附剂的方法,该方法包括:(a)将nay沸石、水性al(oh)3和水性koh混合;和(b)加热步骤(a)所得的混合物经规定量的时间,以获得包含至少90%具有1.0至2.2si/al比的单相菱沸石的组合物。
实施方案2.实施方案1的方法,其中所述单相菱沸石包含钾阳离子,其中k:al摩尔比为至少0.90。
实施方案3.实施方案1-2中任一项的方法,其中步骤(b)加热到约70℃至120℃,还包含保持在70℃至120℃的温度1-8天。
实施方案4.实施方案1-2中任一项的方法,其中步骤(b)加热到约90℃-100℃,还包含保持在90℃至100℃的温度1-8天。
实施方案5.实施方案1-4中任一项的方法,其还包含实施单相菱沸石的离子交换,以产生具有1.0至2.2的si/al比的单相nacha组合物,其中na/al摩尔比大于0.95。
实施方案6.实施方案5的方法,其中实施离子交换包含将含有至少90%的具有1.0至2.2si/al比的单相菱沸石的组合物与具有10倍过量(以nacl相对于单相组合物中钾阳离子摩尔数的摩尔%计)的1mnacl水溶液混合,直到k被na完全交换,以得到单相nacha组合物。
实施方案7.实施方案5-6中任一项的方法,其中所述单相nacha组合物经进一步离子交换,以产生包括至少两种类型阳离子的单相混合阳离子cha。
实施方案8.实施方案7的方法,其中至少两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
实施方案9.实施方案5-6中任一项的方法,其还包含用一种或多种li、ag、k、ca、mg、zn、cu、ba和sr阳离子的水溶液实施nacha组合物的后续离子交换。
实施方案10.实施方案5-6中任一项的方法,其还包含用li阳离子、k阳离子或其组合的水溶液实施nacha组合物的后续离子交换。
实施方案11.实施方案5-6中任一项的方法,其还包含用li阳离子的水溶液实施nacha组合物的后续离子交换,以产生li,nacha组合物。
实施方案12.实施方案11的方法,其中li,nacha组合物的两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
实施方案13.实施方案5-6中任一项的方法,其还包含用k阳离子的水溶液实施nacha组合物的后续离子交换,以产生k,nacha组合物。
实施方案14.实施方案13的方法,其中k,nacha组合物的两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
实施方案15.实施方案5-6中任一项的方法,其中1当量nacha组合物用a当量的k阳离子水溶液离子交换,以得到具有a:(b-a)的k:na比的ak,nacha,其中a为期望的钾阳离子数,且b为每单位cha的阳离子总数,其中b的范围为11.25至18。
实施方案16.实施方案15的方法,其中b为12至18且a为1至7。
实施方案17.实施方案15的方法,其中b为约12.8至15.3且a为1至7。
实施方案18.实施方案17的方法,其中混合阳离子交换菱沸石为1k,nacha、2k,nacha、3k,nacha、4k,nacha或6k,nacha。
实施方案19.实施方案1-16中任一项的方法,其中菱沸石具有1.35至1.6的si/al比。
实施方案20.实施方案1-16中任一项的方法,其中菱沸石具有1.0至2.0的si/al比。
对本领域技术人员显而易见的这些和其它实施方案在本公开的精神和范围内。
附图简述
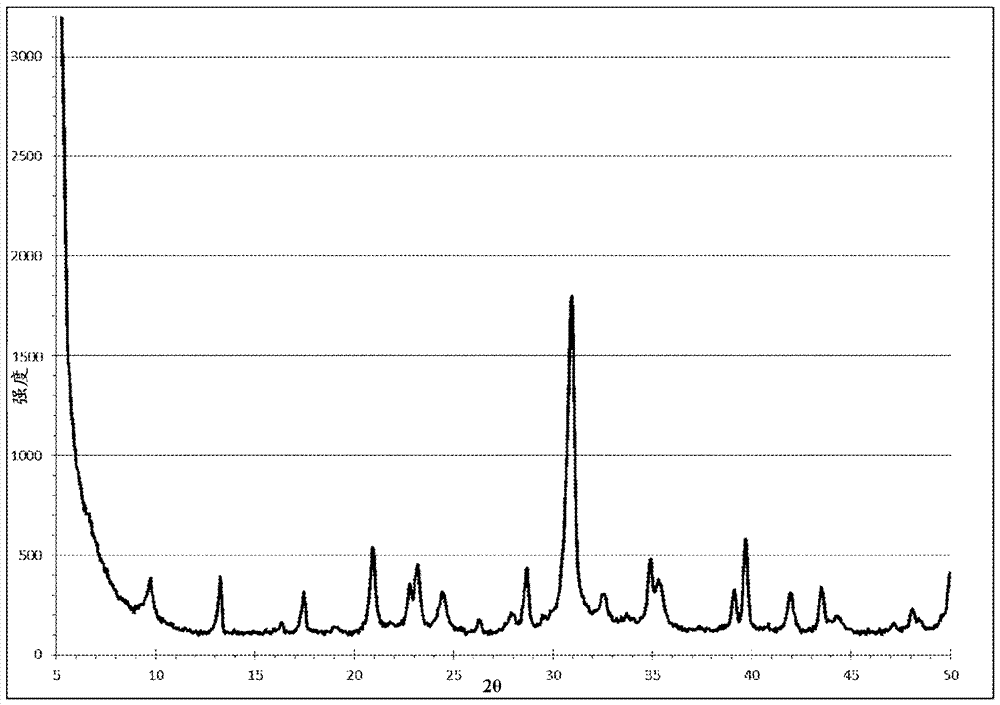
图1为实施例1a,si/al=2的菱沸石(kcha(2.0))的x射线衍射图案;
图2为实施例1a(kcha(2.0))的29si-nmr谱;
图3为实施例1b,si/al=1.85的菱沸石(kcha(1.85))的x射线衍射图案;
图4为实施例1b(kcha(1.85))的29si-nmr谱;
图5为实施例1c,si/al=1.6的菱沸石(kcha(1.6))的x射线衍射图案;
图6为实施例1c(kcha(1.6))的29si-nmr谱;
图7为实施例1d,si/al=1.35的菱沸石(kcha(1.35))的x射线衍射图案;
图8为实施例1d(kcha(1.35))的29si-nmr谱;
图9为对比实施例1的29sinmr谱:si/al=1和2的菱沸石混合物,产生平均si/al=1.5(混合nacha(1.5));
图10为对于一系列菱沸石和文献的沸石,以o2相对n2的动力学选择性对o2吸收速率绘制的绘图;
图11为对于一系列菱沸石和文献的沸石,以o2相对ar的动力学选择性对o2吸收速率绘制的绘图;
图12为以o2相对n2和o2相对ar的动力学选择性对nacha(1.6)中钾离子交换水平绘制的绘图;
图13为以氧吸收速率对nacha(1.6)中钾离子交换水平绘制的绘图;
图14为描绘具有不同si/al比的nacha组合物在-98℃的o2、n2和ar容量的图表。
图15为描绘根据一些实施方案使用的psa循环的流程图;和
图16为描绘钠菱沸石在低温的模拟回收率和生产率性能的图表。
详述
本公开关注可通过动力学分离从粗氩或粗氮流去除氧的吸附剂,但认识到可使用来自任何源的任何含氧流。含氧流体流包含0.5摩尔%氧至49.5摩尔%氧,或2.5摩尔%氧至29.5摩尔%氧。本公开还涉及制备这些吸附剂的方法和使用这些吸附剂从含氧流体分离氧的方法。
与此同时提交并通过引用以其全文并入本文的题为methodforargonproductionviacoldpressureswingadsorption(经由冷变压吸附生产氩的方法)(档案号07941)的美国专利申请序列号15/049704详述了经由冷蒸气变压吸附(psa)纯化氩的设备和方法。另外,与此同时提交(和通过引用以其全文并入本文)的题为modifiedchabaziteadsorbentcompositions,methodsofmakingandusingthem(改性菱沸石吸附剂组合物、其制备和使用方法)(档案号07939和07953)的美国专利申请序列号15/049610和15/049634还描述了非常适合用于本文描述的系统和方法的改性菱沸石。如该申请所说明,吸附剂在不同运行条件下有不同表现。
本公开涉及具有1.0至2.2的si/al比的单相菱沸石沸石组合物。这些菱沸石组合物在环境(0至40℃)和低于环境(0<℃)的温度下表现出改进的生产率、容量和/或再生性质,使得它们适用于ar或n2psa应用。
本发明的组合物提供在环境和低于环境两种温度下o2相对ar和o2相对n2吸附的高动力学选择性。在低于环境温度下观察到o2相对n2和o2相对ar的有效平衡选择性,因为对于本发明的组合物,n2和ar吸收变得极端缓慢。因此,o2容易分离。
组合物包括具有1.0至2.2的si/al比的单相菱沸石沸石组合物,其包含两种或更多种阳离子类型的混合物。“单相”是指组合物至少90%为具有特定si/al比的一种类型的cha(例如cha(1.6)至少90%为具有1.6的si/al比的cha)。在自然中可发现具有大于10%杂质的菱沸石;限制杂质至小于10%改进菱沸石的性能。通过要求组合物至少90%为具有所述si/al比范围内的特定si/al比的一种类型的菱沸石,避免较高和较低比率菱沸石的共混物,且观察到高度规则孔尺寸对气体分离的有益特性。例如,webley使用kuznicki描述的方法,他认为以1-1.8的名义si/al比形成的组合物实际上为cha(1)和cha(2.5)的混合物,而不是本文描述的单相组合物。barrer等人描述si/al=1的纯cha组合物,并展现吸附数据,显示在低温下排阻o2、ar和n2,不论阳离子如何。在独立的研究工作中,webley展现天然cha(2.4)的吸附数据,并显示具有2.4的si/al比的钾菱沸石在0℃至50℃温度范围表现出o2相对ar的选择性吸附;然而,已观察到这些基于平衡的材料在环境温度,即~23℃,呈现非常缓慢的o2吸收。barrer显示了当用小于钾的阳离子取代时cha(2.4)的o2、n2和ar吸附。因此,阳离子交换的si/al比和类型充分影响菱沸石的3.8å名义孔尺寸,使得在其si/al比从1增加至2.4时,cha沸石可从排阻n2、ar和o2变为吸附它们。由阅读该说明书将认识到,相对于cha(1)或cha(2.5),优选si/al比为1.6的cha(cha(1.6))的性能。平均为cha(1.6)的cha(1)和cha(2.5)共混物与单相cha(1.6)组合物并不相同。基于现有的吸附研究,cha(1)和cha(2.5)的共混物将具有两种孔尺寸的混合,其排阻或缓慢吸附o2、ar和n2,或吸附全部这些气体。实际上,我们在含有cha(1.0)和cha(2.0)的混合物的对比实施例中观察到这种混合吸附性能。(参见以下对比实施例1和图9-11。)本文描述的组合物充分利用单相组合物的改进性质,以实现均匀的孔尺寸,其为在cha(1)和cha(2.5)之间的中间尺寸,并因此具有在o2和n2或ar之间的高动力学选择性。
沸石合成领域的普通技术人员应认识到,各种各样的含有二氧化硅和氧化铝的试剂可按合适摩尔比与适当的结构导向剂一起使用,以获得本发明的菱沸石。本发明还描述使用沸石nay作为易得的二氧化硅和氧化铝源制备本发明组合物的便利方法,特别是当与水合氢氧化铝和氢氧化钾组合时。
此外,本文描述和在本发明的si/al范围内的单一和混合的阳离子菱沸石沸石组合物具有出乎意料的气体吸附性质,使得它们可用于气体分离应用。
混合阳离子菱沸石沸石包括不同摩尔比的至少两种阳离子类型,且在单位晶胞结构中具有每种类型的至少一种阳离子。例如,可按a:(b-a)的k:na摩尔比制备钾和钠混合阳离子菱沸石,特别是1:(b-1)、2:(b-2)和3:(b-3)、4:(b-4)或6:(b-6),其中b为初始cha结构的每单位晶胞的na阳离子数,即b为每单位晶胞的阳离子总数,其中有一些被a个钾离子取代。通过本发明组合物的si/al比限定b的范围,因此,对于本发明的组合物,b的范围为11.25至18,和在一些实施方案中12.8至15.3。钾阳离子数a的范围为1至7。比率a:(b-a)(k:na)可为约0.05至约1.25。以下表1显示对于给定si/al比和从完全交换的na(a=0)到7个钾当量(a=7)的期望k含量,a、b和(b-a)的不同值。基于期望的si/al比计算b的值。值得注意的是,这些是计算值,其稍微不同于其它地方呈现的数值,例如以下实施例1的“名义组成”。
菱沸石的混合钠、钾交换形式具有从1.2至1.8的骨架si/al比,na/al比为0.4至1.0,具有在一定压力和温度条件范围内从含氧流吸附大量o2的能力。对于纯气体组分,已在环境压力和175k(-98℃)下达到大于10的o2相对ar的平衡选择性。
通过仔细选择阳离子组成和1.2至1.8的cha的si/al范围,本发明的cha组合物可调节至提供甚至在环境温度下o2吸附与n2或ar相比很高的动力学选择性。在环境温度下,观察到完全na交换的cha(1.6)在相对低的o2吸收速率下,显示适中的o2相对ar和n2的动力学选择性。用较大的钾阳离子完全交换cha(1.6)导致o2、ar和n2基本上被排阻出沸石,推测是由于与nacha(1.6)相比较小的孔尺寸。意外地,混合的k,nacha(1.6)组合物,特别是k3na11al14si22o72(3k,nacha(1.6))、k4na10al14si22o72(4k,nacha(1.6))或k6na8al14si22o72(6k,nacha(1.6)),不仅显示比完全nacha(1.6)更好的o2相对ar和n2的动力学选择性(推测是由于调节得更好的孔尺寸),而且显示在环境温度条件下快得多的o2吸收速率。不清楚为何有效较小的孔尺寸会导致更好的选择性和更高的o2吸收速率两者,但本发明的均质混合k,nacha(1.6)组合物显示该有益性质,在一些实施方案中,关于0.05至1.25的k:na比和关于0.3至0.75的k:na比。在低于1.5,例如1.4的si/al比,观察到在环境温度下,o2吸收速率与si/al>1.5的cha材料相比显著缓慢。nacha(1.4)显示非常缓慢的o2吸收速率,具有相似的n2吸收,同时有效排阻ar。将2个钾阳离子结合到nacha(1.4)的单位晶胞中以制备2k,nacha(1.4)(k2na13al15si21o72)同样导致出乎意料的气体吸收性能。o2和n2两者的总吸收速率增加,但同时,n2显示0.001sec-1的均匀吸收速率,o2显示两个吸收区域,一个比n2快得多,第二个慢得多。总o2吸收约等于n2吸收。相反,更高si/al的cha材料通常吸附的n2为o2的两倍。虽然不旨在受限于理论,但吸收测量表明2个钾阳离子添加到单位晶胞导致cha结构中新的位点变得能让o2而非n2到达,这可以帮助说明为何3k,nacha(1.6)的o2容量也比nacha(1.6)高约30%。
值得注意的是,在175k,nacha吸附剂的o2容量甚至在1.5的si/al以下仍然是高的,同时ar被有效排阻。
本文描述的每一种菱沸石组合物为特别合适从富氧流去除氧的吸附剂组合物,例如用于在氩或氮的纯化中分离氧。该组合物很适合用于在环境温度(-20℃至40℃)和低于环境温度(低至-186℃)下的变压吸附技术。在一些实施方案中,使用-150℃至-50℃的温度。本发明的吸附剂组合物特别合适用于约-130℃至-80℃的psa。氧分离包括使含氧流体流与具有1.2至1.8的si/al比的特定组合物在环境温度或低于环境温度下接触,其中所述组合物包含单相阳离子交换cha组合物。
制备单相kcha
这些组合物容易从沸石nay、水合氢氧化铝和氢氧化钾制备。如本文描述的吸附剂菱沸石组合物可相对简单地制备,通过将nay沸石、水性al(oh)3和水性koh混合,并加热经规定量的时间以获得具有1至2.2的期望si/al比的单相kcha组合物。为获得期望的si/al比,在氢氧化钾存在下调节水合氢氧化铝与nay的比率。加热通常在约70℃至约120℃进行1-8天,如实施例1中阐述。在一些实施方案中,加热在约90℃至约100℃进行并保持在约90℃至约100℃经1-8天。所得的组合物为具有1至2.2的si/al比的单相钾交换菱沸石(kcha),且其中k/al摩尔比大于0.90。(例如>90%的cha单位晶胞阳离子为钾,剩余的单位晶胞阳离子为钠)。在一些实施方案中,k/al摩尔比>0.90,>0.95,>0.97,>0.99,或任何两个这些数值之间的任何值或值的范围。
制备单相nacha组合物
可制备菱沸石组合物的变体。例如,可制备根据本公开的钠交换菱沸石组合物,经由单相钾菱沸石的离子交换,以产生具有1至2.2的si/al比的单相nacha组合物,其中na/al摩尔比大于0.95。例如,离子交换可包括将具有1至2.2的si/al比的单相kcha与过量的水性钠离子混合,以将钾离子完全交换为钠离子,产生具有1至2.2的si/al比的单相nacha。该交换可重复数次,以保证完全的离子交换。在一些情况下,离子交换包含将具有1至2.2的si/al比的单相钾菱沸石与具有10倍过量(以nacl相对于单相钾菱沸石组合物阳离子的摩尔数的摩尔%计)的1mnacl水溶液混合,直到k被na完全交换,以产生单相nacha组合物。(参见实施例2a。)
制备单相混合阳离子cha组合物
可由具有至少1但小于2.2的si/al比的单相nacha组合物经由离子交换以产生包括至少两种类型阳离子的单相混合阳离子cha制备具有至少1但是小于2.2的si/al比的单相混合阳离子交换菱沸石组合物。在一些实施方案中,具有至少1但小于2.2的si/al比的单相nacha组合物与一种或多种期望的阳离子的水溶液混合,以产生期望的混合阳离子菱沸石。在一些实施方案中,混合阳离子cha包含至少两种类型的阳离子,其中每一种以相对于al至少0.05的摩尔比存在。适合类型的阳离子包括li、ag、na、k、ca、mg、zn、cu、ba和sr阳离子。在一些实施方案中,阳离子类型选自li阳离子、k阳离子和其组合。至少两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
在一些情况下,1当量的nacha组合物用过量当量的期望类型的阳离子(m)水溶液离子交换,以产生混合的m,nacha。
在一些情况下,1当量的nacha组合物用a当量的k阳离子水溶液离子交换,以产生具有a:(b-a)的k:na比的ak,nacha,其中a为期望的钾阳离子数,且b为每单位cha的阳离子总数,其中b的范围通过1.0至2.2的si/al比限定。在一些情况下,b为11.25至18,且a为1至7。在一些实施方案中,b为约12.8至15.3,且a为1至7。在一些实施方案中,k,nacha组合物的两种类型阳离子中的每一种相对于al的摩尔比为至少0.05。
例如,在一些实施方案中,混合阳离子交换菱沸石为钾、钠交换的菱沸石(例如kana(b-a)albsi(36-b)o72),具有a:(b-a)的k:na比,其中b为cha结构的每单位晶胞的阳离子总数,a为cha结构的每单位晶胞中的钾阳离子数,而(b-a)为离子交换之后cha结构的每单位晶胞中的钠阳离子数,其中混合还包含根据以下反应式将nabalbsi(36-b)o72与1mkcl混合:
在一些实施方案中,混合阳离子交换菱沸石为kna(b-1)albsi(36-b)o72(1k,nacha)、k2na(b-2)albsi(36-b)o72(2k,nacha)、k3na(b-3)albsi(36-b)o72(3k,nacha)、k4na(b-4)albsi(36-b)o72(4k,nacha)或k6na(b-6)albsi(36-b)o72(6k,nacha)。b的范围通过本发明组合物的si/al比限定。因此,对于本发明的组合物,b的范围为11.25至18,优选12.8至15.3。钾阳离子数a的范围为1至7。以上表1阐述a和b的一些相关值。关于制备混合的钾、钠菱沸石组合物的方法,参见实施例2b。
混合阳离子cha组合物的备选制备
在一些情况下,混合阳离子菱沸石可如下制备:将上述具有1至2.2的si/al比的单相nacha组合物与具有10倍过量(以期望的阳离子类型相对于钠阳离子的摩尔数的摩尔%计)的水溶液混合,以产生混合阳离子菱沸石。阳离子类型为以上描述的那些。可通过重复该反应调节交换的量。例如,当期望的混合阳离子菱沸石为li,nacha时,将上述具有1至2.2的si/al比的单相nacha组合物与单一的以摩尔%计10倍过量的1mlicl水溶液混合,以产生li,nacha组合物(参见实施例2c。)。
实施例
已按以下方式表征本文描述的示例性组合物。除测量它们的吸附性质外,还通过x射线衍射、29sinmr和通过使用icp-oes的元素分析表征新型沸石组合物。
对这些实施例使用rigakuminiflexx射线衍射仪产生粉末x射线衍射(xrd)图案。该仪器装备有toshibaa-20cux射线管。
通过spectraldataservices,inc进行硅核磁共振(29sinmr)。使用的光谱仪为270nmr系统,在270.620mhz的h-1larmor频率下操作,使用7mmcpmasdoty探针。使用45°脉冲获得波谱,脉冲之间有85秒延迟。还通过spectraldataservices,inc进行波谱中峰的解卷积。由相对峰面积,使用式1计算si/al比。
其中:si/al=硅:铝比,i=nmr峰的相对面积。
si(nal)=具有n个铝原子作为通过氧结合的最邻近位置的硅。
n=通过nmr峰表示的最邻近铝原子数。
使用确立的方法通过元素分析确定阳离子交换水平,所述方法涉及溶解固体和随后使用电感耦合等离子体发射光谱法(icp-oes)分析溶液。
实施例1:kcha的直接合成:
表2
根据以下程序按照表2制备具有所示si/al比的实施例组合物1a至1d:
添加al(oh)3和h2o到具有磁性搅拌棒并用结晶皿覆盖的烧杯;加热al(oh)3溶液至66℃并在加热板上搅拌15分钟。
添加nay到250ml聚丙烯瓶。添加al(oh)3溶液到该瓶。用少量(~10ml)di水将过量溶液洗涤到该瓶中。
添加koh到该瓶。
剧烈摇动该瓶1分钟并密封。
将该瓶放置在95℃烘箱中经规定量的时间。
所得样品通过粉末xrd、29sinmr和icp-oes分析表征为基本纯的单相菱沸石,主要为钾形式,如图1-8所示。
以下表3显示以上1c中所示凝胶组合物的结晶曲线,其设计成产生si/al=1.6的cha。结晶曲线中的数据显示,名义cha1.6组合物在低至0.3天内开始结晶,且在结晶条件下经过2周保持主要相。
表3
对比实施例1:通过改性cha(2.0)合成名义cha(1.5)
在该对比实施例中,尝试从cha(2.0)开始合成cha(1.5),并在75℃连同氢氧化铝和氢氧化钠结晶3天。该预制品(prep)类似于kuznicki等人对于cha(1.5)所描述。过滤和用水洗涤之后,干燥分离的产物并通过29sinmr分析。在图9中显示nmr谱,并清楚显示cha(2.0)和cha(1.0)混合物的证据。波谱不显示图6中对于纯cha(1.6)观察到的配位到4、3、2和1个al原子的si的预期统计分布。相反地,迹线显示对于配位到4个al原子的si异常大的峰(这指示cha(1.0))和配位到2个al原子的si周围的峰的较小统计分布(指示cha(2.0))。该结果类似于kuznicki显示的那些。该样品的气体吸收数据包括在下文表4和5以及图10和11中。具有两种不同的si/al比的混合菱沸石吸附剂显示相对高的o2吸收速率和适中的选择性,但对于所有o2、n2和ar吸收,该样品显示极快的非选择性的气体吸收区域和较慢的更有选择性的吸收区域,表明该混合材料的2种单独的孔尺寸。
实施例2:钾菱沸石材料的阳离子交换
在如实施例1中所述从其制备中结晶时,菱沸石的菱沸石相主要为其钾阳离子形式。可制备包括混合阳离子形式的其它阳离子形式,如下文实施例中例示。
实施例2a:nacha:
例如在实施例1中制备的菱沸石的kcha形式与10倍过量(摩尔%基准)的1m氯化钠溶液在90℃混合至少4小时。混合之后,过滤该材料。nacl混合(交换)重复9次,以将材料完全转化为nacha。过滤后,将材料用3倍过量(重量%基准)的di水漂洗3次,并在90℃干燥过夜。通过电感耦合等离子体发射光谱法(icp-oes)确认离子交换的程度。
实施例2b:混合k,nacha:
nacha交换回到kcha在热力学上是非常有利的。对于每种期望的k阳离子取代,单一当量的1m氯化钾与nacha(nabalbsi(36-b)o72)材料交换,例如在实施例2a中在90℃制备至少4小时。(即,k:na比为a:(b-a),其中a代表k的摩尔数,而b代表nacha的初始摩尔数乘以cha组合物每单位晶胞中的钠阳离子数。)然后过滤产物并用3倍过量(重量%)的di水漂洗3次,然后在90℃干燥过夜。通过交换的化学计量测定并通过电感耦合等离子体发射光谱法(icp-oes)确认离子交换程度为3k,nacha。因此,对于kna(b-1)albsi(36-b)o72,1当量nacha与1当量1m氯化钾(kcl)混合,1当量na被1当量k取代,产生1当量的kna(b-1)albsi(36-b)o72(k,nacha)。对于k2na(b-2)albsi(36-b)o72(2k,nacha),将1当量nacha与2当量kcl混合,以产生k2na(b-2)albsi(36-b)o72。对于k3na(b-3)albsi(36-b)o72(3k,nacha),将1当量nacha与3当量kcl混合,以产生k3na(b-3)albsi(36-b)o72。可类似地获得额外的钾水平。b的范围通过本发明组合物的si/al比限定,因此,对于本发明的组合物,b的范围为11.25至18,优选12.8至15.3。
实施例2c:混合li,nacha:
一旦用10倍过量(摩尔%基准)的1m氯化锂溶液在90℃经过至少6小时,菱沸石的nacha形式被交换。交换之后,过滤该材料。licl交换重复2次,以将材料部分转化为混合的li,nacha。过滤以后,用3倍过量(重量%)的di水将材料漂洗3次,并在90℃干燥过夜。
实施例3:吸附速率吸收测量
使用标准体积吸附设备评价吸附剂的传质性质。实验由以下组成:将初始在真空中30℃下的吸附剂样品暴露至760torr(101kpa)检测量的o2、n2或ar。然后跟踪压力变化作为时间的函数。然后从压力时间数据减去使用相同重量石英珠代替吸附剂样品的相似的压力史,以获得吸附气体量作为时间函数的绘图。从吸收曲线的初始斜率,可获得以时间的倒数为单位(sec-1)的测试气体的扩散参数。
可在如下实验时间段内对给定吸附剂样品限定赝平衡容量。在760torr(101kpa)开始测量气体经过重量2.2g的吸附剂样品的压降,直到压降速率<1torr/min。pmax限定减去玻璃珠空白样品压降之后经过2.2g吸附剂样品的总压降或气体吸收。因此,pmax与系统体积一起限定赝平衡容量,并在表5中对不同吸附剂给出这些值。
fickian扩散模型给出扩散参数导出背后的理论,该模型为对吸附剂颗粒内吸附物传输使用更严格的化学势驱动力模型的特例。还考虑有限系统体积对总体动力学的影响。以下给出模型的解析形式:
其中f(t)为分数吸收,dc为结晶内扩散率,rc为晶体半径(扩散长度标度),t为时间,γ为吸附剂最终吸附的吸附物的分数,且pn为以下的非零根:
如ruthven,d.m.principlesofadsorptionandadsorptionprocesses(吸附原理和吸附过程),johnwileyandsons,newyork,1984中阐述。
对本发明的cha组合物测量动力学选择性参数,并与内部测试和来自文献的其它沸石和碳分子筛(cms)材料比较。本文描述的全部菱沸石样品在真空(<10mpa)下在400℃活化8小时,以在吸附测量之前去除水和co2。在表4中将结果汇编:
表4
在括号中的组成表示先前列出的化学式的简写命名。
在可得到时,这些相同材料的平衡数据在表5中列表:
表5
pmax限定减去玻璃珠空白样品压降之后经过2.2g吸附剂样品的压降或气体吸收。因此,pmax与系统体积一起限定实验时间段内给定吸附剂样品的赝平衡容量(*)。
表5和图9与10中的环境温度数据显示:在它们的高o2/n2和o2/ar选择性方面,在报导和测试的所有材料当中,具有si/al~1.6和含有钠和钾离子混合物作为附加骨架阳离子的均质cha相是独特的。3k,nacha(1.6)、4k,nacha(1.6)和6k,nacha(1.6)组合物显示任何测试材料中最高动力学选择性和与除4a沸石以外所有相比更高的o2吸收速率。相反,单一阳离子nacha(1.6)显示在比起3k,nacha(1.6)材料缓慢到约1/30的o2吸收速率下差得多的选择性。kcha(1.6)仍然缓慢得多,且有效排阻o2、n2和ar。在图12和13中甚至更清楚地看到动力学选择性和氧吸收速率两者的这种出人意料的优化,其中对nacha(1.6)中的钾交换水平或钾离子数绘制o2/ar和o2/n2动力学选择性以及o2吸收速率。再次对混合k,nacha(1.6)组合物观察到动力学选择性和速率的最大值。不旨在限于理论,认为这些混合组合物产生对o2精细调节的规则孔尺寸,允许其更快速地迁移通过孔,同时限制n2和ar吸收的速率。
cms和其它报导的沸石以及mofba-rpz-3显示在较慢速率下较差的选择性,除了4a沸石。虽然4a沸石显示很快的o2吸收,但它的o2相对ar吸附的选择性比3k,nacha(1.6)低得多。
表5中的平衡数据表明,除了更高的氧吸收速率和o2相对n2和ar的动力学选择性以外,混合k,nacha(1.6)材料在30℃具有比其它cha组合物高40%的o2容量。
在低于1.5,例如1.4的si/al比,观察到在环境温度下,o2吸收速率与si/al>1.5的cha材料相比显著减慢。nacha(1.4)显示非常缓慢的o2吸收速率,具有相似的n2吸收,同时有效排阻ar。将2个钾阳离子结合到nacha(1.4)的单位晶胞中以制备2k,nacha(1.4)或k2na13al15si21o72同样导致出乎意料的气体吸收性能。o2和n2两者的总吸收速率增加,但同时n2显示0.001sec-1的均匀吸收速率,o2呈现两个吸收区域:一个比n2快得多,而第二个慢得多。总o2吸收约等于n2吸收。相反,较高si/al的cha材料通常吸附的n2为o2的两倍。虽然不旨在限于理论,但吸收测量表明,添加两个钾阳离子到单位晶胞导致在cha结构中新的位点,变得能让o2而非n2到达,这可以帮助说明为何在环境温度下3k,nacha(1.6)的o2容量也比nacha(1.6)高约30%。
实施例4:低温吸附
在175k对具有1.3至2的si/al范围的钠形式cha样品测量低温等温线。使用甲醇和液氮的淤浆浴获得175k至少5小时的时间。注意到,周期性使用2或3次添加液氮以保持温度恒定。在图14中,将1atm(101kpa)各种气氛空气在样品上的赝平衡容量相对于si/al比绘图,还在该图中绘制o2/ar选择性。认为这些气体容量是赝平衡,因为随着气体吸收接近平衡,吸附速率变得比实验持续时间的限度更慢。当样品压力变化在30秒内小于0.01%时,吸附单元记录赝平衡容量。通过取在1atm的纯气体赝平衡容量的比率,计算图14中的选择性。在cha2.0中,吸附容量最高,n2具有最高值,然后是o2,随后是ar。当si/al比下降至1.85时,该次序变换,n2不再像o2那样强烈地吸附,表明n2的部分排阻。随着si/al比降低,o2/ar选择性上升,且在si/al=1.35时最大。因为在低si/al比下更完全地从样品排阻出ar,所以出现该增强的选择性。值得注意的是,这些样品的o2容量在175k仍然高,即使si/al降低。应注意到所有样品为从y型沸石转化而直接合成的单相菱沸石。
以上实施例本质上仅为说明性的,且旨在展示本文描述的改性菱沸石组合物、其制备方法即其在从含氧流中分离o2的潜在用途。
实施例5:经由冷蒸汽psa用nacha(1.6)生产氩
题为methodforargonproductionviacoldpressureswingadsorption(经由冷变压吸附生产氩的方法)(档案号07941)的美国专利申请序号15/049704中描述的方法和系统使用图15中显示的2-床8-步骤冷氩psa过程,用它们计算使用nacha(1.6)吸附剂的过程性能指标,形式为初级产物(ar)回收率和生产率。填充有115.4kg吸附剂的各吸附床为2.44m长和0.30m直径。通过遵循图15中显示的序列分别在4.96bara压力和-100℃温度下操作psa循环。假定床已经先前用初级产物气体(纯化的ar)加压至循环的最高压力水平,将含有94.95摩尔%ar、5摩尔%o2和剩余部分n2的进料气混合物引入床的入口端,并使未吸附气体(大部分ar)从床的出口端排出。继续进料步骤,直到优先吸附组分(o2)的传质区域到达床的出口端,而没有将其基本穿透。在进料步骤(步骤1)期间的流速保持在32.77nm3/h,且在接近进料压力和温度下以15.55nm3/h的速率将含有2.0ppmo2的排出气体从产物槽(槽a)取出作为流11(图15)。在进料步骤终止时,将该床与经历压力均衡再加压步骤(步骤6)的第二床连接,并使一部分空隙以及脱附气体从第一床的产物端转移到第二床的产物端,因此在该步骤(步骤2)末尾降低第一床压力至约4.36bara。在步骤2之后,引入双末端平衡减压步骤(图15中的步骤3),以将更多共吸附的以及空隙气体由床的两端从第一床转移到第二床,因此,第一床的压力下降到约3.12bara。可通过将塔的顶端和第一床的中部或底端连接到第二床的底端,进行双末端再加压。然后将塔逆流减压(步骤4)和随后用1.32bara的初级产物气体逆流排空(步骤5)(其中环境压力为1.013bara)。在排空步骤后,随后通过压力均衡(步骤6和7)与加压(步骤8)步骤将塔加压,使压力水平恢复以开始和重复上述循环。使用所有步骤,整个循环在550秒内完成。来自进料气体的净的(几乎)不含o2的氩回收率为49.97%,且生产率为43.74nm3/h/m3床(图16)。这表明,所提出的方法可用于在低温用nacha(1.6)菱沸石从进料气体去除o2。可任选经由蒸馏或psa中的第二层吸附剂实现n2的进一步去除。
实施例6:用3k,nacha(1.6)经由环境温度psa生产氩
以上讨论的2-床8-步骤psa过程用于在30℃使用3k,nacha(1.6)和cms的过程性能评价。对于3k,nacha(1.6),最高和最低压力水平分别保持在约5.07bara和1.09bara。对于cms,最高和最低压力水平分别保持在约7.22bara和1.15bara。在表4中显示psa模拟结果:
所述结果证明3k,nacha(1.6)可提供环境温度cms氩psa的双倍生产率,同时提供相似的回收率。与用于cms的7.22bara进料压力相比,还在仅5bara进料压力下实现3k,nacha(1.6)氩psa的模拟性能。可在低温蒸馏设备中由静液压头压力得到该较低的进料压力。7.22bara进料压力需要另外的压缩机。
- 还没有人留言评论。精彩留言会获得点赞!