一种实现全血血浆持续分离的微流控器件及其分离方法与流程
本发明属于微流控器件技术领域,具体涉及一种实现全血血浆持续分离的微流控器件及其分离方法。
背景技术:
循环生物标志物已成为癌症等疾病的重要诊断工具。血浆是最重要的循环生物标记物的获取来源,约占健康成年人血液体积的60%。血浆蛋白质组学、转录组学和代谢组学的研究极大的促进了癌症、阿尔茨海默症、败血症等疾病的诊断研究。存在于血浆中的抗体以及外来核酸和抗原可用于诊断严重的感染性疾病,例如在近年来爆发的埃博拉病毒和zika病毒所引起的疾病。然而血样的复杂成分使得无论在实验室还是在床边诊疗(point-of-care,poc)中都难以直接检测生物标志物,血样往往需要预处理分离出血浆,而血浆的简便、快速、高效分离的方法则变得愈发重要。
目前分离提取血浆的方法主要为离心法和过滤法。其中最普遍使用的是离心法,这种方法相对耗时,需要台式离心机等专业设备,无法满足集成化实时实地检测的需要。而且其高速旋转所产生的机械应力会破坏血浆中的生物标志物。而过滤法则是通过压力使血液样本通过滤网进行血浆分离,这种方法的最大问题是容易形成血细胞堵塞,在微量血浆分离应用中该问题更加突出。
大多数的床边诊疗系统都需要微量血浆分离,而随着床边诊疗的快速发展和对实时实地血液分析需求的日益增大,基于微流控的新型血浆分离方法已成为研究热点,这类方法具有分离速度快,纯度高,节省样本等优点。微流控指的是使用微管道(尺寸为数微米到数百微米)处理或操纵微小流体(体积为微升到阿升)的系统所涉及的科学和技术,是一门涉及化学、流体力学、微电子、新材料、生物学和生物医学工程的新兴交叉学科。因为具有微型化、集成化等特征,微流控装置通常被称为微流控器件,也被称为芯片实验室(lab-on-a-chip,loc)和微全分析系统(micro-totalanalyticalsystem,μtas)。微流控的重要特征之一是利用微尺度环境下流体所具有独特的性质和现象,如毛细现象和电渗现象等,可以实现一系列常规方法所难以完成的微操作。因此微流控在生物医学研究领域具有巨大的发展潜力和广泛的应用前景。近年来芯片实验室系统快速发展,成功在检测循环血液生物标志物方面取得了很大进展,成为床边诊疗的重要工具,但仍缺乏在血浆分离部分的成果。在大多数情况下,微流控器件的操作者仍需要依靠台式离心机来分离血浆,即使其所需血浆体积仅为几微升。因此,为了实现真正意义上的床边诊疗,开发快速、便捷、可集成于芯片实验室系统的微量血浆分离方法已成为当务之急。
技术实现要素:
本发明的目的是提供一种实现全血血浆持续分离的微流控器件,解决现有的血浆分离方法面临着无法实时分离、耗时长、样本消耗量大、结构复杂和血样需要稀释等问题。
本发明的另一目的是提供使用上述微流控器件持续分离血浆的方法。
本发明通过以下技术方案来实现:
一种实现血浆持续分离的微流控器件,由导电镀膜玻璃(导电镀膜为金、银、铝或ito,镀膜层厚度为2微米~10微米)、通道层(双面丙烯酸酯压敏胶带或其它透明双面胶,其厚度为50~150微米)和有机玻璃盖片(亚克力有机玻璃盖板或其它有机玻璃材料,厚度为0.5~2mm)组成,导电镀膜玻璃、通道层和有机玻璃盖片粘合为一体;在通道层上设置有由全血通道、血浆通道和细胞通道组成的t字型微通道,全血通道和血浆通道同轴设置,细胞通道垂直于全血通道和血浆通道,三个通道相互间连通;在全血通道、细胞通道和血浆通道交界处的导电镀膜玻璃的镀膜层上,用激光刻蚀掉一条形结构,从而形成电极对,由信号发生器向电极对的两个电极分别输入相位差为180°、幅值为10~30vp-p、频率为50~200khz的交流信号;条形结构的轴线与全血通道中流体的流向成一定角度(30°~60°),且条形结构的左侧边界与细胞通道入口的右侧边界交汇;在有机玻璃盖片的表面上设置有与相应通道位置相对应的通道开口,分别为进样口、血浆收集口和细胞出口;全血通道的宽度为0.05mm~1mm,血浆通道的宽度和全血通道的宽度相同,细胞通道的宽度为0.02mm~0.5mm,且小于全血通道和血浆通道的宽度;三者的深度相同,为0.01mm~0.2mm;电极对的厚度为0.002mm~0.01mm,电极对的间距离为0.005mm~0.05mm。
一种使用上述微流控器件持续分离血浆的方法,全血通过注射泵(进样速度为0.2微升每分钟~5微升每分钟)由进样口进入全血通道,用信号发生器向电极对的两个电极分别输入相位差为180°、幅值为10~30vp-p、频率为50~200khz的交流信号,当全血中的红细胞、血小板、白细胞等生物颗粒推至电极对附近时,它们受到很强的负介电力而被推向细胞通道;而全血中的血浆则继续沿血浆通道流动,血浆被从红细胞、血小板、白细胞等生物颗粒中分离出来,并在血浆收集口被收集,红细胞、血小板、白细胞等生物颗粒则在细胞出口被收集。
采用上述技术方案的积极效果:本发明制作简单、成本低,应用负介电力作用,即可将红细胞、血小板、白细胞等生物颗粒与血浆分离,然后从微流控器件不同的出口进行收集。该装置可持续分离血浆,且不会发生堵塞。本发明的分离参数可以随时调节,可根据不同的实际需要调节全血的进样速度,可得到不同纯度的血浆。
附图说明
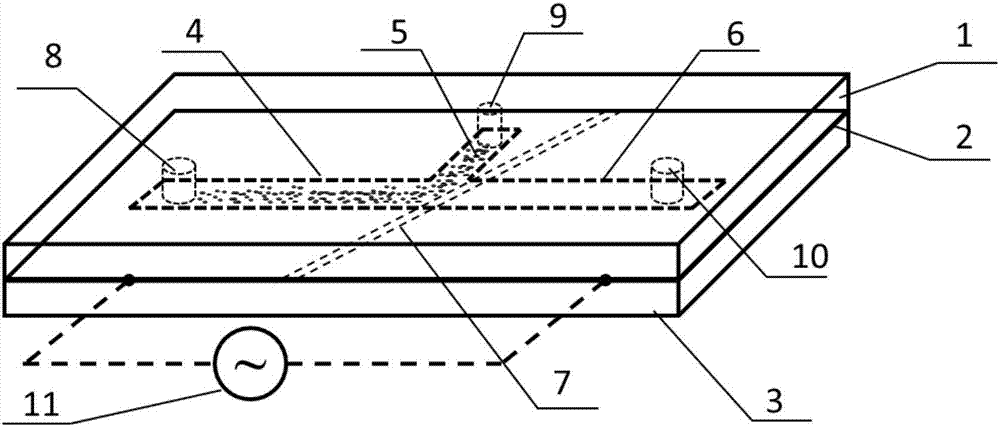
图1为本发明的微流控器件拆分结构示意图;
各部分名称为:导电镀膜玻璃3、通道层2和有机玻璃盖片1,导电镀膜玻璃3、通道层2和有机玻璃盖片1粘合为一体;在通道层上设置有t字型微通道,分别为全血通道4、血浆通道6和细胞通道5;全血通道4和血浆通道6位于同一轴线方向,细胞通道5垂直于全血通道4和血浆通道6,三个通道相互间连通;在全血通道4、细胞通道5和血浆通道6交界处的导电镀膜玻璃的镀膜层上,通过激光刻蚀掉一条形结构,形成电极对7,条形结构的轴线与全血通道4中流体的流向成一定角度且条形结构的左侧边界与细胞通道入口的右侧边界交汇;
在有机玻璃盖片1的表面上设置有与相应通道位置相对应的通道开口,分别为进样口8、血浆收集口10和细胞出口9。信号发生器11向电极对7的两个电极分别输入相位差为180°的交流信号。
图2为实施例1中分离全血血浆的微流控器件示意图。
图3为实施例1中本发明的微流控器件在20vp-p、100khz的电场条件下分离全血血浆的显微镜成像图。其中图a为加电之前全血沿全血通道和血浆通道流动的情况;图b则是在加入电场后红细胞、血小板、白细胞等生物颗粒被介电力推入细胞通道,血浆得到分离的情况。
图4是在20vp-p、100khz的电场条件下,不同血液进样速度条件下分离得到的血浆中红细胞去除率,其中:去除率=(加电前血浆通道中红细胞数量-加电后血浆通道中红细胞数量)/加电前血浆通道中红细胞数量×100%
具体实施方式
实施例1
结合图1,一种微流控器件,由亚克力有机玻璃盖板1、双面丙烯酸酯压敏胶带2和氧化铟锡ito镀膜玻璃3组成,亚克力有机玻璃盖板1和氧化铟锡ito镀膜玻璃3通过双面丙烯酸酯压敏胶带2粘结后密封形成微通道结构,其中,双面丙烯酸酯压敏胶带2上刻有全血通道4、细胞通道5和血浆通道6,ito镀膜玻璃3的镀膜层通过激光刻蚀掉一条宽约为50微米的条形结构形成一对透明电极对7,亚克力有机玻璃盖板1上有进样口8、细胞出口9、血浆收集口10。
图2是本发明的微流控器件结构示意图,如图所示,该微流控器件中有微通道,微通道分为三部分,呈t字型分布且相通,分别为全血通道4、细胞通道5和血浆通道6,微通道开口在亚克力有机玻璃盖板1的表面,分别为进样口8、细胞出口9、血浆收集口10。进样口8、细胞出口9、血浆收集口10分别用于注入全血、收集血浆以及收集细胞。全血通道4及血浆通道6和细胞通道5的交界处的底面上安放着一条形电极对7,条形结构的轴线与全血通道中流体流向成一定角度(30°~60°),且条形结构的左侧边界与细胞通道入口的右侧边界交汇;两个电极分别输入交流电信号。
本发明基于的原理包括:血细胞在非均匀电场中受到电场力作用,这种电场力称为介电力。这一介电力的存在不需要物体本身带电,主要取决于物质和粒子的电学性质,粒子的形状和大小、材质、介电常数以及场强变化率等。所有粒子在电场环境里都存在介电泳现象,在同一电场中所受到的电场力大小,方向都各不相同,因此使用特定的电场可以有选择性地控制血细胞,从而达到将其从血浆中分离的目的。血细胞在某一交流电场频率下向电场密度低的区域运动,此时它所受到的是负介电力;而在另外某电场条件下则会向电场密度高的区域移动,它受到的是正介电力。
本发明中,在通道底部部署电极对,并与全血通道4呈一定角度,当血液样本中的红细胞等生物颗粒推至图2中电极对7附近时被负介电力推向细胞通道5;而血浆则继续沿血浆通道6流动。至此,血浆被从血细胞等生物颗粒中分离出来,并在血浆通道的出口10被收集。
微流控器件的具体制作方法如下:
(1)首先,在压敏双面胶带上设计、制作微流控器件的微通道:采用切割的方式在长20mm、宽10mm、厚度为76微米的压敏双面胶带上加工获得t字型微通道,全血通道、血浆通道的宽为240微米,细胞通道的宽为120微米,全血通道、血浆通道的细胞通道的的深度均为76微米。
(2)ito导电镀膜玻璃长20mm、宽20mm、厚度1mm,ito镀膜层厚度为5微米,利用高功率激光烧灼的方式在t字型通道分叉处位置烧灼ito镀膜层,使镀膜层被分为相距50微米的两个电极,获得图2中用于产生非均匀电场的电极对7。
(3)有机玻璃盖片为透光度为95%的亚克力板。有机玻璃盖片长20mm、宽20mm、厚度为1mm。在该盖片上对应全血通道4的首端、细胞通道5末端和血浆通道6末端的位置打三个直径为0.8mm的孔,分别为进样口8、细胞出口9、血浆收集口10。
(4)导电镀膜玻璃和有机玻璃盖片分别清洗干净后,依图1中自下而上ito导电镀膜玻璃层3、压敏双面胶层2、有机玻璃盖片1的顺序对齐,由压敏双面胶层2粘合。
实施例2
一种使用微流控器件持续分离血浆的方法,取健康人志愿者的新鲜柠檬酸钠抗凝全血,注射泵(longerpumptmlsp02-2,行程分辨率:0.03125μm)调节进样速度,全血进样速度在0.2微升每分钟~5微升每分钟。全血样本通过进样口8进入微流控器件全血通道4,如图3a所示。全血通道4及血浆通道6和细胞通道5交界处的底面上安放着一条形结构的电极对7,条形结构的轴线与全血通道中流体流向成一定角度(本例为60°)。用信号发生器向两个电极分别输入相位差为180°、电压为20vp-p、频率为100khz的交流信号。当全血样本中的红细胞等生物颗粒推至电极对7附近时,它们被负介电力推向细胞通道5;而血浆则继续沿血浆通道6流动,如图3b所示。至此,血浆被从血细胞等生物颗粒中分离出来,并在血浆通道的出口7被收集。
图4是在20vp-p、100khz的电场条件下,不同血液进样速度条件下分离得到的血浆中红细胞去除率。从图中可以得出,血液进样速度越小,血浆中的细胞去除率就越高;反之,血样进样速度越大,血浆中的细胞去除率就越低。
- 还没有人留言评论。精彩留言会获得点赞!