一种微流控传感器芯片系统及其制备方法与流程
本发明涉及一种微流控传感器芯片系统及其制备方法。
背景技术:
微流控芯片结合了生物和微电子加工等技术,将实验室中多种仪器的功能集成到几平方厘米(甚至更小)的芯片上处理,它有很多优点,例如:微型化、集成化、检测效率高、检测成本低等。目前微流控芯片已经应用于生物化学、医学检测、药物合成、药物筛选、环境监测等领域,有着广泛的发展空间和良好的应用前景。微流控系统是一个微型的操作平台,它可以集样品制备、预处理、分离、检测等手段于一体,大大降低了分析的复杂性和所耗时间。同时,由于其自身构造简单,原理清晰,因此很容易与电化学传感器联用。
微传感器是典型的多学科交叉的生长点,涉及到生命科学、物理、化学、信息科学等众多学科和技术。由于微型传感器具有操作简便、快速、准确、易于联机及重复使用等特点,在生命科学研究、医学生物工程临床诊断与分析、生物工艺过程检测与监控、环境质量检测、食品科学、化学化工过程分析及分析化学研究等许多方面都有广泛的应用前景。
专利文献cn103182334b(一种电化学微流控传感器的制备方法及其应用)将改进后的玻璃溶液直接涂到商业化标准印刷电极上。然后将预先设计好管道的pdms芯片和涂有剥离的印刷电极仪器进行真空离子处理,将pdms直接键合到商业化标准印刷电极上,从而构建了一种新型的微流控电化学传感器平台。该专利实现了将传感器集成到微流控芯片上,制作简单。但是,1)该装置没有将微流道层和传感器层分开,并不适合生物传感器,酶传感器会污染微流道内液体;2)该电极结构是印刷在玻璃上的,该微流控传感器系统不具备高度柔韧性的优点,并且未来不适合广泛应用于市场;3)由于电极结构是印刷在玻璃上的,所以该微流控传感器并不能实现两层及以上多层叠加,同时传感器的集成程度低。
专利文献cn101999071a是关于一种用于制造微流控传感器的方法,该方法包括提供多种材料,该多层材料配置为允许它们堆叠形成至少一个第一盖层、第一沟道、检测层,以及第二沟道层。在装配期间,衬底层的带段被夹在中间形成层叠物,以将各元件协同的贯穿于该层叠物的厚度对准。接着从该层叠物带上去除独立的传感器。一个组件化的步骤包括形成一个或多个元件用于沿带的轴向长度间隔地设置的连续传感器。一些元件包括图样化导电结构,该结构通过使用导电油墨和印刷方法优选地被印刷在衬底之上,有时将材料置于可行位置以贯穿于至少一个带的厚度而导电。该专利能够将微流道层和传感器层分开,但是,1)制备过程复杂,组装元件多;2)制备过程中采用多种材料,材料切换繁琐;3)根据其陈述该装置优选适合检测微流道内的微粒,对于生物、化学及药物检测和筛选有待考证。
技术实现要素:
本发明的主要目的在于克服现有技术的不足,提供一种微流控传感器芯片系统及其制备方法,提供一种高度集成、可灵活满足个性化设计要求、简单易操作、低成本的微流控传感器芯片系统及其制备方法。
为实现上述目的,本发明采用以下技术方案:
一种微流控传感器芯片系统,包括依次键合叠加的衬底层、一或多层微流控芯片层、一或多层传感器芯片层以及传感器承载层,其中所述传感器芯片层与所述传感器承载层组合成为传感器层,每个传感器层分别对应于一层微流控芯片中的不同微流道或多层微流控芯片层中的不同层,以满足每一层微流控芯片或每一个微流道有对应的传感器层对其进行检测。
进一步地:
所述传感器承载层具有连接微流控芯片层的传感器输入口、承载所述传感器芯片层的腔体以及传感器输出口;所述传感器芯片层包括:传感器电极垫部分,用来连接外部电路;传感器电极,与所述传感器电极垫部分相连;传感器衬底,优选地,所述传感器衬底的材料是pet、pc、pdms或pmma耐高温、绝缘、透明柔性材料。
所述衬底层、所述微流控芯片层和所述传感器承载层的材料是pdms或pmma材料。
一种微流控传感器芯片系统的制备方法,包括:制备衬底层、一或多层微流控芯片层、一或多层传感器芯片层以及传感器承载层,将各层依次键合叠加,其中所述传感器芯片层与所述传感器承载层组合成为传感器层,每个传感器层分别对应于一层微流控芯片中的不同微流道或多层微流控芯片层中的不同层,以满足每一层微流控芯片或每一个微流道有对应的传感器层对其进行检测。
进一步地:
当仅有一层微流控芯片层时,直接将所述微流控芯片层与所述衬底层键合;当有多层微流控芯片时,先将各微流控芯片层键合叠加后,再与所述衬底层键合叠加,或者将所述衬底层和各微流控芯片层逐层键合叠加。
所述微流控芯片层的培养对象包含以下的一种或多种:
1)人类汗液、唾液、尿液、血液及人体其他代谢产物;
2)动物汗液、唾液、尿液、血液及动物其他代谢产物;
3)研究涉及的重金属、农药残留及食物中某种或某几种含量等的检测;
4)肝细胞、肝组织、肝器官及肝癌细胞;
5)肺细胞、肺组织、肺器官及肺癌细胞;
6)肾细胞、肾组织、肾器官及肾癌细胞;
7)肠细胞、肠组织、肠器官及肠癌细胞;
8)乳腺细胞、乳腺组织、乳腺器官及乳腺癌细胞;
9)胰腺细胞、胰腺组织、胰腺器官及胰腺癌细胞;
10)心肌细胞、心肌组织、心肌器官及心肌癌细胞;
11)皮肤细胞、皮肤组织及皮肤癌细胞;
12)神经细胞、神经组织、神经器官及其癌细胞。
所述传感器芯片层按检测对象分类包括以下的一种传感器或多种传感器的集成:ph传感器、氧气浓度传感器、乳酸传感器、尿酸传感器、白蛋白传感器、葡萄糖传感器、神经递质传感器、钠离子传感器、钾离子传感器、免疫蛋白传感器、震颤传感器、重金属传感器、温度传感器、co2传感器、no传感器;所述传感器芯片层按检测原理分类包括以下的一种传感器或多种传感器的集成:分析物捕获传感器、电导率传感器、等离子体共振传感器、温度传感器、气体传感器、趋化性传感器、细胞因子传感器、离子传感器、压力传感器、电势传感器、电流传器、流通式传感器、填充式传感器、阻抗传感器、电磁场传感器、表面声波传感器、以及代谢传感器。
制备所述传感器芯片层包括如下步骤:
在传感器衬底上涂负胶,用电极结构掩膜板曝光、前烘、显影、坚膜后形成电极图案;
利用磁控溅射技术或者电子束溅射技术在衬底上溅射30-40nm厚度的铬,然后再溅射50-60nm厚度的银/金;
剥离非电极图案部分的金属,使传感器衬底上只有电极区域有金属层,形成电极结构;
蒸镀400nm-600nm厚度的绝缘透明材料作为绝缘层;
涂正胶,用传感器电极垫掩膜板进行光刻后,利用等离子刻蚀技术刻蚀电极垫部分,以便于电极垫与外界连接;
剥离光刻胶,在丙酮溶液中超声6-12小时,或者直接使用去胶液去胶剥离;
涂正胶,用工作电极掩膜板进行光刻工艺,完成曝光、前烘、显影、坚膜步骤;
利用磁控溅射技术或电子束溅射技术,溅射60nm-100nm的铂在工作电极上;
进行金属剥离,在丙酮溶液中超声6-12小时,或者直接用去胶液剥离非工作电极部分;
将包被反应因子的电极切片,固定于已经制作好的传感器承载层上。
所述传感器芯片层表面具有包被材料,所述包被材料包括壳聚糖、水凝胶、普鲁士蓝或ecm,所述包被材料与检测对象对应的反应因子混合,所述反应因子包括酶、离子、抗体或蛋白。
所述衬底层、所述微流控芯片层和所述传感器承载层是用光刻工艺加工成型,或是在用pmma或金属材料制备的模具上用pdms或pmma材料浇筑成型。
本发明的有益效果有:
本发明提供了一种高度集成、简单易操作、低成本、高灵敏度、微流道与传感器有效分离、可具有柔性、可以批量生产的微流控传感器芯片系统及其制备方法,该微流控传感器芯片系统可应用于生物化学、医学检测、药物合成筛选、环境监测等多个领域。
本发明提供的高度集成的微流控传感器系统具有以下优点:1)可同时检测多种研究对象,且互不影响,同时微流控与传感器隔离,不会造成微流控培养对象污染;2)重量轻、体积小、便于携带、操作简单、具有柔性;3)检测对象集成度高、多功用,同时具备标准化特点,可以批量生产,市场应用范围广;4)该系统可以根据研究者要求灵活应用,具有可选择性,满足个性化设计要求。
附图说明
图1是本发明一种实施例的微流控传感器芯片系统的衬底;
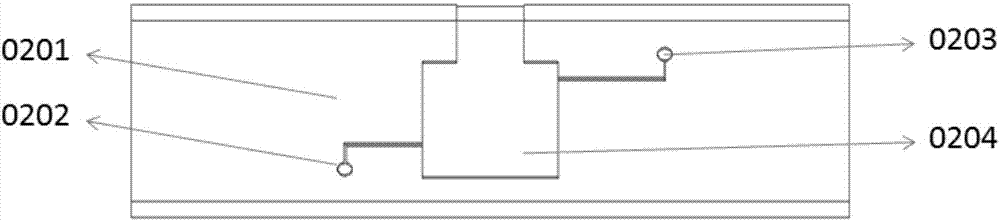
图2是本发明一种实施例的微流控传感器芯片系统的传感器承载层;
图3是本发明一种实施例的微流控传感器芯片系统的传感器芯片;
图4是本发明一种实施例的微流控传感器芯片系统的微流控芯片层;
图5、图6、图7分别是一个实施例的微流控传感器系统的不同视图。
具体实施方式
以下对本发明的实施方式作详细说明。应该强调的是,下述说明仅仅是示例性的,而不是为了限制本发明的范围及其应用。
参阅图1至图7,在一种实施例中,一种微流控传感器芯片系统,包括依次键合叠加的衬底层、一或多层微流控芯片层、一或多层传感器芯片层以及传感器承载层,其中所述传感器芯片层与所述传感器承载层组合成为传感器层,每个传感器层分别对应于一层微流控芯片中的不同微流道或多层微流控芯片层中的不同层,以满足每一层微流控芯片或每一个微流道有对应的传感器层对其进行检测。从而,本发明实施例构建了一种高度集成的微流控芯片系统,该系统能够应用于生物化学、医学检测、药物合成、药物筛选、环境监测等领域。
在优选实施例中,所述传感器承载层具有连接微流控芯片层的传感器输入口、承载所述传感器芯片层的腔体以及传感器输出口;所述传感器芯片层包括:传感器电极垫部分,用来连接外部电路;传感器电极,与所述传感器电极垫部分相连;传感器衬底,优选地,所述传感器衬底的材料是pet、pc、pdms或pmma耐高温、绝缘、透明柔性材料。
在优选实施例中,所述衬底层、所述微流控芯片层和所述传感器承载层的材料是pdms或pmma材料。
一种微流控传感器芯片系统的制备方法,包括:制备衬底层、一或多层微流控芯片层、一或多层传感器芯片层以及传感器承载层,将各层依次键合叠加,其中所述传感器芯片层与所述传感器承载层组合成为传感器层,每个传感器层分别对应于一层微流控芯片中的不同微流道或多层微流控芯片层中的不同层,以满足每一层微流控芯片或每一个微流道有对应的传感器层对其进行检测。
在优选实施例中,当仅有一层微流控芯片层时,直接将所述微流控芯片层与所述衬底层键合;当有多层微流控芯片时,先将各微流控芯片层键合叠加后,再与所述衬底层键合叠加,或者将所述衬底层和各微流控芯片层逐层键合叠加。
在优选实施例中,所述微流控芯片层的培养对象包含以下的一种或多种:
1)人类汗液、唾液、尿液、血液及人体其他代谢产物;
2)动物汗液、唾液、尿液、血液及动物其他代谢产物;
3)研究涉及的重金属、农药残留及食物中某种或某几种含量等的检测;
4)肝细胞、肝组织、肝器官及肝癌细胞;
5)肺细胞、肺组织、肺器官及肺癌细胞;
6)肾细胞、肾组织、肾器官及肾癌细胞;
7)肠细胞、肠组织、肠器官及肠癌细胞;
8)乳腺细胞、乳腺组织、乳腺器官及乳腺癌细胞;
9)胰腺细胞、胰腺组织、胰腺器官及胰腺癌细胞;
10)心肌细胞、心肌组织、心肌器官及心肌癌细胞;
11)皮肤细胞、皮肤组织及皮肤癌细胞;
12)神经细胞、神经组织、神经器官及其癌细胞。
此外,还可以包括研究过程中涉及到的除上述陈述对象外的其他生物、化学、医疗等研究对象。
在优选实施例中,所述传感器芯片层按检测对象分类包括但不仅限于以下的一种传感器或多种传感器的集成:ph传感器、氧气浓度传感器、乳酸传感器、尿酸传感器、白蛋白传感器、葡萄糖传感器、神经递质传感器、钠离子传感器、钾离子传感器、免疫蛋白传感器、震颤传感器、重金属传感器、温度传感器、co2传感器、no传感器。
在优选实施例中,所述传感器芯片层按检测原理分类包括但不仅限于以下的一种传感器或多种传感器的集成:分析物捕获传感器、电导率传感器、等离子体共振传感器、温度传感器、气体传感器、趋化性传感器、细胞因子传感器、离子传感器、压力传感器、电势传感器、电流传器、流通式传感器、填充式传感器、阻抗传感器、电磁场传感器、表面声波传感器、以及代谢传感器。
在优选实施例中,制备所述传感器芯片层包括如下步骤:
在传感器衬底上涂负胶,用电极结构掩膜板曝光、前烘、显影、坚膜后形成电极图案;
利用磁控溅射技术或者电子束溅射技术在衬底上溅射30-40nm厚度的铬,然后再溅射50-60nm厚度的银/金;
剥离非电极图案部分的金属,使传感器衬底上只有电极区域有金属层,形成电极结构;
蒸镀400nm-600nm厚度的绝缘透明材料作为绝缘层;
涂正胶,用传感器电极垫掩膜板进行光刻后,利用等离子刻蚀技术刻蚀电极垫部分,以便于电极垫与外界连接;
剥离光刻胶,在丙酮溶液中超声6-12小时,或者直接使用去胶液去胶剥离;
涂正胶,用工作电极掩膜板进行光刻工艺,完成曝光、前烘、显影、坚膜步骤;
利用磁控溅射技术或电子束溅射技术,溅射60nm-100nm的铂在工作电极上;
进行金属剥离,在丙酮溶液中超声6-12小时,或者直接用去胶液剥离非工作电极部分;
将包被反应因子的电极切片,固定于已经制作好的传感器承载层上。
该系统可以集成多种类型的传感器,其中每层传感器芯片本身集成了多种电化学传感器。
所述传感器芯片层表面具有包被材料,所述包被材料包括壳聚糖、水凝胶、普鲁士蓝或ecm等生物相容性好、对研究对象无污染、无毒的材料。所述包被材料与检测对象对应的反应因子混合,所述反应因子包括酶、离子、抗体或蛋白等。
所述衬底层、所述微流控芯片层和所述传感器承载层是用光刻工艺加工成型,或是在用pmma或金属材料制备的模具上用pdms或pmma材料浇筑成型。
在具体实施例中,图1所示是衬底,用来与微流控芯片层键合形成微流道。图2所示是传感器承载层0201,用来固定传感器芯片,其中包括传感器输出口0202、连接微流控芯片层的输入口0203、以及承载传感器的腔体0204。图3所示是传感器芯片,芯片可以根据对应的微流控芯片检测对象的个数来集成传感器个数,传感器芯片本身属于一个高度集成的芯片。其中,传感器电极垫部分0301用来连接外部电路,传感器衬底0302的材料可以是pet、pc、pdms、pmma等耐高温、绝缘、透明的柔性材料,传感器电极0303可包括工作电极、参比电极和对电极。该传感器的结构、集成程度可根据研究者定制。图4所示是微流控芯片层,微流控芯片可以根据研究者的要求来设计流道形状和大小,同时选择微流控芯片的层数,以及每层芯片的微流道个数,本图所示是一层芯片,设计有5个微流道。其中0401、0402、0403、0404、0405分别表示不同微流道的输入口,0406、0407、0408、0409、0410分别表示不同微流道的输出口,输出口分别对应于图5中的传感器承载层0504、0506、0508、0510、0512。图5、图6、图7分别是一个高度集成的微流控传感器芯片系统的不同视图。如图5所示,微流控传感器芯片系统包括:衬底层0501,微流控芯片层0502,传感器芯片层0503、0505、0507、0509、0511,传感器承载层0504、0506、0508、0510、0512。如图6所示,微流控传感器芯片系统包括:衬底层0601,微流控芯片层0602,传感器层0603、0604、0605、0606、0607。如图7所示,系统具有:微流控芯片输入口0701,传感器芯片输出口0702(也是整个系统输出口),传感器芯片层0703,微流控芯片层与对应传感器芯片层的连接通道0704。
该系统微流控芯片的制备可用光刻工艺制备模具制备成型,也可以用pmma材料制备成模具,用pdms浇筑成型;传感器芯片层数对应于微流控芯片的集成数量,根据微流控芯片培养对象不同,传感器芯片检测对象也相应变化,例如微流控芯片培养肝细胞,那么传感器芯片检测对象可以是白蛋白、乳酸和尿酸;传感器承载层固定传感器芯片。该系统每层通过键合固定在一起。该系统能够实现微流控芯片上的生物化学、医学检测、药物合成、药物筛选、环境监测等领域的应用。
在具体实施例中,一种高度集成的微流控传感器芯片的制备方法,包括如下步骤:
第一步,采用绘图软件绘制衬底掩膜板、微流控掩膜板、传感器承载层掩膜板、传感器电极掩膜板、传感器pad掩膜板、传感器工作电极掩膜板;
第二步,利用微纳光刻工艺或pmma/金属材料制备衬底、微流控、传感器承载层模具,浇筑pdms/pmma等透明、可柔性材料制备衬底、微流控、传感器承载层,备用;
第三步,将微流控层利用等离子技术处理,键合在一起,微流控层数可供研究者随意选择,但不宜超过7层;
第四步,传感器电极衬底采用高温绝缘可柔性材料,例如pet、pc、pdms、pmma等材料。在衬底上涂负胶,用上述电极结构掩膜板曝光、前烘、显影、坚膜后形成电极图案;
第五步,利用磁控溅射技术或电子束溅射技术在上述衬底上溅射30-40nm厚度的铬,然后再溅射50-60nm厚度的银/金;
第六步,剥离上步中的非电极图案部分的金属,使衬底上只有电极区域有金属层;
第七步,在上步中的结构上,蒸镀400nm-600nm厚度的parylenec或其他绝缘、透明、可柔性的材料作为绝缘层;
第八步,在上步基础上涂正胶,用pad掩膜板进行光刻后,利用等离子刻蚀技术将pad部分裸露,以便于与外界连接、加工工作电极;
第九步,在上步基础上剥离光刻胶,在丙酮溶液中超声6-12小时,或者直接使用去胶液去胶剥离;
第十步,在上部基础上涂正胶,用工作电极掩膜板进行光刻工艺,曝光、前烘、显影、坚膜完成后进行下一步;
第十一步,在上步基础上,利用磁控溅射技术或电子束溅射技术,溅射60nm-100nm的铂在工作电极上;
第十二步,在上步基础上进行金属剥离,在丙酮溶液中超声6-12小时,或者直接用去胶液剥离非工作电极部分,完成传感器电极的制作。
以上内容是结合具体/优选的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,其还可以对这些已描述的实施方式做出若干替代或变型,而这些替代或变型方式都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!