即时检测装置平台的制作方法
本发明涉及一种在便携式即时检测装置(poct)中进行样品分析的盒体;一种即时分析装置,包括所述盒体和适用于所述盒体的读取器,用于检测和/或量化样品中的分析物;以及包括所述即时分析装置的所述部件的套件。
背景技术:
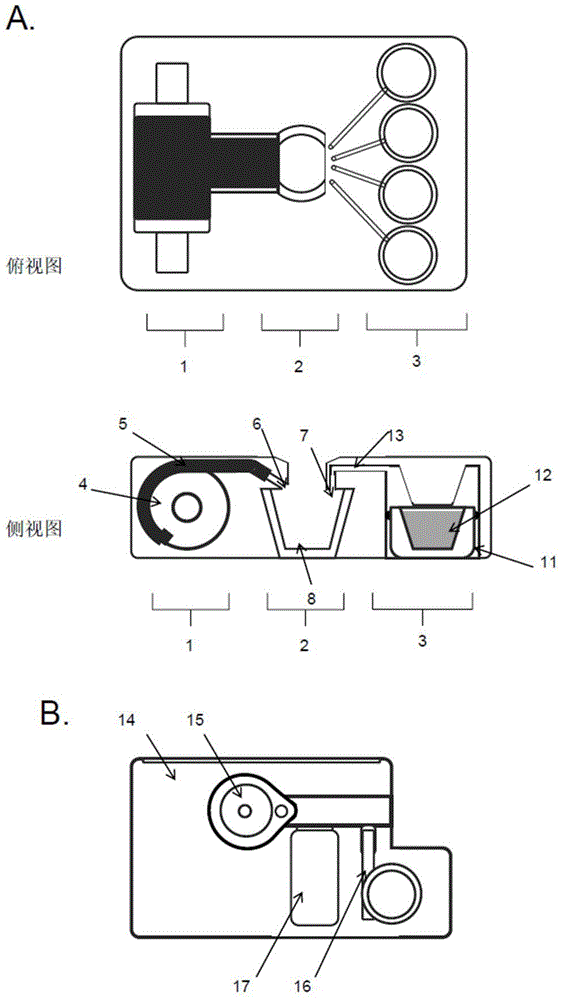
:生物样品的实验室检测传统上用于诊断、筛查、疾病分期、法医分析、妊娠检测、药物检测以及其他原因。虽然一些定性测试,如妊娠检测,已简化为可供患者家用的简单套件,但大量的定量测试仍然需要复杂的程序,这些程序往往需要在实验室环境中使用复杂仪器的、训练有素的技术人员的专业知识。近年来,通过使用包含传感器和计算机电子元件的手持测试装置进行样品分析,这些检测中的一些已可用于即时(poc)分析。即时检测(poct)是在常规分析实验室之外进行的“近患者”诊断测试。在患者附近进行的poct是有益处的,因为它有提供快速结果的潜能,这能使医疗从业者能够更快地采取行动,挽救生命,改善患者的结果,并降低医疗系统的总体成本。一个典型poc装置的例子是基于侧流免疫分析,其依赖于固定在膜(如硝化纤维条)上的捕获试剂从样品中捕获分析物,分析物通过侧流/毛细管作用过程穿过膜。捕获试剂通常是一种抗体,并且通常借助于用视觉上可检测的物质,例如胶体金,标记的第二抗体来检测被捕获的分析物。这种方法已被广泛应用于poct中,例如利用检测尿液中人绒毛膜促性腺激素(hcg)来进行妊娠自检。一般而言,免疫分析poct已被用于不需要高灵敏度的检测中,因此提供可视终点的标记已取得高度成功。检测结果可以进行可视化报告(如hcg妊娠试验)或使用电子读取器报告(如美艾利尔dds2药物滥用检测系统)。现在人们普遍认识到,对于需要高检测灵敏度以检测某种分析物或化合物的痕量来说,poct带来的周转时间的缩短是一个高度合乎需求的目标。然而,使用胶体金作为终点的传统测流法无法提供所需的灵敏度。遗憾的是,常规实验室分析仪提供的高灵敏度检测通常涉及复杂的仪器,并不适合近患者检测。这使得人们对微流体(芯片上的实验室)方法的产生了越来越浓厚的兴趣。到目前为止,只有非常小的一部分基于微流体的poct概念进入到市场:最引人注目的是雅培血气分析仪心肌肌钙蛋白(abbotti-statcardiactroponin)(一种用几滴血液进行心绞痛和冠状动脉闭塞早期检测的酶免疫分析)和美艾利尔分类心肌肌钙蛋白i(aleretriagectni)(荧光免疫分析)检测。因此,人们普遍认为,当前的poct缺乏标准实验室检测的分析性能,这导致它们提供的价值折衷,或导致了需要复杂而昂贵的系统来达到一定的灵敏度。一个关键的例子是作为心肌梗塞标记的心肌肌钙蛋白的测量,其分析灵敏度可能是制约其快速准确诊断的因素,因此具有使用临床化学实验室的必要性。所以在快速增长的临床诊断领域中,需要一种能够提供快速、高灵敏度poct的技术。基于吖啶酯(ae)的化学发光为免疫分析和基因探针分析提供了最灵敏的终点之一,并已应用于常规临床实验室中检测多种分析物。基于ae标记检测的高灵敏度源于其化学发光输出可以在实际上为零的背景下被检测到。为了在实际使用中利用此灵敏度,必须要在开始化学发光反应之前从反应位点去除所有未反应的标记,即ae技术的使用需要信号/背景之间清晰地分离。因此,利用ae标记技术的常规测定方法通常涉及几个清洗步骤,以去除未结合的ae标记(背景),从而达到理想的信号准确度。在这一方面,一般的poct分析形式不允许对特定结合的标记抗体进行足够的清洗,以确保满足ae检测的要求。因此,目前这种灵敏的技术还没有被成功地应用于即时形式。利用新技术,我们在此提供了一种基于信号/背景之间的清晰分离的poct,如此为在高灵敏度分析中的使用提供了必要的灵敏度。技术实现要素:根据本发明的第一方面,提供了一种用于进行样品分析的盒体,该盒体包括:多个隔间,其中第一隔间包括至少一个用于放置样品的反应室,并且反应室表面的一部分附着有捕获试剂;第二隔间包括至少一个用于容纳至少一种试剂的容器,其中所述试剂与所述第一反应室流体连通;以及第三隔间与所述第一或第二隔间一体或者与第一或第二隔间分离,第三隔间包括抽取装置,抽取装置与所述反应室流体连通和/或操作连通,以去除所述反应室中的试剂和/或未反应的产品。在优选实施例中,所述抽取装置包括芯吸或吸收性材料、毛细管/吸管或负压装置。最优选地,盒体包括芯吸或吸收性材料,芯吸或吸收性材料安装在部件上并能够随所述部件移动,以使所述吸芯/材料能够被推进和/或缩回所述反应室。优选地,所述样品是生物样品。本文所述生物样品是指从受试者体内分离出的任何样品,包括但不限于细胞、细胞群、活检、组织、器官、血液、血浆、血清、痰、腹膜液、脑脊髓液、滑膜液、精子、母乳、支气管灌洗液、羊水、恶性腹水、胸膜液、精液、眼泪、尿液、粪便和唾液。可选地,所述生物样品可以是细胞系或保存在培养基中的细胞的上清液。本文中提及的捕获试剂是指任何能够与所述生物样品中的目标分析物进行可逆或不可逆结合的物质或试剂(通过从生物样品中捕获)。以这种方式,如所属领域的技术人员所理解的,使用者将含有或疑似含有目标分析物的生物样品加入到至少一个反应室中,在反应室中,所述分析物(如果存在的话)被特定识别并且被捕获试剂束缚,从而能够识别和/或定量分析物。在本发明第一层面的优选实施例中,所述捕获试剂包括但不限于抗体、适体及适体片段、寡核苷酸或其他特定的配体或受体,特定的配体或受体含有针对生物样品中目标分析物的特定结合配偶体。在本发明进一步的优选实施例中,如所属领域技术人员所知,所述捕获试剂直接附着在反应室表面的至少一部分上,例如但不限于通过吸附或化学偶联固定。可选地,所述捕获试剂通过使用与捕获试剂结合的锚定物,间接附着在反应室表面的至少一部分上。因此,在此实施例中,所述反应室表面的至少一部分被锚定物涂覆,并且所述捕获试剂包括结合锚定物的结合配偶体。最理想地,所述锚定物选自:抗生物素蛋白、寡核苷酸和多核苷酸、蛋白质或凝集素,这些物质结合捕获试剂上的结合配偶体,因此使得捕获试剂附着到反应室表面的至少一部分上。如所属领域技术人员所知,抗生物素蛋白是蛋白质家族中的一员,包括抗生物素蛋白、抗生蛋白链菌素和中性抗生物蛋白,根据它们以高亲和力和特异性与生物素结合的能力被功能定义,生物素作为它们特定的结合配偶体。抗生物素蛋白对生物素的结合亲和力虽然是非共价的,但其亲和力过高以致被认为是不可逆的。因此,在此实施例中,所述捕获试剂是生物素化的。如所属领域技术人员所知,许多试剂一般能通过化学的或酶的方式被生物素化。最理想地,所述生物素化的捕获试剂是生物素化的抗体。凝集素是天然存在的碳水化合物特异性结合蛋白质,其选择性地与碳水化合物基团结合,如典型的糖基团。凝集素在细胞和分子层面上进行识别,并在涉及到细胞、碳水化合物和蛋白质的生物识别现象中扮演重要角色。因此,在本实施例中,所述凝集素与捕获试剂的碳水化合物基团结合,例如但不限发生在抗体及抗体片段上。寡核苷酸和多核苷酸能够通过互补的核苷酸分子结合至捕获试剂,并且这些互补的核苷酸能够用于修改捕获试剂以引起所需的结合。更理想地,所述锚定物是抗生物素蛋白,并且所述捕获试剂包括生物素结合配偶体,或者反之亦可。最理想地,所述锚定物是抗生蛋白链菌素,并且所述捕获试剂包括生物素结合配偶体,或者反之亦可。在本发明第一层面的进一步优选的实施例中,所述反应室以容腔的形式存在,容腔包括基底,所述基底涂覆有捕获试剂和/或锚定物。在进一步优选的实施例中,所述第一隔间包括多个反应室。在进一步优选的实施例中,所述第一隔间包括以容腔的形式存在的反应室,反应室的底部附着有多种捕获试剂,理想地在预估的位点,每种捕获试剂针对所述样品中不同的目标分析物。如所属领域技术人员所理解的,这种方式允许分析一个样品中的多个不同的分析物。此外,如所属领域技术人员所理解的,源于空间上分离的光源的光输出能够通过多种光测量技术分解,这些光测量技术例如但不限于电荷耦合器件(ccds),互补金属氧化物半导体(cmos)传感器和光电二极管阵列。在另一优选的实施例中,反应室中的物质在培养中混合。振荡方法可能涉及盒体的摇晃或振动,使用颗粒或搅拌元件的磁力混合,或者其他的振荡方式,例如,但不限于超声。如所属领域技术人员所理解,捕获试剂或锚定物可以与顺磁颗粒耦合,顺磁颗粒可以被作为分散剂加入到反应室中。在本发明优选的实施例中,涉及目标分析物和颗粒状捕获试剂的引入,其中在未反应组分去除之前可以通过适当放置的电磁铁将颗粒从悬浮液中除去。在进一步优选的实施例中,所述第二隔间包括多个用于容纳多种不同试剂的容器,其中每个容器与反应室流体连通。可选地,所述盒体包括多个另外的隔间,其中另外的隔间的至少一个包括至少一个用于容纳试剂的容器,其中所述试剂与所述反应室流体连通。理想地,所有所述的另外的隔间包括至少一个容器。在一个优选实施例中,所述试剂包括但不限于清洗试剂、标记或被标记试剂、检测试剂、捕获试剂等。本文所提及的清洗试剂是指包括缓冲剂、表面活性剂或其他被设计用于减少被标记试剂的非特异性结合的化合物。本文所提及的标记或被标记试剂是指任何与目标分析物结合的试剂,其中所述标记或被标记试剂直接或间接地连接至指示剂或标记系统,如催化显色的酶、生色团或发光体(例如荧光、磷光、生物发光或化学发光标记物);荧光、磷光、化学发光或生物发光分子或离子中的发射调节器;化学发光或生物发光反应的辅因子;可检测到的微颗粒或纳米颗粒,例如但不限于有色或磁性颗粒。更优选地,指示剂或标记系统包括但不限于传统的酶联免疫吸附测定(elisa)系统或生物发光、化学发光或着色的指示剂系统。更优选地,所述标记或被标记试剂包括但不限于抗体、适体和适体碎片,或其他特定的配体或受体,并且所述标记试剂包括组成化学发光标记系统部分的吖啶酯。本文所提及的检测试剂是指任何被需要的用于引发发光反应,如生物发光或化学发光的试剂。所述试剂可以为氧化剂、催化剂或基质,例如吖啶酯在碱性条件下存在氧化剂时进行发光反应,因此检测试剂包括氧化剂和/或碱性溶液。如所属领域技术人员所理解,检测试剂的性质取决于指示剂或标记系统的性质。最优选地,所述检测试剂被用于化学发光标记的检测,在过氧化氢相继加入酸和碱溶液后进行发光反应,因此所述检测试剂是在酸性溶液和/或碱性溶液中的过氧化氢。另外,如所属领域技术人员所理解,在实施例中其中所述捕获试剂通过使用与捕获试剂结合的锚定物被间接涂覆至反应室表面的至少一部分,所述捕获试剂可被容纳于在容器中。以这种方式,所述捕获试剂能被添加至反应室,然后在反应室中捕获试剂与锚定物结合。有利的是,在使用多个反应室时,这能使不同的捕获试剂被添加至不同的反应室,以检测不同的分析物。此外,从操作角度来看,这是有利的,因为单个锚定物能够用于涂覆每个反应室,之后再依据不同的待检测分析物添加不同的捕获试剂。在一个优选的实施例中,所述容器的至少一个容纳清洗试剂,所述容器的至少一个容纳检测试剂,并且所述容器的至少一个容纳捕获试剂。更理想地,所述容器的至少一个容纳清洗试剂,所述容器的至少一个容纳第一检测试剂,所述容器的至少一个容纳第二检测试剂,所述容器的至少一个容纳捕获试剂,并且所述容器的至少一个容纳标记试剂。最理想地,第一检测试剂是在酸中的过氧化氢,第二检测试剂是碱溶液,捕获试剂是生物素化的抗体,并且标记试剂是吖啶酯(ae)标记的抗体。在进一步优选的实施例中,所述容器包括用于将所述试剂泵送至所述反应室的泵。可选地,所述容器也包括用于控制试剂流入所述反应室的阀。该盒体可包括控制不同流体(如不同试剂和/或流体样品)移动的单个泵,或者可选地,多个泵,多个泵的其中一个,例如,控制流体样品的移动,并且多个泵的至少一个用于控制多个不同试剂的移动。在一个方面,盒体包括多个泵,不同泵控制每种不同流体的移动。在一个可选的实施例中,每种试剂被容纳于包含在容器内的密封的袋子中,所述袋子被紧密靠近连接至反应室的管道。通过活化剂对袋子施压,使袋子将其内容物释放至管道中并将其内容物输送到所述反应室内。任何一种或多种试剂流动至反应室的顺序和时间可能因应用的测试和各自容器中放置的流体类型而异。在一个实施例中,第一容器包括标记或被标记试剂,第二容器包括清洗试剂,第三容器包括检测试剂。在这样的实施例中,待分析的样品被添加至反应室中,并且样品中的任何目标分析物相继或同时与被标记试剂和所述捕获试剂发生反应。如所属领域技术人员所理解,只有部分添加的被标记试剂可以这种方式被捕获。为了保证所有未反应的材料被去除,反应室中的流体使用伸进反应室的吸收性材料去除。因此,只有连接至捕获试剂的被标记试剂附着到反应室中并保留下来。可选地,可以在使用上述吸收性材料之前或之后使用清洗试剂。以此种方式使用的清洗试剂帮助去除未结合的分析物和所不需的材料,以减少残留的背景噪声。因此,吸收性材料用于去除反应室中的液体。必要时可重复此清洗步骤。最后,加入检测试剂,检测试剂的性质取决于使用的标记或被标记试剂的类型。之后通过测量发光信号可以检测和定量样品中的目标分析物。如所属领域技术人员所理解,在可选实施例中,锚定物用于将捕获试剂结合至反应室,盒体可进一步包括额外的容器,额外的容器包括可在首次使用吸收材料之前加入反应室内的捕获试剂,使捕获试剂能够与锚定物结合。优选地,捕获试剂与标记或被标记试剂同时添加。在优选的实施例中,所述吸收性材料安装在线轴上,线轴沿第一方向的圆周运动推进所述材料,线轴沿相反方向的圆周运动缩回所述材料。可选的,所述材料安装在传送带上,传送带沿第一方向的运动推进所述材料,传送带沿相反方向的运动缩回所述材料。理想地,所述可移动元件的布置使所述材料在推进时浸入反应室中并且,在缩回时被移出所述反应室。在本发明特定的实施例中,所述可移动元件上连接有在吸收性材料使用后、切断所述吸收性材料的刀片。在本发明可选实施例中,为保证去除任何反应室中未反应的材料,反应室中的液体使用抽取装置或毛细管流动装置去除。在又一优选的实施例中,所述盒体进一步包括控制装置,控制装置用于使试剂向反应室的流动与所述吸收性材料或抽取装置或毛细管流动装置的使用同步。理想地,控制装置保证试剂能够流入反应室,并且可选地,保证试剂在反应室内停留一段选择的培养时间,之后使用所述吸收性材料或抽取装置或毛细管流动装置抽取留在反应室里的、未与提供的或涂覆在反应室表面结合的捕获试剂。典型地,生物样品将包含目标分析物。生物样品中所述分析物的测定、检测和/或定量在盒体内完成。比如此分析可以是检测对应不同紊乱(例如但不限于慢性代谢紊乱)的分析物,例如血胰岛素、胰岛素原或c肽(糖尿病);其他特定疾病(包括急性疾病)的标志物,例如心脏病标志物(如心肌肌钙蛋白和端脑利钠肽(nt-probnp))、甲状腺功能标志物(如促甲状腺激素(tsh))、肿瘤标志物和感染因子标记物等。典型地,进行分析程序,分析程序中样品中的目标分析物与一种或一种以上提供捕获手段的结合配偶体反应,以及与一种或一种以上被可检测物质标记的结合配偶体反应,在所述反应后,所述可检测物质的数量与所述样品中存在的所述反应物的数量呈函数或反函数关系。在本发明的优选层面,结合配偶体为抗体,并且可检测物质为可以参与发光反应,如生物发光或化学发光反应,的化合物。在本发明的更优选层面中,可检测物质为吖啶酯,吖啶酯可以在过氧化氢加入酸和碱溶液中之后被检测到或被量化。在本发明的进一步层面中,通过使用针对每种分析物检测的抗体,在同一反应室中可以检测一种以上分析物,其中所述抗体被化学改性的吖啶酯标记,以提供单独的发光特性,例如关于波长的或反应动力学的,如此一来,每个被标记的抗体可以在同一反应室中独立于其他被标记抗体被定量。在本发明进一步优选的实施例中,盒体包括用于混合反应室中内容物的振荡部件。如所属领域技术人员所理解,反应容器的振荡能够保证组分试剂的最大反应速度。这种振荡可以例如通过连接反应室与振动马达、在反应室中安装磁力搅拌器或通过其他物理途径移动反应室完成。根据本发明的第二层面,提出一种即时分析装置,即时分析装置包包括本发明所公开盒体以及能与盒体进行功能连通的读取器。例如,可以将盒体插入、放置或连接读取器,并且读取器可包括对接装置,如插槽,或对准装置使盒体适当地插入、放置或连接读取器。在本发明第二层面的优选实施例中,所述读取器包括用于检测捕获试剂和/或标记或被标记试剂的检测器。如所属领域技术人员所理解的,检测器的性质取决于指示剂的性质或捕获试剂标记系统和/或标记试剂的性质。例如,荧光强度或波长的变化能够使用荧光剂监测,化学发光的类似变化可以通过光度计监测。最理想地,所述检测器是用于测量发光的光学检测器。额外地或可选地,所述盒体包括检测器。在本发明第二层面的进一步优选实施例中,所述读取器包括当盒体插入读取器中时、用于控制所述盒体可移动部件的马达,从而使所述吸收性材料推进或缩回。在本发明第二层面的进一步优选实施例中,所述读取器包括用于操作抽取装置的马达,从而去除所述反应室中的液体。可选地,所述读取器可以包括控制装置,控制装置用于使试剂向反应室的流动以及所述马达的使用同步。理想地,控制装置控制试剂流入反应室,并且可选地,试剂在反应室停留一段选择的培养时间,之后所述控制装置控制所述吸收性材料的移动或所述抽取装置的抽取以去除反应室内未结合捕获试剂的残留液体。在本发明第二层面的进一步优选实施例中,提供一种用于混合反应室中内容物的振荡元件。这种振荡例如可以通过连接反应室与振动马达、在反应室中安装磁力搅拌器或通过其他物理途径移动反应室完成。理想地,此功能也由读取器控制。此外,可以设置所述读取器,使得搅拌可应用于随后的清洗步骤中,以确保最大限度地去除未反应的组分试剂。依据本发明的第三层面,提供用于即时分析设备的套件,该套件包括:至少一个本发明中公开的盒体;和至少一个能够与所述盒体进行功能连通的读取器,所述盒体中的分析试剂能用于提供即时检测,以用于识别生物样品中的至少一种分析物。在本说明书描述和权利要求中,词语“包括(comprise)”和“包含(contain)”及其变体,如“包括了(comprising)”和“包括有(comprises)”,表示“包括但不限于”,并不排除其他部分、添加剂、成分、整体或步骤。在本说明书描述和权利要求中,除非上下文另有要求,否则单数形式包含复数形式。特别是在使用不定冠词的情况下,除非上下文另有要求,否则应将说明书理解为考虑多个性和单一性的。本说明书中所有引用的参考文献,包括所有专利或专利申请,均以引用方式写入。不承认任何参考构成现有技术。此外,不承认任何现有技术构成本领域公知常识的一部分。本发明每个层面的优选特征,在描述时可能都与其他任何一个层面相关联。本发明的其他特征将以以下例子公开。一般来讲,本发明延伸至本发明公开的特征(包括所附权利要求和附图)的任意新的一种或任意新的结合。因此,本发明以特定层面关联的方式描述的特征、整体、特性、化合物或化学基团、实施例或举例应被理解为适用于本文描述的任何其他层面、实施例或举例,除非与之不兼容。此外,除非另有说明,否则本文公开的任何特征都可被替换为具有相同或类似用途的备选特征。现将本发明以实施例的方式描述,下述实施例和图片仅供参考:图1(a)展示了依据本发明使用的盒体的俯视图和侧视图的图解说明;以及(b)展示了依据本发明使用的读取器的侧视图的图解说明;图2展示了依据本发明使用的盒体的侧视图的图解说明,示出阐释本发明工作原理的步骤;图3(a-d)展示了用于免疫分析的本发明的盒体。特别地,(a)展示了识别分析物的抗体被添加至反应室;(b)展示了培养期;(c)展示了使用吸收性材料去除反应液;(d)展示了清洗步骤;(e)展示了阐释本发明工作原理的步骤;图4(a-d)展示了在将样品加入反应室(图3)后,本发明的盒体在化学发光免疫分析中的使用。特别地,(a)展示了重复清洗;(b)展示了检测试剂被添加至反应室;(c)展示了第二检测试剂添加至反应室;(d)展示了反应信号的发出;(e)展示了阐释本发明工作原理的步骤;以及图5展示了当用于测量胰岛素原时发明装置的读数。表1使用本发明公开的装置快速分析以测量人体血清中的心肌肌钙蛋白i(ctni),基于化学发光标记的抗体和被涂覆在反应容腔上抗生蛋白链菌素捕获的生物素化抗体的使用。ctni的连续稀释产生的响应在浓度为6-390pg/ml范围内与肌钙蛋白标准平行。这些结果比得上使用常规试剂清洗的流程,说明该快速分析可以被用于人体样品中低水平ctni的测量。表2使用测试盒体测量完整胰岛素原的试样结果。表3常规容腔清洗与盒体清洗的比较(残余发光-rlu)。现在参考附图,首先参考图1,a部分,展示了盒体的侧视图,盒体包括隔间1、隔间2和隔间3。隔间1与隔间3分别位于隔间2的两侧,并分别通过开口6和开口7与隔间2相连接。在实施例中,所示的每个隔间具有不同的功能。隔间1放置线轴4,线轴4上卷绕着一段吸收性材料5。线轴4卷绕的第一方向(顺时针)将吸收性材料5推进至隔间2,并且通过开口6,吸收性材料5得以进入隔间2。相反的,线轴4卷绕的第二方向(逆时针)将吸收性材料从隔间2缩回。显著地,虽然说明了试剂通过卷绕在线轴4上的芯吸材料去除,但也可使用所属领域技术人员所知的其他机理从隔间2中去除试剂,例如但不限于芯吸、毛细管力或负压等类似手段。隔间2包括反应室8,反应室8以容腔或其他类似的形式存在。反应室8的内部下表面9上附着有捕获试剂(未示出)。使用化学或其他吸引力将该试剂直接固定在反应室8上,可选的(且更典型地)通过使用以锚定物的形式存在的中间体将该试剂间接固定在反应室8上,以锚定物的形式存在的中间体,反过来,使用化学或其他吸引力被直接固定在反应室8上。在使用中,盒体配备有已附着到反应室8或供后续使用容器上的捕获试剂。隔间3包括容纳试剂12的容器11。容器11通过导管13和开口7与反应室8流体连通。容纳于容器11的试剂的性质取决于待分析的分析物的性质和/或所使用的检测系统的性质。虽然未示出,容器11还包括泵装置,通过泵装置容器中的试剂能够被选择性地移动至反应室8。目前为止所描述的本发明展示的是盒体的最简单的版本。在其他实施例中,所述盒体进一步设有容器11a、11b及11c等,以容纳本发明分析中所使用的多种不同试剂。额外地或可选地,所述盒体被进一步设有反应室8a、8b、8c等,以同时或连续进行多种分析。无论盒体的复杂性如何,盒体的配置使得至少一种吸收性材料或一个抽取装置或一个毛细管流动部件与一个反应室8可移动接触,并且容纳至少一种试剂的容器11的至少一个与所述反应室8流体连通。图1的b部分展示了适用于容纳上述盒体的读取器14。在此特定的图例中,读取器14设有合适尺寸和形状的空腔以容纳盒体,此外,读取器14还设有能与盒体进行相互作用的协同装置,以确保试剂和材料5能以同步和及时的方式移动至反应室8。特别地,在特定的实施例中,所述读取器14可设有马达15,以转动线轴4,虽然同样可以使用替代的方式。进一步地,读取器14可以选择性包括促动器16以引发试剂12从容器11中的流出。进一步地,读取器14可以包括检测器17,例如光学检测器,以检测反应室8中的读数从而进行分析物检测和/或定量。可以使用备选的检测器17,该选择取决于所用标记和捕获剂的性质。如图2所示,在使用时,生物样品18被添加至反应室8中,再将反应室8放入读取器14中。之后启动读取器14并且读取器14控制添加试剂至反应室8,最后读取样品18中检测到的全部分析物。图3说明了在免疫分析中盒体的使用。反应室8设有捕获试剂。在样品加至反应室8后,将识别分析物的探测器ae标记抗体添加至反应室8(图3a),培养一段预先设定好的时间(图3b),之后,再将材料5浸入反应室8中以去除反应液(图3c)。最后一步可以通过抽取装置或毛细管装置进行。可选地,液体去除后可以进行至少一次清洗步骤(图3d)以及进一步的浸入/去除步骤,即令清洗溶剂从另一个容器11加入到反应室8中,材料5再次浸入到反应室8中(重复图3c中的步骤)或者启动抽取装置。这些步骤如图3e所示。图4展示在此实施例中清洗步骤(图4a)重复3次(清洗步骤进行与否或进行的次数取决于分析的性质和试剂对分析物的相对亲和力)。在清洗完成之后,即确保未使用的反应物被去除时,向反应室8中加入至少一种检测试剂,在此实施例中,将第一检测试剂(图4b)和第二检测试剂(图4c)相继加至反应室8。这些试剂触发了信号的发出(图4d),读取器14能够读取该信号并且对被所述捕获试剂捕获的,也就是所述生物样品中的分析物的量进行指示。若优选,所述读取器能在使用之前,用待检测分析物的已知量进行校准。为阐述本发明的运作,现使用一般术语描述本发明列举的实施例。典型地,盒体中反应室8的底部覆盖上一层锚定物。有利地,此物质是普通类型的,如抗生物素、凝集素或寡核苷酸。更多的容器11a、11b和11c等依据待检测分析物的性质和/或分析反应的性质被充入或容纳有适当的试剂。然而,容器的至少一个容纳有能同时与锚定物和待检测分析物结合的捕获试剂。容器另外的至少一个容纳有还能与分析物结合的检测试剂,但检测试剂在被激活时其本身发出信号,或者检测试剂在被激活时与另一容器中的至少一种其他试剂协同作用、发出信号。此外,材料5通常以缩回形式供应。同样理想地,一个容器包括清洗溶剂。使用中,向反应室8中加入生物样品18,将盒体插入读取器14中。然后读取器14控制从一个或多个容器11向反应室8中添加一种或多种试剂的顺序和时间。当所需反应结束时,如需要的话,将清洗溶液加至反应室8中,然后读取器14控制材料5浸入反应室8中以去除未使用的/过量的反应液。如所属领域技术人员所理解的,捕获试剂与样品室8的结合(直接的或间接的)导致在使用材料5之后分析物保留在样品室8中。相应地,可将至少一种检测试剂加入反应室8中,并提供条件(通过使用其他试剂或合适的触发剂)以引发信号的发出,该信号指示捕获试剂上捕获的分析物的性质和/或数量。为阐述本发明的运作,现使用更明确的术语描述本发明的列举的实施例。实施例1检测用作心肌梗塞标记物的心肌肌钙蛋白材料和方法使用检测盒体测量肌钙蛋白i心肌肌钙蛋白i((ctni)的单克隆抗体从海肽生物(hytest)(图尔库,芬兰)获得。使用2,6-二甲基-4-(n-丁二醇酰氧羰基)苯基10-甲基-吖啶-9-羧酸三氟甲烷磺酸盐(ae)标记抗体。典型地,抗体在水溶液中与ae反应15min,产物通过凝胶过滤净化。将ae标记的抗体存储在含有牛血清白蛋白和叠氮化钠的缓冲液中。令抗体与生物素-lc-lc-n-羟基琥珀酰亚胺(生活科技,伦弗鲁,英国)在水溶液中反应18h以制备生物素化的抗体,产物通过凝胶过滤净化。将生物素化的抗体存储在含有牛血清白蛋白和叠氮化钠的缓冲液中。使用在稀释的碳酸盐/碳酸氢盐缓冲液中浓度为5μg/ml的抗生蛋白链菌素(西格玛奥德里奇,普尔,英国)涂覆聚苯乙烯反应室。容腔在4℃下涂覆整夜。使用含洗涤剂吐温-20(tween-20)(0.1%)的磷酸盐缓冲盐水(pbs)清洗反应室(3次,每次300μl),然后用含牛血清白蛋白(1%)的pbs将其在室温下隔离2h。在倒出液体后,板在减压下干燥整晚。抗生蛋白链菌素涂覆的板密封存储在箔袋中,存储温度为2-8℃。通过向马血清中(西格玛奥德里奇,普尔,英国)添加重组心肌肌钙蛋白(艾碧康,剑桥,英国)制备一系列标准浓度的ctni。将1ml等分试样放入玻璃瓶中冻干,玻璃瓶在真空下塞住。冻干的标准样品在2-8℃下存储。为了进行分析,将单独涂覆有抗生蛋白链菌素的反应室组装至配置好的测试盒体中。将样品(50μl)和ae标记抗体与生物素化的抗体的混合物(50μl)加入到反应室中,使反应进行10分钟。通过短暂地下放吸芯去除容腔中的反应混合物。从适当端口添加洗涤缓冲液(100μl),再用芯吸去除。再重复清洗两次以上,并且向硝酸(0.1m)中注入过氧化氢(0.5%)后注入0.25m氢氧化钠,引发发光反应。使用光电倍增管测量在1s的时间段内收集到的总发光量。结果如表1所示。可以看出,在浓度范围为6-390pg/ml时,人体血浆中的ctni的连续稀释产生的响应与肌钙蛋白标准平行。这些结果表明,此快速分析可用于小背景或无背景干扰情况下测量人体样品中低水平的ctni。表1实施例2使用测试盒体测量完整胰岛素原在马血清中制备了一系列标准浓度的人胰岛素原(第一国际参考制剂84/611,nibsc,pottersbar,en63qg,英国)。为了进行分析,将单独涂覆有抗生蛋白链菌素的反应室组装到配置好的测试盒体中。将样品(25μl)和ae标记的抗体及生物素化的抗体的混合液(100μl)加入到反应室中,使反应进行10分钟。通过上述实施例描述的方法去除反应混合物并清洗。如上述实施例所述引发发光反应,并在1s的时间段内进行测量。结果如图5所示,7个测试样品的结果如表2所示。结果与常规的(3h)完整胰岛素原微孔板免疫分析(elisa)的结果进行比较。表2样品编号poctelisa12.32.0216.216.233.93.8416.816.858.49.661.51.6712.816.4实施例3比较使用本发明盒体清洗的容腔以及使用实验室平板清洗器清洗的容腔盒体组装有涂覆有抗生物蛋白素的容腔,并将ae标记的胰岛素原抗体与生物素化的胰岛素原抗体(100μl)的混合物加至每个容腔中。加至每个容腔中的被标记抗体在实验室微光板光度计中显示的发光读数为3416600rlu。15分钟后,使用盒体芯吸机理清洗容腔(3次,每次150μl清洗缓冲液)。然后将容腔移出,在实验室光度计中测量输出的光。结果与加入了相同抗体混合物但在实验室平板清洗器中清洗的容腔进行了比较。如表3所示,残余活性基本相同(即所添加发光活性的0.02%)。表3盒体清洗与常规容腔清洗的比较(残余发光-rlu)当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1