Ce掺杂CdS纳米粒子光催化剂的制备方法及其应用
ce掺杂cds纳米粒子光催化剂的制备方法及其应用
技术领域
1.本发明属于催化剂技术领域,涉及一种ce掺杂cds纳米粒子光催化剂的制备方法,还涉及上述ce掺杂cds纳米粒子光催化剂的应用。
背景技术:
2.芳香醇选择性氧化生成相应的醛类化合物是基本的有机转化,也是最理想的化学转化方法之一。可广泛用于医药、染料、香水等其它精细化学品的合成。而传统的芳香醇氧化需要在高温、高压和添加额外化学品(如高锰酸钾、重铬酸钾、次氯酸盐、浓硫酸等)的条件下进行,造成不必要的资源消耗和环境污染。太阳能作为一种清洁的、可无限利用的能源,在促进环境化学反应方面具有巨大的潜力。因此,以太阳能为动力的光催化氧化技术在温和条件下实现芳醇的光催化选择性氧化已受到人们的广泛关注。作为过渡金属硫化物家族的一员,cds因能带结构适宜、光响应范围宽等优点,被认为是苯甲醇(ba)选择性氧化为苯甲醛(bad)的良好光催化剂。然而,cds的光催化活性却受到光腐蚀和电子-空穴对的高复合率的限制,进而影响催化效果。
技术实现要素:
3.本发明的目的是提供一种ce掺杂cds纳米粒子光催化剂的制备方法,解决了现有技术中存在的催化效果较差的问题。
4.本发明所采用的技术方案是,ce掺杂cds纳米粒子光催化剂的制备方法,包括以下步骤:
5.步骤1、先将硫脲水溶液加入乙酸镉水溶液中,再向其中加入naoh溶液,搅拌得到混合溶液,将混合溶液置于反应釜中进行水热反应,反应后收集固体,得到cds1样品;
6.步骤2、将cecl3·
7h2o和cds1样品研磨混合后进行煅烧,之后冷却、洗涤、干燥,得到ce掺杂cds纳米粒子光催化剂。
7.本发明的特点还在于:
8.步骤1具体包括以下步骤:
9.步骤1.1、将乙酸镉、硫脲分别溶解于去离子水中得到乙酸镉水溶液、硫脲水溶液;
10.步骤1.2、将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入naoh溶液调节ph值,搅拌得到混合溶液;
11.步骤1.3、将混合溶液置于不锈钢高压反应釜中进行水热反应;
12.步骤1.4、反应结束后冷却至室温,之后离心收集固体,对固体进行洗涤、干燥得到cds1样品。
13.乙酸镉和硫脲的摩尔比为1:1~2。
14.步骤1.2中ph值调节为10~11。
15.水热反应的反应温度为120~135℃,反应时间为10~12h。
16.步骤1.4中干燥过程的干燥温度为60~80℃,干燥时间为12~24h。
17.cecl3·
7h2o和cds1样品的质量比为1~3:10。
18.步骤2的煅烧过程中,煅烧温度为300~330℃,煅烧时间为2~2.5h,升温速率为3~5℃/min。
19.步骤2中干燥过程的干燥温度为60~80℃,干燥时间为12~24h。
20.本发明的另一目的是提供一种ce掺杂cds纳米粒子光催化剂在苯甲醇氧化中的应用。
21.本发明的有益效果是:
22.由于纯cds具有严重的光腐蚀以及高的电子-空穴对复合效率;而ce作为一种具有独特4f能级的稀土元素,即存在两种稳定的氧化态ce(iii)和ce(iv),能有效收集电子,从而提高电子-空穴对的分离效率。本发明的ce掺杂cds纳米粒子光催化剂,在cds中掺杂ce,能有效提高ce掺杂cds纳米粒子中载流子的分离效率,进而提高光催化剂的催化效果。在水溶液中具有较高的光催化苯甲醇选择性氧化性能,具有操作简单、成本低廉等特点。
附图说明
23.图1是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品的xrd图;
24.图2a发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品的xps图;
25.图2b是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品cd元素的xps图;
26.图2c是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品s元素的xps图;
27.图2d是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品ce元素的xps图;
28.图3a是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的cds的tem图;
29.图3b是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的0.2ce-cds的tem图;
30.图3c是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的0.2ce-cdshr-tem图;
31.图3d是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的0.2ce-cdshr-tem放大图;
32.图3e是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品的cd、s、ce分布mapping图;
33.图4a是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到的样品的uv-vis drs图;
34.图4b是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到样品的带隙图;
35.图4c是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到样品的m-s图;
36.图4d是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到样品的光电流曲线图;
37.图4e是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到样品的nyqiust曲线图;
38.图4f是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例1得到样品的pl图;
39.图5是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例2得到样品的xrd图;
40.图6是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例3得到样品的xrd图;
41.图7是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例4得到样品的xrd图;
42.图8是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例5得到样品的xrd图;
43.图9是本发明ce掺杂cds纳米粒子光催化剂的制备方法实施例6得到样品的xrd图;
44.图10是本发明ce掺杂cds纳米粒子光催化剂在应用的不同比例ce掺杂cds样品光催化苯甲醇氧化效果图。
具体实施方式
45.下面结合附图和具体实施方式对本发明进行详细说明。
46.ce掺杂cds纳米粒子光催化剂的制备方法,包括以下步骤:
47.步骤1、先将硫脲水溶液加入乙酸镉水溶液中,再向其中加入naoh溶液,搅拌得到混合溶液,将混合溶液置于反应釜中进行水热反应,反应后收集固体,得到cds1样品;
48.具体的,步骤1.1、将乙酸镉、硫脲分别溶解于去离子水中得到乙酸镉水溶液、硫脲水溶液;乙酸镉和硫脲的摩尔比为1:1~2;
49.步骤1.2、将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入5~7mol/l的naoh溶液调节ph值为10~11,搅拌得到混合溶液;
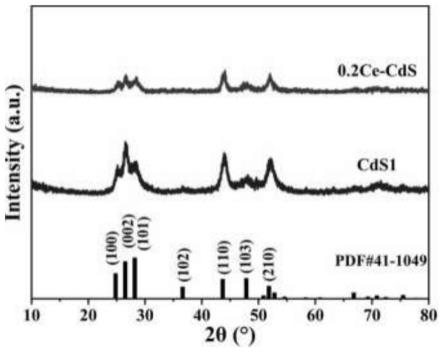
50.步骤1.3、将混合溶液置于不锈钢高压反应釜中进行水热反应,反应温度为120~135℃,反应时间为10~12h;
51.步骤1.4、反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在60~80℃真空干燥12~24h,得到cds1样品。
52.步骤2、按质量比为1~3:10将cecl3·
7h2o和cds1样品于研钵中研磨混合后,以升温速率为3~5℃/min升温至300~330℃,在该温度下煅烧2~2.5h,之后自然冷却至室温,离心洗涤,在温度为60~80℃下干燥12~24h,得到ce掺杂cds纳米粒子光催化剂(ce-cds)。
53.ce掺杂cds纳米粒子光催化剂在苯甲醇氧化中的应用。
54.通过以上方式,本发明的ce掺杂cds纳米粒子光催化剂,在cds中掺杂ce,能有效提高ce掺杂cds纳米粒子中载流子的分离效率,进而提高光催化剂的催化效果。在水溶液中具有较高的光催化苯甲醇选择性氧化性能,具有操作简单、成本低廉等特点。
55.实施例1
56.将10mmol乙酸镉、10mmol硫脲分别溶解于30ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入3.5ml 6mol/l的naoh溶液调节ph值为10.5,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,130℃加热10h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在70℃真空干燥12h,得到cds1样品;
57.将0.2gcecl3·
7h2o和0.5gcds1样品于研钵中研磨混合后,以升温速率为5℃/min升温至300℃,在该温度下煅烧2h,之后自然冷却至室温,离心洗涤,在温度为70℃下干燥13h,得到ce掺杂cds纳米粒子光催化剂,命名为0.2ce-cds。
58.用x射线粉末衍射仪(xrd)对实施例1得到的ce-cds的物相结构进行检测,如图1所示,cds1与0.2ce-cds均表现出相似的物相结构,说明ce掺杂并未改变cds的物相结构。衍射峰分别对应于六方相cds(jcpds no.27-0052)的(100)、(002)、(111)、(110)、(103)和(210)晶面。
59.为了确定复合光催化剂的表面价态,对实施例1所制得的0.2ce-cds光催化剂进行了xps测试。由图2(a)可以看出,能明显检测到cd、s、ce三种元素。在图2b,cd 3d高分辨xps中,纯cds的结合能412.0ev和405.1ev分别对应cd 3d
5/2
和cd 3d
3/2
的自旋轨道,cd的自旋轨道分离能为6.9ev,证实了样品中cd
2+
的存在。与cd原子相比ce原子的电负性更小,掺杂ce后cd 3d的峰向更低,结合能轻微偏移,cd 3d
5/2
和cd 3d
3/2
分别为411.8ev和404.8ev。在图2c的s2p的高分辨xps中,也可以观察到ce-cds样品的s2p
3/2
自旋轨道峰由162.8ev福偏移至162.4ev,s2p
1/2
自旋轨道峰由161.5ev负偏移至161.1ev,且s的自旋轨道分离能均为1.3ev,说明s元素在样品均中以s
2-的形式存在。以上xps结果表明ce掺杂会使cds失去电子,降低cd
2+
和s
2-周围的电子云密度,进一步证实ce成功掺杂到cds中。在ce 3d的xps图2d中,ce 3d谱可反卷积为五对自旋轨道带,u和v分别表示ce 3d
3/2
和ce 3d
5/2
,其中u4/v4、u3/v3和u1/v1峰与电子构型为3d
10
4f0的ce
4+
3d的特征态有关,u0/v0和u2/v2峰与电子构型为3d
10
4f1的ce
3+
3d的特征态有关,说明ce-cds表面的铈离子以+4和+3氧化态存在,其中以+4氧化态为主。
60.对本实施例得到的0.2ce-cdstem图像进行分析,如图3a所示,从cds的tem图像中可以看出纯cds是约为15nm的纳米粒子组成。如图3b所示,通过煅烧过后,cds发生了一定的团聚现象,但是xrd显示经过一定时间的煅烧并不会改变样品的物相结构,通过活性测试也并没有为活性的提高带来一定的收益,反而活性有所降低。从图3c-3dcds的hrtem中可以清晰地观察到六方相cds的(110)和(102)晶面的晶格条纹分别为0.36nm和0.25nm。图3e中可以观察到ce-cds中cd、s和ce元素存在,且分布均匀,进一步说明ce在cds表面均匀分布,ce-cds成功制备。
61.对于光催化材料而言,光吸收能力以及能带结构会影响其光催化活性和氧化还原能力,因此利用紫外-可见漫反射光谱(uv-vis drs)和模特肖特基(m-s)测试分析了实施例1的光学吸收性质和能带位置。如图4a所示,cds1的最大吸收边缘位于可见光区域,0.2ce-cds的吸收边缘发生了蓝移。如图4b所示,可以分析出cds1的带隙值eg分别约为2.28ev。如图4c所示,利用m-s曲线分析了cds导带电位,由能斯特方程:e
fb
(vs.nhe)=e
fb
(ph=0vs.ag/agcl)+0.059*ph+e
θ
(ag/agcl)可分析出e
fb
(cds)=-0.25v vs nhe。因此,cds的cbm值为-0.55v vs nhe,根据eg=e
vb-e
cb
,可得出cds的价带电位为+1.73v。实施例1的瞬时光电流密度如图4d所示,通常,光电流密度越大,光生电子-空穴对的寿命越长。经过5次间歇开/关灯循环,样品的可逆光电流密度一直保持稳定,说明该样品具有较高的光响应稳定性。特别是,0.2ce-cds光电流密度在光照下增加到最大值7.2
×
10-6
a/cm-2
,为cds1(2.0
×
10-6
a/cm-2
)的3.6倍。用电化学阻抗谱测定了实施例1的光生载流子的转移和传输机制,结果如图4e所示。ce掺杂后,0.2ce-cds的nyqiust曲线呈现相对较小的圆弧半径,表明ce-cds的界面电阻小,界面电荷转移速率快。光致发光(pl)可以检测到光生电子-空穴对的复合效
率。样品在350nm激发下,发射峰为550nm(图4f),从图中可以看出cds比0.2ce-cds具有更高的发射强度。发光峰强度减弱表明,0.2ce-cds具有较小的光生电子和空穴复合速率。因此,可以推断ce
3+
/ce
4+
氧化还原对的存在可以收集和转移电子从而提高复合材料光生电子-空穴对的分离效率,进一步提高光催化活性。
62.实施例2
63.将10mmol乙酸镉、15mmol硫脲分别溶解于40ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入7mol/l的naoh溶液调节ph值为10,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,120℃加热12h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在60℃真空干燥24h,得到cds1样品;
64.将0.8gcds1样品于研钵中研磨混合后,以升温速率为3℃/min升温至310℃,在该温度下煅烧2h,之后自然冷却至室温,离心洗涤,在温度为60℃下干燥15h,得到cds2样品。
65.本实施例煅烧前后cds1样品和cds2样品的xrd图如图5所示,从图中可以看出经过煅烧,cds的物相结构并未发生改变。
66.实施例3
67.将10mmol乙酸镉、20mmol硫脲分别溶解于35ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入5mol/l的naoh溶液调节ph值为11,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,135℃加热11h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在80℃真空干燥12h,得到cds1样品;
68.将0.05gcecl3·
7h2o和0.5gcds1样品于研钵中研磨混合后,以升温速率为4℃/min升温至320℃,在该温度下煅烧2.5h,之后自然冷却至室温,离心洗涤,在温度为75℃下干燥13h,得到ce掺杂cds纳米粒子光催化剂,命名为0.05ce-cds。
69.本实施例的cds1样品、0.05ce-cds的xrd对比如图6所示,从图中可以观察到本实施例中的样品仍然为六方相cds,掺杂并没有改变cds的物相结构。
70.实施例4
71.将15mmol乙酸镉、15mmol硫脲分别溶解于30ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入6mol/l的naoh溶液调节ph值为10.5,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,125℃加热11h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在65℃真空干燥18h,得到cds1样品;
72.将0.1gcecl3·
7h2o和0.5gcds1样品于研钵中研磨混合后,以升温速率为4℃/min升温至310℃,在该温度下煅烧2.2h,之后自然冷却至室温,离心洗涤,在温度为75℃下干燥18h,得到ce掺杂cds纳米粒子光催化剂,命名为0.1ce-cds。
73.本实施例的cds1样品、0.1ce-cds的xrd样品对比如图7所示,说明本实施例中的样品在掺杂改性前后物相结构并未发生变化。
74.实施例5
75.将15mmol乙酸镉、20mmol硫脲分别溶解于35ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入7mol/l的naoh溶液调节ph值为11,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,130℃加热10h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在80℃真空干燥12h,得到cds1样品;
76.将0.15gcecl3·
7h2o和0.5gcds1样品于研钵中研磨混合后,以升温速率为5℃/min升温至330℃,在该温度下煅烧2h,之后自然冷却至室温,离心洗涤,在温度为80℃下干燥12h,得到ce掺杂cds纳米粒子光催化剂,命名为0.15ce-cds。
77.本实施例的cds1样品、0.15ce-cds样品的xrd对比如图8所示,说明本实施例中的样品的物相结构仍然为六方相cds。
78.实施例6
79.将15mmol乙酸镉、20mmol硫脲分别溶解于40ml去离子水中得到透明的乙酸镉水溶液、硫脲水溶液;将硫脲水溶液逐滴加入乙酸镉水溶液,再向其中加入6mol/l的naoh溶液调节ph值为10.5,搅拌得到混合溶液;将混合溶液置于100ml聚四氟乙烯内衬的不锈钢高压反应釜中进行水热反应,125℃加热10h;反应结束后冷却至室温,之后离心收集固体,用去离子水和无水乙醇各洗涤数次,在75℃真空干燥15h,得到cds1样品;
80.将0.25gcecl3·
7h2o和0.5gcds1样品于研钵中研磨混合后,以升温速率为3℃/min升温至300℃,在该温度下煅烧2.5h,之后自然冷却至室温,离心洗涤,在温度为75℃下干燥15h,得到ce掺杂cds纳米粒子光催化剂,命名为0.25ce-cds。
81.本实施例的cds1样品、0.05ce-cds的xrd对比如图9所示,本实施例中的样品仍然为六方相cds,掺杂并没有改变cds的物相结构。
82.实施例7
83.分别称取实施例1中制备好的cds1和0.2ce-cds复合光催化剂0.1g加入带有冷却夹套的石英反应器中,再加入50ml0.5mmol/l的苯甲醇溶液,避光超声处理5min使光催化剂均匀分散在苯甲醇溶液中;
84.首先在黑暗条件下磁搅拌30min,确保催化剂与苯甲醇溶液之间达到吸附-解吸平衡;暗反应之后开灯光照30min(可见光光源为300w氙灯(λ≥400nm),光源与液面距离为20cm),每隔10min取3ml悬浮液,用0.22μm的针头过滤器过滤,并用高效液相色谱测定苯甲醇(ba)和苯甲醛(bad)的浓度(hplc,紫外检测器,进样体积20μl,流动相:乙腈/水=45/55(体积比),柱温30℃,流速1ml/min,检测波长248nm)。根据以下公式计算ba的转化率和bad的选择性:
[0085][0086][0087]
上式中,c0为ba的初始浓度,c
ba
和c
bad
分别为反应后ba和bad的浓度。
[0088]
根据上式计算得到cds1和0.2ce-cds苯甲醇的转化率分别为47.5%和94.2%,选择性为99%。由图10可以看出,通过ce对cds的掺杂改性可以有效提高苯甲醇的转化率,0.2ce-cds的转化率是cds1的2倍。随着光照时间的延长,苯甲醇的转化率增加,苯甲醛的选
择性一直维持为99%。
[0089]
实施例8
[0090]
考察不同质量比的ce-cds复合光催化剂对苯甲醇选择性氧化效果的影响。将实施例1~6中的光催化剂分别用于苯甲醇选择性氧化。根据cecl3·
7h2o的添加量分别命名为cds1、cds2、0.05ce-cds、0.1ce-cds、0.15ce-cds、0.2ce-cds、0.25ce-cds。活性测试步骤与实施例7相同。从图10中可以看出光照30min,cds1、cds2、0.05ce-cds、0.1ce-cds、0.15ce-cds、0.2ce-cds、0.25ce-cds苯甲醇的转化率分别为47.5%、38.1%、81.5%、86.9%、94.2%、89.8%。说明ce掺杂能有效提高苯甲醇的转化率,且随着掺杂量的变化苯甲醇的转化率变化不大,其中cecl3·
7h2o最优量为0.2g即cecl3·
7h2o和cds1的质量比为1:2.5(实施例1中的条件)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1