电磁阀、具有电磁阀的投递器及具有电磁阀与防拆保险的投递器的制作方法
[0001]
本新型系关于一种电磁阀控制之投递器,经由该电磁阀对气体压力之精确控制,而使该投递器能精确和轻易达成无针投递药物、生物性物质或保养品组合物至患者皮下之功效。
[0002]
先前技术
[0003]
随着医学美容(cosmetology)技术之进展以及各式医疗技术之演进,已发展出各式各样之美容及美妆产品组合物、抗老化产品等,但能将该等产品安全递送至目标物(如患者之皮肤)之方法甚为有限。一般坊间商业上可购得之电动按摩器具,其仅是将该等美容及美妆产品组合物、抗老化产品或具医疗效果之药物,以按摩之方式涂抹在患部上之皮肤,然后期待皮肤能自行吸收;然而其所得到之效果却极其有限,也往往浪费该等昂贵之美容及美妆产品组合物、抗老化产品或具医疗效果之药物。虽然后来亦有开发出一些雾化器产品,其号称能将欲递送之美容及美妆产品组合物雾化,而增加皮肤吸收之效果,但其仅是简单之将欲递送之物雾化,其效果亦无法被接受。
[0004]
虽然市面上亦有提供基因枪装置,可用来递送生物性物质,但其缺点为噪音太大,且其震波所产生之高速高压气体很容易杀死细胞,不容易控制其强度,因此有其危险性,不适合用于递送药物、生物性物质或保养品组合物至患者皮下。
技术实现要素:
[0005]
有鉴于此,本新型之目的系在提供一种新颖之电磁阀,及由该电磁阀控制之投递器,以构造简单使体积及压损较小之新颖电磁阀控制气体开关,而轻易达成无针投递药物或保养品至患者皮下之功效;且本新型之电磁阀控制之投递器,操纵简单、安全、节省成本、无需麻药,即可投递药品或保养品至患者皮下。
[0006]
本新型提供一种电磁阀,及具有该电磁阀之可递送化妆品组合物、生物性物质(dna或rna或蛋白质等)及药物之投递器,其包括:
[0007]
一喷嘴、一送料机构、一蓄压舱及一启动组件,或进一步包括一防拆保险;该喷嘴后上方系与该送料机构连接,及其后端系与该蓄压舱连接;该送料机构之下方系分别与该喷嘴及该蓄压舱连接;该蓄压舱前端系分别与该送料机构及该喷嘴连接;该电磁阀前端系与该蓄压舱连接;及该防拆保险系设置于该蓄压舱下方之一握把结构,以提供该握把结构上之该启动组件之保险功能。
[0008]
其中该构造简单和压损较小之新颖电磁阀机构包括:一电磁开关、一阀本体、一阀盖、一阀轴、一复位弹簧、一第一橡胶环、一第二橡胶环及一第三橡胶环;该阀本体与阀盖沿轴心固锁相连,并于阀本体与阀盖相连处设置第一橡胶环以确保不使气体泄漏,阀本体沿轴心线设置一轴孔提供复位弹簧及阀轴作动之空间;阀轴上设置一第二橡胶环及一第三橡胶环,第二橡胶环为防止阀门处气体泄漏,第三橡胶环使得轴孔可分隔前腔及后腔之压力;其后腔底部设置之复位弹簧将阀轴推向阀门以关闭出气。
[0009]
该电磁阀结构具一流体入口、阀门、第一流道、第二流道及排气孔,该流体入口与该前腔及第一流道连通,第二流道与后腔连通,排气孔与大气连通;电磁开关与该阀本体固锁相连,该电磁阀开关受控于电磁开关,电磁开关关闭时,使一第一流道和一第二流道连通,故使前腔及后腔气体压力平衡,因后腔较前腔多一复位弹簧之弹簧力,使阀轴抵住阀门,电磁阀关闭;电磁开关开启时,使第二流道和排气孔连通,后腔之压力与大气连通,使得后腔气体压力卸除,当前腔压力大于复位弹簧之弹簧力时电磁阀开启;该电磁阀利用该电磁开关,形成该阀轴之一前腔和一后腔间之一压力差,设计上该压力差需大于该复位弹簧之设计弹簧力量,而促使该阀轴移动,以执行该阀门开关之动作。
[0010]
该电磁阀内部流体路径设计上避免过多转折,使流体形成流畅之流体路径,可减少流体经流电磁阀之压力损失,简易机构设计仅需少量部件,使得本新型之电磁阀可使用于各种应用,如本新型之投递器或可携式基因枪等。此外,该流畅之流体路径,无转角设计,使得本新型之阀门较传统之阀门容易清理,因此可避免欲被递送之化妆品组合物、生物性物质及药物之间之交互污染。
[0011]
此外,该电磁阀气体流量系由该流体路径上之有效断面面积与阀门开口尺寸控制,有效断面面积即电磁阀内部流体路径之最小断面面积,其中该供气系统可为氮气供气系统或氦气供气系统。
[0012]
该蓄压舱系经由该电磁阀控制,当该电磁阀之该阀门开启时,该蓄压舱与该电磁阀连通,因此该蓄压舱被供应一气体至该蓄压舱中直至该气体建立一压力,该压力再将由该送料机构释出之该化妆品组合物、该生物性物质或该药物加速,而使该生物性物质或该药物经由该喷嘴送达一目标物;其中该压力系等同于该电磁阀之流体出口之压力(即阀门开启时,阀门处之压力);其中该气体为一氮气或一氦气;当该电磁阀之该阀门关闭时,该蓄压舱与电磁阀不连通。
[0013]
本新型投递器所递送之该生物性物质系选自于一核酸物质、一蛋白质、一病毒颗粒、一肉毒杆菌及其组合所组成之群组,而该药物系为一经皮吸收之药物;该化妆品组合物系选自于醇类、酯类、复合多醣体、坚果油及维生素及其组合所组成之群组。
附图说明
[0014]
图1为本新型一较佳实施例之投递器本体结构剖面示意图。
[0015]
图2为本新型一较佳实施例之电磁阀剖面示意图,图(a)为电磁阀关闭状态
-ꢀ
第一流道位置剖面、(b)为电磁阀关闭状态-第二流道位置剖面,图(c)为电磁阀开启状态-第一流道位置剖面、图(d)为电磁阀开启状态-第二流道位置剖面。
[0016]
图3为本新型一较佳实施例之防拆保险示意图。
[0017]
图4为图示电磁阀样品稳定流量测量之安装方式。
[0018]
图5为图示电磁阀样品压差测量之安装方式。
[0019]
图6为本新型电磁开关作动之示意图;图(a):电磁开关关闭示意图,图(b):电磁开关关闭示意图,图(c):电磁开关开启示意图;图(d)电磁开关开启示意图。
[0020]
符号说明:100投递器;101喷嘴;102送料机构;103蓄压舱;104握把结构;105启动组件;106防拆保险;107后端接头;108电磁阀;200电磁阀;201阀本体;201a第一流道;201b第二流道;201c排气孔;202阀盖;203复位弹簧;204阀轴;204a前腔;204b后腔;205电磁开
关;206 第一橡胶环;207第二橡胶环;208第三橡胶环;209流体入口;210阀门; 211轴心线;300防拆保险;301公端;302母端;303卡楯;401气体钢瓶; 402受测电磁阀;403气流方向;404连通管;405气体调压阀;406浮子式流量计;1000电磁开关;1001开关主体;1002线圈;1003动铁芯;1004 复位弹簧;1005第一流道;1006第二流道;1007排气孔;1008第一气密环;1009第二气密环;1010第三气密环;1011第四气密环;d可移动之距离;g衔接处。
具体实施方式
[0021]
为进一步阐明本新型,兹以下列实施例并配合图式,以详细说明本新型之构成内容及其所达成之功效。
[0022]
实施例一
[0023]
如图1所示,其图示本新型一较佳实施例之一种投递器100之本体结构部分。该投递器100至少包括一喷嘴(nozzle)101、一送料机构102、一蓄压舱103、一握把结构104、一启动组件105、一防拆保险106、一后端接头107及一电磁阀108。该后端接头107经电磁阀108连接一气体来源(如一高压气瓶),经由电磁阀108控制并提供一气体(如氮气或氦气)流入(如箭头所示之方向)蓄压舱103,随后该气体于蓄压舱103之空间内,建立一较高之预定压力后,藉由该压力将由送料机构102所释出之化妆品组合物、生物性物质(dna或rna 或蛋白质等)或药物加速,最后经由喷嘴101递送至目标物。蓄压舱103所使用之材料为坚固耐用之轻质金属,如铝合金、铝镁合金等。送料机构102及喷嘴 101所使用之材料则为生物兼容性金属,如不锈钢、不锈钢合金、钴合金或钛合金等。上述递送机制之作动,系经由握把结构104上之启动组件105所启动,而握把结构104上之防拆保险106则赋予保险之功能,防止误触启动组件105 所产生之不必要之递送。
[0024]
本新型较佳实施例中所递送之化妆品组合物、生物性物质或药物可使用不含携带颗粒之液体溶液或含携带颗粒之液体溶液,并利用一适当之压力将液体溶液均匀加速至所需之速度,而减少对目标物(如皮肤细胞)之损害。
[0025]
本新型投递器中之送料机构102,可设计成可定时和定量释出欲被递送之液体溶液,使得本新型投递器能更准确递送一定剂量之液体溶液至目标物。
[0026]
实施例二本新型之电磁阀工作原理
[0027]
如图2所示,本新型为构造简单和压损较小之电磁阀200,由一电磁开关 205来驱动,电磁开关205关闭时使第一流道201a及第二流道201b连通,使得阀轴204之前腔204a中之压力与阀轴204之后腔204b气体压力相等,因此阀轴 204前后腔之气体压力平衡,所以阀轴204静止不动,而使阀门210关闭。当电磁开关205开启时使第二流道201b及排气孔201c连通,此时阀轴204之后腔 204b中之压力通过第二流道201b由排气孔201c卸压,使得阀轴204之前腔204a 中之气体压力大于阀轴204之后腔204b中之气体压力,因此阀轴204利用此压力差向后运动,最后电磁阀200中之阀门210被打开,所以气体流通,即气体源中之气体流入第1图中之蓄压舱103。
[0028]
当电磁开关205关闭时,使第一流道201a与第二流道201b连通,此时阀轴 204之后腔204b之压力与阀轴204之前腔204a之压力相等,但复位弹簧203之弹簧力和阀轴204之后腔204b之压力大于阀轴204之前腔204a之压力,故将阀轴 204推向前,进而关闭阀门210,因此气体断流,即气体无法流入第1图中之蓄压舱103。
[0029]
由以上之说明可知,本新型之电磁阀优于一般之电磁阀之特点包括:
[0030]
1.流畅式流体路径设计,可避免流体经过电磁阀时之压力损失。
[0031]
2.简易式机构设计,使得电磁阀组成料件较少且组装简便,更有利于配合不同产品之客制化生产,如本新型之投递器。
[0032]
3.电磁开关205之功能为气流引导,故需选择符合功能需求之电磁开关搭配使用。
[0033]
如图6所示,符合功能需求之电磁开关1000机构包括:一开关主体1001、一线圈1002、一动铁芯1003、一复位弹簧1004、一第一气密环1008、一第二气密环1009、一第三气密环1010及一第四气密环1011;该电磁开关本体沿轴心线设置一轴孔提供复位弹簧1004、动铁芯1003作动之空间;动铁芯1003上设置一第一气密环1008、一第二气密环1009、一第三气密环1010及一第四气密环1011,为确保不使气体泄漏。当线圈1002通电时产生电磁力,使动铁芯 1003克服弹簧力,因此第二流道1006与排气孔1007连通;当线圈1002断电时电磁力消失,动铁芯1003在弹簧力的作用下复位,因此第一流道1005与第二流道1006连通。
[0034]
实施例三
[0035]
如图3所示,本新型之防拆保险300包括一公端301和一母端302,公端301 和母端302利用紧配合条件,使得两者被紧密结合,此外于公端处可另外锁上一螺丝,避免公端301和母端302彼此脱离。于公端301和母端302间设置一卡楯303(如o型扣环)。结合后之防拆保险300,有一可移动之距离d,当于公端 301处往下推时,其移动距离d至一定位,此时卡楯303会卡住启动组件105(图 1),使启动组件105无法被按压;当于公端301处往上推时,其移动距离d至一定位,此时卡楯303会离开启动组件105(图1),使启动组件105可被按压。
[0036]
防拆保险300之公端301和母端302之衔接处g,其表面有一经设计之齿纹,以增加两端结合之摩擦力。若欲强行使用工具分离公端301和母端302,该齿纹随即会被破坏,无法再将两端结合,而由此达成本新型防拆保险300 之防拆功能。
[0037]
其他电磁阀样品稳定流量与压差测量
[0038]
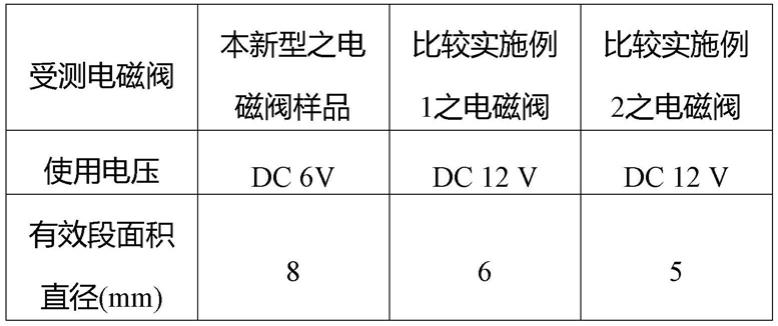
表1受测电磁阀
[0039][0040]
比较实施例1=smc(商品名),比较实施例2=ckd(商品名)
[0041]
测量稳定流量
[0042]
使用工具:浮子式流量计、氮气、气体调压阀及气管。
[0043]
测量方法说明:
[0044]
安装方式如图4所示,在氮气瓶上安装气体调压阀,并连接气管至浮子式流量计,在流量计另一端接上气管并连接受测之电磁阀,完成测量前安装作业。开启氮气瓶,触发受
测电磁阀,并将气体调压阀出气端压力设定在15psi,观察流量计之浮子稳定于哪一刻度。
[0045]
水位高度差测试
[0046]
使用工具:氮气、气体调压阀、气管、连通管及卷尺(用于记录水位高度)。
[0047]
测量方法说明:
[0048]
安装方式如图5所示,安装完成后,开启氮气气瓶、触发受测电磁阀,逐渐将气体调压阀出气端压力调至5psi,记录两端水位高度差。
[0049]
测试结果:
[0050]
表2稳定流量量测数据
[0051][0052]
表3水位高度差量测数据
[0053][0054]
结论
[0055]
经测试,发现比较本新型之电磁阀在流量方面有最佳表现;且水位高度差量测数据中得知压力损失在受测电磁阀中为最小。
[0056]
投递器施打膜联蛋白a2(anxa2)
[0057]
表4实验组别
[0058][0059]
(1)以pbs配置浓度5μg/20μl膜联蛋白a2之溶液。
[0060]
(2)将c57bl/6老鼠秤重并固定,于鼠蹊部以针筒施打水合氯醛(chloralhydrate)5%,剂量为0.2ml/20g。
[0061]
(3)将老鼠腹部剃毛,并以原子笔于胸腹部画十字表投递器之施打范围。
[0062]
(4)依照表4之实验组别进行施打后,再以co2进行牺牲。
[0063]
(5)以原子笔画之线条取下皮肤及肌肉,用夹片固定防止蜷曲后,浸泡至 30%酒精进行脱水,并逐步增加酒精浓度经直至纯酒精为止。
[0064]
(6)以石蜡包埋作组织切片,并进行组织免疫染色,最后以光学显微镜观察。
[0065]
表5膜联蛋白a2施打结果
[0066][0067]
投递器在20至100psi之压力条件下,皆可以将膜联蛋白a2投递至真皮层,其投递深度并不受压力条件改变之影响,其中于50、60或70psi之投递压力条件下,其呈现之投递效果最佳,80psi之压力条件则膜联蛋白a2 之表现量减少(表5)。
[0068]
投递器随着压力条件之改变(20至100psi之间),皆能将药物(膜联蛋白 a2)投递至真皮层,尤其是50至70psi之间之效果最佳,故最佳为以选择压力条件50至70psi之间进行药物递送。
[0069]
投递器施打pcmv-β-galactosidase dna(巨细胞病毒质体-β-半乳糖苷酶脱氧核糖核酸)
[0070]
测试方法:
[0071]
(1)以ddh2o(双蒸水)配制金粒包覆1μg pcmv-β-galactosidase vector(巨细胞病毒质体-β-半乳糖苷酶载体)溶液。
[0072]
(2)将c57bl/6小鼠小鼠秤重并固定,于鼠蹊部以针筒施打水合氯醛(chloral hydrate)5%,剂量为0.2ml/20g。
[0073]
(3)将老鼠腹部进行剃毛,透过投递器对小鼠于50psi压力下施打20μl pcmv-β-galactosidase vector溶液和金粒包覆pcmv-β-galactosidase vector溶液。
[0074]
(4)于48小时后,将老鼠进行牺牲,并取下老鼠腹部皮肤进行石蜡切片。
[0075]
测试结果:
[0076]
该结果显示基因投递于48小时之后,β-galactosidase(β-半乳糖苷酶)基因表现于真皮层与表皮层之间,证明本新型之投递器进行基因投递,其最深深度可以达到真皮层。因此,此结果亦显示本新型之投递器应用于基因治疗或dna疫苗接种方面,亦可以有效产生反应。
[0077]
投递器施打人类生长激素
[0078]
测试方法:
[0079]
(1)以生理食盐水配制40μg/10μl之生长激素溶液。
[0080]
(2)将c57bl/6小鼠小鼠秤重并固定,于鼠蹊部以针筒施打水合氯醛(chloral hydrate)5%,剂量为0.2ml/20g。
[0081]
(3)将老鼠腹部进行剃毛,透过本新型之投递器对小鼠于60psi压力下施打 200μl人类生长激素(100μl之剂量设定条件,施打2次),或透过传统注射器进行注射。
[0082]
(4)于第2、4、8小时后,对老鼠进行抽血。
[0083]
(5)透过elisa kits(酵素结合免疫吸附分析法试剂组)分析其第2、4、8小时之血液中生长激素变化水平。
[0084]
测试结果:
[0085]
无论是透过本新型之投递器或传统式注射器施打生长激素,皆可以促使血液中之生长激素浓度水平上升许多;但也显示于传统式注射器的注射条件下,其血液中生长激素之浓度水平于第2小时即上升起来,浓度略高于本新型之投递器投递组别。即使如此,在第4、8小时之结果却显示本新型之投递器投递组别之血液生长激素浓度明显高于传统式注射器之组别,甚至随着时间之增加,差距越来越大。因此,本新型之投递器之递送效果,基本上系优于传统式注射器。
[0086]
luciferase蛋白(荧光素酶蛋白)投递结构破坏性测试
[0087]
测试方法:
[0088]
(1)将2.4ng/μl luciferase蛋白溶液透过含有1mg/ml bsa(牛血清白蛋白)之1x 裂解缓冲溶液(lysis buffer)稀释成浓度0.01ng/μl。
[0089]
(2)100μl luciferase蛋白溶液透过本新型之投递器分别以40至80psi投递至50 ml离心管中。而控制组则是未经过本新型之投递器投递之稀释luciferase蛋白溶液。
[0090]
(3)每个组别各取50μl与50μl bglar(荧光素酶测定试剂盒)进行均匀混合,并进一步测量其冷光值。
[0091]
(4)破坏百分率计算公式,其公式如下:
[0092]
破坏百分率(%)=(控制组(control)之rlu(相对光单位)值-基因枪施打回收液体之rlu值)/控制组(control)之rlu值
×
100%。
[0093]
测试结果:
[0094]
表6
[0095][0096]
破坏率(%)1.546934005 0.87034706 0.787516 0.583416 0.106939
[0097]
表6显示luciferase活性之破坏率于40psi至80psi时,随着压力之增加,对投递物质之破坏率也随之增加,但于80psi时之破坏率仍仅为1.55%。故根据本新型之投递器于压力范围40至80psi下进行操作,对投递物质之破坏性系不大。
[0098]
luciferase蛋白投递后之半衰期测试
[0099]
测试方法:
[0100]
(1)以ddh 2
o配制金粒包覆1μg pgl3-luciferase vector(荧光素酶基因质体3-荧光素酶载体)溶液,以及
[0101]
1、3、10μg pgl3-luciferase vector溶液。
[0102]
(2)将c57bl/6小鼠秤重并固定,于鼠蹊部以针筒施打水合氯醛(chloral hydrate)5%,剂量为0.2ml/20g。
[0103]
(3)将老鼠腹部进行剃毛,透过本新型之投递器对c57bl/6小鼠于60psi裸脱氧核糖核酸(naked dna)压力下施打20μl pgl3-basic vector(荧光素酶基因质体3-基础载体)溶液和金粒包覆pgl3-luciferase vector溶液,以及各浓度之pgl3-luciferase vector溶液。
[0104]
(4)于24、48、72、96、120、144、168小时的时候,对老鼠进行抽血,并分离出血清。
[0105]
(5)以bglar试剂组(bglar kits)分析血液中luciferase(荧光素酶) 的表现量。
[0106]
测试结果:
[0107]
透过本新型之投递器投递金粒包覆基因或裸露基因入老鼠体内后,金粒包覆方式投递或裸露方式投递之luciferase基因于24小时内即达到最高表现量。金粒包覆之投递方式下,此时其表现量高于裸露基因投递方式之组别。但换成时间依赖性之模式下进行观察,结果却显示裸露基因方式之投递下,其活性却比金粒包覆投递方式之活性高,甚至于168小时仍具有活性。因此,此结果显示出以本新型之投递器投递dna疫苗,裸露投递方式比金粒包覆投递方式之半衰期长。
[0108]
综上所述之实施例,仅是本新型之较佳实施例,并非对本新型做任何形式上之限制,任何所属技术领域中具有通常知识者,若在不脱离本新型所提技术方案之范围内,利用本新型所揭示技术内容所作出局部更动或修饰之等效实施例,并且未脱离本新型之技术方案内容,均仍属于本新型技术方案之范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1