一种荧光分析方法和装置与流程
本发明属于体外检测技术领域,具体地涉及一种基于测量荧光强度的分析方法和装置。
背景技术:
在免疫检测领域中,常常需要对各类抗原或抗体进行定性或定量检测。现有技术中,以“竞争抑制和双抗夹心”为基础衍生出多种免疫反应分析方法,如:放射免疫法、酶联免疫法、化学发光法、时间分辨荧光法和荧光免疫法等,可用于确定病原微生物,对人体的特异性蛋白定量检测,从而对疾病进行辅助诊断或监测等等,用途非常广泛。这类免疫反应分析方法,通常将捕获抗体固定于固相载体,然后与抗原(目标蛋白)反应,洗涤后再与标记抗体反应,洗涤,最后检测放射性强度、溶液吸光度或光信号等,从而报告检测样本中目标蛋白的浓度。上述方法的自动化免去了人工洗涤的烦琐,但正因为自动化,使得仪器体积庞大价格昂贵,一般只在大型实验室使用。1990年,Beggs等综合胶体金和免疫分析技术,建立了胶体金免疫层析法(GICA),用于检测人尿和血清中的HCG(BEGGSM,NOVOTNYM,SAMPEDROS.Aselfperformingchromatographicimmunoassayforthequalitativedeterminationofhumanchorionicgonadotrophin(HCG)inurineandserum[J].ClinChem,1990,36:1084-1085)。此后20年,人们在GICA的基础上,开发出了用于病原体(CN03115143.4)、激素(CN200610014168.3)、心脏标志物(CN200410011165.5)、肿瘤标志物(CN200510104796.6)、自身免疫病标志物(CN200410027291.X)等的检测试剂;同时也应用到食品、环境(CN03116692.X)和兽医(CN02139704.X)领域。由于该方法只需肉眼观察即可,非专业人士也可操作,使急诊、基层医院、病人床边和现场等远离大型实验室的地方开展相关检测成为可能,所以应用范围相当广泛。虽然这种免疫分析技术已经超过20年的发展,但其基本的工作原理并未改 变,这决定了到目前为止,它只用于定性或半定量检测(根据检测线灰度深浅定量),且灵敏度也不如前述的定量免疫分析方法,其进一步的应用遇到了瓶颈。因此,本领域急需对现有的胶体金层析方法进行变革,在赋予其高灵敏度和定量准确的新优势的同时,保持其快捷、简便、成本低廉等特点,从而进一步扩展其应用领域。
技术实现要素:
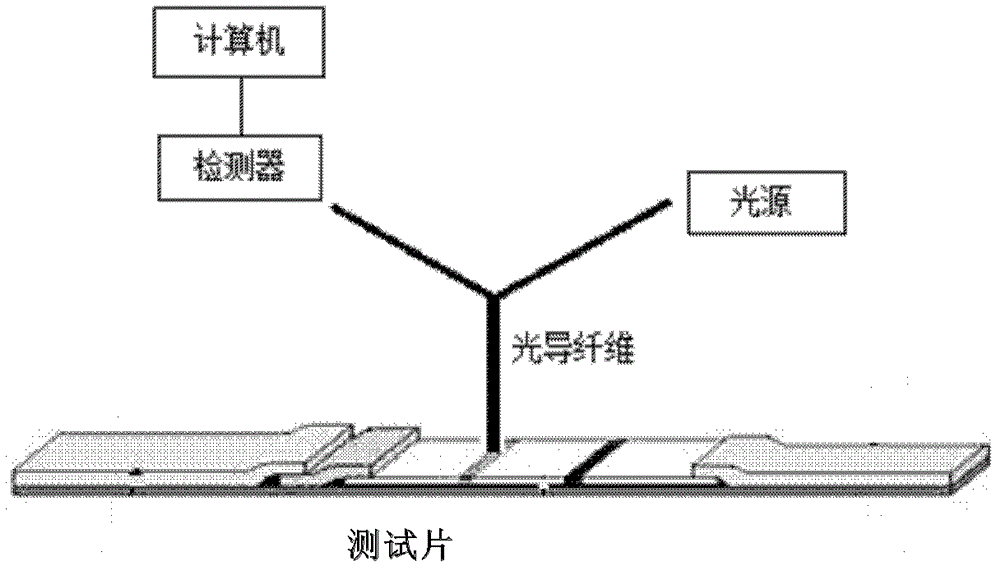
本发明提供了一种测试片,用于定量检测样品中的待测物。本发明提供了一种定量检测待测物的检测方法,所述方法灵敏度高,定量准确。本发明还提供了一种定量检测待测物的检测装置。本发明第一方面提供了一种测试片,该测试片包括:(i)可加入样品的加样区;(ii)位于加样区近端的结合区,所述结合区包含:一种或多种可流动的结合剂,所述结合剂中至少一种被吸光物质标记,所述结合剂能与待测物或其等同物结合形成含吸光物质的复合物;(iii)位于结合区近端和加样区远端的测试区,所述测试区包含固定化的捕获剂,所述捕获剂用于捕获从结合区移动至测试区的被吸光物质标记的结合剂或含吸光物质的复合物,所述测试区具有荧光;和(iv)位于测试区近端和结合区远端的样品吸收区,其中吸收区具有吸收能力,从而使得加至加样区的样品从加样区扩散至末端样品吸收区;其中,当所述捕获剂捕获所述被吸光物质标记的结合剂或所述含吸光物质的复合物时,所述吸光物质影响所述测试区的荧光强度。在另一优选例中,所述测试区的荧光为所述测试片的自有荧光。在另一优选例中,所述的吸光物质影响所述测试区的荧光强度是导致测试区的荧光强度下降。在另一优选例中,所述待测物为抗原或抗体。在另一优选例中,所述结合剂特异性结合待测物或其等同物;较佳地,所述结合剂为抗原、抗体或寡核苷酸。在另一优选例中,所述结合区可以包含两种结合剂,其中,一种被吸光物 质标记的结合剂,另一种被生物素标记的结合剂,所述两种结合剂同时与待测物结合,从而形成一种被生物素标记的含吸光物质的复合物。在另一优选例中,所述含吸光物质的复合物可以含有待测物,也可以含有待测物等同物。在另一优选例中,所述捕获剂特异性结合被吸光物质标记的结合剂或含吸光物质的复合物。在另一优选例中,所述捕获剂为链亲和素、待测物的抗体或待测物的等同物。在另一优选例中,所述结合剂的数量大于所述待测物的数量;所述捕获剂的数量大于从结合区移动至测试区的被吸光物质标记的结合剂或含吸光物质的复合物的数量。在另一优选例中,所述的待测物包括:蛋白、核酸或小分子化合物。在另一优选例中,所述的待测物是液相(溶液)、悬浮液或固相。在另一优选例中,所述的待测物包括肿瘤标志物、心肌标志物等特异性的蛋白。在另一优选例中,所述测试片自有荧光的激发或发射光谱与所述吸光物质的吸收光谱全部或部分重叠。在另一优选例中,所述的吸光物质选自下组:胶体金、纳米金棒、纳米银棒或其组合。在另一优选例中,所述的胶体金是平均粒径为10-70nm的胶体金颗粒。在另一优选例中,在测试区和样品吸收区之间还包含至少一个对照区,所述对照区含有固定化的对照剂,其中,所述对照剂用于特异性结合被吸光物质标记的结合剂。在另一优选例中,所述对照区用于揭示待测物的检测结果的有效性。本发明第二方面提供了一种定量检测待测物的荧光分析方法,包括步骤:(1)将待测物样品加至本发明第一方面所述的测试片的加样区;(2)测量所述测试片的测试区的荧光强度,从而换算为待测物的数量。本发明第三方面提供了一种定量检测待测物的荧光分析方法,包括步骤:(a)提供一本发明第一方面所述的测试片;(b)将待测物样品加至所述测试片的加样区;(c)样品中的待测物移动至结合区,与其中的被吸光物质标记的结合剂结 合,从而形成可流动的含有吸光物质的复合物;(d)步骤(c)中剩余的被吸光物质标记的结合剂或步骤(c)得到的可流动的含有吸光物质的复合物移动至测试区,与其中的捕获剂结合,从而形成固定于测试区的含有吸光物质的复合物;(e)测量所述测试区的荧光强度,从而换算为待测物的数量。在另一优选例中,所述测试区的荧光为所述测试片的自有荧光。在另一优选例中,当捕获剂结合步骤(c)中剩余的被吸光物质标记的结合剂时,所述捕获剂为所述结合剂的抗体或抗原、或为待测物等同物。在另一优选例中,当待测物样品为固相时,步骤(b)还包括加入溶剂(如水或缓冲液)。在另一优选例中,在步骤(2)或步骤(e)中,将测试区与对照区中间处的荧光强度F2与测试区的荧光强度F1的比值,和标准曲线进行比较,从而确定待测物的数量;或者将测试区的荧光强度F1和标准曲线进行比较,从而确定待测物的数量。在另一优选例中,所述的方法还包括用已知浓度的待测物标准品进行测量,从而制作标准曲线的步骤。本发明第四方面提供了一种检测试剂盒,所述试剂盒包括:一本发明第一方面所述的测试片;和使用说明书。本发明第五方面提供了一种定量检测待测物的荧光测量装置,所述的装置包括:(a)一本发明第一方面所述的测试片;(b)一用于检测荧光强度的检测器;和(c)描述使用方法的使用说明。在另一优选例中,所述装置还包括光源和计算机。所述光源通过光导纤维照射到检测线处,激发出的荧光通过光导纤维进入检测器,由计算机进行数据处理和分析。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1是测试片示意图。图2是检测装置示意图。图3是实施例1的AFP标准系列浓度(C)与相应荧光强度比值(F2/F1)标准曲线图。图4是实施例2的CRP标准系列浓度的对数值(lgC)与相应荧光强度比值的对数值lg(F2/F1)标准曲线图。具体实施方式本发明人通过长期而深入的研究,发现了一种基于荧光淬灭原理的检测方法,所述方法不仅可以通过目测测试区的颜色来判断是否含有待测物;还可以通过测量测试区荧光强度的方式来定量检测待测物,上述方法可以直接通过淬灭物质对测试区的自有荧光强度的影响,从而测定待测物的数量。所述方法不仅具有灵敏度高,定量准确的优点,而且操作仍然十分简便、快捷、且成本低廉。所述方法是基于本发明提供的一种测试片,通过一种含有光源和检测器的装置实现了对待测物的定量检测。在此基础上,发明人完成了本发明。测试片现在更详细地描述用于制造本发明测试片的方法和材料。应注意,测试片的具体构造可以变化,这取决于意图用测试片来进行的具体测试。在实施例之外制造测试片的变动方法,也落于本发明范围之中。如图1所示,测试片1可包括背衬片2,其长度与测试片相同。加样区3位于测试片的一端,样品垫片31位于加样区,可通过粘合剂粘贴于加样区。吸收区7位于测试片的另一端,在加样区的远端,吸水垫片71位于吸收区。结合区4位于加样区和吸收区之间,在加样区的近端和吸收区的远端,结合垫片41位于结合区。测试区5(也称检测线)位于结合区和吸收区之间,通常测试区设置在膜片56上,通过所述膜片连接结合垫和吸水垫。优选地,所述膜片上还设置有对照区6(也称质控线),对照区位于测试区和吸收区之间,也可以位于测试区和结合区之间,并与测试区之间有适当的空间。测试片制造方法,优选地,如图1所示,分别将样品垫片、结合垫片、膜片、吸水垫片通过粘合剂粘贴于背衬板上,即得所述测试片。背衬片可以用任何稳定的、无孔的材料制成,其强度应足以支承材料和粘于其的测试片。因为许多测定用水作为扩散介质,因此背衬片较佳地是基本上不透水的。在一个优选例中,背衬片是用聚合物膜制成的,更佳地是用聚氯乙烯膜制成的(如PVC胶板)。样品垫片可用任何吸收性材料制成。可使用的材料例子包括:纤维素、硝酸纤维素、乙酸纤维素、玻璃纤维、尼龙、聚电解质离子交换膜、丙烯共聚物/尼龙、和聚醚砜。结合垫片或膜片可以用任何材料制成,只要该材料有足够孔隙度从而允许在表面和内部发生流体的毛细管作用。结合垫片或膜片应有足够的孔隙度,从而允许涂有抗体或抗原的颗粒移动。结合垫片或膜片还可被含待检测分析物的样品中所用的液体润湿(例如,对于水性液体具有亲水性,对于有机溶剂具有疏水性)。通过例如在美国专利No.4,340,482或No.4,618,533中所述的方法(这些方法描述了将疏水表面转变成亲水表面),可以改变其疏水性从而使其具有亲水性以便用于水性液体。可用于制造结合垫片或膜片的材料例子包括:聚脂膜、纤维素、硝酸纤维素、乙酸纤维素、玻璃纤维、尼龙、聚电解质离子交换膜、丙烯共聚物/尼龙、和聚醚砜(polyethersulfone)。在一个优选例中,结合垫片是用聚脂膜制成的,膜片是用硝酸纤维素制成的。吸收垫片可以用任何能吸收作为样品和缓冲液的液体的材料制成。吸收垫片的吸收能力应足够大,以便吸收添加至测试片的液体。适用于吸收垫片的材料的例子包括纤维素和玻璃纤维。检测方法本发明测试片可用于大量不同的侧流分析方法,而这些分析方法涉及使用一种或多种可流动的结合剂和一种固定化的捕获剂,以及利用测试区自有的荧光强度的变化。优选地,所述方法包括步骤:(1)将待测物样品加至本发明所述的测试片的加样区;(2)测量所述测试片的测试区的荧光强度,从而换算为待测物的数量。在加样后,样品中的待测物移动至结合区,所述结合区含有结合剂,所述 待测物与其中的结合剂结合,从而形成含吸光物质的复合物;接着,剩余的含吸光物质的结合剂和结合区中形成的含吸光物质的复合物移动至测试区,与其中的捕获剂结合,从而形成富集有吸光物质的测试区。具体地,当所述富集在测试区的吸光物质影响(部分淬灭或全部淬灭)所述测试区的荧光强度(测试片自有荧光)时,本发明的检测方法即可通过检测测试区荧光强度来测定待测物的数量。待测物或其等同物如本文所用,术语“待测物”、“其等同物”或“分析物”指待用测试片检测以及可任选地被定量测定的、样品中的任何组份,待测物或其等同物或分析物的例子包括:蛋白质,如激素或其他分泌蛋白质、酶和细胞表面蛋白;糖蛋白;肽;小分子;多糖;抗体(包括单克隆抗体或多克隆抗体及其片段);核酸;药物(包括地高辛等强心甙类药物);毒素;毒品;病毒或病毒颗粒;细胞壁组份;或其他具有表位的化合物。优选地,所述的待测物包括肿瘤标志物、心肌标志物等特异性的蛋白,所述肿瘤标志物选自下组:甲胎蛋白(AFP)、C-反应蛋白(CRP)、癌胚抗原(CEA)、癌抗原125(CA125)、糖抗原19-9(CA19-9)、总前列腺特异性抗原(PSA)、游离前列腺特异性抗原(f-PSA)、神经原特异性烯醇化酶(NSE)、糖链抗原(CA242)、癌抗原(CA15-3)、或人绒毛膜促性腺激素(β-HCG)。结合剂本发明所用的结合剂可以是任何能够结合于待测物或其等同物的物质。具体地,为特异性结合待测物或其等同物的物质。所述结合剂中至少一种是被吸光物质标记,所述结合剂能与待测物或其等同物结合形成含吸光物质的复合物;有各种不同类型的分子可用作分析物结合剂,其中包括例如:寡核苷酸、抗体、工程化蛋白、肽、半抗原、或含有抗原(该抗原具有分析物结合位点)的异源混合物的裂解物。P.Holliger等人,TrendsinBiotechnology13:7-9(1995);S.M.Chamow等人,TrendsinBiotechnology14:52-60(1996)。如果待检测分析物是配体,那么可使用结合于该配体的受体,反之亦然。优选地,所述的待测物或其等同物是抗原,且所述的结合剂是可结合于所 述抗原的抗体;或者所述的待测物或其等同物是抗体,且所述的结合剂是可结合于所述抗体的抗原或所述抗体的抗体(抗抗体)。捕获剂本发明所用的捕获剂可以是任何能结合含吸光物质的复合物和/或结合剂的物质,包括例如:抗体、工程化蛋白、肽、半抗原、或含有抗原(该抗原具有分析物结合位点)的异源混合物的裂解物。所述捕获剂用于捕获从结合区移动至测试区的含吸光物质的复合物和/或剩余的被吸光物质标记的结合剂,从而使得吸光物质富集在测试区。优选地,可以通过抗原和抗体的结合或寡核苷酸与互补核酸单链特异性结合的方式或通过生物素(biotin)和链亲和素(Streptavidin,SA)的结合方式,将捕获剂与含吸光物质的复合物和/或剩余的被吸光物质标记的结合剂结合,从而将吸光物质富集混合于测试区。所述捕获剂和含吸光物质的复合物或剩余的被吸光物质标记的结合剂的结合为特异性结合。优选地,所述的捕获剂是链亲和素、待测物的抗体或待测物等同物。吸光物质的选择用于本发明的吸光物质应有较宽泛的紫外可见甚至红外吸收光谱,总的原则是其吸收光谱与测试片自有荧光的激发或发射光谱部分或完全重叠。最优的是完全重叠,如此会有较高的检测灵敏度。代表性的吸光物质包括(但并不限于):胶体金、纳米金棒、纳米银棒等组合,它们的吸收光谱范围为300~1000nm不等,只要所选吸光物质的吸收光谱与测试片自有荧光激发或发射光谱重叠即可。胶体金颗粒可用任何常规方法制造,例如总结于G.Frens,1973NaturePhysicalScience,241:20(1973)中的方法。其他方法描述于美国专利No.5,578,577、5,141,850、4,775,636、4,853,335、4,859,612、5,079,172、5,202,267、5,514,602、5,616,467、5,681,775。如本文所用,术语“纳米金棒”指具有一定纵横比、且横轴和纵轴处于5-200纳米范围的金颗粒。一种特别优选的吸光物质是胶体金,尤其是粒径为20-40nm的胶体金。荧光淬灭原理含吸光物质标记的物质,被测试区的捕获试剂捕获后,含吸光物质标记的物质会在测试区富集,当测试片自有荧光的激发或发射光谱与该吸光物质的吸收光谱全部或部分重叠时,因共振能量转移,吸光物质会对测试片自有荧光产生淬灭作用,即淬灭测试区的荧光强度。工作原理现结合图1和具体的实施方式说明本发明检测方法的工作原理:利用膜片56本身的自有荧光。检测线处固定能与结合剂结合的物质(即捕获剂)。所述结合剂位于结合垫片,可流动。所述结合剂被样品溶解后,在层析过程中与样品中的待测物或其等同物结合形成含吸光物质的复合物,所述复合物流经检测线时被捕获,待测物越多,被捕获的所述复合物也就越多。具体地,当所述复合物(部分淬灭或全部淬灭)影响所述膜片检测线处的荧光强度时,即可通过检测荧光强度来测定待测物的数量。本发明在此提供了基于上述原理的如下优选方法:方法一:(1.1)样品加在玻璃纤维样品垫片上,样品中的待测物(如抗原)在毛细作用下向吸水垫片方向移动,途经载有结合剂(如针对抗原的金标抗体、biotin标记的抗体)的结合垫片后,将所述结合剂完全复溶,层析过程中抗原与结合剂形成“金标抗体-抗原-biotin抗体”的3元复合物,被检测线处的捕获剂(如Streptavidin)捕获;3元复合物中的金淬灭膜条检测线处的自有荧光。(1.2)多余的游离金标抗体继续前移,被固定在质控线处的对照剂(如抗金标抗体的抗体)捕获,呈现红色,说明检测有效。(1.3)分别测定膜条检测线处的荧光强度F1及检测线与质控线中间处的荧光强度F2,计算F2/F1的值,值越大说明待测物浓度越高,反之则越低;如样本中无待测物时,不能形成3元复合物,则F2/F1≈1。方法二:将捕获剂(如针对待测物中抗原的捕获抗体)固定于检测线处。(1.1)样品加在玻璃纤维样品垫片上,样品中的待测物(如抗原)在毛细作用下向吸水垫片方向移动,途经载有结合剂(如抗原的金标抗体)的结合垫片后,将所述结合剂完全复溶,层析过程中抗原与结合剂形成“金标抗体-抗原”的2元复合物,被检测线处的捕获抗体捕获;2元复合物中的金淬灭膜条检测线处的自有荧光。(1.2)多余的游离金标抗体继续前移,被固定在质控线处的对照剂(如抗金标抗体的抗体)捕获,呈现红色,说明检测有效。(1.3)分别测定膜条检测线处的荧光强度F1及检测线与质控线中间处的荧光强度F2,计算F2/F1的值,值越大说明待测物浓度越高,反之则越低;如样本中无待测物时,不能形成2元复合物,则F2/F1≈1。本发明还适用于竞争抑制法:(1.1)将待测物的等同物固定于检测线处作为捕获剂,结合剂的抗体固定于质控线处;(1.2)将结合剂(如金标抗体)滴加于附图1的结合垫片处,样品加在玻璃纤维样品垫片上,其中的待测物(如抗原)向吸水垫片方向移动,途经载有所述结合剂的结合垫片并将其完全复溶,液体前行过程中,样品中的待测物和结合垫片上的结合剂形成金标抗体-抗原的“第1二元复合物”;(1.3)剩余的结合剂前行至膜片56的检测线处,与待测物的等同物形成金标抗体-待测物等同物的“第2二元复合物”而被捕获,待测物浓度越高,形成的“第2二元复合物”越少,相应地,被捕获的“第2二元复合物”越少;(1.4)未被捕获的结合剂与“第1二元复合物”继续前行,被质控线处结合剂的抗体捕获,质控线显示红色,试验有效;(1.5)分别测定膜条检测线处的荧光强度F1及检测线与质控线中间处的荧光强度F2,计算F2/F1的值,值越大说明待测物浓度越小,反之则越大。检测装置现结合图2说明本发明的检测装置:如图2所示,所述装置可以包括:测试片、检测器、光源、光导纤维和计算机。还可以包括一份检测方法的使用说明。其中测试片的工作原理如上所述, 荧光强度的检测方法可以如下所述(但不仅限于此),任何可用于检测荧光强度的方法均可用于本发明的检测装置。荧光强度的检测光源通过光导纤维照射到检测线处,激发出的荧光通过光导纤维进入检测器,所得到的数据由计算机进行处理和分析。所述光导纤维可以是Y型的,分别连接于光源、检测线和检测器。本发明中,光源用于提供某一发射波长的光线,从而激发测试片发出荧光。可选用任何可以提供合适波长的光源,包括(但不限于):LED、氙灯、卤钨灯、激光等。一种优选的光源是激光光源,激光光源可用本领域常规的方法和设备(如激光器)产生。代表性的激光器包括(但并不限于):半导体激光器、氦氖激光器、氩离子激光器、还包括波长可选的激光器、多波长激光器和双波长激光器等。激光器产生的激光波长与激光介质有关,常见的激光波长见下表1:表1激光种类波长(纳米)氩氟激光(紫外光)193氪氟激光(紫外光)248氙氯激光(紫外光)308氮激光(紫外光)337氩激光(蓝光)488氩激光(绿光)514氦氖激光(绿光)543氦氖激光(红光)633罗丹明6G染料(可调光)570-650红宝石(CrAlO3)(红光)694钕-钇铝石榴石(近红外光)1064本发明中的检测器可以是(但不限于)光电倍增管、CCD或光电池等。标准曲线在本发明中,可以直接通过测定检测线处的荧光强度,从而确定所述待测物的数量;也可以通过测定检测线处的荧光强度F1和检测线与质控线中间处的荧光强度F2,计算F2/F1的值,从而确定所述待测物的数量。在优选例中,可通过与标准曲线进行比较,从而获得定量结果。标准曲线可用以下方法获得:将已知的不同浓度(C)的待测物样品通过上述检测方法后,分别测量其在检测线处的荧光强度(F),将各浓度(C)或其对数值(logC或lgC)和相应的荧光强度(F)或其对数值(logF或lgF)作图,得到标准曲线;或者将已知的不同浓度(C)的待测物样品通过上述检测方法后,分别测量其在检测线处的荧光强度(F1),检测线与质控线中间处的荧光强度F2,计算F2/F1的值,将各浓度(C)或其对数值(logC或lgC)和相应的荧光强度比值(F2/F1)或其对数值(logF2/F1或lgF2/F1)作图,得到标准曲线。本发明的主要优点有:(1)本发明提供了一种测试片。(2)本发明提供了一种上述测试片的检测方法,所述方法基于荧光淬灭原理,通过测量测试片自有荧光强度测定待测物的数量,所述方法快捷、简便、成本低廉,而且灵敏度高,定量准确。(3)本发明还提供了一种检测装置,所述装置基于上述检测方法,可广泛用于定量检测领域。下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(NewYork:ColdSpringHarborLaboratoryPress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。实施例试剂和设备:针对AFP的1对单克隆抗体(Ab1和Ab2),市售品;针对C-反应蛋白(CRP)的单克隆抗体,市售品;CRP抗原,市售品;AFP抗原购自Biodesign;30nm的胶体金,市售品;Streptavidin(SA),市售品;小牛血清白蛋白(BSA),市售品;Biotin,市售品;检测器:USB4000-FL(美国海洋光学公司);光源:532nm激光光源。实施例1:血清中甲胎蛋白(AFP)的检测(利用膜片的自有荧光)1、金标抗体的制备1.1胶体金-抗体保存液四硼酸钠0.1g小牛血清白蛋白(BSA)0.25gNaN30.025g加水溶解后用6NHCl调pH至7.4,补水至250ml,用0.45μm滤膜过滤后,4~8℃保存。1.2工作液Na2HPO4·12H2O6.1gNaCl8.5gPVP405.0g硼酸2.1gPEG1.0g10%BSA50mlNaN30.2g加水溶解后用6NHCL调pH至7.0~7.5补水至1000ml,用0.45μm滤膜过滤后,4~8℃保存。1.3金标抗体(Gold-Ab1)的制备1.3.1取20~30nm颗粒胶体金液20ml,在磁力搅拌下缓慢加入已纯化的Ab1抗体1.0ml(0.6mg/ml),在室温下搅拌30min;1.3.2加10%的BSA0.8ml(终浓度0.4%),室温搅拌5min;1.3.3加10%的PEG0.4ml(终浓度0.2%),室温搅拌5min;1.3.412000~1500r/min离心60~40min,小心吸离心上清,沉淀溶于0.5ml保存液中,金标抗体的光密度(O.D)约为100O.D,其中Ab1抗体的浓度为1mg/ml,置4℃保存备用;2.biotin标记Ab22.1Ab2预处理2.2取上述预处理的Ab210μL,加入25μL的1mg/mlNHSS-BiotinDMSO溶液,混匀,4℃冰箱避光反应2小时,透析过夜备用。3.SA点膜与上载Gold-Ab1、biotin-Ab2取SA1mg/ml的磷酸盐缓冲液(pH7.2)0.5μl点在附图1检测线位置,避光室温干燥;取Gold-Ab1、biotin-Ab20.5μl滴加在附图1的结合垫片上。4.标准曲线制备4.1用工作液配制AFP系列标准溶液(浓度见表2);4.2取5只测试片,水平放置,分别在各样品垫上加5种浓度的50μl标准溶 液;4.310min后,测定各测试片上检测线处605nm的荧光强度F1及检测线与质控线中间处605nm的荧光强度F2,计算F2/F1的值数据见表2,标准曲线见图3。表2AFP标准系列浓度与相应荧光强度5、样本检测用血清样本替代标准系列溶液,重复4.2、4.3步骤,将F2/F1代入标准曲线,测得6个样本的AFP值见表3。表3本发明方法检测结果与罗氏电化学发光法检测结果本发明方法检测结果与罗氏电化学发光法检测结果的相关性良好,R2=0.9637。实施例2:基于竞争抑制法检测C-反应蛋白(CRP)1.CRP单抗标金(Gold-CRP)过程同实施例1步骤1,不同点在于,用已纯化的CRP单抗替代Ab1抗体, 标记后胶体金O.D值为75,CRP单抗浓度为1mg/ml。2.用PBS-TBN配制1mg/ml的CRP纯抗原,取0.2μl点于检测线处;用PBS-TBN配制1mg/ml的CRP抗体的抗体,取0.2μl点于质控线处;取0.5μlGold-CRP加于结合垫,室温干燥备用。3、标准曲线制备3.1用工作液配制CRP系列标准溶液(浓度见表4);3.2取5只测试片,水平放置,分别在各样品垫上加5种浓度的50μl标准溶液;3.310min后,测定各测试片上检测线处605nm的荧光强度F1及检测线与质控线中间处605nm的荧光强度F2,计算F2/F1的值数据见表4,标准曲线见图4。表4CRP标准系列浓度与相应荧光强度5、样本检测用血清样本替代标准系列溶液,重复3.2、3.3步骤,将F2/F1代入标准曲线,测得6个样本的CRP值见表5。表5发明方法检测结果与酶联免疫法法检测结果本发明方法检测结果与酶联免疫法法检测结果的相关性良好,R2=0.9586。结论:本发明所述方法仅通过测量淬灭物质对测试区自有荧光强度的影响来测定待测物的数量,既克服了自有荧光带来的荧光信号的干扰,而且不需要加入任何荧光物质标记的试剂,显著减少了原料的使用,节约了经济成本,且实验方法更简便。可见,本发明所述方法不仅具有灵敏度高,定量准确的优点,而且快捷、操作简便、成本低廉。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1