用于细胞治疗的生物标志物的制作方法
本发明涉及用于监测个体炎性病况进展的方法。在特定实施方案中,患者正在接受炎性病况的治疗并且所述方法包括监测一种或多种生物标志物的水平以监测疾病进展,例如以帮助临床医生优化治疗方案。在特定实施方案中,个体正在接受用间质干细胞(MSC)的治疗。在特定实施方案中,本发明涉及监测患有由软骨损伤或软骨退变,例如OA,表征的病况的患者的自体或同种异体细胞治疗效果的方法,例如以帮助从业者确定适当的时间以施用另一剂量的细胞。本发明还提供方法中使用的试剂盒和组分。
发明背景
炎症和炎性病况是一般人群中严重的健康问题,并且甚至更确切地在老龄化人群中,其中慢性炎性病况可以呈现持续的衰竭性的和退化的机动性和疼痛,炎症可以作为对损伤或由物理、化学或生物制剂造成的异常刺激的响应而出现。当术语“炎症”用来表示病症时,是指由炎症产生、由炎症导致或者导致炎症的,不正常的或以正常方式不能解除的病理过程。炎症性病症可以是全身性的或局限于特定的组织或器官中。
骨关节炎(OA)是自发性、无法治愈的慢性和衰竭性骨骼肌疾病并且在澳大利亚被超过140万人报告。OA发作与老化最密切相关,并且关键观察结果是软骨改变和疼痛。OA传统上被称为非炎性疾病,但越来越明显的是炎症在OA疾病进展中发挥着重要作用。通常用非类固醇抗炎药(NSAID)和止痛药管理OA患者以减轻OA症状并且以控制受影响的关节处的疼痛。目前,当NSAID以及皮质类固醇治疗不再有益,通常的治疗是全关节置换。这给30-60岁的患者带来重要问题。许多骨科外科医生对于对小于50岁的人进行关节置换是犹豫的,因为 植入物不太可能持续他们的一生。
近年来,在医学研究中已经有向针对多种疾病的创新的再生治疗的转变。在关节疾病例如关节炎,许多研究小组已经使用OA的动物模型来探索成体间质干细胞(MSC)作为潜在的再生治疗的用途。在急性和慢性软骨损伤的动物模型中,用MSC的治疗产生半月板和透明软骨再生,以及OA类疾病进展、软骨损失、骨赘形成和软骨下增厚的减少。通过生物活性因子的分泌,这些细胞还已经被证实具有显著的抗炎性和免疫调节效果。脂肪组织是特别引人类注目的用于治疗目的的细胞来源,因为其包含的每克MSC是骨髓的每克MSC的500-1000倍。与丰富的MSC一起,脂肪组织还包含免疫细胞、血管平滑肌细胞、内皮细胞和周皮细胞,其总体被称为基质血管部分(SVF)。通过标准的吸脂技术获得大量脂肪组织的能力和快速分离SVF的能力允许临床上同一天的细胞治疗程序。
例如,题为“Therapeutic methods using adipose tissue-derived cell suspensions comprising adipocytes”的国际专利申请PCT/AU2009/001070(WQ2010/020005)和澳大利亚专利申请第2009201915号,两者的内容均通过交叉引用并入本文,描述用于治疗包括OA的骨骼肌病况的自体脂肪来源的细胞治疗。
题为“Therapeutics using multiple injections of cells”的澳大利亚专利申请第2013204930号描述了已经令人惊奇地鉴定了自体脂肪组织来源的细胞悬浮液可以被冷冻并且恢复用于作为有计划注射过程的随后施用,以提供与单剂量相比改进的治疗结果。其中描述了,令人惊讶地,此类冷冻细胞可以在不需要从冷冻保存中恢复后培养细胞的情况下使用。如AU2013204930中所述,这允许发明人开发治疗骨关节炎、以及包括疼痛的多种其他病况的改进的方法,其通过随时间向个体施用包含多个剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的治疗过程,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,并且随后的一剂或多剂包含细胞悬浮液的已经冷冻贮存的一部分。
仍然存在对另外的方法的需求以有助于患有炎性病况、OA和相 关病症,以及其中涉及软骨损伤或软骨退变的其他病况的患者的治疗。
发明概述
本发明人认为拥有帮助治疗医师确定患者的炎性病况的进展的方法将是对他们有利的,例如以有助于关于向患者施用治疗剂量的适当的时间的指导决定,例如向患者施用一剂MSC,或一剂脂肪组织来源的细胞悬浮液,其可以是自体或同种异体细胞悬浮液,特别是不依赖于患者对自己病况的主观评价的方法,所述对自己病况的主观评价例如疼痛得分或不适水平的自我报告。
如本文所述,提供了使用生物标志物以评价炎性病况的进展并且帮助鉴定由炎症表征的病况的基于间质细胞治疗的适当的治疗时间。本发明人已经鉴定了巨噬细胞迁移抑制因子(MIF)在正在接受针对炎性病况的间质干细胞治疗的患者的血清中是可检测的,所述炎性病况例如OA、神经变性疾病和溃疡性结肠炎,并且可检测的MIF水平与治疗结果相关,例如炎性病况的稳定或改善。在特定实施例中,在OA的治疗中举例说明了可检测的MIF水平与治疗结果相关,所述治疗结果例如降低的软骨降解。MIF是刺激受损组织降解的炎性细胞因子。
本发明人还已鉴定CTX-II,II型胶原C-端端肽,在正在接受针对OA的患者的血清和尿中是可检测的,并且可检测的CTX-II水平与软骨降解相关。MIF的血清水平与MSC治疗后观察到的降低的组织降解相关,例如在OA中,降低的血清MIF与降低的尿液CTX II相关,CTX II是软骨降解的标志物。
本发明人还已鉴定COMP是另外的与OA非常相关的软骨特异性分解产物。COMP在疾病进展期间增加(在血清中)。与CTX一样,本文的实施例展示了治疗后此标志物的稳定或略微减少。
因此,在本发明的一个方面,提供了用于监测患有炎性病况的患者的疾病进展的方法,该方法包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中与所述第一生物样品相比,在所述第二生物样品中所述生物标志物的水平的改变指示疾病进展。在此术语中,疾病进展可以是病况已经恶化、稳定或改 善。
在实施方案中,与第一生物样品相比,第二生物样品中所述生物标志物的可检测的水平的增加指示炎性病况的病理进展或恶化。在实施方案中,与第一生物样品相比,第二生物样品中所述生物标志物的可检测的水平的降低指示炎性病况的稳定或改善。
在本发明的另一方面,提供了治疗需要所述治疗的个体的炎性病况的方法,该方法包括向所述个体施用包含间质干细胞(MSC)的细胞悬浮液,其中该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的炎性病况的方法,该方法包括随时间向所述个体施用包含多个剂量的包含间质干细胞(MSC)的细胞悬浮液的治疗过程,其中该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的炎性病况的方法,该方法包括随时间向所述个体施用包含多个剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的治疗过程,其中第一剂量包含新鲜制备的细胞悬浮液的一部分并且随后的一剂或多剂包含所述细胞悬浮液的已经冷冻贮存的一部分,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的炎性病况的方法,该方法包括随时间向所述个体施用包含多个剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液的治疗过程,其中所有剂量包含已经冷冻贮存的细胞悬浮液,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平。
在另一方面,本发明提供治疗需要所述治疗的个体的炎性病况的方法,该方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液,其中所述第 一剂量包含新鲜制备的细胞悬浮液的一部分,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中第一生物样品是在开始所述治疗之前来自所述患者的基线样品,并且第二生物样品是在第一剂量后来自所述患者的样品,其中如果第二样品中的生物标志物MIF的水平与第一样品大致相同,施用另一剂量的所述自体脂肪组织来源的细胞悬浮液,其中所述另一剂量包含在开始治疗时已向患者施用过的细胞悬浮液的一部分,该部分在使用之前已经冷冻贮存。
在另一方面,本发明提供治疗需要所述治疗的个体的炎性病况的方法,该方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中第一生物样品是在开始所述治疗之前来自所述患者的基线样品,并且第二生物样品是在第一剂量后来自所述患者的样品,其中如果第二样品中的生物标志物MIF的水平与第一样品大致相同,施用另一剂量的同种异体脂肪组织来源的细胞悬浮液,其中所有剂量的细胞悬浮液在使用之前已经冷冻贮存。
在另一方面,本发明提供治疗需要所述治疗的个体的炎性病况的方法,该方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中第一生物样品和第二生物样品均在第一剂量后从所述患者获得,其中如果确定第二样品中的生物标志物MIF的水平比第一样品增加,施用另一剂量的自体脂肪组织来源的细胞悬浮液,其中另一剂量包含在开始治疗时已向患者施用过的细胞悬浮液的一部分,该部分在使用之前已经冷冻贮存。
在另一方面,本发明提供治疗需要所述治疗的个体的炎性病况的方法,该方法方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液,确 定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中所述第一生物样品和所述第二生物样品均在所述第一剂量后从所述患者获得,其中如果确定所述第二样品中的生物标志物MIF的水平比所述第一样品增加,施用另一剂量的同种异体脂肪组织来源的细胞悬浮液,其中所有剂量的细胞悬浮液在使用之前已经冷冻贮存。
在实施方案中,MSC选自自体细胞、同种异体细胞、脐带血细胞和扩增的脐带血细胞,或其混合物。
在实施方案中,炎性病况是由软骨损伤或软骨退变表征或与软骨损伤或软骨退变相关的病况。在实施方案中,炎性病况选自:骨关节炎、类风湿性关节炎和炎性肠病。在实施方案中,炎性肠病是溃疡性结肠炎。
在实施方案中,监测或治疗炎性病况的方法,其中炎性病况选自OA或由软骨损伤或软骨退变表征或与软骨损伤或软骨退变相关的病况,还包括确定所述生物样品中的选自CTX-II和COMP的至少第二生物标志物的水平。
在另一方面,本发明提供用于监测患有由炎症和组织降解,例如,软骨损伤或软骨退变,表征的病况的患者的疾病进展的方法,该方法包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平,其中与所述第一生物样品相比,所述第二生物样品中所述生物标志物的水平的改变指示疾病进展。在此术语中,疾病进展可以是病况已经恶化、稳定或改善。
在本发明的另一方面,提供了治疗需要所述治疗的个体的由软骨损伤或软骨退变表征的病况的方法,该方法包括向所述个体施用包含间质干细胞(MSC)的细胞悬浮液,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的由软骨损伤或软骨退变表征的病况的方法,该方法包括随时间向所述个体施 用包含多个剂量的包含间质干细胞(MSC)的细胞悬浮液的治疗过程,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的由软骨损伤或软骨退变表征的病况的方法,该方法包括随时间向所述个体施用包含多个剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的治疗过程,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,并且随后的一剂或多剂包含所述细胞悬浮液的已经冷冻贮存的一部分,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平。
在本发明的另一方面,提供了治疗需要所述治疗的个体的由软骨损伤或软骨退变表征的病况的方法,该方法包括随时间向所述个体施用包含多个剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液的治疗过程,其中所有剂量包含已经冷冻贮存的细胞悬浮液,该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平。
在实施方案中,与第一生物样品相比,第二生物样品中所述生物标志物的可检测的水平的增加,指示病况的病理进展或恶化。在实施方案中,与第一生物样品相比,第二生物样品中所述生物标志物的可检测的水平的降低,指示病况的稳定或改善。
在实施方案中,当细胞悬浮液是同种异体细胞悬浮液时,患者是非人类动物,例如猫、狗或马。
在实施方案中,由软骨损伤或软骨退变表征的病况是慢性病况。在实施方案中由软骨损伤或软骨退变表征的病况是关节炎。在实施方案中由软骨损伤或软骨退变表征的病况是骨关节炎(OA)或类风湿性关节炎(RA)。
在实施方案中,由软骨损伤或软骨退变表征的病况是急性病况,例如软骨损伤或软骨创伤。
在实施方案中,该方法包括确定来自所述患者的至少第一生物样品和第二生物样品中的COMP、CTX-II和MIF中的两个或多个的水平。
在实施方案中,该方法包括确定来自所述患者的至少第一生物样品和第二生物样品中的COMP、CTX-II和MIF的水平。
第一生物样品和第二生物样品可以是来自患者的以收集时间分开的任何两个样品。在实施方案中,第一生物样品是在开始针对病况的治疗之前来自所述患者的基线样品。在实施方案中,第二生物样品是在开始针对病况的治疗后来自所述患者的样品。在实施方案中,第二生物样品是在开始针对病况的治疗后一周至十二个月来自所述患者的样品。在实施方案中,第一生物样品和所述第二生物样品均是在开始所述治疗后来自所述患者的样品。
在实施方案中,第一生物样品是在开始针对所述病况的治疗之前来自所述患者的样品,并且第二生物样品是在开始治疗后来自所述患者的样品,其中如果在所述第一样品和所述第二样品中,所述至少一种生物标志物的确定的水平大致相同,施用另一剂量的细胞悬浮液。
在实施方案中,该方法还包括确定来自所述患者的另外的生物样品,例如第三生物样品、第四生物样品、第五生物样品等中的所述生物标志物的水平,其中每个所述生物样品在开始针对病况的治疗之前或之后不同时间从所述患者获得。例如,第一生物样品可以是在开始针对病况的治疗之前来自所述患者的样品,并且第二和随后的生物样品可以是在开始针对病况的治疗之后大约每月来自所述患者的样品。
在实施方案中,生物样品是血清。在实施方案中,生物样品是尿。在一个实施方案中,生物标志物是CTX-II并且生物样品是尿或血清。在一个实施方案中,生物标志物是MIF并且生物样品是血清。在一个实施方案中,生物标志物是COMP并且生物样品是血清。
在实施方案中,治疗方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物COMP、 CTX-II和MIF中的一种或多种的水平,其中第一生物样品是在开始所述治疗之前来自所述患者的基线样品,并且第二生物样品是在所述第一剂量后来自所述患者的样品,其中如果第二样品中的生物标志物COMP、CTX-II和MIF中的至少一种的水平与第一样品大致相同,施用另一剂量的自体脂肪组织来源的细胞悬浮液,其中另一剂量包含在治疗开始时已向患者施用过的细胞悬浮液的一部分,该部分在使用之前已经冷冻贮存。
在实施方案中,治疗方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物COMP、CTX-II和MIF中的一种或多种的水平,其中第一生物样品是在开始所述治疗之前来自所述患者的基线样品,并且第二生物样品是在所述第一剂量后来自所述患者的样品,其中如果第二样品中的生物标志物COMP、CTX-II和MIF中的至少一种的水平与第一样品大致相同,施用另一剂量的同种异体脂肪组织来源的细胞悬浮液,其中所有剂量的细胞悬浮液在使用之前已经冷冻贮存。
在实施方案中,治疗方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物COMP、CTX-II和MIF中的一种或多种的水平,其中第一生物样品和第二生物样品均在所述第一剂量后从所述患者获得,其中如果确定第二样品中的生物标志物COMP、CTX-II和MIF中的至少一种比第一样品增加,施用另一剂量的自体脂肪组织来源的细胞悬浮液,其中另一剂量包含在治疗开始时已向患者施用过的细胞悬浮液的一部分,该部分在使用之前已经冷冻贮存。
在实施方案中,治疗方法包括以下步骤:向所述患者施用第一剂量的包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液,确定来自所述患者的至少第一生物样品和第二生物样品中生物标志物COMP、CTX-II和MIF中的一种或多种的水平,其中第一生 物样品和第二生物样品均在所述第一剂量后来自所述患者,其中如果确定第二样品中的生物标志物COMP、CTX-II和MIF中的至少一种比第一样品增加,施用另一剂量的同种异体脂肪组织来源的细胞悬浮液,其中所有剂量的细胞悬浮液在使用之前已经冷冻贮存。
在实施方案中,当患者是人类时,本发明的方法通过执业医师或通过在执业医师监督下的人,或其组合进行。
在实施方案中,当患者是人类时,方法的所有步骤通过注册执业医师进行或在注册执业医师的监督下进行,所述注册执业医师在整个所述方法中对所述个体的临床护理负有主要责任。
在实施方案中,方法的一步或多步通过在所述执业医师监督下的一人或多人进行。在一个实施方案中,方法的集合步骤通过多个个体进行。
在实施方案中,方法的集合步骤在多个位置进行。在一个实施方案中,从所述患者获得生物样品的步骤与施用一个剂量、准备用于测试的生物样品或确定至少一种生物标志物的水平的步骤中的一个或多个在不同地点进行。
以上所述的本发明的简述不是限制性的并且其他特征和优点将通过以下详述的优选实施方案的说明书以及权利要求中变得显而易见。
附图简述
图1:在整个试验中安慰剂和治疗组的ICOAP总疼痛得分。数据表示为平均值±平均值标准误(SEM)。
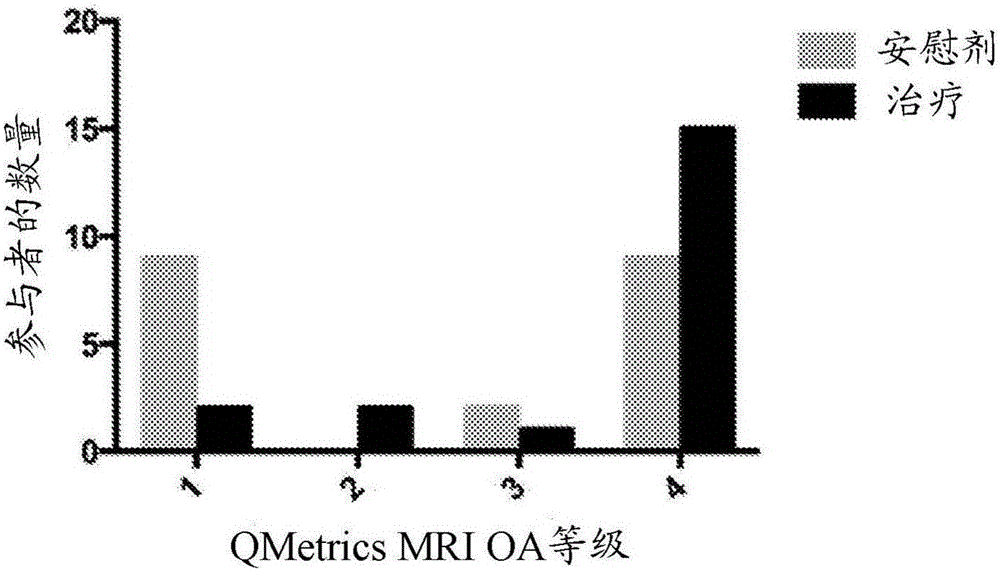
图2:试验参与者的测试膝盖中的软骨损伤的基线QMetrics MRI评价。
图3:在试验参与者的尿中测量的肌酸酐校正的CTX-II水平。数据表示为平均值±平均值标准误(SEM)。
图4:在基线和6个月时的试验参与者中的循环血清MIF水平。数据表示为log2荧光值的平均值±SEM。
图5:在治疗(A)和安慰剂(B)组通过基线MRI来源的OA等级分层CTX-II数据。数据表示为平均值±平均值标准误(SEM)。
图6:两个患有神经变性疾病的男孩中的2011年第二次MSC治疗之前的基线MIF水平和治疗后2个月和5个月时的MIF。
图7:治疗专家对患有神经变性疾病的两个男孩的用MSC治疗后评价结果,显示记录的他们的各种神经学任务和体能任务的得分。
图8:在基线和远至治疗后4个月时的HiQCell患者中循环血清MIF水平。归一化的巨噬细胞迁移抑制因子(MIF)。曲线上的y值是来自混合效应模型的预测log2(Val)。画在箱形图上的线确定为从混合模型偏移-1.388和斜率-0.06848。统计学上,斜率显著不同于0,p-值为0.001。使用混合线性模型,其中患者ID形成11个水平的随机效应,时间形成8个水平的固定因子。Val代表MIF测定读取:log2(Val)~时间+(1|ID)。
图9:HiQCell关节注册参与者在基线和远至治疗后4个月时的肌酸酐校正的尿液CTX水平的箱形图。来自时间趋势混合模型的归一化CTX。曲线上的y值是来自混合效应模型的预测log2(Val)。画在箱形图上的线确定为从混合模型的偏移-1.173和斜率0.01265。统计学上,斜率与0无显著不同,p-值为0.983。使用混合线性模型,其中患者ID形成12个水平的随机效应,时间形成8个水平的固定因子。Val代表ELISA吸收读取:log2(Val)~时间+(1|ID)。
图10:HiQCell关节注册参与者在基线和远至治疗后4个月时的血清COMP水平的箱形图。来自时间趋势混合模型的归一化COMP。曲线上的y值是来自混合效应模型的预测log2(Val)。统计学上,斜率与0无显著不同,p-值为0.285。使用混合线性模型,其中患者ID形成12个水平的随机效应,时间形成8个水平的固定因子。Val代表ELISA吸收读取:log2(Val)~时间+(l|ID)。
图11:患有溃疡性结肠炎的两个成年人中2014年MSC治疗之前的基线血清MIF水平以及治疗后6周和12周时的MIF。患有溃疡性结肠炎的两个成年人在2013年用培养扩增的同种异体脐带血来源的MSC治疗过一次。静脉注射施用细胞。
缩写
如本文所使用,SVF是基质血管组分的缩写。
如本文所使用,CTX-II是II型胶原C-端肽的缩写。
如本文所使用,MIF是巨噬细胞迁移抑制因子的缩写。
如本文所使用,OA是骨关节炎的缩写。
如本文所使用,RA是类风湿性关节炎的缩写。
如本文所使用,NSAlD是非类固醇抗炎药的缩写。
如本文所使用,ICOAP是间歇性和连续性骨关节炎疼痛的缩写。
如本文所使用,OSCARS是骨关节炎干细胞远景研究的缩写。
如本文所使用,OARSI是骨关节炎国际研究学会的缩写。
如本文所使用,MSC是间质干细胞的缩写。
如本文所使用,COMP是软骨寡聚基质蛋白的缩写。
如本文所使用,HSC是造血干细胞的缩写。
定义
本文所用的与本发明相关的各种组分,例如载体、稀释剂、冻存剂,的上下文中的术语“药物可接受的”意图不仅包括适用于向人类个体施用的此类组分,还包括适用于向非人类哺乳类个体施用的那些组分。在特定实施方案中,药物可接受的组分适用于向非人类哺乳类个体施用。在特定实施方案中,药物可接受的组分适用于向人类个体施用。在特定实施方案中,药物可接受的组分适用于向非人类哺乳类个体和向人类个体施用。
除非上下文另有说明,术语病症、病况和疾病通常在本文中可互换使用。
本说明书上下文中的术语“治疗(treating)”、“治疗(treatment)”、“治疗(therapy)”等是指病况或疾病的症状和/或潜在原因的缓解,例如炎症或炎性病况,或骨关节炎,或与软骨损伤或软骨退变相关或由软骨损伤或软骨退变表征的病况,或腱损伤或疼痛。在某些实施方案中,治疗会减缓,推迟或阻止疾病或者疾病症状或损伤进展,或者逆转疾病或损伤的进展,至少是暂时性的。因此,在本发明上下文中术语“治疗(treatment)”或其衍生词例如“治疗(treating)”当与治疗性应用相关使用 时包括治疗的所有方面时,例如缓解与待治疗病况相关的疼痛,缓解待治疗病况的严重性,改善待治疗病况的一种或多种症状,等。术语“治疗”或其衍生词的使用被理解成意为“被治疗的”个体会经历任意一种或多种上述的益处。
本说明的全文中,提及的“一种(a)”或“一个(one)”元件不排除复数,除非上下文另有说明。类似地,提及“一个实施方案”不排除该描述的实施方案的特征与一个或多个其他描述的实施方案结合应用,除非上下文另外确定。
本文使用的术语“治疗有效量”在其含义内包括用于本发明以提供所需的治疗效果的无毒但是足够剂量的化合物或组合物。所需的确切量将因个体之间而异,取决于一些因素例如被治疗的物种,个体的年龄和一般情况,合并症,待治疗病况的严重程度,施用的具体试剂以及施用模式等。因此,在任一给定的案例中,合适的“有效剂量”可以由本领域技术人员仅使用常规方法来确定。
在本说明书的上下文中,术语“包含”意为包括,但并非仅包括。另外,术语“包含”的变体,例如“(包含)comprise”和“(含有)comprises”,具有相对应的变化的含义。因此,术语“包含”及其变体以包容的含义而不是排他的含义使用,使得被描述为包含整数A,或包含整数A和B等的组合物、方法等中任选地存在其他整数或者特征等。
在本说明书的上下文中,术语“约”和“大约”将被理解为表示熟练的受众(addressee)与给定值相关联的通常可接受的范围。
在本说明书中的上下文中,当对参数给定范围时,可被理解为该参数包括了给定范围之内所有的值,包括所述范围的给定端点。例如,范围“5至10”将被理解为包括值5,6,7,8,9和10,以及给定范围内的任何子范围,例如6至10,7至10,6至9,7至9等,并包括整数之间的,在所述范围的上下文中合理的任何值与范围,如5.5,6.5,7.5,5.5至8.5和6.5至9等。例如,范围“10%至30%”应理解为包括数值10%、11%、12%、13%和所有直至30%的整数并且包括30%,以及给定范围内的任何子范围,例如包括子范围10%至15%、12%至18%、20%至30%等,以及包括在给定范围的上下文中合理的整数之间的任 何数值和范围,例如10.5%、15.5%、25.5%等。
在本说明书的上下文中,术语“多个”(“plurality”)和“多个”(“multiple”)意指任意大于一的数。
应当指出的是,本文提及在治疗或疗法中使用本发明的方法和组合物将被理解为适用于人类应用和非人类应用,如兽医方面的应用。因此,应理解的是,除另有说明外,提及患者,个体或个人意为人类或非人类,例如社会、经济、农业或研究上重要的任何物种的个体,包括但不限于羊,牛,马,猪,猫,犬,灵长类动物,啮齿类动物分类学成员,尤其是家养的或农场的那些分类学成员如羊,牛,马,猪和犬。
当在本文中描述本发明的各种实施方案或方面的实施例时,他们将通常以适当的术语,包括“例如”(“such as”)或“例如”(“for example”)或“包括”(“including”)开始。应理解,实施例被描述为包含的可能性,例如为了说明或理解的目的,并且不作为限制提供,除非上下文另有说明。
本文所称药物组合物还可以被称为药剂,例如当预期用于治疗用途时。因此,应理解当本发明被描述为包括所述组分的组合物在制备用于预期的治疗目的的药物组合物中的用途时,该描述同样地意指制备用于所述预期的治疗目的的药剂的用途,除非上下文另有说明。
本文引用的所有参考文献通过引用将其整体以被允许的程度并入本文。
本文的文档的任何描述,或来源于或基于那些文档的本文声明,不是对该文档或派生的声明是澳大利亚或其他地方的相关领域的公知常识的一部分的承认。
实施方案描述
在已知的通过施用包含MSC的自体或同种异体细胞悬浮液治疗炎性病况,例如神经变性疾病,包括溃疡性结肠炎的炎性肠病,包括克罗恩病的自身免疫疾病和多发性硬化以及其他慢性炎性病况的方法中,治疗医师基于各种因素做出在何适当的时间施用治疗剂量的评价, 所述各种因素,例如疼痛、神经功能、机动性、内视镜检查、活检组织的组织学检查和成像。然而,这些方法的每个均有缺点,并且在许多情况下,在症状以可观的方式改变之前发生显著的组织损伤。在一些情况下,评价工具是侵入性的,例如内视镜检查和活检组织的组织学检查。在其他情况下,患者可能不能提供症状的准确的评价以指导治疗医师。通过在分子水平定量损伤的程度,生物标志物能够为成像和其他评价工具提供强大的辅助。本发明人预期在成像和其他评价技术将能够准确地反映疾病状态之前,生物标志物分析使得在疾病状态的早期诊断成为可能。
在已知的通过施用自体或同种异体脂肪组织来源的细胞悬浮液治疗由软骨损伤或软骨退变表征的病况的方法中,所述软骨损伤或软骨退变,例如OA、RA以及其他慢性病况和急性软骨损伤,治疗医师基于各种因素,例如,疼痛和机动性以及成像,做出在何适当的时间施用治疗剂量的评价。然而,这些方法的每个均有缺点。例如,基于受影响的关节的身体状况的评价,例如在足够的专业知识和基础设施不容易获得的情形下,通过经核磁共振成像(MRI)的成像是昂贵的并且可能是耗时的。当评价是基于主观测试,例如疼痛得分或机动性的自我报告时,可能出现困难。例如,自我报告的疼痛和生活质量得分不总是与真实的组织损伤密切相关,即,在OA中,自我报告的疼痛和生活质量得分可能与软骨损伤的程度不密切相关。存在给关节成像的许多方式,包括X射线和MRI,然而这些的每个在提供组织损伤程度的非常详细的视野上是不完善的。通过在分子水平定量损伤的程度,生物标志物能够为成像和疼痛得分提供强大的辅助。本发明人预期在成像技术将能够准确地反映疾病状态之前,生物标志物分析使得在疾病状态的早期诊断成为可能。
另外,疼痛和机动性的问题之一是等到患者报告这些系统的时候,疾病已经进展并且在关节中已经发生进一步损伤。通过在症状发作之前治疗,疾病的进展可以被停止或减慢。这对其他炎性病况也同样适用。
在评价的后一种形式中暗示的是在已经做出施用另一剂量的决定 之前,患者的病况将已经恶化,或至少他们的不适水平将增加并且或者他们的机动性已经进一步恶化。作为个体患者特异性的任何形式的评价的备选,治疗过程可以基于周期性的施用,例如自上一剂量后某一段时间后施用另一剂量,例如,三个月后,或六个月后。简单的基于时间的评价的一个缺点是评价可能与个体的特殊情况没有具体的相关性,包括退化或炎症的水平将依赖于许多事情,例如重量、运动水平和运动类型。
本发明人已经鉴定,MIF在患有炎性病况的患者的血清中是可检测的并且可检测的水平可以作为炎症或病况的临床进展的标志物。因此,当炎性病况恶化时,MIF的可检测的水平增加,反之,当病况改善时,可检测的水平减少。因此,本文描述了用于监测患有炎性病况的患者的疾病进展的方法,所述方法包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平,其中与所述第一生物样品相比,所述第二生物样品中所述生物标志物的水平的改变指示疾病进展。
该监测疾病进展的能力在帮助临床医生改善或优化用于患有炎性病况的患者的治疗方案中也具有有效性。例如本发明提供治疗需要所述治疗的个体的炎性病况的方法,所述方法包括向所述个体施用包含间质干细胞(MSC)的细胞悬浮液,其中该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的生物标志物MIF的水平。
本发明人还已经鉴定软骨特异性胶原片段(II型胶原C-端肽;CTX-II)在血清和尿中是可检测的,COMP在血清中是可检测的,并且巨噬细胞迁移抑制因子(MIF)在来自正在接受OA和其他骨骼肌病况治疗的患者的血清中是可检测的。特别地,如本文所述,在基线(即,治疗前)和6个月之间,CTX-II水平在治疗组中降低并且在安慰剂组显著增加。在治疗组中观察到了血清MIF水平的显著下降,MIF是参与软骨降解途径的关键细胞因子。因此,本发明人在本文中描述来自患者的生物样品中的COMP、CTX-II和MIF中的一种或多种的检测可以用于帮助治疗医师确定在何适当的或最佳的时间施用一剂量的自体脂肪组织来源的细胞悬浮液。因为本发明人假定这些生物标志物来指示 正在接受治疗的软骨的病理改变,因此本文公开的方法对其他由软骨损伤或软骨退变表征的病况的治疗也有应用,所述其他由软骨损伤或软骨退变表征的病况,例如RA以及其他慢性病况和急性软骨损伤。
尽管本文的实施例显示当间质干细胞例如来自培养扩增的同种异体脐带血来源的MSC或当自体细胞悬浮液是治疗试剂时,本发明的方法是适当的,题为“Therapeutic methods using adipose tissue derived cell suspension comprising adipocytes”的PCT/AU2009/001070(WG2010/020005),其内容通过应用并入本文,显示同种异体细胞悬浮液也用于治疗此种病况。因此,本发明的方法也应用于使用同种异体脂肪组织来源的细胞悬浮液帮助适当的治疗患者。
第一生物样品和第二生物样品可以是来自患者的以收集时间分开的任何两个样品。提及的“第一”和“第二”无意表明他们是按时间顺序从患者收集的第一样品和第二样品;它们是已经在不同时间从患者获得的简单的两个样品,“第二”样品在“第一”样品之后已经获得。因此,应理解另外的样品可能在被称为“第一”样品和“第二”样品之前、之后或之间的任何时间已经从患者获得,在所述“第一”样品和“第二”样品中确定生物标志物的水平。任何或所有另外的样品也可以被用于分析生物标志物水平。
还应理解,提及确定生物标志物的水平,例如在第一生物样品中,可以意指确定在相同的时间点采集的两个样品中的水平,例如当生物标志物之一需要或期望在血清中确定,并且另一个在相同时间点的样品中待确定的生物标志物需要或期望在尿样中确定。为了进一步说明上下文,该方法可以包括确定例如,第一生物样品中的MIF和CTX-II的水平。如果将使用血清样品确定MIF的水平并且使用尿样确定CTX-II的水平,血清和尿样在相同时间获得,因此,在本上下文中,它们一起代表第一生物样品。因此,生物样品可以由在相同时间从患者获得的两个不同类型(例如,一个尿和一个血清)的样品组成。尽管以第一生物样品的形式说明和解释,相同的同样地适用于任何其他数值的样品。
第一生物样品可以是在开始治疗之前从患者获得的样品。这样的 样品也可以被称为基线样品。在实践中,该样品在开始治疗的同一天获得并且在实践中,可以在施用所述第一剂量的治疗后立即获得,因为将预期生物标志物的可检测的水平将不会立即受到施用第一剂量的治疗的影响。因此,应理解,提及“先于”开始所述治疗从患者获得第一或基线生物样品还包括施用治疗的初始剂量后约24小时内从所述患者获得的生物样品,因为已知生物标志物在从治疗剂量开始约24小时内与可检测的治疗前水平相比无改变。
第一生物样品可以是在炎性病况的治疗开始后来自患者的样品。在说明性实施方案中,例如,第一生物样品可以是治疗开始后大约一个月来自患者的样品并且第二生物样品可以是治疗开始后大约三、四、五或六个月来自患者的样品。在这种情况下,与治疗前或基线水平相比,患者的病况由于治疗剂量的改善可以体现在第一治疗后样品中减少的MIF的水平,以及与第一治疗后样品相比,第二治疗后MIF的水平的增加可以表明潜在病况的恶化。如此医师可以使用本发明的方法来监测炎性病况的进展或恶化,例如在病况的初始改善或稳定后。因此,治疗医师可以确定施用另一剂量的MSC,或包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液,或包含脂肪组织来源的非脂肪细胞的同种异体脂肪组织来源的细胞悬浮液是适当的。通常,另一剂量将是在治疗开始时已向患者施用过的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的一部分,该部分在使用前已经冷冻贮存。
如此,该方法通过提供给医师一个客观测量,通过该客观测量表征个体患者的炎性病况的进展。该方法可以与其他医师可获得的措施结合用于评价患者的炎性病况的状态以确定适当的时间施用第二或随后剂量的MSC或细胞悬浮液,例如患者或受影响的关节的机动性的增加或降低,患者报告的疼痛得分的增加或减小,超声或MRI分析,患者认知能力的改变,或患者腹部不适的改变。具体的另外的标准可以依赖于炎性病况的潜在的性质。
在说明性实施方案中,第一生物样品可以是治疗开始后大约一个月来自患者的样品并且第二生物样品可以是治疗开始后大约三、四、 五或六个月来自患者的样品。在这种情况下,与治疗前或基线水平相比,患者的病况由于一剂量的改善可以体现在第一治疗后样品中生物标志物COMP、CTX-II和MIF中的一种或多种的水平的降低,以及与第一治疗后样品相比,第二治疗后生物标志物COMP、CTX-II和MIF中的一种或多种的水平的增加可以表明潜在病况的恶化。如此医师可以使用本发明的方法来监测炎性病况的进展或恶化,例如在病况的初始改善或稳定后。因此,治疗医师可以确定施用另一剂量的MSC,或包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液是适当的。通常,另一剂量将是在治疗开始时已向患者施用过的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的一部分,该部分在使用前已经冷冻贮存。
如此,该方法通过提供给医师一个客观测量,通过该客观测量表征个体患者中病况的进展,例如OA、RA或软骨损伤。该方法可以与医师可获得的其他措施结合用于评价施用第二或随后剂量的细胞悬浮液的适当的时间,例如患者或受影响的关节的机动性的增加或降低,患者报告的疼痛得分的增加或减小,或超声或MRI分析。
通过监测一种或多种生物标志物的水平,医师可以能够在患者经历或者报告关节的不适或疼痛得分增加前或患者经历或报告受影响的关节的机动性降低前鉴定例如受影响的关节的恶化。基于本文所述的方法通过施用第二或随后的一剂,医师可以能够降低此类恶化的影响或持续时间,例如通过降低其他可能已经是患者经历的疼痛的显著增加或患者经历的机动性的显著降低。
监测一种或多种生物标志物的水平可以包括来自患者的样品中的COMP、CTX-II和MIF中的至少一种的水平的患者特异性的时间线的随时间的累积。例如,医师可以有包括治疗开始前来自患者的一种或多种样品的“基线”评价并且可以有治疗开始后来自患者的任何数量的样品。样品可以是定期获得,例如每月,或每三个月或每六个月,或它们可以不定期获得,例如通过一周至六或十二个月间隔的任何期间。当预期潜在病况或一种或多种生物标志物的水平相对快速的改变时,样品间的时间间隔将通常较短以允许医师密切监测患者的相关改变。 当预期潜在病况或一种或多种生物标志物的水平相对缓慢的改变时,将通常更低频率地获取样品。
确定生物样品或样品中的选自COMP、CTX-II和MIF中的至少一种生物标志物的水平可以同时完成,使得第一、第二和,如果存在,另外的样品可以全部同时确定。可选地,可以在与其他样品不同的时间评价一种或多种样品的生物标志物,例如,可以在收集后,立即评价每个样品的生物标志物的水平。
本文实施例的附图,本发明的实施方案可以说明如下。
如本文所述,生物标志物COMP、CTX II和MIF可以用作再治疗的指标。患者之间将会存在天然的生物学的差异,但是成功的脂肪组织来源的细胞悬浮液治疗将减少MIF并且稳定或减少CTX II并且稳定或减少COMP。治疗后监测将指示软骨降解过程何时已经达到有问题的水平,以治疗前COMP、CTX II和MIF的基线水平为关键点。当COMP、CTX II和MIF的治疗后水平增加时,例如接近或返回治疗前水平,医师将拥有软骨降解是活跃的强有力的指示。当接受治疗的病况是炎性病况时,优选的生物标志物是MIF。
因此,本发明包括多种生物标志物的用途,当结合使用时,提供关于软骨降解状态以及因此由软骨降解表征的病况,例如OA、RA和软骨损伤的状态的指示。本发明还包括单个的生物标志物的用途,优选地MIF,以提供用间质干细胞,包括用自体或同种异体脂肪组织来源的细胞悬浮液治疗前及治疗期间的炎性病况的状态的指示。
治疗骨关节炎和本文所提及的其他病况的方法
如在共同待决的题为“Therapeutics using multiple injections of cells”的澳大利亚专利申请第2013204930号中所描述,其内容通过引用并入本文,与之前已知的治疗相比,骨关节炎的治疗过程可以为个体提供改善的结果,所述治疗过程使用在一段时间内向个体施用包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的多次施用。以这种方式,包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液通常是已经由来自患者的单一的脂肪组织提取物制备,分 成有用的部分或等分的细胞悬浮液,第一剂量在细胞悬浮液制备后立即施用并且其他部分在适当的条件下贮存直至需要第二以及,当适当时,第三、第四、第五剂量等,此时将需要的剂量从贮藏恢复并且向个体施用。
如例如题为“Therapeutic methods using adipose tissue derived cell suspension comprising adipocytes”的PCT/AU2009/001070(WO2010/020005)所示,其内容通过引用并入本文,同种异体细胞悬浮液还可以用于治疗此类病况并且因此本文所述方法也应用于使用同种异体脂肪组织来源的细胞悬浮液的治疗。
如示于,例如,题为“Therapeutics using adipose cells and cell secretions”的PCT/AU2012/001140(WO2013/040649),其内容通过引用并入本文,包含MSC,例如脂肪组织来源的非脂肪细胞和细胞分泌物的组合的组合物,也可以用于治疗本文提及的此类病况并且因此本文所述方法也应用于使用此类组合的治疗。
本发明通过提供监测患有OA或病况的患者的临床进展的方法,提供治疗骨关节炎和其他涉及软骨退变、损伤或创伤的病况的方法的进一步的改进,所述监测方法可以独立于用于治疗OA或病况的方法使用,或可以优选地与用于此类治疗的方法结合使用。本文的方法也应用于治疗炎性病况。
特别地,本发明的方法可以为治疗医师或当整合入患者的总体治疗计划时为患者提供好处,例如通过使用组合的方法,其中随时间用包含多个剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液的治疗过程治疗患者,其中第一剂量包含新鲜制备的细胞悬浮液的一部分,并且随后的一剂或多剂包含细胞悬浮液的已经冷冻贮存的一部分,并且其中该方法还包括确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平。在该治疗过程中,基于至少一种生物标志物的水平确定随后的剂量的一个或多个的施用的时间,例如当第二生物样品中的至少一种生物标志物的水平比第一生物样品更高时。
在优选的实施方案中,确定了至少生物标志物MIF的水平,单独 地或额外地与COMP和CTX-II中的一种或多种。
炎性病症
本文所述方法适用于治疗炎性病症和/或适用于缓解个体的与炎性病症相关的疼痛。应理解,术语炎性病症和炎性病况可以在本文中互换使用,除非上下文另有说明。
炎症可以作为对损伤或由物理、化学或生物制剂造成的异常刺激的响应而出现。炎症反应可以包括局部反应及其导致的病理变化,致伤物质的破坏或去除,以及导致修复和愈合的响应。当术语“炎症”用来表示病症时,指由炎症产生,由炎症导致或者导致炎症的,不正常的或以正常方式不能解除的病理过程。炎症性病症可以是全身性的或局限于特定的组织或器官中。
已知炎症会在许多病症中发生,包括但不限于:全身性炎性反应(SIRS);阿尔茨海默病(以及相关病况和症状包括:慢性神经炎症、神经胶质活化;增加的小神经胶质;神经炎性斑形成;以及对治疗的响应);肌萎缩性侧索硬化(ALS)、关节炎(以及相关病况和症状,包括但不限于:急性关节炎症,抗原诱导的关节炎,与慢性淋巴细胞性甲状腺炎相关的关节炎,胶原诱导的关节炎,青少年关节炎;类风湿性关节炎,骨关节炎,预后和链球菌诱导的关节炎,脊柱关节炎,痛风性关节炎),哮喘(以及相关病况和症状,包括:支气管哮喘;慢性阻塞性呼吸道疾病;慢性阻塞性肺病,青少年哮喘和职业性哮喘);心血管疾病(以及相关病况和症状,包括动脉粥样硬化;自身免疫性心肌炎,慢性心肌缺氧,充血性心力衰竭,冠状动脉疾病,心肌病和心脏细胞功能障碍,包括:动脉平滑肌细胞激活;心脏细胞细胞凋亡;以及心脏细胞功能的免疫调节;糖尿病及相关病况,包括自身免疫性糖尿病,胰岛素依赖型(1型)糖尿病,糖尿病性牙周炎,糖尿病性视网膜病和糖尿病性肾病);胃肠道炎症(以及相关病况和症状,包括腹腔疾病,相关的骨质减少,慢性结肠炎,克罗恩病,炎性肠病和溃疡性结肠炎);胃溃疡;肝炎,例如病毒性和其他类型的肝炎,胆固醇型胆结石和肝纤维化,HIV感染及相关病况,包括退变性反应,神经变性反应,以及 HIV相关的霍奇森病,川崎综合征以及相关疾病和病况,包括皮肤粘膜淋巴结综合征,子宫颈淋巴结病,冠状动脉病变,水肿,发烧,增加的白细胞,轻度贫血,皮肤削落,皮疹,结膜发红,血小板增多;皮肤的炎性病症,包括皮炎,例如特异反应性皮炎及相关病况;多发性硬化,肾病及相关疾病和病况,包括糖尿病性肾病,终末期肾病,急性和慢性肾小球肾炎,急性和慢性间质性肾炎,狼疮性肾炎,古德帕斯丘综合征,血液透析存活和肾缺血性再灌注损伤,神经变性疾病及相关疾病和病况,包括急性神经退变,老化和神经变性疾病中IL-I的诱发、IL-I诱导的下丘脑神经元的可塑性和慢性应激强反应性,眼病及相关疾病和病况,包括糖尿病性视网膜病,Graves氏眼病和葡萄膜炎,骨质疏松症及相关疾病和病况,包括牙槽、股骨、桡骨、脊椎骨或腕部骨损失或骨折发生率,绝经后骨损失,质量、骨折发生率或骨损失比率,中耳炎(成年人或儿科的),胰腺炎或胰腺腺泡炎,牙周疾病以及包括成人的、早发性和糖尿病性的相关疾病和病况;肺病,包括慢性肺病,慢性鼻窦炎,肺透明膜疾病,SIDS中的缺氧和肺的疾病;冠状动脉或其他血管移植物的再狭窄;风湿病,包括类风湿性关节炎,风湿性阿孝夫氏小结,风湿性疾病和风湿性心肌炎;甲状腺炎,包括慢性淋巴细胞性甲状腺炎;尿路感染,包括慢性前列腺炎、慢性骨盆痛综合征和尿结石病;免疫性疾病,包括自身免疫性疾病,例如脱发,自身免疫性心肌炎,格雷夫斯氏病(Graves'disease),格雷夫斯氏(Graves)眼病,硬化性苔癣,多发性硬化,牛皮癣,系统性红斑狼疮,系统性硬化,甲状腺疾病(例如淋巴瘤性甲状腺肿和甲状腺肿瘤(桥本氏甲状腺炎,淋巴性甲状腺肿),睡眠病症和慢性疲劳综合征以及肥胖症(非糖尿病的或与糖尿病相关的),对传染性疾病的抵抗力,所述传染性疾病例如利什曼病,麻风病,莱姆病,莱姆关节炎,疟疾,脑型疟疾,脑膜炎,与疟疾相关的肾小管间质性肾炎),其是由细菌,病毒(例如巨噬细胞病毒,脑炎,非洲淋巴细胞瘤病毒,人类免疫缺陷病毒,流行性感冒病毒)或原生动物(例如,恶性疟原虫,锥虫)导致的,对创伤的反应,包括大脑创伤(包括中风和局部缺血,脑炎,脑病,癫痫,围产期脑损伤,长时间高热惊厥,SIDS和蛛网膜下腔出血),低出生体重(例 如大脑麻痹),肺损伤(急性出血性肺损伤,古德帕斯丘综合征,急性缺血再灌注),心肌功能障碍,由职业性和环境的污染物导致的(例如,对有毒油类综合征矽肺的敏感性),辐射创伤,以及伤口愈合反应的效率(例如,烧伤或热创伤,慢性伤口,外科手术敞口和脊髓损伤),败血症,甲状腺功能减退,氧依赖性,颅异常,早发性更年期、个体的移植反应(拒绝或接受),急相反应(例如,发热反应),一般炎性反应,急性呼吸窘迫反应,急性系统性炎性反应,伤口愈合,粘附,免疫炎性反应,神经内分泌反应,发烧发展和抵抗,急相反应,压力反应,疾病敏感性,重复运动应激,网球肘,韧带和腱问题,以及疼痛管理和反应。
在特定实施方案中,炎性病症是关节相关的炎性病症,例如关节炎。
本发明的方法和组合物可以用于治疗韧带损伤和腱损伤或用于缓解与此类损伤相关的疼痛。韧带损伤和腱损伤,在某些形式中,可以分类为炎性病症。一些韧带损伤和腱损伤可以认为不是炎性病症。为免生疑问,本发明中考虑的韧带损伤和腱损伤可以是炎性病症或与其相关的那些,以及可以认为不是炎性病症的那些。
以下段落描述脂肪组织来源的细胞悬浮液、包含MCS的细胞悬浮液的来源和制备,以及向患者施用此类治疗过程的方法。
脂肪组织
用于本发明的治疗方法的细胞悬浮液是自体脂肪组织来源的细胞悬浮液或同种异体脂肪组织来源的细胞悬浮液。脂肪组织可以是人类脂肪组织或哺乳动物脂肪组织,取决于治疗的个体并取决于将使用自体还是同种异体细胞悬浮液。脂肪组织可以包括“白色”脂肪组织,或“棕色”脂肪组织。
脂肪组织可以源自个体身体中,或在同种异体材料的情况下,可得到的供体的身体中的任何来源。皮下脂肪,例如,经表皮伤容易地获得,或通过使用“锁孔手术”技术。例如脂肪组织可以是使用吸脂技术收集的组织,或当雄性或雌性动物绝育时与生殖组织一起去除的脂肪组织。脂肪组织可以在对预定的治疗的个体进行的美容程序的期间 收集。脂肪组织可以特别地收集,作为个体的表明的病况的预定治疗的一部分。脂肪组织可以用组织培养基或缓冲等渗溶液冲洗以去除附着的血细胞,以及可以被修整或粗加工以在生成脂肪组织来源的细胞悬浮液之前去除大血管或结缔组织元件。
脂肪组织可以来自成熟的动物或来自青少年动物。
在特定实施方案中,个体或患者是伴侣动物,例如犬科动物或猫科家养动物,或役用动物。在其他特定实施方案中,个体或患者是农场动物或竞赛动物,选自马、驴(donkey)、驴(ass)、牛、水牛、绵羊、山羊、骆驼或猪。在其他特定实施方案中,个体或患者是人类。通常,当患者是人类时,脂肪组织是自体的。
脂肪组织来源的细胞悬浮液
如本文所使用的术语“脂肪组织来源的细胞悬浮液”包括从脂肪组织分离的细胞或脂肪组织小聚集物或块,或以下两种或多种的混合物:分离的细胞、脂肪组织的小聚集物和块。脂肪组织来源的细胞悬浮液包含脂肪组织来源的非脂肪细胞。细胞悬浮液可以使用本领域容易获得的技术通过机械离解脂肪组织获得。可以使用任何适当的方法用于脂肪组织的机械离解,例如通过用刀片或用剪刀切碎脂肪组织,或通过强迫脂肪组织经过具有足以将组织碎裂成分离的细胞或脂肪组织的小块的孔径的网孔或筛网,或这些技术的组合。当分离的脂肪来源的细胞再结合成大的集合时,例如通过在培养基中静置,可以形成脂肪组织的小聚集物。脂肪组织的小块或聚集物可以是直径小于十毫米,直径小于五毫米,直径小于一毫米,直径小于500μm或直径小于250μm。
可以用筛网或网孔过滤脂肪组织来源的细胞悬浮液以去除大于筛网或网孔孔径的细胞聚集物或组织块。
蛋白水解酶可用于促进脂肪组织离解成脂肪组织来源的细胞悬浮液。适用于此类用途的酶是本领域公知的,并且包括但不限于胰蛋白酶和胶原酶。通常在使用脂肪组织来源的细胞提取物前,去除和/或不然使蛋白水解酶失去活性,因为这些酶可能与所需的细胞的体内使用 不相容。蛋白水解酶可以与用于脂肪组织的机械分离的技术结合使用以生成脂肪组织来源的细胞悬浮液。
机械离解技术可以在不使用一种或多种蛋白酶的情况下使用。以这种方式使用的技术可以用来快速地生成脂肪组织来源的细胞悬浮液。
细胞悬浮液可以分散于液体中。液体可以在脂肪组织离解之前、期间或之后加入脂肪组织。该液体可以包含在适当的培养条件下能够维持脂肪组织细胞存活至少24小时的培养基。该液体可以包含等渗缓冲溶液,例如磷酸盐或HEPES缓冲盐水,其能够维持脂肪组织细胞存活至少一个小时。该液体可以包含组织培养基。该液体可以包含支持或延长脂肪组织细胞在细胞悬浮液中存活的血清或血清组分。血清或血清组分可以是自体血清或血清组分。
在一些实施方案中,细胞悬浮液可以不加液体,但作为代替,细胞被分散于在组织离解过程中形成的液体中。
脂肪组织来源的细胞悬浮液的制备可以包括离心步骤。分散于液体,例如培养基,中的分离的细胞或脂肪组织的小聚集物或块的离心是在大约500g 10分钟,或足够的时间和在足够的离心力下以生成包含脂肪来源的非脂肪细胞的细胞沉淀,在其上是一层培养基,漂浮在培养基上进而是包含有活力的脂肪细胞的一层,以及漂浮在顶部的是一层来自破裂的脂肪细胞的脂质。离心之后,在某些实施方案中,将脂质层和培养基层丢弃并混合保留的细胞,留下脂肪组织来源的细胞悬浮液,其包含有活力的脂肪细胞,以及脂肪来源的非脂肪细胞。在其他实施方案中,将仅保留包含有活力的脂肪细胞的层。
在其他实施方案中,可以将包含脂肪细胞的层去除并且因此不包含于脂肪组织来源的细胞悬浮液中。这将通常在制备基本上不含脂肪细胞的脂肪组织来源的细胞悬浮液时发生。在本文中,被称为基本上不含脂肪细胞的细胞悬浮液意指与起始材料相比,已经显著地耗尽脂肪细胞的细胞悬浮液,例如通过离心后去除脂肪细胞级分。应理解,当用于细胞悬浮液相关时,基本上不含脂肪细胞包括完全不存在脂肪细胞,以及还包括其中材料中脂肪细胞的最低的保留已经发生的情况。
在其他实施方案中,在脂肪组织来源的细胞悬浮液的制备中,可 以去除脂肪组织的脂肪细胞含量的仅一部分。在这种情况下,所得到的细胞悬浮液将包含脂肪细胞,但与起始材料中的比例相比,相对于诸如干细胞的其他保留组分以降低的比例。在一实施方案中,脂肪组织来源的细胞悬浮液包含至少10体积%的脂肪细胞。在一实施方案中,脂肪组织来源的细胞悬浮液包含介于10体积%和30体积%之间的脂肪细胞。在一实施方案中,脂肪组织来源的细胞悬浮液包含至少10数量%的脂肪细胞(也就是说,细胞悬浮液中的细胞总数量的至少10%是脂肪细胞)。在一实施方案中,脂肪组织来源的细胞悬浮液包含至少20数量%的脂肪细胞。在一实施方案中,脂肪组织来源的细胞悬浮液包含至少30数量%的脂肪细胞。在一实施方案中,脂肪组织来源的细胞悬浮液包含介于10数量%和30数量%之间的脂肪细胞。
可以使用一个离心步骤或多个离心步骤,例如以提供额外的细胞分离步骤。在其他实施方案中,脂肪组织来源的细胞悬浮液的制备不包括离心步骤。
脂肪组织来源的细胞悬浮液可以或可以不包含有活力的脂肪细胞。当存在时,脂肪细胞可以在它们的细胞质中保留可检测的数量的脂质,并且可以基于由脂质提供的不同密度,与脂肪来源的非脂肪细胞分离。脂质可以是可检测的,使用光学显微镜技术,包括相差显微镜,或通过用亲油性染料,例如Oil Red O,染色细胞样品。在它们的细胞质中保留脂质的脂肪细胞比其他脂肪来源的细胞相当地更脆弱,并且因此当需要有活力的脂肪细胞时,应避免损伤或杀死大部分的脂肪细胞的用于离解组织的技术。例如,超声离解脂肪组织或其中脂肪组织被剧烈摇晃的技术不太可能提供含有大量的有活力的脂肪细胞的细胞悬浮液。脂肪细胞的活性可以使用容易获得的技术,例如LIVE/DEAD细胞活性测定(Life Technologies)容易地测定。
脂肪组织来源的细胞悬浮液可以包含脂肪细胞和脂肪来源的非脂肪细胞两者。脂肪来源的非脂肪细胞通常包括基质血管级分的细胞,包括间质干细胞。基质血管级分的细胞通常在本文所述的脂肪组织来源的细胞悬浮液的离心条件下沉淀。
在包含脂肪细胞和脂肪来源的非脂肪细胞两者的实施方案中,脂 肪组织来源的细胞悬浮液可以通过包含如本文所述的离心步骤的方法方便地制备,在该实施方案中,收集脂肪细胞细胞层和沉淀的脂肪来源的非脂肪细胞两者。可选地,在这些实施方案中,脂肪组织来源的细胞悬浮液可以如本文所述通过在没有离心步骤的情况下分离脂肪组织而制备。
脂肪组织来源的细胞悬浮液或其一部分,任选地包含脂肪细胞,可以在适当的条件下贮存。贮存条件通常允许保留细胞悬浮液中一些或全部细胞的细胞活性,例如大于50%、大于60%、大于70%、大于80%、大于90%,或大于95%。
当将冷冻贮存脂肪组织来源的细胞悬浮液或其一部分时,其可以在适于冷冻细胞的任何载体液体中。作为说明性但非限制性的实例,细胞可以分散于培养基中,在冷冻之前培养基可以是含血清或不含血清的,例如DMEM、RPM1、基本培养基,或在血清中。
脂肪组织来源的细胞悬浮液通常还包含自体血清或血浆,其可以在细胞悬浮液的制备期间或在制备的后期加入,例如当细胞沉淀与制备的细胞悬浮液中不需要的组分分离时。
当将冷冻贮存脂肪组织来源的细胞悬浮液时,细胞悬浮液可以与包含细胞分泌物的组合物结合。包含细胞分泌物的组合物可以包括,例如来自脂肪组织来源的细胞悬浮液的培养的透明培养基或可以包括来自脂肪组织来源的细胞悬浮液的培养的浓缩培养基。用于贮存细胞、细胞悬浮液并且特别是脂肪组织来源的细胞悬浮液的此类方法公开于题为“Therapeutics using adipose cells and cell secretions”的PCT/AU2012/001140(WO2013/040649)中,其内容通过引用并入本文。
当将冷冻贮存脂肪组织来源的细胞悬浮液时,其通常还包含冻存剂。应理解,可以使用用于贮存细胞悬浮液而没有细胞活性随时间的显著的损失的任何添加剂和方法。例如,本领域已知的用于贮存间质干细胞的方法。作为实例,细胞悬浮液可以包含适当浓度,例如5%至10%的二甲基亚砜(DMSO)或甘油。作为进一步的实例,细胞悬浮液可以包含一种或多种冻存剂糖类,例如适当浓度的海藻糖、葡聚糖、葡萄糖、蔗糖。例如,可以包含浓度在1%w/v至30%w/v范围内的冻存 剂糖。在进一步的实例中,可以包含浓度在5%w/v至10%w/v范围内的冻存剂糖。
细胞悬浮液的成分,例如液体培养基和冻存剂,在使用浓度下通常是药物可接受的。这具有脂肪组织来源的细胞悬浮液可以在用最小限度的解冻后处理解冻后施用给个体的优势。
细胞悬浮液旨在作为折磨个体的病况的治疗过程的一部分。以那种方式,当使用自体细胞悬浮液时,该过程包含在一段时间内的向个体的多个剂量的细胞悬浮液,脂肪组织从所述个体获得并且细胞悬浮液从所述个体制备。治疗的时间过程将通常在几周至几月并且可能一年或多年。为了使用的容易性,通常在制备后立即将脂肪组织来源的细胞悬浮液分成有用的部分或等分并且将用于第二和,在适当的情况下,第三、第四、第五剂量等的材料随后冷冻贮存以在适当的时间恢复。通常,贮存的材料将是包含单剂量的部分或等分。
通常,当治疗使用自体细胞悬浮液时,作为治疗过程的第一剂量施用的至少一个等分或部分细胞悬浮液,将在加入冻存剂或其他旨在帮助细胞悬浮液的贮存的组分之前,从制备的细胞悬浮液获得。
细胞悬浮液可以被称为药物组合物因为它通常还包含药物可接受的载体稀释剂、赋形剂或佐剂的一种或多种。
通常将细胞悬浮液在受控条件下冷冻以最小化细胞损伤,例如通过缓慢冷冻,通常以约1℃/min的速率,例如通过置于可编程的冷冻装置中,或在-70℃至-90℃冰箱中的保温箱中。为了贮存,通常随后将冷冻细胞转移至液氮贮存。
当治疗过程使用同种异体脂肪组织来源的细胞悬浮液时,所有剂量可以在使用前冷冻贮存。在此类治疗过程中,一或多剂量可以源自不同的供体。
可用于脂肪组织来源的细胞悬浮液的制备的细胞处理方法和装置描述于题为“Cell processing method and device”的共同待决的申请PCT/AU2012/000272(WO2012/122603),其内容通过引用并入本文。
MSC的分离
间质干细胞(MSC)可以用于本发明的任何方法中。MSC可以从身体中的任何组织获得。来源包括骨髓、脂肪组织和脐带血。骨髓(BM)含有MSC和造血干细胞(HSC)。在BM中,与HSC相比,MSC以较低的数量存在,MSC和HSC分别以每百万BM细胞中10和100个细胞。使用抽吸针例如jamshidi,收获BM。10mL体积的BM将含有大约6×107成核细胞,这些细胞中600至6000是干细胞。为了将成核细胞与红血细胞分开,进行密度梯度离心程序,例如Ficoll-paque。在通过在盐水中的温和的离心的洗涤后,可以立即施用细胞,或可以进一步纯化或通过组织培养和/或免疫学分离方法使其富集。在实施方案,MSC可以是同种异体或可以是自体。在实施方案中,MSC可以是培养扩增的MSC。
MSC在脂肪中的水平高于其在骨髓中的水平。对这一发现的最可能的解释是,MSC与其他成核细胞类型一起,与叠加脂肪组织的致密毛细管床的庞大网络相关。脂肪组织可以通过手术切除或通过吸脂收获,并且本文描述了用于从脂肪组织制备非脂肪细胞细胞悬浮液,包括包含MSC的悬浮液,的方法。
在我们的经验中,从脂肪组织回收的MSC的数量在每克50,000至5百万。
脐带血是在出生时残留在脐带和胎盘的静脉中的血。这种血富含造血干细胞并且还含有低数量的MSC。更高数量的MSC存在于脐带胶质中,脐带胶质是围绕在脐带中脐静脉和血管周围的组织
MSC还可以从其他来源分离,例如外周血、滑膜、肌肉、骨膜、牙髓、胎盘。
治疗方法
在本发明的方法的实施方案中,向患有由软骨损伤或软骨退变表征的病况的个体提供治疗过程,所述软骨损伤或软骨退变,例如骨关节炎、类风湿性关节炎或软骨损伤,在治疗过程中,在制备细胞悬浮液后立即向个体施用第一剂量的包含脂肪组织来源的非脂肪细胞的自体脂肪组织来源的细胞悬浮液。在本文中,第一剂量可以描述为作为 新鲜制备的细胞悬浮液向个体施用。在本文中,术语新鲜制备的及本文所用的类似的术语意指如此施用的细胞悬浮液是在其制备的同一天向个体施用。如本文所述,用从将对其施用治疗过程的个体获得的脂肪组织制备脂肪组织来源的细胞悬浮液,因此所得到的细胞悬浮液是自体细胞悬浮液。通常,从自个体分离脂肪组织直到制备的细胞悬浮液准备施用所花费的时间长达约两至三小时。因此,新鲜制备的样品是在从个体去除脂肪组织的两至三小时内准备向个体施用的样品。
如本文所示,本发明的方法,其使用生物标志物COMP、CTX-II和MIF来帮助监测患者的潜在病况,还适用于使用同种异体脂肪组织来源的细胞悬浮液治疗。
如本文所述,任何治疗方法可以使用间质干细胞的细胞悬浮液。在本文所示的非限制性实例中,用于神经退变和溃疡性结肠炎的脐带MSC治疗是同种异体人类治疗。本文描述了同种异体培养扩增的MSC,例如用于人类治疗。
应理解,在本发明的方法的上下文中,一剂意指在给定的时间向个体施用细胞悬浮液,不论那一剂是在单次应用中施用还是在多于一次的应用中施用。作为说明性实例,一剂可以由单次施用组成,例如单次注射至个体的身体上的靶位点。作为进一步的说明性实例,一剂可以由向个体的身体的一个或多个靶位点的多次施用组成,例如多次注射。第一和或随后的剂量中的任一个,例如第二、第三、第四、第五剂量等的任一个因此可作为单次应用或作为多次应用施用。
该方法可以包括治疗过程,其包含第一剂量和第二剂量,或第一剂量、第二剂量和第三剂量,或第一剂量、第二剂量、第三剂量和第四剂量,或第一剂量、第二剂量、第三剂量、第四剂量和第五剂量,或执业医师认为适合患者的任何其他数量的剂量。
在实施方案中,脂肪组织来源的细胞悬浮液包含细胞的聚集物和/或包含脂肪组织块。在实施方案中,脂肪组织来源的细胞悬浮液还包含脂肪细胞。在实施方案中,细胞悬浮液基本上不含脂肪细胞。在实施方案中,脂肪组织来源的细胞悬浮液通过包括在制备脂肪组织来源的细胞悬浮液的期间去除(i)部分脂肪细胞含量或(ii)基本上所有脂肪 细胞含量的方法制备。
在实施方案中,治疗过程包括第一剂量的包含非脂肪细胞和脂肪细胞的细胞悬浮液,并且一个或多个随后的一剂或多剂的一个或多个的细胞悬浮液基本上不含脂肪细胞。在实施方案中,治疗过程包含第一剂量的包含非脂肪细胞和脂肪细胞的细胞悬浮液,并且一个或多个随后的一剂或多剂的一个或多个的细胞悬浮液包含非脂肪细胞和脂肪细胞。
在实施方案中,治疗过程包括在介于三和十二个月之间的总治疗时间内施用的多剂量。在实施方案中,治疗过程包括在介于三个月和几年,例如一、两、三或多年,之间的总治疗时间内施用的多剂量。在实施方案中,治疗过程包括在介于六和十二个月之间的总治疗时间内施用的多剂量。在实施方案中,治疗过程包括在介于三和九个月之间的总治疗时间内施用的多剂量。在实施方案中,治疗过程包括在介于六和九个月之间的总治疗时间内施用的多剂量。
在实施方案中,随后的一剂或多剂在解冻后立即向个体施用,例如解冻后约10分钟内,或解冻后约20分钟内,或解冻后约30分钟内或解冻后约一小时内或解冻后约两小时内。
在本发明的方法中,在确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF中的至少一种生物标志物的水平后向患者施用多剂中的至少一剂,通常第二或随后的剂量。在实施方案中,在来自患者的至少第一生物样品和第二生物样品中确定生物标志物COMP、CTX-II和MIF中的至少两种的水平。在实施方案中,在来自患者的至少第一生物样品和第二生物样品中确定三种生物标志物COMP、CTX-II和MIF的水平。在实施方案中,基本上所有剂量是在确定来自所述患者的至少第一生物样品和第二生物样品中的选自COMP、CTX-II和MIF的至少一种生物标志物的水平后向患者施用。在实施方案中,如此确定的生物标志物的水平表明患者的病况的恶化,从而为治疗医师提供指示以向患者施用另一剂量。
介于第一和每个随后的剂量之间的适当的时间段在不同的患者之间甚至对于给定患者可以是不同的,剂量之间的间隔可以变化。使用 本发明的方法允许治疗医师基于与疾病进展相关的生物标志物的客观测量向患者施用一剂量的细胞悬浮液。这向医师提供了另外的、改进的基础,在该基础上将确定施用一剂量的细胞悬浮液的适当的时间。在本发明之前,剂量的时间可以基于简单的周期性应用,例如每三个月,在这种情况下,患者可能经受比需要的更多的剂量,或剂量的时间可以基于由患者经历的增加的疼痛,或由患者经历的减少的机动性,这是不期望的。如此,为了治疗一时间段内个体的相同的病况,个体在那段时间内被施用多剂量的细胞悬浮液是本发明的方法中预期的治疗过程。
在实施方案中,治疗过程包括多剂量,在该多剂量中每个随后的剂量与前一剂量以介于一周和十周之间的时间分开。在实施方案中,治疗过程包括多剂量,每个随后的剂量与前一剂量以介于两周和八周之间的时间分开。在实施方案中,治疗过程包括多剂量,每个随后的剂量与前一剂量以介于两周和六周之间的时间分开。对于任何给定的治疗过程,介于每个剂量之间的时间段可以是或可以不是一致的时间段。作为说明性实例,介于第一剂量和第二剂量之间的时间段与介于第二剂量和第三剂量之间的时间段可以或可以不相同。
可以在远离受折磨的区域的位点向个体患者施用药物组合物。在本文中,“远离”意指施用不是将细胞悬浮液直接应用至炎症或其他损伤或正在接受治疗的疾病的位点,在这些情况下这种位点是可识别的。作为说明,在治疗关节炎关节的情况中,如本领域中之前所述的,施用涉及脂肪组织来源的细胞悬浮液直接注射至受折磨的关节。此类施用对治疗医师或临床医生的角色要求很高的技能以确保适当的精密度。在此类施用中需要的对受影响的肢体或关节的处理也增加了患者经历的痛苦,无论患者是人类还是非人类。通过提供脂肪组织来源的悬浮液的远程施用,本发明提供用于治疗此类疾病的改进的方法、用途和组合物。例如,远程施用可以通过皮下注射,例如在正在接受治疗的动物(例如猫或狗)的颈部的颈背中,或通过肌内注射。作为进一步的实例,通过肌内注射向狗的施用可以注射至狗的大腿。作为进一步的实例,通过肌内注射向绵羊的施用可以在尾褶中。
生物样品
生物样品是其中可以检测到所需的生物标志物的任何适当的样品。通常,样品是血液或其级分,例如血浆或血清。用于从个体收集血液以及用于为了测试目的分离所需的血液级分的方法是本领域已知的。在实施方案中,生物样品是滑膜液。在实施方案中,生物样品是尿。在实施方案中,在尿样中确定生物标志物CTX-II。在实施方案中,在血清样品中确定生物标志物CTX-II。在实施方案中,在血清样品中确定生物标志物MIF。在实施方案中,在血液或例如滑膜液的液体中确定生物标志物MIF。在实施方案中,在血清样品中确定生物标志物COMP。在实施方案中,在尿样中确定生物标志物COMP。
从患者获得生物样品的步骤可以作为本发明的方法的一部分进行或可以作为单独的步骤进行。从个体获得血液样品的步骤可以作为本发明的方法的连续系列步骤的一部分进行。从个体获得血液样品的步骤可以作为与本发明的方法的一个或多个剩余步骤分开的不同的步骤进行,例如以时间、位置或操作员分开。因此,在本发明的方法的进行中,获得血液样品可以或可以不涉及从所述个体提取血液。本发明的方法的进行可以,例如,包括在容器中接收血液样品,作为与本发明的方法分开的练习,该血液之前已经从个体提取。作为进一步的实例,获得血液样品可以包括,从暂时贮存恢复从个体提取的血液样品,从个体提取血液样品作为与本发明的方法分开的练习。应理解,本发明的方法因此可以完全地离体进行。
可以在收集,如果需要,处理后立即测试样品以确定生物标志物的存在或水平,或可以将样品或其处理的级分在适当的条件下贮存直到测试。例如,生物样品可以是血液或其级分(优选血清或血浆)。例如,当生物样品是其尿,可以先将其离心以去除碎片和细胞,并且随后在用于测试之前贮存。将这些样品理想地冷藏贮存1或2小时并且更优选地冷冻贮存。
通常,当患者是人类时,生物样品可以通过例如,执业医师或保健专业人员,在执业医师的临床护理下从个体收集。执业医师可以是 依法注册的、授权的或认证的独立从医的任何人。保健专业人员可以是许可的、授权的、注册的或认证的以独立地或在执业医师的监督下从个体收集生物样品的任何人。例如,保健专业人员可以是注册的或登记的护士,或执业医师的助手或临床帮手。应理解,生物样品可以,例如,在常规的门诊程序期间收集,所述门诊程序将通常在在执业医师的临床护理下的患者上实施。
当生物样品是尿时,样品可以在具有对患者的总体临床护理的执业医师的直接或间接监督下收集,但是通过患者自己物理收集。
在特定实施方案中,本发明的方法通过执业医师或通过在执业医师监督下的一人或多人,或通过其组合进行。在执业医师监督下的人可以是,例如,保健专业人员,药剂师,临床的、医学的或病理实验室技术员,或科学家。应理解,本发明的方法可以通过执业医师或通过在执业医师监督下的一人或多人,或通过其组合在任何实验室进行。例如,生物样品的收集、制备和或测试可以在与向患者施用治疗剂量的位置不同的位置进行。类似地,脂肪组织的收集,脂肪组织来源的细胞悬浮液的制备和施用可以通过不同的个体进行并且可以在不同的位置进行。当那种情况发生时,在整个所述方法中,通常所有步骤通过执业医师进行或在对所述患者的临床护理负有主要责任的注册的执业医师的监督下进行。
测试生物样品
用于测试生物样品中生物标志物的存在的方法,例如本文提及的那些,是本领域已知的。例如,潜在地包含目标生物标志物的样品可以与特异性结合生物标志物多肽或其片段的抗体接触。可选地,在使样品接触抗体前,可以将抗体固定在固体支撑物上以促进洗涤和随后的复合物的分离。固体支撑物的实例包括,例如,微量滴定板、珠、十字叉或微珠。还可以将抗体连接至ProteinChip阵列或如本领域已知的探针基板。
用于检测抗体标志物复合物的存在或测量抗体标志物复合物的量的有用的测定包括,例如,酶联免疫吸附测定(ELISA)、横向流动测定、 放射免疫测定(RIA),或蛋白质印迹测定。此类方法描述于,例如,Clinical Immunology(Stites&Terr,eds.,第7版,1991);Methods in Cell Biology:Antibodies in Cell Biology,第37卷(Asai,ed.1993);以及Harlow&Lane,supra。
该方法可以包括完整的蛋白质、多肽或其片段的检测。因此,应理解,本文提及的确定生物标志物的水平,或其类似的措辞,意图包括其中生物标志物以其整体被检测的情况以及其中生物标志物的片段,例如多肽片段被检测的情况,除非上下文另外说明。然而,当生物标志物自身是完整蛋白质的分解产物时,不适用反之亦然。因此,作为澄清,当生物标志物是CTX-II,其是胶原片段,提及确定CTX-II的水平不意图包括确定胶原的水平。该方法还可以还包括对照的包含,例如为了方法的正确或一致性能。
在CTX-II的情况下,例如,使用肌酸酐浓度校正CTX-II并且可以表达为在患者中观察到的ng/mmol肌酸酐水平。在贡献本文的实施例的个体中,观察到的水平介于约100至约1500ng/mmol之间。
使用来自R&D系统(R&D systems)的ELISA测定进行COMP和MIF的定量。根据制备商说明书,使用Urine Pre-clinical(CTX-II)ELISA(Immunodiagnosticsystems,UK)测定进行(CTX-II)的定量。使用Creatinine Parameter Assay(R&D系统,USA)用肌酸酐(Cr)校正CTX-H水平。如在说明书(http://www.mdsystems.com/Products/SMF00B)和在Alexander et al.Exp Neurol.2012August;236(2):351-362中描述的进行MIF ELISA。如在说明书(http://www.mdsystems.com/Products/DCMP0)和在V.B.Kraus et al./Osteoarthritis and Cartilage 19(2011)中所述的进行COMP和CTX-II ELISA测定。特定是表II,其包含了用于描述用于COMP和CTX-II的ELISA测定的许多论文的参考文献,每个参考文献的内容通过引用并入本文。
血液收集。在所需的时间点,使用18规针从患者收集8-36mL的血液至含有EDTA的BD真空容器(Becton Dickinson,USA)中。使用 聚蔗糖密度梯度分离将血液组分分开。以1:50的稀释度将完全蛋白酶抑制剂混合物(Roche,Switzerland)加入血浆并且将样品在冰上运输至实验室。将血浆在16000×g下离心5mins以去除任何细胞材料、等分并且在-80℃贮存。
Bio-Plex分析。Bio-Plex悬浮液阵列系统(Bio-Rad,USA)使用独特的荧光着色珠以允许在单个孔中同时定量多达100种分析物。使用Bio-Plex双波长激光的基于流量的微型板读数系统,通过检测与一抗和相应的报告复合物缀合的独特的珠定量目标分析物。将样品经过0.2μm Nanosep MF Centrifugal Devices withMembrane(Pall Scientific,USA)以9000×g过滤5分钟。根据制备商的说明书,使用所需的Bio-Plex测定(Bio-Rad,USA)分析50uL的每个过滤的样品。Bio-Plex Pro II磁力洗涤站可以用于洗涤步骤并且可以使用具有5.0版本的软件的Bio-Plex 200系统(Bio-Rad,USA)获得数据。
现在将关于以下实例更详细地描述本发明,仅通过说明的方式。意图将实例用于说明本发明并且不应该被解释为限制整个本说明书的描述的公开内容的一般性。
试剂盒和组合物
本发明还提供包含可用于执行本发明的方法的一种或多种组分的试剂盒。例如,药物组合物,例如包含MSC,或脂肪组织来源的细胞悬浮液,可以被提供为试剂盒的一部分,例如包括可用于预期治疗的另外的组分,例如,例如书面说明书,或其可以提供为单个的项目,例如单个的小瓶或等分的组合物。
试剂盒可以包含用于收集或制备生物样品,或用于检测特定的生物标志物的一种或多种试剂。例如,试剂盒可以包含一种或多种试剂,其能够结合和或检测,优选能够特异性结合和或检测,选自MIF、CTX-II和COMP的一种或多种生物标志物。试剂盒可以包含一种或多种试剂,其用于定量生物样品中生物标志物的水平,所述生物标志物例如MTF、CTX-II和COMP中的任何一种或多种。
试剂盒可以是分区化的试剂盒,该术语包括其中试剂包含于单独的容器中,以及可以包括小的玻璃容器、塑料容器或塑料条或纸条的任何试剂盒。此类容器可以允许试剂从隔室向另一隔室的有效转移同时避免样品和试剂的交叉污染,以及每个容器的试剂或溶液以定量的方式从一个隔室向另一个添加。此类试剂盒还可以包括将接受测试样品的容器,包含用于测定的抗体的容器,包含洗涤试剂(例如磷酸盐缓冲盐水、Tris缓冲液等)的容器,以及包含检测试剂的容器。试剂盒的不同的组分可以在不同的温度呈现、贮存或运输。
实施例
实施例1:骨关节炎干细胞远景研究
骨关节炎干细胞远景研究(OSCARS)是随机的、双盲的、安慰剂对照的试验以评估用于治疗OA的自体脂肪来源的细胞治疗的安全性和功效。将总共40名患者随机化(20:20)以接受自体脂肪来源的细胞或安慰剂的单次关节内注射至他们的测试膝盖。参与者完成了自报告的疼痛问卷(间歇性和连续性骨关节炎疼痛[ICOAP]索引)。在基线和治疗后6个月时使用MRI T2Mapping评价软骨降解的程度,并且使用在尿中的软骨特异性胶原片段(CTX-1I)和在血清中的一组48种细胞因子测量软骨降解。
所有患者经历了他们的总疼痛得分的大的和显著的下降,所述总总疼痛得分在整个试验中被保持。MRI T2Mapping显示自体脂肪来源的细胞治疗通过减慢软骨降解,即使在患有严重的软骨损伤的个体中,可以具有疾病减轻效果。与该发现一致,在基线和6个月之间,治疗组中CTX-II水平减少,但在安慰剂组中CTX-II水平显著增加(p=0.04)。在治疗组中观察到了涉及软骨降解途径的关键细胞因子——巨噬细胞迁移抑制因子(MIF)的血清水平的显著降低。
OSCAR是为评估自体脂肪来源的细胞治疗用于降低OA患者膝盖疼痛的效果而设计的世界上首次的实验。该临时报告中的结果显示短期至中期症状改善在安慰剂组和治疗组中是类似的。软骨降解的客观标志物在治疗组中降低了并且这经MRI T2Mapping证实,这表明 自体脂肪来源的细胞治疗可以减慢OA的进展并且在较长时期内产生改善的结果。
以下呈现了该研究进行的方式的更详细的解释,和该研究的结果和细节。
试验设计
OSCAR是在澳大利亚悉尼Royal North Shore Hospital进行的伦理认可的第II期、双盲的、安慰剂对照的试验。如果年龄>40的患者已经被诊断为膝盖骨关节炎,按照Osteoarthritis Research Society International(OSARSI)定级为:数值等级量表(MRS)上1级或2级中间的或外侧的隔室或骨赘中的射线照相的关节间隙变窄,2级或3级中间或外侧的隔室而没有关节间隙变窄,以及至少4级的有症状的膝盖骨关节炎疼痛,他们适合于参加试验。将总共40名患者随机分配(1:1)以接受自体脂肪来源的细胞或安慰剂的单次关节内注射至他们的测试膝盖。
研究目的是确定在患有被诊断为膝盖骨关节炎的患者中,自体非扩增的脂肪来源的干细胞的注射是否改善了疼痛并且改变了疾病进展。主要目的是确定使用自体干细胞以降低膝盖骨关节炎的疼痛症状的功效。第二目的是:(a)确定在膝盖骨关节炎的治疗中使用自体干细胞的中期安全性;(b)评估自体干细胞的注射对疾病进展的生物标志物的影响;(c)确定使用自体干细胞对生活质量的影响。
方法学
所有参与者经过常规的吸脂程序以收获大约200g的脂肪组织。如之前(Blaber SP,Webster RA,Hill CJ,et al.Analysis of in vitro secretion profiles from adipose-derived cell populations.J Transl Med 2012;10:172-88;其内容通过引用并入本文)所述处理该组织。简而言之,将脂肪组织用胶原酶消化并离心以获得沉淀的细胞(SVF)和脂肪细胞。将SVF和脂肪细胞悬浮液用盐水洗涤两次。将所得到的混合细胞群再分散于盐水中至最终体积为5mL。通过独立的放射科医师,治疗组接受该细胞 悬浮液的关节内注射至他们的测试膝盖,而安慰剂组接受盐水的关节内注射。在整个试验中,参与者和研究者对治疗配置保持不知情。在整个研究中,对患者监测不利事件(AE)和伴随药物。
参与者在1个月、3个月、6个月和12月完成自报告的疼痛问卷(间歇性和连续性骨关节炎疼痛[ICOAP]索引)。在基线和治疗后6个月时使用MRI T2Mapping评价软骨质量。第二结果测量包括在基线、治疗后1个月和6个月时,尿和血清生物标志物的评价。在Royal North Shore Hospital使用ELlSA试剂盒在尿中测量CTX-II。尿液肌酸酐水平也通过ELISA测量并且所有示出的CTX-II数据是肌酸酐校正的。在Macquarie University,在Australian Proteome Analysis Facility(APAF)使用Bio-Rad Bio-Plex试剂盒对血清进行了一组48种细胞因子的分析。使用意向治疗原则分析数据。
结果和讨论
该研究显示自体脂肪来源的细胞治疗是安全的并且临床上可行的。该治疗被患者良好耐受并且不存在重大中期安全性问题并且无关节感染。
安慰剂和自体脂肪来源的细胞治疗组经历了其总疼痛得分从基线的大的和统计学显著的减少,如通过ICOAP所测量的,其被保持至12个月的最终随访时间点(图1)。就自报告的结果而言,特别是疼痛,安慰剂组的显著的效果并不出人意料,因为已经确定安慰剂对OA患者具有治疗效果。
通过MRI评价软骨降解。通过两个膝盖的放射线照相成像对患者筛选以包含至该试验中。所有患者按照Osteoarthritis Research Society International(OSARSI)定级为:1级或2级中间的或外侧的隔室或骨赘中的射线照相的关节间隙变窄,2级或3级中间或外侧的隔室而没有关节间隙变窄,并随机分成安慰剂或治疗组。关节的放射线照相成像通过关节间隙变窄提供关节的软骨质量的间接测量但不提供软组织信息。MRI是强有力的和灵敏的成像技术,其使得可以评价软骨形貌和 生理学。MRI T2Mapping使得可以定量评价软骨的分子含量和结构。特别地,T2Mapping评价胶原束取向和蛋白聚糖-胶原基质的完整性,以及通过水含量评价软骨损伤的程度。
在基线和治疗后6个月时,在所有参与者的测试膝盖上进行MRI T2Mapping。通过专门研究MRI成像的独立的合同研究组织Qmetrics Technologies进行分析。T2Mapping显示,在治疗后6个月的时间点,软骨的损失比预计的较慢。据发现,两组均表现出与那些进展的个体相比,保持稳定的个体的比例更高。尽管所有参与者具有OARSI关节间隙变窄1级或2级,在基线时软骨损伤的详细评价不是包含标准的一部分。
MRI分析显示,在自体脂肪来源的细胞治疗组中,在基线时存在显著更多的患有高级的软骨损伤的参与者,也就是说与安慰剂组相比,在治疗组中存在显著(p 0.03)更多的4级OA患者。图2示出在基线的通过MRI的软骨损伤的QMetrics评价,其通过OA等级排名。这将易于使自体脂肪来源的细胞治疗组倾向于向OA的加速进展,因此,将使其不太可能在组之间观察到显著的差异,然而没有观察到这种现象。该结果表明通过减慢软骨降解,自体脂肪来源的细胞治疗可以具有疾病改善效果。
通过OA生物标志物的评价分析疾病进展。为了在分子水平研究自体脂肪来源的细胞治疗的效果,在基线、治疗后1个月和治疗后6个月时,在参与者的尿和血清中测量OA生物标志物。CTX-II是II型胶原C-端端肽并且是在尿中测量的软骨损伤的非侵入性标志物。在该试验中,在安慰剂组中的基线和6个月之间观察到了尿液CTX-II增加31%(p=0.04;图3)。在试验过程中,自体脂肪来源的细胞治疗组中的平均CTX-II水平降低。鉴于MRI分析表明在基线该组包含显著更多的患有高级软骨损伤的个体,该结果是出人意料的。该结果与Qmetrics T2Mapping MRI结果相关,其中Qmetrics T2Mapping MRI结果表明自体脂肪来源的细胞减慢软骨降解,即使在患有高级软骨损伤的个体中。
尽管骨关节炎在历史上被称为非炎性疾病,现在越来越明显的是低级炎症在OA疾病进展中发挥着重要作用。OA涉及降解和修复机制之间的失衡并且影响整个关节结构。为了研究自体脂肪来源的细胞治疗对炎症的效果,在APAF(Macquarie University),在参与者的血清中测量和分析了一组48种细胞因子、趋化因子和生长因子。
分析表明,在1个月和6个月,与安慰剂组相比,自体脂肪来源的细胞治疗降低了炎症。关键细胞因子是巨噬细胞迁移抑制因子(MIF),其在6个月时在自体脂肪来源的细胞治疗组显著降低(p=0.00;图4)。MIF由许多细胞包括T细胞和滑膜纤维母细胞产生。与健康对照相比,在患有膝盖OA的患者的血清和滑膜液中检测到更高水平的MIF。MIF以浓度和时间依赖性方式诱导滑膜纤维母细胞中基质金属蛋白酶MMP-1和MMP-3的上调。MMP在软骨的破坏中具有主要作用。因此,自体脂肪来源的细胞治疗组中循环MIF水平的降低可能通过降低的酶水平而具有降低的软骨降解。
通过MRI来源的OA等级分层CTX-II结果。骨关节炎通常在人的膝盖的双侧形成,但还可以影响身体中的其他关节。设计用自体脂肪来源的细胞治疗或安慰剂盐水注射治疗单侧膝盖OA的OSCAR试验。然而,基线放射线照相筛选说明大多数参与者还有在其未治疗的膝盖中OA的迹象。在一些情况下,与其测试膝盖相比,其未治疗的膝盖患有更高级的关节间隙变窄和骨赘得分。因为在本研究中研究的OA生物标志物是在试验参与者的血清和尿中测量,未治疗的膝盖和其他关节炎的关节中的损伤程度将已经对这些结果做出贡献。为了确定CTX-II的水平是否在患有高级软骨降解的个体中增加,利用MRI通过OA等级评价将结果分层。图5A和5B示出通过MRI来源的OA等级分层的安慰剂和自体脂肪来源的细胞治疗组的CTX-II值。
在自体脂肪来源的细胞治疗组中,15名4级OA患者在基线具有491ng/mmol的平均CTX-II水平,在6个月时该水平降低至477ng/mmol。9名安慰剂4级OA患者CTX-II水平从在基线的490ng/mmol的平均值增加至在6个月的702ng/mmol,增加43%(使用单尾t-检验p=0.037;使用双尾t-检验p=0.074)。在治疗后六个月时,比较来自测 试和安慰剂的4级OA患者,15名测试患者具有477ng/mmol的平均值并且9名安慰剂患者702ng/mmol(使用单尾t-检验p-值=0.066)。该结果表明在有高级软骨损伤的安慰剂组中的软骨降解在试验过程中增加。相反,在有相同程度的软骨损伤的自体脂肪来源的细胞治疗组的参与者组群中软骨降解减慢。综上所述,这些结果证实自体脂肪来源的细胞治疗可以对治疗OA具有疾病改善效果。
OSCAR是为评估自体脂肪来源的细胞治疗用于降低OA患者膝盖疼痛的效果而设计的世界上首次的实验。该治疗过程良好耐受并且不存在重大中期安全性问题。结果显示短期至中期症状改善在安慰剂组和治疗组中是类似的。软骨降解的客观标志物在治疗组中降低并且这个经MRI T2Mapping证实,这表明自体脂肪来源的细胞治疗可以减慢OA的进展并且在较长时期内产生改善的结果。
实施例2:用MSC治疗神经变性疾病
两个4岁的患有神经变性疾病(单羧酸转运蛋白8(MCT8)缺陷)的儿童在2010年治疗过一次并且在2011年用培养扩增的同种异体脐带血来源的MSC治疗一次。静脉注射施用细胞。
图6示出在2011年第二次MSC治疗前基线MIF水平和在治疗后2个月和5个月时的MIF。MIF的减少与男孩们进行的神经学任务和体能任务中的改善有关。
通过治疗专家不断地评价男孩们并且记录他们的各种神经学任务和体能任务得分(图7)。在每次MSC治疗后,他们显示了出人意料的收获。在第一次MSC治疗后,言语和职业性治疗显示了显著的改善。在第二次MSC治疗后,他们进行体能任务的能力显示了显著的改善。
实施例3:用自体脂肪来源的细胞治疗骨骼肌病况
在该实施例中提及的数据集包括来自HiQCell Joint Registry的骨关节炎患者。注册方案已经由Bellberry Human Research Ethics Committee认可并且向Australian and New Zealand Clinical Trials Registry注册。HiQCell Treating Medical Practitioners(TMP)是该研究的 共同研究者并且包括在骨骼肌病况的诊断和治疗中培训的骨科外科医生和体育医生。这是无限制患者募集的观察性注册。与随机的、受控临床试验不同,不存在包含或排除标准,所以所有正在接受用Regeneus信任的TMP的HiQCell治疗的患者合适于包含,导致多样化的群体。还从HiQCell Joint Registry外的HiQCell患者收集血清样品和尿样。
方法学
所有参与者经过常规的吸脂程序以收获大约200g的脂肪组织。如之前(Blaber SP,Webster RA,Hill CJ,et al.Analysis of in vitro secretion profiles from adipose-derived cell populations.J Transl Med 2012;10:172-88;其内容通过引用并入本文)所述处理该组织。简而言之,将脂肪组织用胶原酶消化并离心以获得沉淀的细胞(SVF)和脂肪细胞。将SVF和脂肪细胞悬浮液用盐水洗涤两次。根据将被注射的关节的数量,将所得到的混合细胞群再分散于盐水中至最终体积5mL-10mL。将混合细胞群的一部分注射至每个受影响的关节。
在十五名患者的一个亚群中,结果测量包括评价在基线和治疗后的每月时间点的尿和血清生物标志物。在Macquarie University,在Australian Proteome Analysis Facility(APAF)使用ELISA试剂盒测量尿中的CTX-II。还通过ELISA测量了尿液肌酸酐水平并且示出的所有CTX-II数据是肌酸酐校正的。分析血清的软骨寡聚基质蛋白(COMP)和MIF。COMP是骨关节炎和相关的软骨降解的认可的生物标志物,其血清水平在OA患者中显著提高。(J Orthop Res.2013Jul;3l(7):999-1006.doi:10.1002/jor.22324.Epub 2013Feb 19,Serum cartilage oligomeric matrix protein(COMP)in knee osteoarthritis:a novel diagnostic and prognostic biomarker)。
结果
在2014年7月,总共386名患者包括于关节注册表中,代表用HiQCell治疗的总数494名患者的78%。所有治疗的关节的平均疼痛得分在每个治疗后时间点降低:在治疗后2周后降低24%;6个月后 46%;在1年后49%以及在2年后51%。
图8示出从治疗前至治疗后4个月时血清MIF水平的箱形图。趋势分析示出在治疗后4个月时MIF水平显著(p 0.001)降低。图9和10示出从治疗前至治疗后4个月时CTXII和COMP的箱形图和趋势线。该趋势与在QSCARS研究(实施例1)中观察到的趋势类似并且表明在从HiQCell关节注册表中分析的15名参与者中软骨降解减慢。综上所述,这些结果证实自体脂肪来源的细胞治疗可以对治疗OA具有疾病改善效果。
实施例4:用MSC治疗溃疡性结肠炎
用脐带MSC治疗患有一种炎性肠病(IBD)形式——溃疡性结肠炎的两名成年人。溃疡性结肠炎由大肠的炎症和多发性溃疡表征。在2013年,将每个个体用单次剂量的培养扩增的同种异体脐带血来源的MSC治疗,静脉注射施用。图11示出当在治疗后6周和12周评价时可测量的MIF的降低。细胞治疗在减轻炎症(如通过血清中可检测的MIF所测量)和减轻疾病的症状方面是有效的。
如在本文的实施例中所示,在来自患有病况的患者的生物样品中确定的目标生物标志物水平的校正提供了方法的基础,通过所述方法来评价患者的病况的状态,例如帮助治疗医师以确定向患者施用治疗剂量的适当的时间。
- 还没有人留言评论。精彩留言会获得点赞!