抗体蛋白二硫键配对分析方法与流程
本发明涉及生物技术领域,特别涉及一种抗体二硫键配对分析方法。
背景技术:
二硫键即S-S键,是2个巯基被氧化而形成的-S-S-形式的硫原子间的共价键,是一种常见的蛋白质翻译后修饰,交联多肽链内或链间的两个半胱氨酸,在形成稳定的蛋白质空间结构、保持正确的空间构象、调节生物学活性方面起着非常重要的作用。二硫键正确配对利于肽链迅速折叠并形成紧密的、稳定的空间结构,形成局部疏水中心,能阻止水分子进入肽的内部破坏氢键,形成稳定的高级结构区域。
二硫键只具有相对的稳定性,其共价键容易被还原而断裂,当二硫键被断开还原为巯基基团时,蛋白质结构及构象必然发生改变,可能完全或部分丧失原有的生物学功能,巯基含量较高的抗体具有较低的生物活性和较低的热稳定性(Chader jian WB,Chin ET,Harris RJ,et al.Effect of copper sulfate on performance of a serum-free CHO cell culture process and the level of free thiol in the recombinant antibody expressed.Biotechnology Progress 2005;21(2):550-553;Lacy ER,Baker M,Brigham-Burke M.Free sulfhydryl measurement as an indicator of antibody stability.Analytical Biochemistry 2008;382:66-8)。正确的二硫键配对方式对抗体蛋白药物生物学活性至关重要,错配或不能完全形成二硫键往往意味活性的降低(Ouellette D,Alessandri L,Chin A,Grinnell C,Tarcsa E,Radziejewski C,et al.Studies in serum support rapid formation of disulfide bond between unpaired cysteine residues in the VH domain of an immunoglobulin G1molecule.Analytical Biochemistry 2010;397:37-47)。在细胞株克隆筛选、纯化工艺确认、制剂配方筛选、产品稳定性确认等研发周期过程中,监控二硫键配对可以判断抗体蛋白工艺开发。现有的技术方法多是采用几种特异性酶进行联合酶解来确认抗体的二硫键配对形式。
西妥昔单抗(Cetuximab,)是一种嵌合型抗体蛋白,目前已在多 个国家批准用于治疗结直肠癌,是一种重要的抗癌药物,其包括6对链内二硫键,1对链间二硫键和1对铰链区二硫键。但是,目前对西妥昔单抗二硫键分析需要采用多种特异性酶进行联合酶解才能确认,非常不方便。
因此,一种简单、有效的抗体蛋白(如Cetuximab)二硫键配对分析方法仍是目前急需的。
技术实现要素:
本发明的目的在于提供一种抗体蛋白二硫键配对分析方法,该方法克服了现有二硫键配对分析技术中N-糖对特异性酶酶解蛋白时的空间位阻作用和对肽段离子化效率的抑制作用,以及需要使用多种酶切方式的缺点,仅通过较少的酶切方式,即能准确确认及定位二硫键肽段。
为实现上述目的,本发明采用以下技术方案:
一种蛋白质二硫键配对分析方法,所述方法包括步骤:1、对蛋白质进行去除N-糖(N-Glycosylations)处理;2、对蛋白质进行变性处理;3、在非还原条件下使用特异性酶酶解蛋白质;4、将酶解后的蛋白质分成两份样品,对其中一份样品进行还原,对另一份样品不进行还原,两份样品均终止酶解;5、对终止酶解后的样品进行质量肽谱图分析。
较佳的,所述蛋白质为抗体蛋白;进一步的,所述抗体蛋白为含N-糖链的抗体蛋白,最优选为西妥昔单抗(Cetuximab)。
较佳的,步骤1中使用肽N-糖苷酶F(PNGase F)去除所述蛋白质的N-糖;优选溶液pH值为7.0~8.0。
较佳的,步骤1中使用盐酸胍(GuHCl)对所述蛋白质进行变性处理;优选变性样品体系中盐酸胍浓度为5M~7.6M。
较佳的,步骤2中所述特异性酶为胰蛋白酶和/或丝氨酸蛋白酶Lys-C;优选胰蛋白酶的用量为1﹕20(wt/wt,酶/蛋白);优选Lys-C的用量为1﹕200(wt/wt,酶/蛋白)。
在一具体实例中,所述胰蛋白酶的用量为1﹕20(wt/wt,酶/蛋白),Lys-C的用量为1﹕200(wt/wt,酶/蛋白)。
较佳的,步骤3中使用DTT对所述其中一份样品进行还原;优选样品体系中DTT浓度为60mM。
较佳的,步骤4中加入甲酸FA终止酶解;优选FA终体积浓度为0.1%。
在另一具体实例中,对步骤4中所述其中一份样品加入0.1M DTT,于37℃水浴孵育30min;两份样品均分别加入甲酸FA至终体积浓度0.1%,终止酶解反应。
较佳的,步骤5中,所述蛋白质的二硫键配对确认是通过ESI-Q-TOF MS方法进行分析,所得数据采用BiopharmaLynx软件进行处理分析。
在另一具体实例中,ESI-Q-TOF MS分析采用以下方法实现:将蛋白质用50mM NH4HCO3(pH8.0)溶液稀释至1.5-2mg/mL(以酶解前蛋白浓度计);然后Waters Acquity UPLC BEH300C181.7μm 2.1×150mm色谱柱分离;进行Q-TOF质谱分析。
本发明专利抗体蛋白西妥昔单抗(Cetuximab)轻链含有5个半胱氨酸Cys,分别为Cys23、Cys88、Cys134、Cys194、Cys214,重链含11个半胱氨酸Cys,分别为Cys22、Cys95、Cys146、Cys 202、Cys222、Cys228、Cys231、Cys263、Cys323、Cys369、Cys427,从轻链N-末端开始到C-末端分别标示为1C~5C,从重链N-末端开始到C-末端分别标示为6C~16C,理论配对链内二硫键为1C/2C、3C/4C、6C/7C、8C/9C、13C/14C、15C/16C,链间二硫键为5C/10C,铰链区二硫键为11C+12C/11C+12C。
实验结果表明,通过利用特异性脱糖酶去除抗体蛋白N-糖后再进行蛋白变性后酶解,可以排除抗体蛋白N-糖对特异性酶在酶解解蛋白时的空间位阻作用,降低N-糖对肽段离子化效率的抑制,从而克服现有技术对含有N-糖位点二硫键肽段需要采用酶切位点较多特异性酶联合胰蛋白酶才能确认的缺点;且实验结果表明,单一酶胰蛋白酶酶切时不能确认西妥昔单抗的5C/10C和11C+12C/11C+12C两条二硫键肽段,单一酶Lys-C酶切时不能确认1C/2C和6C/7C两条二硫键肽段,而胰蛋白酶联合Lys-C酶切可以确认西妥昔单抗全部二硫键肽段,避免Lys-C酶切时造成的肽段较长碎片离子不丰富的缺点,也避免了胰蛋白酶酶切时专一性不够易产生部分漏切导致肽段丰度较低的缺点。
总之,与现有技术相比,本发明具有如下的有益效果:本发明通过去除抗体蛋白N-糖后再进行蛋白变性后酶解,仅需胰蛋白酶联合Lys-C酶切方式即可确认西妥昔单抗全部二硫键配对,酶切方式相对较少,并且二硫键肽段碎片离子较为丰富。
附图说明
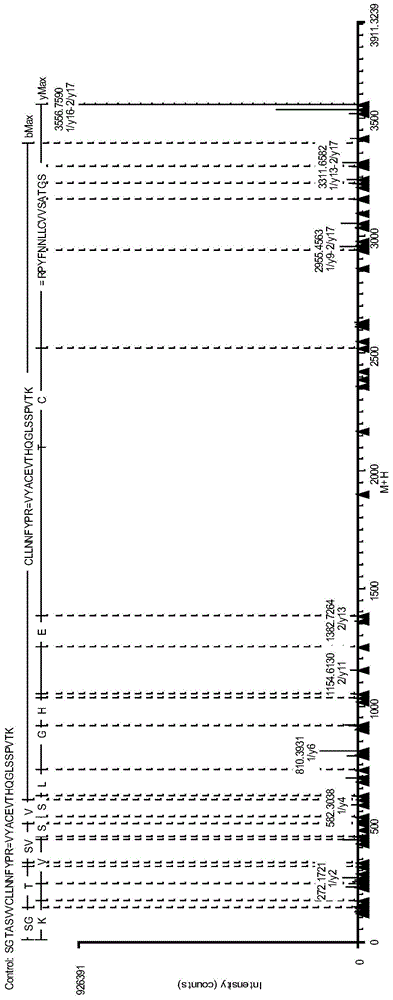
图1,为本发明实施例1抗体蛋白二硫键肽段(1C/2C)碎片离子图;
图2,为本发明实施例1抗体蛋白二硫键肽段(3C/4C)碎片离子图;
图3,为本发明实施例1抗体蛋白二硫键肽段(5C/10C)碎片离子图;
图4,为本发明实施例1抗体蛋白二硫键肽段(6C/7C)碎片离子图;
图5,为本发明实施例1抗体蛋白二硫键肽段(8C/9C)碎片离子图;
图6,为本发明实施例1抗体蛋白二硫键肽段(11C+12C/11C+12C)碎片离子图;
图7,为本发明实施例1抗体蛋白二硫键肽段(13C/14C)碎片离子图;
图8,为本发明实施例1抗体蛋白二硫键肽段(15C/16C)碎片离子图;
图9,为本发明实施例1自由巯基肽段(1C)碎片离子图;
图10,为本发明实施例1自由巯基肽段(2C)碎片离子图;
图11,为本发明实施例1自由巯基肽段(3C)碎片离子图;
图12,为本发明实施例1自由巯基肽段(4C)碎片离子图;
图13,为本发明实施例1自由巯基肽段(5C)碎片离子图;
图14,为本发明实施例1自由巯基肽段(6C)碎片离子图;
图15,为本发明实施例1自由巯基肽段(7C)碎片离子图;
图16,为本发明实施例1自由巯基肽段(8C)碎片离子图;
图17,为本发明实施例1自由巯基肽段(9C)碎片离子图;
图18,为本发明实施例1自由巯基肽段(11C+12C)碎片离子图;
图19,为本发明实施例1自由巯基肽段(13C)碎片离子图;
图20,为本发明实施例1自由巯基肽段(15C)碎片离子图;
图21,为本发明实施例1自由巯基肽段(16C)碎片离子图。
附图中肽段中氨基酸之间的每一条虚线表示检测到的该肽段的一个碎片离子(b离子或y离子),y离子是从肽段羧基端开始,b离子是从肽段氨基端开始。一般碎片离子越多越丰富,即表明该肽段是理论肽段,碎片离子较少,则不一定是理论肽段,可能是具有相同分子量的其他肽段,碎片离子的多少与肽段的长度 及碎裂模式有关,太短或太长的肽段在诱导碰撞电离碎裂模式下一般碎片离子都较少。
具体实施方式
以下结合具体实施例对本发明进一步阐述,不应理解为是对本发明的限制。下列实施例中未注明具体条件的实验方法,均是按照常规条件或制造厂商所建议的条件进行实验。
以下实施例中所用抗体蛋白为西妥昔单抗(上海抗体药物国家工程研究中心有限公司提供)。
实施例1:抗体蛋白二硫键配对分析(胰蛋白酶联合Lys-C酶切)
抗体蛋白二硫键配对分析步骤:
(1)N-糖(N-Glycosylations)去除
取1mg抗体蛋白样品,加入50mM NH4HCO3(pH8.0)溶液至体积20~50μL,加入1μL肽N-糖苷酶PNGase F(NEB,500000u/mL),混匀后,37℃孵育24小时。
(2)蛋白变性处理
取蛋白样品0.5mg加入到380μl变性缓冲液中(8M盐酸胍+5mM EDTA+0.5M Tris,pH8.3)混匀,37℃孵育60分钟。超滤离心或经脱盐柱脱盐至50mM的NH4HCO3(pH8.0)缓冲液中。
(3)酶解
取(2)中蛋白100μg,以1:20(wt/wt)加入Trypsin,以1:200加入Lys-C,联合酶解抗体蛋白,37℃孵育4小时。
(4)还原和终止酶解
待(3)中样品酶解完成后,取出一半体积样品加入甲酸FA至终体积浓度0.1%;另一半体积样品加入1μL0.1M DTT,于37℃水浴30min后,加入甲酸FA至终体积浓度0.1%,终止酶解反应,同时酸化肽段。
(5)ESI-Q-TOF质量肽谱图分析
混匀后离心10min(转速≥12000rpm),ACQUITY UPLC BEH300C18色谱柱(1.7μm,2.1×150mm,Waters公司)分离后,ESI-Q-TOF质谱分析,BiopharmaLynx软件分析。
所述ESI-Q-TOF MS分析典型参数包括质谱参数和液相条件优选如表1:
表1:ESI-Q-TOF MS分析质谱参数和液相条件
流动相A:0.1%FA-H2O,流动相B:0.1%FA-ACN,质谱清洗液:50%CAN,质谱IntelliStart阀清洗液:50%MeOH,柱温:45℃,检测波长:214nm,进样体积:5μL或10μL,样品室温度:10℃,液相梯度洗脱条件:流动相B在80分钟内从1%到36%。
实验结果:实验结果见下表2-3,其中:表2为本发明实施例1非还原条件抗体蛋白二硫键肽段分子量与理论分子量对比表;表3为本发明实施例1非还原条件抗体蛋白自由巯基肽段分子量与理论分子量对比表。
表2:非还原条件抗体蛋白二硫键肽段分子量与理论分子量对比表
表3:非还原条件抗体蛋白自由巯基肽段分子量与理论分子量对比表
经ESI-Q-TOF质量肽谱图分析,抗体蛋白二硫键肽段(1C/2C)碎片离子图见附图1,二硫键肽段(3C/4C)碎片离子图见附图2,二硫键肽段(5C/8C)碎片离子图见附图3,二硫键肽段(6C/7C)碎片离子图见附图4,二硫键肽段(9C/10C)碎片离子图见附图5,二硫键肽段(11C+12C/11C+12C)碎片离子图见附图6,二硫键肽段(13C/14C)碎片离子图见附图7,二硫键肽段(15C/16C)碎片离子图见附图8,自由巯基肽段(1C)碎片离子图见附图9,自由巯基肽段(2C)碎片离子图见附图10,自由巯基肽段(3C)碎片离子图见附图11,自由巯基肽段(4C)碎片离子图见附图12,自由巯基肽段(5C)碎片离子图见附图13,自由巯基肽段(6C)碎片离子图见附图14,自由巯基肽段(7C)碎片离子图见附图15,自由巯基肽段(8C)碎片离子图见附图16,自由巯基肽段(9C)碎片离子图见附 图17,自由巯基肽段(11C+12C)碎片离子图见附图18,自由巯基肽段(13C)碎片离子图见附图19,自由巯基肽段(15C)碎片离子图见附图20,自由巯基肽段(16C)碎片离子图见附图21,
实施例2:抗体蛋白完整分子量分析(胰蛋白酶酶切)
抗体蛋白二硫键配对分析步骤:
(1)N-糖(N-Glycosylations)去除
取1mg抗体蛋白样品,加入50mM NH4HCO3(pH8.0)溶液至体积20~50μL,加入1μL肽N-糖苷酶PNGase F(NEB,500000u/mL),混匀后,37℃孵育24小时。
(2)蛋白变性处理
取蛋白样品0.5mg加入到380μl变性缓冲液中(8M盐酸胍+5mM EDTA+0.5M Tris,pH8.3)混匀,37℃孵育60分钟。超滤离心或经脱盐柱脱盐至50mM的NH4HCO3(pH8.0)缓冲液中。
(3)酶解
取(2)中蛋白100μg,以1:20(wt/wt)加入Trypsin酶解抗体蛋白,37℃孵育4小时。
(4)还原和终止酶解
待(3)中样品酶解完成后,取出一半体积样品加入甲酸FA至终浓度0.1%;另一半体积样品加入1μL0.1M DTT,于37℃水浴30min后,加入甲酸FA至终浓度0.1%,终止酶解反应,同时酸化肽段。
(5)ESI-Q-TOF质量肽谱图分析
混匀后离心10min(转速≥12000rpm),ACQUITY UPLC BEH300C18色谱柱(1.7μm,2.1×150mm,Waters公司)分离后,ESI-Q-TOF质谱分析,BiopharmaLynx软件分析。
所述ESI-Q-TOF MS分析典型参数包括质谱参数和液相条件优选与实施例1中相同。
实验结果:能确认除5C/10C和11C+12C/11C+12C以外的二硫键配对。
实施例3:抗体蛋白完整分子量分析(Lys-C酶切)
抗体蛋白二硫键配对分析步骤:
(1)N-糖(N-Glycosylations)去除
取1mg抗体蛋白样品,加入50mM NH4HCO3(pH8.0)溶液至体积20~50μL,加入1μL肽N-糖苷酶PNGase F(NEB,500000u/mL),混匀后,37℃孵育24小时。
(2)蛋白变性处理
取蛋白样品0.5mg加入到380μl变性缓冲液中(8M盐酸胍+5mM EDTA+0.5M Tris,pH8.3)混匀,37℃孵育60分钟。超滤离心或经脱盐柱脱盐至50mM的NH4HCO3(pH8.0)缓冲液中。
(3)酶解
取(2)中蛋白100μg,以1:200加入Lys-C酶解抗体蛋白,37℃孵育4小时。
(4)还原和终止酶解
待(3)中样品酶解完成后,取出一半体积样品加入甲酸FA至终浓度0.1%;另一半体积样品加入1μL0.1M DTT,于37℃水浴30min后,加入甲酸FA至终浓度0.1%,终止酶解反应,同时酸化肽段。
(5)ESI-Q-TOF质量肽谱图分析
混匀后离心10min(转速≥12000rpm),ACQUITY UPLC BEH300C18色谱柱(1.7μm,2.1×150mm,Waters公司)分离后,ESI-Q-TOF质谱分析,BiopharmaLynx软件分析。
所述ESI-Q-TOF MS分析典型参数包括质谱参数和液相条件优选与实施例1中相同。
实验结果:能确认除1C/2C和6C/7C以外的二硫键配对。
综上,与现有技术相比,本发明通过特异性脱糖酶去除N-糖,可以排除融合蛋白N-糖对特异性酶在酶解解蛋白时的空间位阻作用,降低N-糖对肽段离子化效率的抑制,通过胰蛋白酶联合Lys-C酶切方式即能确认抗体蛋白(如西妥昔单抗)所有二硫键配对方式,方法简单方便、有效可靠。
- 还没有人留言评论。精彩留言会获得点赞!