一种检测温胆片工艺稳定性的方法与流程
本发明属于医药化工领域,涉及一种检测温胆片工艺稳定性的方法。
背景技术:
温胆片是由广州中医药大学第一附属医院中药房研制的药品,该中药1998年被批准为[98]穗卫医制(省)字第A-294号医院制剂,可治疗眩晕呕吐、虚烦、失眠、惊悸癫痫等病症。
温胆片的生产是将郁金、法半夏、枳实、陈皮、甘草、竹茹和茯苓七味药材混合,依次进行溶剂提取、浓缩、醇沉和精制步骤。由于温胆片的工艺步骤多、涉及成分复杂,目前尚无检测其质量稳定性或工艺稳定性的方法,无法对温胆片的质量或工艺进行控制。
辛弗林是一种肾上腺素受体兴奋剂,具有提高新陈代谢、增加热量消耗、氧化脂肪的作用,被广泛应用于医药、食品、饮料等行业,其IUPAC命名为4-[1-羟基-2-(甲基氨基)乙基]苯酚,结构式如下:
技术实现要素:
中药制剂温胆片的药材种类多、成分复杂、工艺环节繁杂,目前尚无检测其工艺稳定性的方法。本发明发明人惊奇地发现通过测定温 胆片的辛弗林转移率,可以检测温胆片的工艺稳定性,从而对温胆片产品质量稳定性进行很好地把控。
生产本发明温胆片的七种药材比例为:竹茹400-800重量份、法半夏400-700重量份、郁金400-700重量份、甘草100-300重量份、陈皮100-300重量份、茯苓400-800重量份和枳实400-800重量份。
具体为,竹茹550-750重量份、法半夏450-600重量份、郁金450-600重量份、甘草150-250重量份、陈皮150-250重量份、茯苓450-600重量份和枳实550-750重量份。
优选为,竹茹660重量份、法半夏550重量份、郁金550重量份、甘草165重量份、陈皮165重量份、茯苓550重量份、枳实660重量份。或者,竹茹500重量份、法半夏450重量份、郁金500重量份、甘草150重量份、陈皮200重量份、茯苓600重量份、枳实700重量份。
本发明温胆片的制备方法为:将郁金、法半夏、枳实、陈皮、甘草、竹茹和茯苓七味药材按上述比例混合后,加水浸泡半小时,加热至沸腾,回流提取1-2h,提取两次,提取过程中冷凝收集挥发油,将提取液过滤后浓缩,再经乙醇醇沉、过滤,将上清液浓缩成稠膏,加辅料制成颗粒,喷上挥发油,压片即得。所收集的挥发油含有原料药材成分,也是发挥药效的有效成分。
温胆片由七味药材生产,其中法半夏、郁金、竹茹和茯苓的含量测定和化学成分研究在《中华人民共和国药典》(2010年版)中都没有涉及。仅能查阅文献得知,法半夏中含葫芦巴碱,郁金中含姜黄素,竹茹中含苜蓿素。
发明人对这三种成分及原料药材进行了研究,发现:当药材郁金选用温郁金时,其不含有姜黄素;竹茹的苜蓿素含量仅为0.0087%,含量过低,不易检测;除法半夏外,甘草中也含有葫芦巴碱且含量超过法半夏,葫芦巴碱成分的专属性差,而且甘草属于使药,其成分不合适作指标;据此,上述三种成分均不适合作为检测指标。
发明人对陈皮和枳实两味药材进行了深入研究,发现陈皮与枳实的化学成分接近,都含有橙皮苷与辛弗林。发明人分别以橙皮苷和辛弗林作为检测指标研究了温胆片的质量稳定性和工艺稳定性,发现制备温胆片过程中橙皮苷的转移率太低,容易造成检测不准确,不适合作为指标,而辛弗林转移率较高,适于作为检测指标。
本发明涉及一种检测温胆片工艺稳定性的方法,包括测定温胆片的辛弗林转移率的步骤。
本发明所述方法的一个实施方式中,当辛弗林转移率≥40.8%时,工艺稳定性合格;具体地,当辛弗林转移率≥41%、≥42%、≥43.5%、≥44%、≥45.4%、≥46%、≥47%、≥48%、≥49%、≥50%或≥50.21%时,工艺稳定性合格。
本发明所述方法任一项的实施方式中,辛弗林转移率=100%×温胆片中辛弗林质量(μg)/药材中辛弗林质量(μg)。
本发明所述方法任一项的实施方式中,药材中辛弗林质量(μg)=处方枳实中辛弗林质量(μg)+处方陈皮中辛弗林质量(μg);具体地,处方枳实中辛弗林质量(μg)=处方枳实质量(g)×处方枳实中辛弗林含量(μg/g);具体地,处方陈皮中辛弗林质量(μg)=处方陈皮质量(g)×处方陈皮中辛弗林含量(μg/g)。
本发明所述方法任一项的实施方式中,处方枳实中辛弗林含量测定参照《中华人民共和国药典》(2010年版)一部第230页;具体地,处方陈皮中辛弗林含量测定包括将陈皮、甲醇混合,以液相色谱测定提取液中辛弗林含量的步骤。
本发明所述方法任一项的实施方式中,陈皮辛弗林含量测定包括如下(1)-(4)中的任意一项或者多项,
(1)混合前,将陈皮破碎成中粉;
(2)每克陈皮中加入甲醇50-100mL;
(3)在超声下混合;具体地,超声处理后,用甲醇补足损失重量;
(4)将提取液过滤;具体地,滤膜孔径为0.22μm。
本发明所述方法任一项的实施方式中,陈皮辛弗林含量测定的液 相色谱检测条件为如下(1)-(7)中的任意一项或者多项,
(1)色谱柱为正相硅胶键合二醇基色谱柱;
(2)检测波长为275nm;
(3)流动相的流速为0.6-1.2mL/min;
(4)理论塔板数大于或等于14000;
(5)液相色谱为高效液相色谱;
(6)柱温:35℃;
(7)流动相A为5mM醋酸铵溶液,流动相B为乙腈,流动相A、B体积百分数变化如下表,
本发明所述方法任一项的实施方式中,温胆片中辛弗林质量测定包括将温胆片、甲醇混合,以液相色谱测定提取液中辛弗林含量的步骤。
本发明所述方法任一项的实施方式中,温胆片辛弗林含量测定包括如下(1)-(5)中的任意一项或者多项,
(1)混合前,将温胆片破碎;
(2)在超声下混合;具体地,超声处理后,用甲醇补足损失重量;
(3)甲醇浓度为50-100%v/v;
(4)每克温胆片加入甲醇50-100mL;
(5)将提取液过滤;具体地,将滤液进一步纯化;优选纯化步骤是滤液蒸干—残渣溶解—过聚酰胺柱洗脱。
本发明所述方法任一项的实施方式中,温胆片辛弗林含量测定的液相色谱检测条件为如下(1)-(6)中的任意一种或者多项,
(1)色谱柱为正相硅胶键合二醇基色谱柱;
(2)以乙腈和醋酸铵溶液作流动相;优选,乙腈作为流动相A,5mmol/L的醋酸铵溶液作为流动相B;更优选,流动相A和流动相B的体积比为(60-95):(5-40);
(3)检测波长为275nm;
(4)流动相流速为0.6-1.2mL/min;
(5)理论塔板数大于或等于14000;
(6)液相色谱为高效液相色谱。
本发明中,术语“工艺稳定性”是指工艺承受物料的波动及工艺与设备的改变,而不造成负面质量影响的能力(ICH工艺稳健性)。
本发明中,术语“中粉”指能全部通过四号筛,但混有能通过五号筛不超过60%的粉末。
本发明中,术语“理论塔板数”是指色谱的柱效参数之一,用于定量表示色谱柱的分离效率。
发明的有益效果
(1)本发明通过温胆片的辛弗林转移率数值来检测温胆片工艺的稳定性。
(2)本发明进一步地,将温胆片辛弗林转移率≥40.8%,作为温胆片工艺稳定性合格的标准,从而实现了对温胆片产品质量的把控。
(3)本发明的液相色谱检测使用正相硅胶键合二醇基色谱柱可更好地保留辛弗林成分,平衡时间更短,测定速度更快,灵敏度和分离 度更高。
而且,正相硅胶键合二醇基色谱柱无需添加离子对试剂,减少了对色谱柱的损伤,可使辛弗林成分在色谱柱上更好的保留。
(4)本发明样品提取方法简单,样品杂质含量少,降低了对液相色谱仪的干扰,提高了检测的准确度。
附图说明
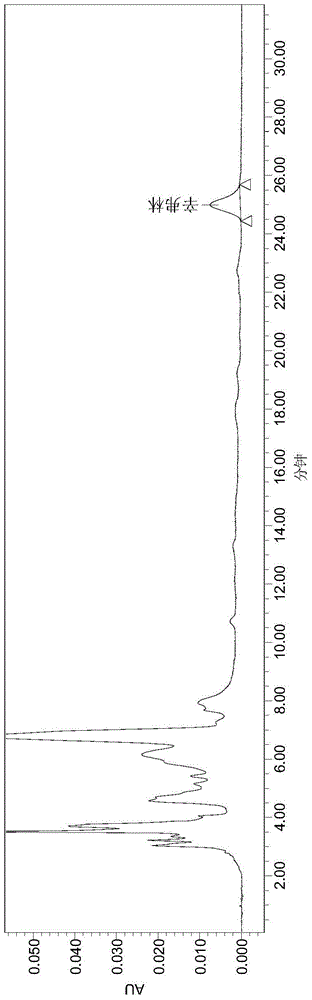
图1:本发明采用体积比80:20的乙腈和5mmol/L醋酸铵溶液作流动相检测温胆片Ⅰ辛弗林含量的液相色谱图。
图2:本发明采用体积比90:10的乙腈和5mmol/L醋酸铵溶液作流动相检测温胆片Ⅰ辛弗林含量的液相色谱图。
具体实施方式
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
一、温胆片的制备
制备例1
将七味药材竹茹660重量份、法半夏550重量份、郁金550重量份、甘草165重量份、陈皮165重量份、茯苓550重量份和枳实660重量份按比例混合后,加水浸泡半小时,加热至沸腾,回流提取1.5h,提取两次,提取过程中冷凝收集挥发油,将提取液过滤后于80℃浓缩,再经乙醇醇沉、过滤,将上清液于80℃浓缩成稠膏,加糊精制成颗粒,喷上挥发油,压片得到第Ⅰ批温胆片。
制备例2
将七味药材竹茹550重量份、法半夏450重量份、郁金450重量份、甘草150重量份、陈皮150重量份、茯苓450重量份和枳实550重量份按比例混合后,加水浸泡半小时,加热至沸腾,回流提取1.5h,提取两次,提取过程中收集挥发油,将提取液过滤后于80℃浓缩,再经乙醇醇沉、过滤,将上清液于80℃浓缩成稠膏,加糊精制成颗粒,喷上挥发油,压片得到第Ⅱ批温胆片。
制备例3
将七味药材竹茹750重量份、法半夏600重量份、郁金600重量份、甘草250重量份、陈皮250重量份、茯苓600重量份和枳实700重量份按比例混合后,加水浸泡半小时,加热至沸腾,回流提取1.5h,提取两次,提取过程中收集挥发油,将提取液过滤后于80℃浓缩,再经乙醇醇沉、过滤,将上清液于80℃浓缩成稠膏,加糊精制成颗粒,喷上挥发油,压片得到第Ⅲ批温胆片。
二、温胆片辛弗林转移率和橙皮苷转移率的测定方法
测定所用的辛弗林标准品和橙皮苷标准品均由中国食品药品检定研究院提供,批号分别为110727-201107和110721-201115。
(一)温胆片辛弗林转移率的测定方法
(1)温胆片中辛弗林质量测定
①由温胆片提取样品:
每批取10片(约0.25g/片)温胆片,破碎、研磨成细粉,称取1g温胆片细粉加入50-100%(v/v)甲醇50-100ml,称定重量,超声处理10-60min,冷却至室温,再称重量并用50-100%(v/v)甲醇补足减失的重量,放冷、过滤,精密量取续滤液10mL蒸干,残渣加水10mL溶解,通过聚酰胺(60~90目,2.5g,内径为1cm,干法装柱),用25mL水洗 脱,收集洗脱液,转移至25mL容量瓶中,加水至刻度,摇匀即得;
②样品辛弗林含量的测定:
用高效液相色谱(岛津LC-20AT高效液相色谱仪;SPD-M20A紫外检测器;Labsolutions数据处理软件系统)检测样品,色谱条件为:进样量:10μl;色谱柱:正相硅胶键合二醇基色谱柱(YMC-Pack Diol-120-NP,250*4.6mm,5μm,12nm);流动相:乙腈为流动相A,5mmol/L的醋酸铵溶液为流动相B,流动相A与B的体积比为80:20;检测波长275nm,流速为1.0mL/min,理论塔板数不低于14000。
③温胆片中辛弗林质量计算方法:
取辛弗林标准品加水分别配成7.44μg/mL、14.88μg/mL、29.76μg/mL、59.52μg/mL、89.28μg/mL、119.04μg/mL和148.8μg/mL的7种标准溶液,将7种标准溶液按照上述方法检测,以标准溶液浓度为横坐标,色谱峰面积为纵坐标进行线性回归,得到线性方程y=5218.2x-1829.9,R=0.9999,将样品的色谱峰面积代入线性方程中计算得到样品辛弗林含量,再按下式计算得到温胆片中辛弗林质量。
温胆片中辛弗林质量(μg)=样品辛弗林含量(μg/mL)×25mL×稀释倍数×每批温胆片质量(g)/温胆片细粉质量(g)
其中,稀释倍数=初始加入甲醇体积(mL)/10mL。
(2)药材中辛弗林质量测定:
Ⅰ、处方中枳实和陈皮都含有辛弗林,处方枳实中辛弗林含量测定参照《中华人民共和国药典》(2010年版)一部第230~231页进行,因印刷批次不同,也可能造成页码的差异。
Ⅱ、处方陈皮中辛弗林含量测定:
i.由陈皮提取样品:
精密称取陈皮中粉3份(用于计算平均值),每份约1g,分别置于200mL具塞锥型瓶中后,精密加入100mL甲醇,称定重量,超声处理1h。再称重并用甲醇补足失重,摇匀,0.22μm微孔滤膜滤过即得。
ii.样品检测方法:
参照温胆片中辛弗林质量测定中②进行。
不同之处在于:柱温:35℃;流动相A为5mM醋酸铵溶液,流动相B为乙腈,流动相A、B体积百分数变化如表1。
表1
iii.计算方法:
取辛弗林标准品用色谱纯甲醇溶解,制成辛弗林含量为0.036mg/ml的标准溶液,将标准溶液按照上述方法测定。采用外标法计算得到样品辛弗林含量,再按下式计算得到处方陈皮中辛弗林含量。
处方陈皮中辛弗林含量(μg/g)=样品辛弗林含量(μg/mL)×100mL/陈皮中粉质量(g)
Ⅲ、按下式计算得到药材中辛弗林质量。
药材中辛弗林质量(μg)=处方枳实质量(g)×处方枳实中辛弗林含量(μg/g)+处方陈皮质量(g)×处方陈皮中辛弗林含量(μg/g)
(3)温胆片辛弗林转移率计算:
按下式计算得到温胆片辛弗林转移率。
辛弗林转移率=100%×温胆片中辛弗林质量(μg)/药材中辛弗林质量(μg)
(二)温胆片橙皮苷转移率的测定方法
(1)温胆片中橙皮苷质量测定:
①由温胆片提取样品:
取温胆片置研钵中研碎,精密称取0.5g置具塞锥形瓶中,精密加入50mL甲醇密封,称定重量,超声处理(功率250W,频率59kHz)30min,取出放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液即可。
②样品橙皮苷含量的测定:
用高效液相色谱检测样品,色谱条件为:进样量:10μl;以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.1%磷酸(体积比20∶80)为流动相;检测波长为285nm;柱温:35℃;理论塔板数以橙皮苷峰计不低于15000。
③温胆片中橙皮苷含量计算方法:
取橙皮苷标准品适量,用纯水溶解配制成0.11mg/mL的标准溶液,将标准溶液按上述方法检测,采用外标法并按下式计算温胆片中橙皮苷质量。
温胆片中橙皮苷质量=V样×A样×C标×m批/(A标×m样)
其中,V样为样品总体积(mL),A样为样品峰面积,C标为标准溶液浓度(μg/mL),A标为标准溶液峰面积,m样为温胆片取样量(g),m批为每批温胆片质量(g)。
(2)药材中橙皮苷质量测定:
Ⅰ、处方中枳实和陈皮都含有橙皮苷,处方陈皮中橙皮苷含量测定参照《中华人民共和国药典》(2010年版)一部第176~177页进行,由于印刷批次不同,也可能造成页码的差异。
Ⅱ、处方枳实中橙皮苷含量测定:
i.由枳实提取样品:
参考(一).(2).Ⅱ.i中由陈皮提取样品。不同之处在于用枳实中 粉替换陈皮中粉使用。
ii.样品检测方法:
用高效液相色谱检测样品。色谱条件为:进样量:10μL;色谱柱:YMC-Pack,ODS-AM,4.6*250mm,5μm;检测器:紫外检测器;检测波长:283nm;柱温:35℃;流速:1.0mL/min;流动相A:水,流动相B:乙腈,A和B体积比80:20。
iii.计算方法:
取橙皮苷标准品用色谱纯甲醇溶解,制成橙皮苷含量为0.080mg/mL的标准溶液,将标准溶液按照上述方法检测。采用外标法计算得到样品橙皮苷含量,参照(一).(2).Ⅱ.iii计算得到处方枳实中橙皮苷含量。
Ⅲ、按下式计算得到药材中橙皮苷质量。
药材中橙皮苷质量(μg)=处方枳实质量(g)×处方枳实中橙皮苷含量(μg/g)+处方陈皮质量(g)×处方陈皮中橙皮苷含量(μg/g)
(3)温胆片橙皮苷转移率计算:
按照下式计算得到温胆片橙皮苷转移率。
橙皮苷转移率=100%×温胆片中橙皮苷质量(μg)/药材中橙皮苷质量(μg)
三、工艺稳定性评价
将制备例1-3的第Ⅰ、Ⅱ、Ⅲ批温胆片分别按照二.测定辛弗林转移率和橙皮苷转移率,结果见表2。
表2
由表2可知,温胆片生产中辛弗林转移率远远大于橙皮苷转移率,辛弗林转移率更容易准确测量,适合作为工艺稳定性评价指标。而且,制备例1-3的辛弗林转移率≥40.8%,说明制备例1-3温胆片制备工艺的稳定性高。
此外,根据制备例1-3分别制备10批温胆片,按制备例1生产的10批命名为温胆片Ⅰ1-Ⅰ10,按制备例2生产的10批命名为温胆片Ⅱ1-Ⅱ10,按制备例3生产的10批命名为温胆片Ⅲ1-Ⅲ10。将各批温胆片按照二.测定辛弗林转移率,结果显示,温胆片Ⅰ1-Ⅰ10的辛弗林转移率接近于50.68%;温胆片Ⅱ1-Ⅱ10的辛弗林转移率接近于51.94%;温胆片Ⅲ1-Ⅲ10的辛弗林转移率接近于50.21%。说明辛弗林转移率≥40.8%,温胆片制备工艺稳定。
另外,测定温胆片Ⅰ中辛弗林质量时,分别采用A和B体积比为80:20、90:10两种流动相进行样品检测,所得液相色谱图分别如图1、2所示。
由图1与图2对比可知,流动相A与B的体积比为80:20较体积比为90:10时的出峰时间更早,检测速度更快,而且分离度更好,基线更为稳定。
四、温胆片工艺稳定性检测的方法学研究
(1)精密度:
配制浓度为29.76μg/mL的辛弗林标准溶液按照二.(一).(1).②中方法测定,重复进样6次,并计算RSD,结果为1.41%,表明仪器精密度良好。
(2)稳定性:
按照二.(一).(1)方法对温胆片I提取样品、测定5次,5次分别是在起始、6h、12h、24h和36h的时间点将10μl样品注入高效液相色谱中,测定辛弗林色谱峰面积,计算5次测定色谱峰面积的RSD为1.85,结果表明提取的样品在36小时内稳定。
(3)重现性:
按照二.(一).(1)方法制备6份温胆片Ⅰ的样品并进行测定,结果测定温胆片辛弗林含量的RSD为1.92,表明方法的重现性良好。
(4)加样回收率:
取10片温胆片Ⅰ(已测定辛弗林含量为3.80mg/g)破碎、研磨成细粉,称取0.5g温胆片6份,分别于具塞锥型瓶内,分别加入辛弗林标准品约1.9mg,按二.(一).(1)方法测定加标品辛弗林含量,按下式计算加样回收率,并计算RSD。
加样回收率=(加标品辛弗林含量-温胆片Ⅰ辛弗林含量)/标准品加入量×100%
结果,辛弗林加样回收率的平均值为97.6%,RSD为0.96%,加样回收率符合要求,说明该方法的准确度较高。
尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。
- 还没有人留言评论。精彩留言会获得点赞!