核医学图像解析技术的制作方法
本申请公开的发明一般来说涉及解析核医学图像的技术。根据实施方式的不同,特别涉及提取核医学图像中的肿瘤区域的技术。根据实施方式的不同,特别涉及提取核医学图像中的肿瘤轮廓的技术。
背景技术:
由于可认为spect制剂99mtc-hmdp、pet制剂18f-naf主要化学吸附到作为骨无机质的基本组成的羟磷灰石结晶上,且较多地由骨代谢亢进的造骨部分吸附,所以能够使恶性肿瘤的骨转移、骨折等炎症部位变成高积聚而描绘出。
spect制剂99mtc-hmdp在静脉内投放后迅速地分布到全身的骨组织中,在投放后1-2小时左右,能够得到高画质的骨闪烁图。
有如下报告:pet制剂18f-naf在投放后30分钟以后能够得到稳定的骨闪烁图。另外,由于pet能够正确地修正体内的减弱、散射,所以能够得到具有高的定量性的图像。
技术实现要素:
虽然骨闪烁图能够定性地(视觉地)检测异常病变,但有时也会积聚在作为排泄路径的肾脏、膀胱中,并成为解析的妨碍。
为了解决该问题,本申请发明人公开以下的涉及核医学图像数据的解析技术的发明。本发明的特征在于:
·从完成与该核医学图像数据的位置匹配的ct图像数据提取骨区域;
·显示所述核医学图像数据中的与所述提取的骨区域重叠的区域的数据;以及
·不显示所述核医学图像数据中的不与所述提取的骨区域重叠的区域的数据。
例如,在骨闪烁图的解析中,在使用一直以来使用的将预定阈值以上的区域提取作为病变的方法的情况下,作为生理性积聚的肾脏、膀胱这样的内脏器官被显示·提取作为高积聚部位。与之相对,根据上述发明,由于不显示核医学图像数据中的不与骨区域重叠的区域的数据,所以能够除去由正常的生理性理由导致的积聚的影响,并进行核医学图像数据的观察和解析。
此外,在本申请说明书和权利要求书中,“核医学图像数据”这一用语是既包括二维核医学图像数据也包括三维核医学图像数据的概念。上述发明既可应用于二维核医学图像数据,也可应用于三维核医学图像数据。
在骨闪烁图中进行肿瘤的观察的情况下,有时需要从核医学图像数据之中提取相当于肿瘤的区域。在进行该工作的现有技术中,存在:通过使核医学图像数据显示在显示器上并用鼠标等描画肿瘤的轮廓而进行肿瘤提取的方法、设定适当的像素阈值并将具有该阈值以上的像素值的区域决定为肿瘤的方法。
但是,在前者的情况下,根据操作者的技能或喜好的不同,提取的肿瘤的大小会产生偏差。另外,在后者的情况下,根据投放量、生理性积聚的有无等患者条件、成像条件以及拍摄装置的不同,不得不使最佳的阈值不同。作为结果,在这两种方法中,提取的肿瘤的大小有可能产生偏差。
为了解决该问题,本申请发明人公开以下的涉及从核医学图像数据自动提取肿瘤的技术的发明。本发明的特征在于:
·从核医学图像数据包括的像素组取得相当于骨骼的区域的像素组;
·基于所述取得的像素组中的至少一部分的像素值求出标准偏差;以及
·基于所述标准偏差,提取骨肿瘤像素组。
根据上述发明,由于统计地提取骨肿瘤像素组,所以抑制了由操作者导致的提取结果的偏差,能够客观地进行肿瘤提取。
上述发明也既可应用于二维核医学图像数据,也可应用于三维核医学图像数据。
在三维骨闪烁图中进行肿瘤的观察的情况下,有时需要三维地提取肿瘤的轮廓。在进行该工作的现有技术中,存在:通过使核医学图像数据显示在显示器上,并用鼠标等描画肿瘤的轮廓而进行轮廓提取的方法、在预先指定包括肿瘤的范围后设定适当的像素阈值,并将像素值超过该阈值的边界设为肿瘤轮廓的方法。
但是,在前者的情况下,根据操作者的技能或喜好的不同,提取的肿瘤形状会产生偏差。另外,手动三维地进行轮廓提取是烦杂的作业,对操作者来说花费功夫,另外,根据操作者的不同,形状也会产生偏差。在后者的情况下,根据设定的阈值的值的不同,检测出的肿瘤轮廓有时会变动。
为了解决该问题,本申请发明人公开以下的涉及从三维核医学图像数据自动提取肿瘤的轮廓的技术的发明。本发明的特征在于:
·在所述核医学图像数据中,将基准点设定在包括肿瘤的区域内;
·从所述基准点起呈三维放射状扫描像素,并在各扫描方向上制作像素值曲线;
·针对所述像素值曲线或在所述像素值曲线上应用了平滑处理而成的曲线,制作梯度大小曲线;
·针对所述像素值曲线或在所述像素值曲线上应用了平滑处理而成的曲线,设定轮廓判定范围;以及
·在所述轮廓判定范围之中,在对应的所述梯度大小曲线或在所述梯度大小曲线上应用了平滑处理而成的曲线中,基于具有最大的尖度的顶点,决定该像素值曲线上的肿瘤轮廓点。
根据上述发明,由于自动地提取肿瘤的轮廓,所以抑制了由操作者导致的提取结果的偏差,能够客观地进行肿瘤轮廓提取。另外,由于自动进行轮廓提取,显著减轻了操作者的劳力。
在本申请说明书中公开的发明的优选实施方式的一例的特征在于,包括:
从完成与核医学图像数据的位置匹配的ct图像数据提取骨区域;
显示所述核医学图像数据中的与所述提取的骨区域重叠的区域的数据;以及
不显示所述核医学图像数据中的不与所述提取的骨区域重叠的区域的数据。
在本申请说明书中公开的发明的优选实施方式的另一例的特征在于,包括:
从核医学图像数据包括的像素组取得相当于骨骼的区域的像素组;
基于所述取得的像素组中的至少一部分的像素值求出标准偏差;以及
基于所述标准偏差,提取骨肿瘤像素组。
本发明的优选实施方式的另一例的特征在于,包括:
在所述核医学图像数据中,将基准点设定在包括肿瘤的区域内;
从所述基准点起呈三维放射状扫描像素,并在各扫描方向上制作像素值曲线;
针对所述像素值曲线或在所述像素值曲线上应用了平滑处理而成的曲线,制作梯度大小曲线;
针对所述像素值曲线或在所述像素值曲线上应用了平滑处理而成的曲线,设定轮廓判定范围;以及
在所述轮廓判定范围之中,在对应的所述梯度大小曲线或在所述梯度大小曲线上应用了平滑处理而成的曲线中,基于具有最大的尖度的顶点,决定该像素值曲线上的肿瘤轮廓点。
本申请发明例如能够具体实现作为具有完成上述特征的至少某一个的单元的系统、通过由处理单元执行而使系统完成上述特征的至少某一个的程序、完成上述特征的至少某一个的方法等。
在权利要求书包括的权利要求中确定了几个本发明的优选具体实现方式。但是,在这些权利要求中确定的构成不一定包括本说明书和附图公开的全部新颖的技术思想。预先记载:申请人主张无论是否记载在当前的权利要求中,对本说明书和附图公开的全部新颖的技术思想具有接受专利的权利。
附图说明
图1是用于说明系统100的主要构成的图,所述系统100是可执行在本说明书中公开的各种处理的硬件的例子。
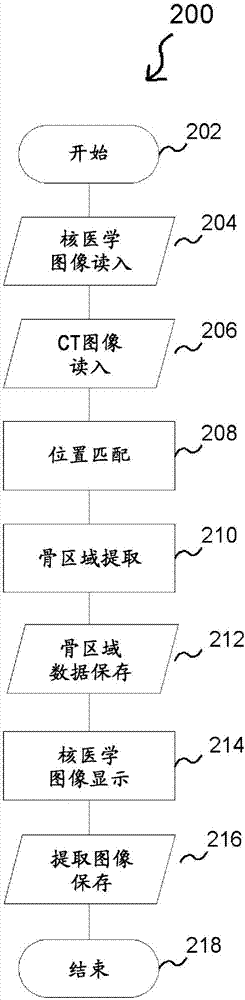
图2是用于说明从核医学图像数据130提取骨区域的新颖的处理200的流程图。
图3a是介绍利用像素制作的骨骼的图像的例子的图,所述像素是在步骤210中仅通过阈值进行提取而残留的。
图3b是介绍对图3a的图像施加闭运算处理而得到的图像的例子的图。
图4a是用于说明步骤214的显示的例子的图。
图4b是用于说明步骤214的显示的例子的图。
图5是用于说明从核医学图像数据自动提取肿瘤的新颖的处理500的流程图。
图6是在步骤518中提取的骨肿瘤像素组的显示的例子。
图7a是用于说明从核医学图像数据自动提取肿瘤的轮廓的新颖的处理700的流程图。
图7b表示可在步骤720中进行的处理的一例。
图8a表示在步骤708中进行的显示的例子。
图8b表示在步骤710中设定的基准点的例子。
图8c是用于说明在步骤712中进行的扫描的样子的图。
图8d是在步骤712中制作的像素曲线(profile)的一例。
图8e是表示在步骤714中进行的平滑的一例的图。
图8f是在步骤716中制作的梯度大小曲线的一例。
图9是用于说明在步骤720中进行的、决定进行肿瘤轮廓点的判定的范围的处理的一例的图。
图10a是用于说明在步骤722中进行的、肿瘤轮廓点的决定处理的一例的图。
图10b是用于说明在步骤722中进行的、肿瘤轮廓点的决定处理的一例的图。
图11是用于说明在步骤724中进行的、提取的轮廓点的显示的一例的图。
图12是用于说明使用图2的流程图介绍的处理200的应用例1200的流程图。
图13是用于说明处理1200的效果的例子的图。
具体实施方式
图1是用于说明系统100的主要构成的图,所述系统100是可执行在本说明书中公开的各种处理的硬件的例子。如图1所示,系统100在硬件上与一般的计算机相同,能够具备cpu102、主存储装置104、大容量存储装置106、显示器·接口107、外围设备接口108以及网络·接口109等。与一般的计算机同样地,作为主存储装置104,能够使用高速的ram(随机存取存储器),作为大容量存储装置106,能够使用廉价且大容量的硬盘或ssd等。能够将用于信息显示的显示器与系统100连接,其经由显示器·接口107连接。另外,能够将键盘、鼠标、触摸面板这样的用户接口与系统100连接,其经由外围设备接口108连接。网络·接口109能够用于经由网络与其他计算机或互联网连接。
在大容量存储装置106中,能够存储操作系统(os)110、用于提供在本说明书中公开的特征性处理的核医学图像解析程序120等。系统100的最基本的功能通过os110使cpu102执行来提供。另外,在本说明书中公开的特征性处理通过由cpu102执行核医学图像解析程序120包括的程序指令组的至少一部分而提供。在本说明书中公开的特征性处理能够大致分为三种,第一种是生理性积聚部位的除去处理,第二种是肿瘤区域的自动提取处理,最后一种是肿瘤轮廓的自动提取处理。也可以是,为了完成这三种处理中的每一个,核医学图像解析程序120具备程序指令组或程序模块122、124、126。根据实施方式的不同,这些程序指令组或程序模块可以分别独立于其他程序指令组或程序模块被存储或复制、下载或贩卖。根据实施方式的不同,这些程序指令组或程序模块可以相互不能分离地成为浑然一体,形成单一的核医学图像解析程序120。众所周知,程序的安装方式有多种,这些方式全部包括在本申请公开的发明的范围内。
在大容量存储装置106中,还能够存储有成为核医学图像解析程序120的解析对象的核医学图像数据130、与核医学图像数据130对应的ct图像数据132以及其他数据134、136、138等。
除了图1所示的要素以外,系统100也能够具备电源、冷却装置等与通常的计算机系统具备的装置同样的构成。关于计算机系统的实施方式已知有利用各种各样的技术的各样各样的方式,该技术例如有:适于存储装置的分散·冗长化和虚拟化、多台cpu的利用、cpu虚拟化、dsp等特定处理的处理器的使用;将特定处理硬件化而组合于cpu。本申请公开的发明可以搭载在任意方式的计算机系统上,其范围不由计算机系统的方式限定。本说明书公开的技术思想一般来说能够具体实现为:(1)具备指令的程序,所述指令构成为通过由处理单元执行,使具备该处理单元的装置或系统完成在本说明书中说明的各种处理;(2)通过该处理单元执行该程序而实现的装置或系统的工作方法;以及(3)具备该程序和构成为执行该程序的处理单元的装置或系统等。如上所述,软件处理的一部分有时被硬件化。
另外,需要注意的是,在很多情况下,在系统100的制造贩卖时、启动时,数据130~138不存储在大容量存储装置106之中。这些数据例如也可以是经由外围设备接口108或网络·接口109从外部装置传送给系统100的数据。根据实施方式的不同,数据134~138可以通过cpu102执行程序120或其他程序而形成。另外,根据程序120或os110的安装方式的不同,数据134~138有时不存储在大容量存储装置106中,只存储在主存储装置104中。为谨慎起见,预先记载:本申请公开的发明的范围不由是否存在数据130~138限定。
接着,预先说明在本说明书公开的实施例中成为处理的对象的核医学图像数据130。核医学图像数据130例如能够是通过以肿瘤的骨转移检查等为目的实施的spect检查而得到的二维图像数据或三维图像数据。更具体而言,例如,能够是:向被检查者静脉内投放99mtc-hmdp作为放射性药品,并利用spect装置检测从体内放射的放射线,基于该放射线计数值形成的二维图像数据或三维图像数据。通常,构成这些图像的像素的各像素值具有与放射能计数值对应的值,即,各像素值表示放射能的强度。
此外,为谨慎起见,预先说明:本说明书公开的实施例能够解析的数据不仅限于spect图像数据。在实施例能够解析的数据中有各种数据,例如,也能够解析将18f-naf作为放射性药品使用的pet图像数据。
ct图像数据132能够是使用x射线ct拍摄与制作了核医学图像数据130的被检查者同一人物而得到的三维图像数据。当前开发了将spect和ct一体化而成的装置,能够在spect检查的实施的同时拍摄ct图像。图像数据130和132可以是使用这样的装置一起拍摄的图像数据。
接着,使用图2以后各图,说明本说明书公开的几个特征性处理的例子。
图2是用于说明本说明书公开的骨区域提取处理200的流程图。在该流程图中介绍的处理例如能够是通过cpu102执行核医学图像解析程序120的骨区域提取程序模块122,从而由系统100完成的处理。
步骤202表示处理的开始。在步骤204中,读入在本实施例中成为处理对象的三维核医学图像数据130。例如,按照核医学图像解析程序120包括的程序指令组的指示,cpu102将图像数据130的至少一部分从大容量存储装置106复制到主存储装置104。
此外,根据实施例的不同,核医学图像数据130能够是利用专用的读取装置读取存储在存储介质中的数据,并经由外围设备接口108取入系统100的数据。另外,在另一方案中,作为与载波重叠的数据信号,核医学图像数据130也可以是经由网络·接口109取入的数据。根据实施例的不同,取入的核医学图像数据130既可以暂时存储在大容量存储装置106中并复制到主存储装置104,也可以直接存储在主存储装置104中并按原样供处理。
在步骤206中,读入ct图像数据132。
在步骤208中,进行核医学图像数据130与ct图像数据132的位置匹配(影像融合:co-registration)。即,在核医学图像130与ct图像132之间,使身体的方向或大小、位置三维地一致。通过经过该处理,能够相互比较核医学图像130和ct图像132。该处理有时也简称为配准(registration)。由于影像融合功能包括于在市场上能够得到的许多核医学图像数据解析程序中,所以在本实施例中,也可以使用安装在这样的程序中的已有方法、其他公知的方法来进行影像融合。可以利用手动的方法,即,将核医学图像数据和ct图像数据一起作为图像显示,并通过鼠标等的操作,使一方图像平行移动或旋转,而与另一方图像匹配的方法来进行配准。
根据实施方式的不同,图像数据130与132之间的影像融合有时已经完成。例如,在图像数据130和132是利用将spect或pet与ct一体化而成的装置一起拍摄到的图像数据的情况下,核医学图像数据130与ct图像数据132的影像融合有时在从装置输出的阶段就已经完成。在该情况下,当然不需要步骤208的处理。
在步骤210中,使用ct图像数据132,三维地进行骨区域的提取。根据实施方式的不同,该处理可以是在ct图像上仅将具有阈值以上的像素值的区域提取作为骨区域的处理。但是,如果仅通过阈值进行提取,则有时骨骼的内部会缺失,或会产生噪声。因此,根据实施方式的不同,也可以是,将在图像数据上施加利用公知的方法的闭运算处理而残留的像素确定作为骨区域,所述图像数据由具有阈值以上的像素值的像素构造而成。另外,作为除去噪声的方法,可以使用除去体素(voxel)数为一定阈值以下的体(volume)的方法、手动指定噪声并除去的方法。
此外,在骨区域的提取中使用的阈值能够使用本领域技术人员一般已知的、作为表示骨区域的ct值的值。在本实施例中,使用152。
在图3a中,介绍利用像素制作的骨骼的图像的例子,所述像素仅通过阈值进行提取而残留。另外,在图3b中,介绍对图3a的图像施加闭运算处理而得到的图像的例子。观察图3a可知:虽然是骨骼的内部,根据位置的不同,也存在较黑地显示且未被提取作为骨区域的位置。另一方面,在图3b的图像中,可知:较白地显示骨骼的内部、脊椎骨之间,与图3a的图像相比,良好地提取了骨区域。因此,在本实施例中,将在利用阈值提取的图像数据上施加闭运算处理而得到的数据,即,能够将如图3b例示的方式图像化的数据作为提取的骨区域,使用于后面的处理。另外,在本实施例中,将闭运算处理频数设为三次。另外,提取的骨区域的数据例如可以是如下图像数据:提取作为骨区域的像素具有一个以上的像素值,对于未提取作为骨区域的像素,向像素值分配了0或null码。提取的骨区域的数据例如可以预先存储在主存储装置104中,和/或,例如可以作为数据134存储在大容量存储装置106中(步骤212)。
优选的是,在步骤210中,用户能够任意地调整在骨区域的提取中使用的阈值、闭运算处理的频数。优选的是,核医学图像解析程序120(或骨区域提取程序模块122)构成为能够进行这样的任意的设定。
在步骤214中,使用在步骤210中得到的骨区域数据,进行核医学图像数据130的显示。本步骤中的显示处理的特征在于:显示核医学图像数据130包括的像素中的、与在步骤210中提取的骨区域重叠的像素,不显示不与该骨区域重叠的像素。例如,可以设为:针对核医学图像数据130的各像素,调查在步骤210中得到的骨区域数据134的对应的像素是否存在0或null码以外的有效的像素值,仅在存在有效的像素值的情况下显示该像素(即,不显示不包括于骨区域数据134的像素)。另外,作为另一方案,也可以是,针对核医学图像数据130的各像素,进行向在步骤210中得到的骨区域数据134的对应的像素以外的像素赋予0或null码这样的处理。
使用图4a和图4b,说明通过步骤214的显示将成为怎样的显示的例子。首先,图4a是在从ct图像数据132切出适当的断面并显示的图像上,从核医学图像数据130切出同一断面并重合显示而成的图像。能够在用标号402和404表示的位置观察到放射能的积聚。(由于在专利申请文件上必须用黑白表示图像这样的限制,可能难以看清用标号404表示的位置。)但是,用标号402表示的位置是膀胱,放射能积聚的理由是排泄作用,理由不是存在病变。与之相对,在用标号404表示的位置观察到的积聚的理由可能是存在病变。
图4b也是在与图4a中使用的图像相同的ct图像上重合显示了核医学图像数据130的对应的断面而成的图像。但是,显示的核医学图像数据的像素仅是与在步骤210中提取的骨区域重叠的像素。如直接判明地,在肾脏或膀胱的区域中,未显示放射能的积聚。与之相对,在用标号404表示的位置观察到的积聚按原样残留。即,在图4b中,由生理性理由导致的积聚基本上不出现在显示的核医学图像上,另一方面,由病变导致的积聚正确地出现在显示的核医学图像上。因此,通过上述处理。能够除去由正常的生理性理由导致的积聚的影响,并进行核医学图像数据的观察和解析。
此外,关于上述处理,在下述非专利文献1中,公开了基于正常模型从ct图像检测出异常部位的技术,所述正常模型利用多个ct图像数据构造而成。但是,未公开从核医学图像数据提取骨区域,并高精度地检测出肿瘤部位的技术。另外,关于有效地除去生理学的积聚部位的方法,此前也没有公开的例子。
非专利文献1:周向荣、藤田广志,“躯干部区域的单纯ct图像中的解剖学正常构造的认识”,medicalimagingtechnology,vol.24no.3,2006年5月,第167-172页
当进行彩色显示时,图4a与图4b的不同变得更明了,能够非常明了地观察到仅在骨区域显示了核医学的信息。(本来图4a和图4b是彩色图像,但由于能够用于专利申请用的附图的颜色数量的限制,才用黑白来表现。)另外,需要注意的是,图4a、图4b以及图3a、图3b是使用三维图像数据的一个断面制作的图像,核医学图像数据130、ct图像数据132是三维图像数据。
此外,也可以是,通过显示器·接口107,将用于显示图像数据的数字或模拟的信号发送给与显示器·接口107连接的显示装置,从而进行图像数据的显示。因此,需要注意的是,在本申请的说明书和权利要求书中使用的“显示”这样的语句除了现实地显示在显示装置上,也包括生成用于在显示装置上进行图像的显示的数字或模拟的信号。
在图4b中,与ct图像重叠的核医学图像数据实质上是如下图像数据:仅与骨区域重叠的像素具有(例如0或null码以外的)有效的像素值,向不与骨区域重叠的像素分配了0或null码这样的像素值。根据实施方式的不同,可以将这样的图像数据例如作为骨区域核医学图像数据136,例如预先存储在大容量存储装置106中(步骤216)。
步骤218表示处理的结束。
接着,使用图5,进行从核医学图像数据自动提取肿瘤的新颖的处理的说明。
图5是用于说明本说明书公开的从核医学图像数据130提取肿瘤的处理500的流程图。在该流程图中介绍的处理例如能够是通过cpu102执行核医学图像解析程序120的肿瘤提取程序模块124,从而由系统100完成的处理。
步骤502表示处理的开始。在步骤504中,读入成为处理500的对象的三维核医学图像数据130。在步骤506中,从核医学图像数据130取得相当于骨骼的区域的像素组。根据实施方式的不同,该处理能够是使用图2说明的处理200本身。因此,根据实施方式的不同,步骤506可以是从存储单元(例如大容量存储装置106)读出在处理200的步骤216中保存的骨区域核医学图像数据136。
在步骤508中,基于在步骤506中取得的像素组的像素值,制作直方图。根据实施方式的不同,也可以做成该像素值本身的直方图。但是,图像数据130的各像素的像素值通常表示放射线的计数值,是会根据被检查者的体重、放射能投放量等而发生变动的值,是在测量之间会产生偏差的值。因此,在本步骤的优选实施方式中,首先,优选的是,将各像素值转换成suv(standardizeduptakevalue:标准摄取值)等正规化而成的值,制作suv等的直方图。这是由于,suv是正规化值,且是如下的值:针对相同的组织,则无论测量条件如何均能够期待取得一定程度上相同的值。此外,如在本申请的技术领域中众所周知地那样,suv是按如下方式定义的值。
suv={衰减修正后的关心区域内放射能量(kbq)÷关心区域体积(ml)}/{放射能投放量(mbq)÷被检查者的体重(kg)}
即,suv是用单位体重的放射能投放量将关心区域的放射性浓度正规化而成的值,是可成为反映放射能或放射性药品的摄入量的指标的值。
在步骤510中,决定制作的直方图的峰值。即,确定最大的频数(频率)。在步骤512中,在制作的直方图中,决定频数成为上述峰值的预定比例的等级值(classvalue)。例如,决定频数成为上述峰值的5%的等级值。在出现上述峰值的等级值的前后,决定两个该频数成为上述峰值的5%的等级值。在步骤512中,将用这两个等级值划定的区间决定为计算在下一步骤中计算的标准偏差的区间。
在步骤514中,计算在步骤512中决定的区间所包括的等级值的标准偏差。
在步骤516中,决定在肿瘤像素组的提取中使用的阈值。当将在步骤512中计算得到的两个等级值中的较大的等级值表述为basevalue,将在步骤514中计算得到的标准偏差表述为sd时,在步骤516中计算的阈值t能够用以下公式表示。
t=basevalue+α·sd
在这里,α是常数。当α较大时,提取作为肿瘤像素的像素的数量变少,当α较小时,提取的像素的数量变多。因此,优选的是,构成为:根据核医学检查装置的不同、医生的喜好的不同,α的值能够调节。优选的是,核医学图像解析程序120(或肿瘤提取程序模块124)构成为能够任意设定α。然而,根据本申请发明人的调查,已经判明:如果采用0.5作为α,在很多情况下能够得到适当的结果。
在步骤518中,将其像素值或基于其像素值计算得到的suv成为在步骤516中决定的阈值以上的像素提取作为有可能存在骨肿瘤的区域的像素组(骨肿瘤像素组)。
在步骤520中,进行在步骤518中提取的骨肿瘤像素组的显示。在图6中示出该显示的一例。该图是在从三维核医学图像数据130切出适当的断面并显示的图像上重合显示了位于该断面上的骨肿瘤像素组而成的图。
图中,用标号t表示的、用浓的颜色表示位置是提取的骨肿瘤像素组。用标号b表示的位置也用浓的颜色表示,但这是与膀胱对应的像素组,由于是放射能的生理性积聚,所以仅仅是较浓地显示。由于向肾脏或膀胱等的生理性积聚部位所对应的像素组没有包括于在步骤506中提取的骨区域像素组,所以在步骤518中不提取作为肿瘤。在实际使用的实施方式中,为了能够明确地判别骨肿瘤像素组,优选的是,骨肿瘤像素组t用与生理性积聚像素组b明确不同的颜色表示。图6实际上本来也是用彩色制作,是核医学图像数据130的断面也包含生理性积聚像素组b在内用灰度显示,且骨肿瘤像素组t用红色显示而成的图。由于在专利申请用附图中能够使用的颜色数量的限制,图6是将这样的附图黑白化而成的附图。
根据上述处理,由于使用直方图和标准偏差统计地提取骨肿瘤像素组,所以能够抑制由操作者导致的提取结果的偏差,客观地进行肿瘤提取。另一方面,通过任意设定α,也能够进行与操作者的要求对应的灵活设定。
此外,需要注意的是,在本实施例中,三维地进行步骤506~步骤518的处理。即,在步骤506中提取的骨区域像素组具有三维的扩展。另外,在步骤514中计算的标准偏差是具有三维的扩展的骨区域像素组的像素值的标准偏差。在步骤518中提取的骨肿瘤像素组也具有三维的扩展。图6所示的断面图仅示出了其一个断面。
但是,根据实施方式的不同,也可以使用三维核医学图像数据130的特定断面的数据,二维地进行步骤506~步骤518的处理。
根据实施方式的不同,也可以使用在步骤514中计算得到的标准偏差和在该标准偏差的计算中必然地计算得到的平均值,将在步骤516中设定的阈值设定为:
阈值=平均值+β·标准偏差。
另外,根据实施方式的不同,也可以使用在步骤506中提取的全部像素组,计算上述平均值、标准偏差,并设定上述阈值。并且,根据实施方式的不同,也可以不将各像素转换成suv,在原来的像素值的状态下,计算上述平均值、标准偏差,设定上述阈值。由本申请发明人调查到:通过这些方法设定阈值,有时也能够良好地提取肿瘤像素组。此外,β是正的数,是用户能够任意设定的值,但由本申请发明人调查到:如果设为β=1,则在很多情况下能够良好地提取肿瘤像素组。
根据实施方式的不同,可以预先保存在步骤518中提取的骨肿瘤像素组的数据。例如,作为骨肿瘤像素组数据138,例如可以预先存储在大容量存储装置106中(步骤522)。步骤524表示处理的结束。
接着,使用图7a,进行从核医学图像数据自动提取肿瘤的轮廓的新颖的处理的说明。
图7a是用于说明本说明书公开的从核医学图像数据130提取肿瘤轮廓的处理700的流程图。在该流程图中介绍的处理例如能够是通过cpu102执行核医学图像解析程序120的肿瘤轮廓提取程序模块126,从而由系统100完成的处理。
步骤702表示处理的开始。在步骤704中,读入成为处理700的对象的核医学图像数据130。在步骤706中,从核医学图像数据130切出适当的断面图像,并显示在显示装置上。
在步骤708中,在步骤706中显示的断面图像上,强调显示了包括肿瘤的区域。为了进行该处理,需要从核医学图像数据130提取包括肿瘤的区域。该提取处理能够用几种方法进行。一种能够是使用图5说明的处理500本身。因此,根据实施方式的不同,可以在步骤706中,从存储单元(例如大容量存储装置106)读出在处理500的步骤522中保存的骨肿瘤像素组数据138。然后,也可以是,从骨肿瘤像素组数据138之中,将位于在步骤706中显示的断面上的像素组可识别地(例如,用与在步骤706中显示的断面图像不同的颜色)显示。
应在步骤708中进行的、从核医学图像数据130提取包括肿瘤的区域的方法的另一例是:将在核医学图像数据130之中具有预定阈值以上的像素值的像素组作为包括肿瘤的区域。该方法的另一例是:操作者用眼睛判定包括肿瘤的区域,例如通过用鼠标包围等操作来指定该区域。根据实施方式的不同,为了从核医学图像数据130提取包括肿瘤的区域,既可以安装上述任一种方法,另外,也可以用与这三种方法不同的方法进行肿瘤区域提取。在任一情况下,优选的是,提取的肿瘤区域以操作者能够容易地判别的形式显示在画面上。
在图8a中示出在步骤708中进行的显示的例子。如图所示,在核医学图像数据130的断面图像上,显示了用浓的颜色表示的区域。用标号802表示的、该用浓的颜色表示的区域是肿瘤区域。本来,优选图8a是彩色图像,更优选的是,肿瘤区域使用的颜色设为与核医学图像数据130的断面图像使用的颜色明确不同的颜色。(图8a本来也是彩色图像,用标号802表示的区域用红色涂抹。)此外,图中例示的该肿瘤区域是通过使用图5说明的处理500的实施方式提取的区域。(同时,也通过使用图2说明的处理200的实施方式,进行放射性药品的生理积聚部位的除去。在相当于膀胱的部位完全看不到积聚就是因为这个原因。)
此外,在步骤706中显示的断面图像能够是包括系统100自动提取的肿瘤区域的断面图像。自动提取肿瘤区域的方法例如能够是与步骤708关联地在上面说明的方法。因此,根据实施方式的不同,在步骤706中进行的处理和在步骤708中进行的处理有时其顺序(图7a所示的顺序)一部分逆转而进行,另外,以一体不可分的方式来进行。系统100可以构成为:作为在步骤706中显示的断面,例如,自动地选择包括自动提取的肿瘤区域的中心坐标的断面、包括在该肿瘤区域中具有最大像素值的像素的断面。另外,系统100可以构成为:在有多个自动提取的肿瘤区域的情况下,作为在步骤706中显示的断面,自动地选择包括具有最大的体积的肿瘤的断面。另外,系统100可以构成为:在有多个自动提取的肿瘤区域的情况下,一览显示各肿瘤区域从而用户能够选择,响应于用户选择特定的肿瘤区域,显示包括该肿瘤区域的断面。并且,系统100可以构成为:用户能够自由地选择·变更在步骤706中显示的断面图像。例如,可以构成为:能够使用滚动条这样的用户接口要素,自由地选择·变更。
在步骤710中,在显示的肿瘤区域内进行基准点的设定。该基准点是成为下一步骤中的像素扫描的基准的点。根据实施方式的不同,基准点的设定能够用几种方法进行。一种是基于操作者的选择操作而设定。例如,可以是,当操作者在显示装置上用鼠标点击在步骤708中显示的肿瘤区域内的某一个点时,系统100将与点击的位置对应的核医学图像数据130的像素设定作为上述基准点。明显的是,除了鼠标以外,也能够使用其他输入单元进行同样的处理。
根据实施方式的不同,也可以将系统100构成为自动设定上述基准点。例如,可以将肿瘤区域的中心坐标、在肿瘤区域内具有最大的像素值的像素作为上述基准点。
某个实施方式构成为:为了自动设定上述基准点,进行以下处理。
(1)复制图像数据130。
(2)在复制的图像数据中,自动提取肿瘤区域,并且将提取的肿瘤区域以外的像素的像素值全部设定为null。肿瘤区域的提取方法例如能够是与步骤708关联地在上面说明的方法。
(3)切出包括在自动提取的肿瘤区域内具有最大的像素值的像素的断面。
(4)在该断面内包括的肿瘤区域中,设定两个端点。首先,第一端点设为一方的轴(例如x轴)的坐标值最小的像素。另外,第二端点设为该坐标值最大的像素。
(5)将位于第一端点与第二端点的中间点的像素作为基准点的候选。
(6)在设为基准点的候选的像素的像素值不是null的情况下,将该像素决定作为最终的基准点。
(7)在设为基准点的候选的像素的像素值是null的情况下,返回(4),在肿瘤区域内将第一端点或第二端点稍微(例如一个像素的量)偏移,再执行(5)以后的处理。
在处理700中,将基准点设定在哪里不会对最终的肿瘤轮廓提取结果的质量带来那么大的影响。其中,基准点优选设定在肿瘤区域内。
此外,在显示的断面图像之中显示了多个肿瘤区域的情况下,对各个肿瘤区域设定基准点。
在图8b中示出在步骤710中设定的基准点的例子。用标号802表示的颜色较浓的区域与图8a的肿瘤区域相同。在本例中,基准点设定在用标号804表示的黑点的位置。
在步骤712中,以基准点为起点,呈三维放射状扫描核医学图像数据130,在各扫描方向上调查像素值的变化,并制作像素值的曲线。将该样子示出在图8c中。从基准点804起呈放射状描绘了4条箭头806,该一条一条表示扫描方向。在图中只描绘了4条扫描方向,但实际上应呈三维放射状在所有方向上进行扫描。在后面介绍的轮廓提取例中,在同一平面内以基准点为中心,以1°为间隔在360°所有方向上进行扫描,并且使进行扫描的平面绕着通过基准点的轴线以1°为间隔旋转180°,在该各个平面内进行所有方向扫描,从而进行轮廓提取。因此,制作了全部360×180=64800个像素值曲线。当然,这些数值仅为例示,角度的间隔当然可以使用与之不同的值。
用标号810表示的圆表示特定平面内的扫描范围。即,在该平面上的各扫描方向上,在从基准点起到达圆810为止的范围内进行像素值的扫描。通过按这种方式限定扫描范围,防止了扫描不需要的范围而浪费计算资源。在本例中,针对各扫描方向,从基准点到达圆810为止,在26个点进行像素值的采样。优选的是,扫描范围设定为包括整个肿瘤区域。当然,该采样数也仅为例示。
在图8d中,示出了在一个扫描方向上制作的像素值曲线的例子。横轴的值与进行了采样的点的位置对应。如上所述,在本例中,由于在26个点进行了采样,在图中,标注了26个点。纵轴的值是像素值。
在步骤714中,对在前一步骤中制作的每一个像素值曲线施加平滑。平滑化的方法可以使用任意的方法,例如,可以是利用众所周知的三点移动平均法的平滑化。即,也可以是,利用将某采样点的像素值置换为该点和相邻采样点这三个点的像素平均值这样的方法来施加平滑。另外,根据实施方式的不同,可以应用各种平滑处理。在图8e中,示出用上述的三点移动平均法对图8d所示的像素值曲线进行平滑处理而成的曲线(在图8e中,由于不能够对两端的值取三点的平均值,所以按原样保留原来的数据值)。
在步骤716中,对平滑处理而成的像素值曲线制作梯度大小曲线。在有点1(x1,y1)和点2(x2,y2)时,它们之间的梯度大小用{(x2-x1)2+(y2-y1)2}的平方根定义。在本步骤中,针对在前一步骤中进行了平滑处理而成的像素值曲线的各点,在相邻的点之间计算梯度大小。因此,在本例中,对分别具有26个点的像素值的每个像素值曲线,制作具有25个点的梯度大小值的梯度大小曲线。在图8f中,示出记载了某(完成平滑的)像素值曲线的例子和对应的梯度大小曲线的例子的图表。
在步骤718中,对在前一步骤中制作的每一个梯度大小曲线施加平滑。与对像素值曲线施加平滑的情况下同样地,平滑化的方法可以使用任意的方法,例如,可以是利用众所周知的三点移动平均法的平滑化。在本例中,也使用该方法,进行梯度大小曲线的平滑化。
在步骤720中,在像素值曲线之中,决定进行肿瘤轮廓点的判定的范围(轮廓判定范围)。轮廓判定范围基于在像素值曲线(或在步骤714中平滑处理而成的像素值曲线)中成为极值的点(极值点)进行。极值点的搜寻例如能够以如下方式进行:在像素值曲线(或在步骤714中平滑处理而成的像素值曲线)中,取相邻的各点之差,将该差成为0或正负的符号发生变化的点作为极值点。轮廓判定范围例如能够决定为从像素值曲线(或在步骤714中平滑处理而成的像素值曲线)的起点到成为极小值的点为止。
使用图7b,介绍可在步骤720中进行的轮廓判定范围决定处理的一例。步骤742表示处理的开始。在步骤744中,针对在步骤714中平滑处理而成的像素值曲线,进行取极值的点(极值点)的搜寻。如上所述,该搜寻能够是:针对构成平滑处理而成的像素值曲线的各点,取与相邻的点的像素值之差,将该差成为0或正负的符号逆转的点设为极值点。
在步骤746中,在检索到的多个极值点之间计算像素值之差,求出其最大值。
在步骤748中,从在步骤744中检索到的多个极值点之中,检索满足预定条件的极小值点(即,取最小值的极值点)。在这里检索到的极小值点例如能够是最近的极大值点(或最大值点)之间的像素值之差例如为在步骤746中计算出的最大值的例如20%以上,且最接近基准点(在步骤710中设定的点)的极小值点(即,横轴的值最小的极小值点)。
在步骤750中,决定了轮廓判定范围。轮廓判定范围例如能够设为从像素值曲线的起点(即,最接近基准点的点)到在步骤748中确定的极小值点为止的范围。
在图9中,表示在步骤720中决定的轮廓判定范围的例子。
另外,需要注意的是,用于轮廓判定范围决定的上述处理是例示。根据实施方式的不同,有时也用其他方法决定轮廓判定范围。例如,根据实施方式的不同,可以构成为:将最接近基准点的点设为起点,将从在步骤708中提取的肿瘤区域向外侧远离了一定范围的点(例如,向外侧远离了5个像素的点)设为终点,将由该起点和终点夹着的范围设为轮廓判定范围。
根据实施方式的不同,例如,在步骤748中确定的极小值点可以是极值点间的像素值之差成为最大的极小值点(即,出现在步骤746中求出的最大值的极小值点)。
根据实施方式的不同,例如,轮廓判定范围的起点可以是极大值点,所述极大值点比在步骤748中确定的极小值点接近基准点,且与该极小值点的像素值之差是在步骤746中计算出的最大值的例如20%以上。
需要注意的是,根据实施方式的不同,轮廓判定范围设定的具体处理可以有多种。另外,在上述说明中,使用了20%这样的数值,当然这仅为例示,也可以使用其他值。
返回图7a,继续处理700的说明。在步骤722中,针对在步骤720中决定了轮廓判定范围的像素曲线,使用在步骤718中制作的完成平滑的梯度大小曲线,决定该像素值曲线上的肿瘤轮廓点。该步骤例如能够按如下方式推进。
(子步骤1)在步骤720中设定的判定范围内,检索完成平滑的梯度大小曲线的顶点。即,检索出现极大值的极值点。
(子步骤2)在子步骤1中只检索到一个顶点的情况下,将与该顶点对应的像素值曲线上的点决定为肿瘤轮廓点。
(子步骤3)在子步骤1中检索到多个顶点的情况下,对各顶点计算尖度,并将具有最大尖度的顶点所对应的像素值曲线上的点决定为肿瘤轮廓点。在这里,尖度定义为:在梯度大小曲线上,从顶点(极大值点)向相邻的极小值点(出现极小值的极值点)延伸的两条矢量之间的角度(θ)的余弦(cosθ)。即,将从顶点向相邻的极小值点的方向矢量分别设为
v1={x1,y1}
v2={x2,y2}
时,尖度cos(θ)按如下方式定义。
在图10a和10b中例示了轮廓点决定的样子。图10a与上述子步骤2的状况对应,在判定范围内,只检索到一个梯度大小曲线的顶点。因此,与该顶点对应的像素值曲线上的点被提取作为肿瘤的轮廓点。
另一方面,图10b与上述子步骤3的状况对应,在判定范围内,检索到多个梯度大小曲线的顶点。在此情况下,对各顶点计算尖度,出现最大尖度的顶点(即,cosθ的值成为最大的顶点)被提取作为肿瘤的轮廓点。
此外,谨慎起见,需要提醒的是,步骤714至722的处理是对在步骤712中制作的全部像素值曲线独立地进行的。例如,如上所述,为了制作图11所示的轮廓提取例,制作了全部64800个像素值曲线。对这些全部像素值曲线独立地进行步骤714至722的处理。
在步骤724中,进行提取的轮廓点的显示。根据实施方式的不同,可以将提取的轮廓点连接并设为封闭曲线并显示。在图11中记载了提取的轮廓点的显示例。描绘在该图中的是对图8a、图8b所示的肿瘤区域802提取的轮廓点1102和轮廓1104。基本上应该是针对在步骤712中制作的每一个像素值曲线决定一个轮廓点1102(有时也因错误等不能决定)。虽然在图中只描绘了全部13个轮廓点1102,当然,实际上决定了远多于此的轮廓点1102。闭曲线1104是连接了所提取的轮廓点1102而成的曲线。
步骤726表示处理的结束。
根据步骤700,由于自动地提取肿瘤的轮廓,所以抑制了由操作者导致的提取结果的偏差,能够客观地进行肿瘤轮廓提取。另外,在本实施例中,由于除了在步骤710中选择基准点以外,全部自动进行轮廓提取,所以轮廓提取所需的操作者的劳力非常少即可。
以上,说明了本说明书公开的技术思想的优选实施方式,但这些技术思想的实施方式当然不限于介绍的内容。上述例子仅为实施方式的一例,除此以外,能够取各种实施方式。
作为例子,使用图12,介绍一个使用图2的流程图介绍过的处理200的利用例。在图12中介绍的处理1200是核医学图像的解析和显示方法,涉及以操作者能够识别由骨骼的病变导致的积聚的方式显示的方法。
步骤1202表示处理的开始。在步骤1204中,读入成为处理1200的对象的核医学图像数据130。在步骤1206中,读入在图2的处理200的步骤212中存储的骨区域数据134。
在步骤1208中,从核医学图像数据130切出适当的断面,并显示作为图像。切出的断面例如可以是包括像素的断面,所述像素在骨区域内具有最大的像素值。然后,在步骤1210中,针对相同的断面图像,为了区别由肿瘤等导致的积聚,使用适当的阈值,提取具有该阈值以上的像素值的像素。
在用步骤1212~1218表示的循环中,针对提取的像素的每一个,与在步骤1206中读入的骨区域数据进行比较,判定该像素是否与骨区域重叠(步骤1214)。在判定为该像素与骨区域重叠的情况下,以在步骤1208中显示的图像上操作者能够用眼睛识别的方式显示与该像素对应的位置。例如,用红色等容易明确地知道的颜色来显示。另一方面,在判定为该像素不与骨区域重叠的情况下,不进行这样的显示,进行针对下一个像素的判定。
当针对在步骤1210中提取的全部像素进行了步骤1214的判定处理时,处理1200退出循环并结束(步骤1220)。
以图13为例,说明处理1200提供怎样的显示。图13a是在核医学图像数据130的某个断面像中,用白色表示具有阈值以上的像素值的像素的图,所述阈值与在步骤1210中使用的阈值相同。示出了:在用标号1302和1304表示的位置,存在具有阈值以上的像素值的像素。但是,用标号1304表示的位置的像素值较高的理由是由生理性积聚所导致的,而不是由肿瘤等导致的积聚所导致的。与之相对,图13b是通过处理1200而制作的显示,即,仅可识别地显示具有预定阈值以上的像素值且与骨区域重叠的区域,对于虽然是具有该阈值以上的像素值的区域却不与骨区域重叠的区域,通过以不可识别的方式显示这样的处理而制作并显示。与图13a进行比较,虽然在骨区域观察到的积聚1302与图13a相同地强调显示,但生理性积聚1304未强调显示。也就是说,通过处理1200,能够排除生理性积聚的影响,仅明确地观察由骨骼的病变导致的积聚。
此外,在图13中,在强调显示中使用了白色,但这本来是不适当的。这是由于,白色也为了描绘其他区域而使用。实际上,为了进行该强调显示,优选使用彩色。在图13或本申请的其他附图中没有使用彩色不过是因为在专利申请的附图中不能够使用彩色这样的限制。
在本说明书公开的技术思想中,除此以外还存在各种实施方式。
在说明书或附图中介绍的各种实施例所包括的各个特征不是只能与直接记载了包括该特征的实施例一起使用的特征,也能够组合使用于在这里说明的其他实施例或没有说明各种具体实现例中。特别是,在流程图中介绍的处理的顺序不一定必须按介绍的顺序执行,也可以根据实施的方案的要求,以更换顺序或并列地同时执行,进一步一体不可分地安装多个块或作为适当的循环执行的方式安装。这些变形全部包括在本申请公开的发明的范围内,发明的范围不由处理的安装方式限定。在权利要求中确定的处理的记载顺序也并非确定了处理的必需的顺序,例如,处理的顺序不同的实施方式、包括循环并执行处理的实施方式等也包括在权利要求涉及的发明的范围中。预先记载:无论在当前的权利要求书中是否进行了专利请求,申请人主张对不偏离发明的思想的全部方式具有接受专利的权利。
附图标记的说明
100系统
102cpu;
104主存储装置
106大容量存储装置
107显示器·接口
108外围设备接口
109网络·接口
110操作系统
120核医学图像解析程序
130-138数据
- 还没有人留言评论。精彩留言会获得点赞!